Журнал физической химии, 2021, T. 95, № 8, стр. 1189-1193
Влияние пространственного фактора на кинетику деструкции окта(4-трет-бутилфенил)тетрапиразино-порфиразина в системе азотсодержащее основание–диметилсульфоксид
О. А. Петров a, *, М. В. Шиловская a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: poa@isuct.ru
Поступила в редакцию 23.09.2020
После доработки 23.09.2020
Принята к публикации 30.09.2020
Аннотация
Исследовано состояние окта(4-трет-бутилфенил)тетрапиразинопорфиразина в диметилсульфоксиде. Обнаружено образование устойчивого во времени комплекса с переносом протонов. Показано, что введение добавок н-бутиламина и диэтиламина в диметилсульфоксид приводит к деструкции этого комплекса с последующим разрушением тетрапиразинопорфиразинового макроцикла. Установлено влияние трет-бутильных заместителей в октафенилтетрапиразинопорфиразине на кинетические параметры процесса.
Порфиразины с аннелированными ароматическими гетероциклами (Н2РА) относятся к числу интенсивно исследуемых соединений в связи с их возрастающим применением в качестве оптических материалов для записи информации, компонентов цветных и оптических фильтров, флуорохромов, светоизлучающих устройств [1]. Одно из важных критериев использования Н2РА в практических целях – изучение их устойчивости в различных условиях среды, что позволяет расширить спектр полезных свойств этого класса соединений. К настоящему времени количественные данные о стабильности аннелированных порфиразинов в протоноакцепторных средах весьма немногочисленны [2, 3].
В связи с этим в данной работе исследовано состояние окта(4-трет-бутилфенил)тетрапиразинопорфиразина в диметилсульфоксиде и системе азотсодержащее основание (В) – диметилсульфоксид (DMSO), а также показано влияние заместителей в макроцикле на кинетические параметры деструкции окта(4-трет-бутилфенил)тетрапиразинопорфиразина (H2Pa((C6H4Bu)2Pyz)4) и октафенилтетрапиразинопорфиразина (H2Pa(Ph2Pyz)4). В качестве В были взяты н-бутиламин (BuNH2), трет-бутиламин (ButNH2), диэтиламин (Et2NH) и три-н-бутиламин (Bu3N).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Окта(4-трет-бутилфенил)тетрапиразинопорфиразин синтезировали по методике [4]. Бензол, диметилсульфоксид и азотсодержащие основания (ACROS) использовали без дополнительной очистки. Для проведения кинетических измерений в термостатируемую кювету спектрофотометра SHIMADZU-UV-1800 помещали свежеприготовленный раствор H2Pa((C6H4Bu)2Pyz)4 в DMSO с постоянной концентрацией и добавляли переменные количества азотсодержащих оснований. Скорость деструкции комплекса с переносом протонов H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO определяли по уменьшению оптической плотности раствора на длине волны λ = 664 нм. Текущую концентрацию комплекса определяли по формуле:
где А0, Аτ и А∞ – оптические плотности растворов в начальный момент времени, в момент времени τ и после завершения реакции (τ∞); С° и C – начальная и текущая концентрации комплекса H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO. Все измерения проводили в условиях реакции псевдопервого порядка, поэтому наблюдаемую (экспериментальную) константу скорости деструкции H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO рассчитывали по формуле: Точность кинетических параметров оценивали с помощью обычных методов статистики при доверительном интервале 95%. Использование метода Стьюдента позволило определить относительные ошибки в значениях kн и Еа, которые составили не более 4 и 10% соответственно.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
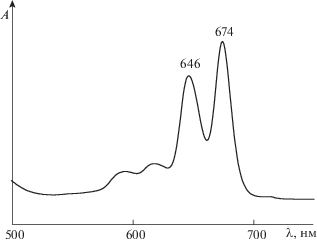
Предварительными исследованиями установлено, что электронный спектр поглощения (ЭСП) H2Pa((C6H4Bu)2Pyz)4 в среде нейтрального бензола имеет в видимой области расщепленную Q-полосу с λI = 674 и λII = 646 нм, соответствующую D2h-симметрии π-хромофора молекулы (рис. 1). При замене бензола на слабоосновный диметилсульфоксид в ЭСП H2Pa((C6H4Bu)2Pyz)4 регистрируется нерасщепленная Q-полоса с λ = = 664 нм, характерная для D4h-симметрии тетрапиразинопорфиразинового макроцикла (рис. 2). Повышение симметрии молекулы от D2h до D4h, происходящее в результате изменения энергий высшей заполненной и низшей вакантной молекулярных орбиталей [5], указывает на то, что H2Pa((C6H4Bu)2Pyz)4, как и H2Pa(Ph2Pyz)4 [2], в присутствии DMSO проявляет свойства двухосновной NH-кислоты и образует комплекс с переносом протонов H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO. Следует ожидать, что в этом комплексе делокализованные протоны NH-групп, связанные с двумя внутрициклическими атомами азота и атомом кислорода молекул DMSO, располагаются над и под плоскостью макроцикла [6, 7], а перенос протонов ограничивается стадией образования Н-связанной ионной пары (II). Этому способствует выраженная NH-кислотность тетрапиразинопорфиразинового макроцикла (рK1а = 5.82 [8]) и ионизирующая способность DMSO [9]. При этом не исключается возможность реализации кислотно-основного равновесия с Н-комплексом (Н-ассоциатом I):
Перенос протонов от H2Pa((C6H4Bu)2Pyz)4 к DMSO с образованием разделенных растворителем ионных пар с последующей их диссоциацией представляется маловероятным [10].Рис. 2.
Изменение электронного спектра поглощения H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в системе н-бутиламин – DMSO в течение 15 мин при $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = = 0.51 моль/л, Т = 323 К.
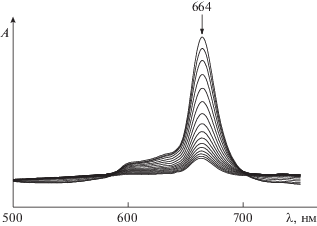
Дальнейшие исследования показали, что комплекс H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO обладает достаточно высокой устойчивостью во времени. Характер его ЭСП в DMSO остается без изменений в течение ~ 90 ч при 318 К. Качественно другая картина наблюдается при введении в DMSO добавок н-бутиламина и диэтиламина. В ЭСП H2Pa((C6H4Bu)2Pyz)4 независимо от природы основания с течением времени регистрируется уменьшение интенсивности нерасщепленной Q-полосы при λ = 664 нм (рис. 2). Одновременно с этим наблюдается изменение ярко-зеленой окраски раствора до бесцветной.
В интервале $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.13–2.00 и $С_{{{\text{E}}{{{\text{t}}}_{{\text{2}}}}{\text{NH}}}}^{^\circ }$ = 1.20–7.23 моль/л в DMSO процесс деструкции H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO имеет первый порядок по комплексу с переносом протонов (рис. 3) и близкий к единице (в пределах экспериментальной ошибки) по основанию (рис. 4). Следовательно,
где kн и k – наблюдаемая константа скорости деструкции и константа скорости деструкции второго порядка соответственно; В – BuNH2 и Et2NH; С1 – концентрация H2Pa((C6H4Bu)2Pyz)4. Аналогичным кинетическим уравнением второго порядка описывается деструкция комплекса H2Pa(Ph2Pyz)4 ⋅ 2DMSO [2].Рис. 3.
Зависимости lg(C°/C) от времени деструкции комплекса H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в системе азотсодержащее основание – DMSO при Т = 323 К и $С_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.51 моль/л (1), $С_{{{\text{E}}{{{\text{t}}}_{{\text{2}}}}{\text{NH}}}}^{^\circ }$ = 7.23 моль/л (2).
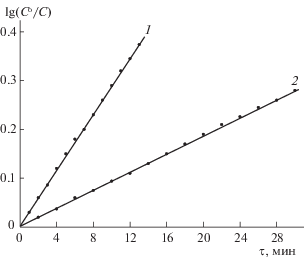
Рис. 4.
Зависимости $\lg {{k}_{{\text{н}}}}$ от $\lg С_{{\text{В}}}^{^\circ }$ для деструкции комплекса H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в системе азотсодержащее основание – DMSO при 303 К в присутствии н-бутиламина (1) и диэтиламина (2).

Наиболее вероятная причина распада макроцикла связана с протеканием конкурентной реакции за протон:
(6)
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{({{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{Bu}})}_{{\text{2}}}}{\text{Pyz}})}_{4}} \cdot 2{\text{DMSO}} + {\text{В}}\;\xrightarrow{{{{k}_{{\text{1}}}}}} \\ \xrightarrow{{{{k}_{{\text{1}}}}}}\;{{{\text{[HPa((}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{Bu}}{{{\text{)}}}_{{\text{2}}}}{\text{Pyz}}{{{\text{)}}}_{{\text{4}}}} \cdot {\text{DMSO}}]}^{ - }} + \\ + \;{\text{Н}}{{{\text{В}}}^{ + }} + {\text{DMSO}}, \\ \end{gathered} $(7)
$\begin{gathered} {{[{\text{HPa((}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{Bu}}{{{\text{)}}}_{{\text{2}}}}{\text{Pyz}}{{{\text{)}}}_{4}} \cdot {\text{DMSO}}]}^{ - }} + {\text{В}}\;\xrightarrow{{{{k}_{2}}}} \\ \xrightarrow{{{{k}_{2}}}}\;{{[{\text{Pa}}{{({{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{Bu}})}_{{\text{2}}}}{\text{Pyz}})}_{{\text{4}}}}]}^{{2 - }}} + {\text{Н}}{{{\text{В}}}^{ + }} + {\text{DMSO}}. \\ \end{gathered} $На стадиях (6) и (7) молекулы азотсодержащего основания, благодаря выраженной протоноакцепторной способности, вытесняют молекулы DMSO. При этом высокая ионизирующая способность среды благоприятствует диссоциации комплекса с переносом протонов с образованием дианионной формы [Pa((C6H4Bu)2Pyz)4]2–. Она относится к группе симметрии D4h [5], и поэтому не отличается от электронного спектра поглощения H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO. Из-за отсутствия компенсации избыточного заряда в макроцикле дианионная форма окта(4-трет-бутилфенил)тетрапиразинопорфиразина подвергается самопроизвольному распаду с образованием низкомолекулярных бесцветных продуктов реакции. Изменение ЭСП H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в присутствии значительного избытка основания происходит без спектральной регистрации промежуточного комплекса [HPa((C6H4Bu)2Pyz)4 ⋅ ⋅ DMSO]–. Этот факт позволяет полагать, что k1 < < k2. Однако детальный механизм деструкции тетрапиразинопорфиразинового макроцикла представляется чрезвычайно сложным и требует специального углубленного изучения.
Из данных (табл. 1) видно, что процесс деструкции H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в системе основание – DMSO характеризуется низкими значениями констант скорости и достаточно высокими значениями энергии активации (Еа) процесса. Причина этого явления связана с особенностями строения тетрапиразинопорфиразинового макроцикла. Непрерывное π,π-перекрывание по внутреннему 16-членному контуру (С8N8), а также увеличение числа π-электронов в ароматической системе за счет мезо-атомов азота и ее расширение в результате аннелирования четырех пиразиновых колец способствует увеличению затрат энергии на преодоление сил электростатического отталкивания с молекулами основания. Наряду с этим, объемные трет-бутилфенильные заместители, находящиеся в частичном сопряжении с ароматической π-системой макроцикла, создают пространственные помехи для благоприятного контакта молекул-партнеров, что, по-видимому, вносит основной вклад в кинетические параметры деструкции H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO.
Таблица 1.
Кинетические параметры реакции деструкции H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO в системе азотсодержащее основание – DMSO, ([H2Pa((C6H4Bu)2Pyz)4 ⋅ ⋅ 2DMSO]0 = 1.05 × 10–5 моль/л)
| $С_{{\text{В}}}^{^\circ }$, моль/л | Т, К | kн × 104, c–1 | k × 104, л/(моль c) | Еа, кДж/моль |
|---|---|---|---|---|
| н -Бутиламин | ||||
| 0.13 | 298 | 0.30 | 2.20 | 46 |
| 303 | 0.40 | 2.95 | ||
| 313 | 0.70 | 5.10 | ||
| 323 | 1.25 | 9.00 | ||
| 0.26 | 298 | 0.60 | 2.10 | 45 |
| 303 | 0.80 | 2.80 | ||
| 313 | 1.40 | 4.90 | ||
| 323 | 2.40 | 8.60 | ||
| 0.51 | 298 | 1.10 | 2.10 | 47 |
| 303 | 1.51 | 2.86 | ||
| 313 | 2.65 | 5.00 | ||
| 323 | 4.80 | 9.00 | ||
| 1.01 | 298 | 2.05 | 2.00 | 46 |
| 303 | 2.77 | 2.75 | ||
| 313 | 4.90 | 4.85 | ||
| 323 | 8.60 | 8.50 | ||
| 2.00 | 298 | 4.15 | 2.15 | 46 |
| 303 | 5.60 | 2.90 | ||
| 313 | 9.85 | 5.10 | ||
| 323 | 17.50 | 9.05 | ||
| Диэтиламин | ||||
| 1.20 | 298 | 0.03 | 0.03 | 70 |
| 303 | 0.05 | 0.04 | ||
| 313 | 0.13 | 0.11 | ||
| 323 | 0.28 | 0.23 | ||
| 2.41 | 298 | 0.06 | 0.02 | 72 |
| 303 | 0.09 | 0.04 | ||
| 313 | 0.23 | 0.10 | ||
| 323 | 0.53 | 0.23 | ||
| 4.82 | 298 | 0.12 | 0.03 | 70 |
| 303 | 0.20 | 0.04 | ||
| 313 | 0.47 | 0.10 | ||
| 323 | 1.11 | 0.25 | ||
| 7.23 | 298 | 0.16 | 0.02 | 73 |
| 303 | 0.26 | 0.04 | ||
| 313 | 0.72 | 0.11 | ||
| 323 | 1.57 | 0.24 | ||
Как и следовало ожидать, пространственное экранирование неподеленной электронной пары атома азота в амине объемными алкильными заместителями ингибирует процесс деструкции комплекса с переносом протонов, поскольку затрудняет протекание стадий (6) и (7). Так, максимальная скорость распада комплекса H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO наблюдается в присутствии н-бутиламина (${\text{р}}K_{{\text{a}}}^{{298}}$ = 10.60 [11]). При переходе к близкому по протоноакцепторной способности диэтиламину (${\text{р}}K_{{\text{a}}}^{{298}}$ = 10.84 [11]) скорость деструкции, судя по величинам k298 (табл. 1), уменьшается более, чем в 60 раз на фоне роста Еа процесса. В случае три-н-бутиламина (${\text{р}}K_{{\text{a}}}^{{298}}$ = 10.97 [11]) комплекс H2Pa((C6H4Bu)2Pyz)4 ⋅ ⋅ 2DMSO не подвергается деструкции. На это указывает характер ЭСП окта(4-трет-бутилфенил)тетрапиразинопорфиразина в системе DMSO – Bu3N. Интенсивность Q-полосы с λ = = 664 нм не изменяется в течение ~58 ч при 333 К. Наряду с увеличением числа алкильных заместителей в амине дестабилизации комплекса с переносом протонов противодействует разветвление углеводородной цепи в молекуле основания. В системе DMSO – ButNH2 комплекс H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO обладает аналогичной устойчивостью, как и в DMSO.
Анализ кинетических данных (табл. 1, 2) показывает, что деструкция комплексов с переносом протонов замещенных тетрапиразинопорфиразина характеризуется достаточно близкими значениями констант скорости. При этом значение Еа процесса возрастает при переходе от H2Pa(Ph2Pyz)4 ⋅ 2DMSO к H2Pa((C6H4Bu)2Pyz)4 ⋅ 2DMSO. Этот факт не является неожиданным, если принять во внимание, что трет-бутилфенильные заместители в отличие от фенильных проявляют более сильный экранирующий эффект и, как следствие, приводят к росту энергетических затрат в ходе протекания конкурентной реакции за протон.
Таблица 2.
Кинетические параметры реакции деструкции H2Pa(Ph2Pyz)4 ⋅ 2DMSO в системе азотсодержащее основание – DMSO [2] ([H2Pa(Ph2Pyz)4 ⋅ 2DMSO]0 = = 1.20 × 10–5 моль/л)
| Основание (В) | $С_{{\text{В}}}^{^\circ }$, моль/л | $k_{{\text{н}}}^{{298}}$ × 104, c–1 | k298 × 104, л/(моль c) | Еа, кДж/моль |
|---|---|---|---|---|
| н-Бутиламин | 0.63 | 1.71 | 2.48 | 28 |
| Диэтиламин | 4.82 | 0.28 | 0.04 | 62 |
Список литературы
Novakova V., Donzello P.A., Ercolani C. et al. // Coord. Chem. Rev. 2018. V. 361. № 4. P. 1.
Петров О.А., Стужин П.А., Иванова Ю.Б. // Журн. физ. химии. 2008. Т. 82. № 2. С. 266.
Осипова Г.В., Петров О.А., Ефимова С.В. // Журн. общ. химии. 2013. Т. 83. Вып. 3. С. 510.
Иванова Ю.Б., Дмитриева О.А., Хрушкова Ю.В. и др. // Там же. 2020. Т. 90. № 5. С. 760.
Stuzhin P., Khelevina O., Berezin B. // Phthalocyanines: Properties and Applications. N.Y.: VCH Publ. Inc., 1996. V. 4. P. 23.
Kokareva E.A., Petrov O.A., Khelevina O.G. // Macroheterocycles. 2009. V. 2. № 2. P. 157.
Петров О.А., Аганичева К.А., Гамов Г.А., Киселев А.Н. // Журн. физ. химии. 2020. Т. 94. № 9. С. 1379.
Stuzhin P.A. // J. Porphyrins Phthalocyanines. 2003. V. 7. № 12. P. 813.
Райхардт К. Растворители и эффекты среды в органической химии. М.: Мир, 1991. 764 с.
Молекулярные взаимодействия / Под ред. Г. Ратайчака, У. Орвилл-Томаса. М.: Мир, 1984. 599 с.
CHC Handbook of Chemistry and Physics / Ed. by William M. Haynes. 2013. 2668 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии