Журнал физической химии, 2021, T. 95, № 8, стр. 1255-1261
Влияние озонирования на сорбционные свойства лигноцеллюлозных материалов по отношению к катионному красителю
Е. М. Бенько a, *, Н. А. Мамлеева a, А. Н. Харланов a
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: benko_elena@mail.ru
Поступила в редакцию 18.11.2020
После доработки 18.11.2020
Принята к публикации 25.11.2020
Аннотация
Получены и проанализированы изотермы адсорбции метиленового голубого (МГ) из водных растворов на сульфатном лигнине, древесине осины и образцах древесины, предварительно обработанных озоном. Изотермы адсорбции описаны моделью Ленгмюра. Определены значения адсорбционной емкости, удельной поверхности и константы адсорбционного взаимодействия. Установлено, что предобработка древесины озоном приводит к уменьшению константы связывания красителя с поверхностью, сорбционная емкость практически не меняется. С использованием данных ИК-спектроскопии показано, что озонированные лигноцеллюлозные материалы отличаются высоким содержанием карбонильных и карбоксильных групп, способных к электростатическому взаимодействию и ионному обмену, и низким содержанием ароматических структур. Сделан вывод о том, что присутствие в растительном сорбенте лигнина способствует повышению эффективности сорбции красителя.
В связи с проблемой рационального использования природных ресурсов расширяется поиск новых областей применения растительных лигноцеллюлозных материалов, которые являются промышленными и сельскохозяйственными отходами. Среди них лигнин, древесные опилки, древесная кора, пшеничная и рисовая солома, подсолнечная лузга, кукурузные початки, рисовая шелуха и др. Один из вариантов утилизации таких отходов – получение на их основе так называемых “сорбентов низкой стоимости”.
Адсорбционные технологии широко используются для удаления органических и неорганических загрязнителей из промышленных и бытовых сточных вод, преимущественно в тех случаях, когда концентрация этих веществ в воде невелика, и они биологически не разлагаются или сильно токсичны.
Помимо доступности и дешевизны, достоинство сорбентов на основе растительных биополимеров – их физико-химические характеристики – наличие разнообразных функциональных групп, способных осуществлять различные типы взаимодействия между адсорбентом и адсорбатом. Кроме того, сорбционную емкость и селективность таких сорбентов можно изменять путем их модифицирования. Для этих целей используют разнообразные физические и химические методы активации: паровой взрыв в присутствии СО2 и NH3, термическую обработку с добавлением химикалий (Na2CO3, Na2SO4, NaCl, KCl, KOH, H3PO4, ZnCl2), микроволновое излучение, химическую обработку для введения кислород-, азот-, серосодержащих функциональных групп или удаления из биомассы тех или иных компонентов. Методы активации и сорбционные свойства материалов на основе растительной биомассы по отношению к красителям, ионам тяжелых металлов и другим органическим и неорганическим загрязнителям обсуждаются в обзорах [1–5].
Один из способов модифицирования лигноцеллюлозных материалов – их делигнификация путем озонирования. Обработанные озоном лигноцеллюлозные материалы характеризуются более высоким содержанием полярных групп [6, 7] и наличием в клеточных стенках дополнительных пор, которые образуются при удалении лигнина и части гемицеллюлоз [8, 9]. Однако данных о влиянии озонирования на пористую структуру и сорбционные свойства растительной биомассы в литературе практически нет, не считая противоречащих друг другу результатов работ [10, 11].
Цель настоящей работы – изучение изменений сорбционных свойств лигноцеллюлозного материала (древесных опилок) при удалении лигнина в процессе обработки озоном. В качестве адсорбата выбран катионный краситель метиленовый голубой (МГ), который часто используется в качестве модельного вещества для изучения сорбционных свойств различных материалов. Для выяснения роли лигнина в связывании красителя также исследована адсорбция МГ на лигнине.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Адсорбенты: древесные опилки осины (Populus tremula, фракция 0.6–1.0 мм), а также лигнин сульфатного производства целлюлозы (ОАО “Архангельский целлюлозно-бумажный комбинат”).
Методика озонирования опилок и способ расчета количества поглощенного озона (расхода озона) подробно описаны в [12]. После обработки озоном образцы промывали водой и высушивали на воздухе.
Адсорбат: катионный краситель метиленовый голубой (МГ) (N,N,N',N'-тетраметилтионина хлорид тригидрат) C16H18CIN3S ⋅ 3H2O – реактив марки “ч.д.а.”, производства ОАО “Шосткинский завод химических реактивов”.
Адсорбцию МГ проводили из растворов в дистиллированной воде при комнатной температуре. Навеска опилок составляла 20–50 мг, объем раствора 10–20 мл, концентрация МГ 10–5–10–4 моль/л. Навеска лигнина 300–500 мг, объем раствора 15 мл, концентрация МГ 10–4–10–3 моль/л, рН 5.4. Время адсорбции 7 суток. Концентрацию МГ в контактном растворе определяли по оптическому поглощению при длине волны λ = 665 нм (ε665 = 6.3 × 104 л/моль см) на спектрофотометре Cary 3E Varian.
Величину адсорбции находили по формуле:
где с0 и с – начальная и равновесная концентрация раствора, V – объем раствора, m – масса абсолютно сухого материала.Для описания экспериментальных данных использовали адсорбционную модель Ленгмюра:
(1)
$\frac{1}{\Gamma } = \frac{1}{{b{{\Gamma }_{{\text{m}}}}}}\frac{1}{c} + \frac{1}{{{{\Gamma }_{{\text{m}}}}}},$Удельную площадь поверхности адсорбента определяли, предполагая, что МГ образует монослойное заполнение с плоской ориентации молекул:
где Аm = 106 × 10–20 м2 – эффективная площадка молекулы метиленового голубого [13], NA – число Авогадро, Гm – величина предельной адсорбции (моль/г).Коэффициенты распределения красителя между твердой и жидкой фазами Kэф (л/г) рассчитывали по начальному участку изотермы как отношение равновесной адсорбции Г (моль/г) к равновесной концентрации с (моль/л).
ИК-спектры регистрировали на приборе Bruker Equinox 55/S в режиме пропускания. Образцы лигнина и древесины дополнительно измельчали, смешивали с КВr и прессовали в таблетки массой 300 мг. Содержание анализируемого материала в таблетках с КВr составляло 0.125 мас. % для древесины и 0.5% для лигнина. Экспериментальные ИК-спектры древесины преобразовывались в единицы оптической плотности (D) с помощью программы OPUS 6.0 (Bruker).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ИК-спектр лигнина
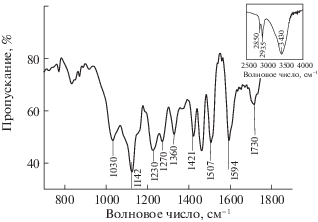
Лигнины – природные полимеры нерегулярного строения, состоящие, в основном, из фенилпропановых субъединиц. Лигнин лиственной древесины содержит гваяцильные и сиренгильные структурные субъединицы, лигнин хвойной древесины на ~90% состоит из гваяцильных структур [14]. В ИК-спектре лигнина (рис. 1) видны интенсивные полосы поглощения при 1594, 1507, 1430 см–1 – скелетные колебания ароматического кольца; 1142 см–1 – плоскостные деформационные колебания С–Н-связи гваяцильных колец; 1030 см–1 – деформационные плоскостные колебания связей в ароматическом кольце гваяцильного типа и деформационные колебания С–О в первичных спиртах [15, 16]; 1230, 1270 см–1 – колебания гваяцильного кольца с валентными колебаниями С–О-групп. Полоса 1730 см–1 валентных С=О колебаний карбоксильных групп с алифатическим заместителем имеет низкую интенсивность. Полосы поглощения валентных С–Н-колебаний в метильных и метиленовых группах ЛГ наблюдаются при 2850 и 2935 см–1; при 3430 см–1 – О–Н-колебания гидроксогрупп, связанных водородной связью.
Таким образом, адсорбент характеризуется спектром, типичным для лигнинов с ароматическими структурами гваяцильного типа; содержит алифатические и кислородсодержащие структуры. По данным [17], сульфатный лигнин содержит 16.0 мас. % ОСН3, 0.75 мас. % карбоксильных СО–ОН, 2.98 мас. % фенольных ОН, карбонильных С=О – 3.58 мас. %.
Адсорбция метиленового голубого на лигнине
На рис. 2 приведена изотерма адсорбции МГ на лигнине и результат ее моделирования в линейных координатах уравнения Ленгмюра (1). Адсорбция обратима. При адсорбции из растворов модель Ленгмюра предполагает формирование монослоя, образующегося вследствие конкуренции между адсорбированным веществом и растворителем. В этом случае значение Гm соответствует полному вытеснению растворителя из монослоя. Адсорбированный слой рассматривают как двумерную фазу, в которой соотношение компонентов определяется различием в энергии их взаимодействия с поверхностью адсорбента, а суммарное относительное заполнение поверхности адсорбента молекулами компонентов раствора всегда равно единице [18].
Рис. 2.
Изотерма адсорбции МГ на лигнине (а) и линеаризация изотермы в координатах уравнений (1) (б) и (3) (в).

Для двухкомпонентной системы изотермическое адсорбционное равновесие записывается как
где y2 и x2 – мольные доли растворенного вещества в адсорбированной фазе и в равновесном объемном растворе, x2= n2/(n1+ n2), y2= (a2/a1+ a2), n1, n2 – число молей компонентов раствора, a1– полная удельная адсорбция компонента 1 (воды), a2 – полная удельная адсорбция компонента 2 (МГ), f2 и fa2 – коэффициенты активности, K2 – парциальная константа равновесия, а уравнение (2) соответствует парциальной изотерме адсорбции компонента 2 из раствора. При расчете y2 учитывается величина адсорбционного объема Va, считая, что Va = a2Vm, Vm – молярный объем растворенного вещества. Количество адсорбированной воды определяется из соотношения:${{a}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = (Va – a2Vm)/${{V}_{m}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}$. Полагая, что Г ~ а2 и f2 → 1 для разбавленных растворов МГ,
(3)
${{K}_{2}} = ({{y}_{2}}{\text{/}}{{x}_{2}})\quad {\text{или}}\quad \lg {{y}_{2}} = \lg {{K}_{2}} + \lg {{x}_{2}}.$Согласно проведенным расчетам, образованию монослоя МГ на поверхности лигнина соответствует Гm = 1.54 × 10–4 моль/г. Если предположить плоское расположение молекул красителя на поверхности, то величина поверхности составит Sуд = 98 м2/г.
Значение K2 = 15490, а стандартное мольное уменьшение свободной энергии при достижении изотермического равновесия (–ΔG° = RT$\ln {{K}_{2}}$) = = 24.1 кДж/моль. По-видимому, основная часть МГ адсорбируется на гидрофобных областях полимера за счет дисперсионных взаимодействий π-систем МГ с фенольными и алифатическими структурами лигнина. Дефицит электронной плотности на системе сопряжения катиона красителя обусловливает сродство МГ к богатым электронной плотностью ароматическими группами полимера и способствует дополнительным взаимодействиям с электроотрицательными (ОН, С=О, СОО– и др.) группами поверхности.
В работе [19] исследованы сорбционные свойства сульфатного лигнина по отношению к фенолу. Удельная поверхность по фенолу составила Sуд = 90 м2/г, что близко к величине, определенной по адсорбции МГ. Величина изменения свободной энергии для фенола, который сорбируется на лигнине за счет дисперсионных взаимодействий, –∆G° = 16.7 кДж/моль. Тот факт, что в случае МГ значение –∆G° существенно больше, согласуется с представлением, согласно которому, сорбция катионного красителя на лигнине осуществляется вследствие комбинации дисперсионных и кулоновских взаимодействий катиона МГ с неполярными и отрицательно заряженными группами лигнина.
ИК-спектры образцов древесины
На рис. 3 представлены ИК-спектры поглощения образцов древесины при различных значениях удельного расхода озона. ИК-спектр исходного образца характеризуется полосой 1506 см–1 валентных С–С-колебаний ароматических колец. [16]. По мере возрастания количества поглощенного озона интенсивность полосы 1506 см–1 уменьшается, что указывает на деструкцию ароматических структур. У озонированных образцов интенсивность полос поглощения валентных колебаний С–О и С–О–С при 1165, 1100 и 1059 см–1, характерных для углеводов, возрастает. Интенсивность полосы 1736 см–1 (валентные С=О-колебания карбонильных и карбоксильных групп с алифатическим заместителем) у озонированных образцов возрастает [16, 20].
Рис. 3.
ИК-спектры поглощения образцов озонированной древесины. Количество поглощенного озона: 0 (1), 1.4 (2), 2.3 (3) и 3.6 ммоль/г (4).

В табл. 1 приведены значения Dν/${{D}_{{\nu \;{\text{исх}}}}}$ для полос поглощения 1736 и 1506 см–1, которые указывают на изменение соотношения ароматических и карбоксильных групп в исследованных образцах ЛЦМ (${{D}_{{\nu \;{\text{исх}}}}}$ и Dν – значения оптической плотности полосы ν в исходном и озонированном образцах). Наиболее заметные изменения Dν/${{D}_{{\nu \;{\text{исх}}}}}$ соответствуют поглощению первых порций озона, достигаемых за 5–10 мин обработки озоном.
Таблица 1.
Доля водорастворимых продуктов озонирования (ПР), содержание остаточного лигнина (ЛГ), значения (Dν/${{D}_{{\nu \;{\text{исх}}}}}$) в ИК-спектрах ЛЦМ и параметры изотерм адсорбции МГ в зависимости от количества поглощенного озона при различной продолжительности озонирования (t)
| № | t, мин | [О3] × 103, моль/г |
ПР, % [12] |
ЛГ, % [23] |
Dν/${{D}_{{\nu \;{\text{исх}}}}}$ | Kэф, л/г |
Гm × 105, моль/г |
Sуд, м2/г |
R2 | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1736 см–1 | 1506 см–1 | |||||||||
| 1 | 0 | 0 | 0 | 24 | 1.0 | 1.0 | 2.8 | 8.5 | 54 | 0.9925 |
| 2 | 7 | 1.4 | 15 | 12 | 1.48 | 0.52 | 1.3 | 7.7 | 50 | 0.9987 |
| 3 | 15 | 2.3 | 30 | – | 1.53 | 0.49 | 1.1 | 8.3 | 53 | 0.9843 |
| 4 | 60 | 3.6 | 35 | 10 | 1.63 | 0.49 | 1.3 | 8.3 | 53 | 0.9992 |
Полоса поглощения 3440 см–1 относится к валентным колебаниям ОН-групп, связанных водородными связями, полосы 2922 и 2854 см–1 – к валентным С–Н-колебаниям в СН3-, СН2- и СН-группах. Эти полосы у озонированных образцов практически не меняются. Полоса 1633 см–1 деформационных колебаний воды присутствует во всех образцах [20].
Таким образом, данные ИК-спектров показывают, что обработка древесины осины озоном приводит к разрушению ароматики и образованию материала с высоким содержанием кислородсодержащих групп. Этот вывод согласуется с результатами определения содержания лигнина в озонированных образцах из древесины осины: при расходе озона 1.5 ммоль/г содержание ЛГ падает с 24% до 12% (степень делигнификации 50%) [21].
Сорбция метиленового голубого на образцах озонированной древесины
Исследовали три озонированных образца, отличающиеся продолжительностью озонирования и количеством поглощенного озона. Известно, что под действием озона происходит окислительная деструкция лигнина с разрывом ароматических колец и образованием водорастворимых алифатических кислот [22]. Помимо продуктов озонолиза лигнина, часть гемицеллюлоз, и экстрактивных веществ может быть также удалена из озонированного образца промыванием. Доля водорастворимых продуктов озонирования (ПР) и содержание остаточного лигнина (ЛГ) в зависимости от количества поглощенного озона приведены в табл. 1.
В исходном образце древесины осины содержится 24% лигнина, 45% целлюлозы и 26% гемицеллюлоз. При расходе озона 3.6 ммоль/г содержание лигнина в образцах снижается до 10% [23]. Из табл. 1 следует, что, несмотря на различия в продолжительности обработки озоном (7, 15, 60 мин) и количестве поглощенного озона (1.4, 2.3, 3.6 ммоль/г), величины содержания остаточного лигнина в образцах 2–4 различаются мало. Как показано в [24, 25], на начальных этапах озонирования растительной биомассы озон расходуется преимущественно на реакции с лигнином, и его содержание резко снижается. По мере деструкции доступного для озона лигнина начинают преобладать реакции озона с другими компонентами растительной биомассы и промежуточными продуктами озонирования. В результате деструкция лигнина замедляется.
При озонировании растительной биомассы протекают также реакции, приводящие к модифицированию ее компонентов кислородсодержащими функциональными группами. Согласно данным ИК-спектров, обработанные озоном образцы характеризуются повышенным содержанием карбонильных и карбоксильных групп (рис. 3, табл. 1).
Таким образом, полученные лигноцеллюлозные материалы № 2–4 отличаются от исходной древесины более низким и примерно одинаковым содержанием лигнина (10–12%), а также наличием карбоксильных и карбонильных функциональных групп, количество которых заметно возрастает по мере увеличения расхода озона (от образца № 2 к образцу № 4).
Обработка озоном может приводить к структурным изменениям биополимерного композита. Например, к появлению микропор вследствие удаления лигнина и гемицеллюлоз и реорганизации микрофибрилл целлюлозы в делигнифицированной клеточной стенке [8–11, 26–28]. Некоторые поры могут стать недоступны для адсорбата из-за отложения на поверхности биомассы продуктов озонирования, например, продуктов поликонденсации ароматических фрагментов лигнина [7, 29] или нерастворимых оксалатов кальция [6, 30]. Оксалаты образуются при взаимодействии примесных солей кальция с продуктом озонолиза лигнина – щавелевой кислотой.
Изотермы адсорбции метиленового голубого на исходных и обработанных озоном опилках осины приведены на рис. 4. Во всех случаях наблюдается адсорбционно-десорбционный гистерезис. Гистерезис может быть обусловлен кинетическими причинами – длительностью установления адсорбционно-десорбционного равновесия. Перенос крупных молекул красителя из раствора в полимерный материал и обратно контролируется процессами набухания адсорбента и внутренней диффузии адсорбата в капиллярно-пористой структуре адсорбента [30, 31].
Рис. 4.
Изотермы адсорбции МГ на образцах исходной (1) и озонированной (2–4) древесины (а) и их линеаризация в координатах уравнения Ленгмюра (б). Количество поглощенного озона: 0 (1), 1.4 (2), 2.3 (3) и 3.6 ммоль/г (4). Пунктиром показаны десорбционные ветви изотерм № 1 и № 4.
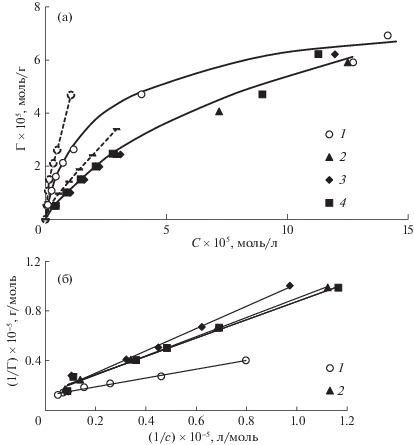
Другая возможная причина адсорбционно-десорбционного гистерезиса – химическая неоднородность адсорбента, который включает компоненты, обладающие различными адсорбционными свойствами по отношению к МГ. Лигнин способен извлекать МГ из водных растворов, в основном, за счет дисперсионных и π–π-взаимодействий. Целлюлоза может необратимо адсорбировать катионные красители благодаря сочетанию электростатического взаимодействия и ионного обмена [32].
Из изотерм адсорбции видно, что обработанные озоном образцы древесины характеризуются более низким, чем исходные, сродством к МГ. Принципиальных различий между озонированными образцами 2–4 не наблюдается. Уменьшение сродства МГ к поверхности лигноцеллюлозных материалов при частичном удалении лигнина и при одновременном увеличении содержания карбоксильных групп (центров ионного взаимодействия) свидетельствует о преобладающей роли дисперсионных и π–π-взаимодействий в связывании красителя с сорбентом. В литературе имеются сведения о том, что присутствие небольшого количества лигнина в сорбентах на основе целлюлозы повышает эффективность связывания красителей и ароматических соединений [33, 34].
Из изотерм следует, что величина емкости монослоя для всех образцов практически одинакова. Это означает, что после озонной обработки структурных превращений, существенным образом изменяющих долю поверхности, доступной для молекул красителя, не происходит.
Поскольку увеличение содержания в озонированных образцах карбоксильных групп, способных осуществлять ионное взаимодействие с МГ, также не влияет на сорбционную емкость, то можно заключить, что МГ связывается с растительным сорбентом в основном за счет адсорбционного взаимодействия, а не ионного обмена.
Полученные экспериментальные изотермы адсорбции удовлетворительно описываются моделью мономолекулярной адсорбции Ленгмюра (рис. 4б). Рассчитанные эффективные константы распределения красителя между твердой и жидкой фазой (Kэф), величины емкости монослоя (Гm) и удельной площади поверхности (Sуд), доступной для молекул МГ, для исходного и озонированных образцов приведены в табл. 1.
Сравнение полученных значений сорбционной емкости по МГ с литературными данными для других растительных материалов показывает адекватность найденных величин (табл. 2).
Таблица 2.
Адсорбционная емкость растительных сорбентов (по МГ)
| Сорбенты | Емкость, мг/г | Ссылки | |
|---|---|---|---|
| Лигнин | щелочной (стебли кукурузы) | 121.2 | [35] |
| уксуснокислый (щепа эвкалипта) | 63.3 | [36] | |
| муравьинокислый (жом сахарного тростника) | 34.2 | [37] | |
| органосольвентный (рисовая солома) | 40.0 | [38] | |
| сульфатный (хвойный) | 57.6 | [*] | |
| Древесина | вишни | 39.8 | [39] |
| грецкого ореха | 59.2 | ||
| дуба | 29.9 | ||
| сосны | 27.8 | ||
| осины | 27.1 | [*] | |
Таким образом, на основании проведенных исследований и литературных данных можно заключить, что связывание МГ на поверхности лигноцеллюлозных растительных материалов является сложным процессом, включающим как адсорбцию, так и ионный обмен. В адсорбционном взаимодействии основную роль, по-видимому, играет гидрофобный ароматический полимер лигнин. Древесные опилки и лигнин можно рассматривать в качестве перспективных сорбентов для удаления катионных красителей из промышленных сточных вод. Эти материалы возобновляемы, доступны, имеют низкую стоимость. Однако для их успешной реализации на практике требуются дальнейшие исследования, направленные на выяснение механизма сорбции, а также определение оптимальных условий ее проведения.
Список литературы
Supanchaiyamat N., Jetsrisuparb K., Knijnenburg J.T.N. et al. // Bioresour Technol. 2018. https://doi.org/10.1016/j.biortech.2018.09.139
Shukla A., Yu-Hui Zhang, Dubey P. et al. // Journal of Hazardous Materials. 2002. V. B95. P. 137.
Mohd R., Othman S., Rokiah H. et al. // J. Hazard Mater. 2010. V. 177. P. 70 https://doi.org/10.1016/j.jhazmat.2009.12.047
Yagub M.T., Sen T.K., Afroze S. et al. // Advances in Coll. Interface Science. 2014. V. 209. P. 172. https://doi.org/10.1016/j.cis.2014.04.002
Boushew A., Shen X., Edyvean R.G. // J. Wat. Res. 1997. V. 31. № 8. P. 2084.
Mamleeva. N.A., Autlov S. A.,Bazarnova N.G. et al. // Russ. J. Bioorg. Chem. 2016. V. 42. № 7. P. 694.
Мамлеева Н.А., Бабаева Н.А., Харланов А.Н., Лунин В.В. // Журн. физ. химии. 2019. Т. 93. № 1. С. 28.
Benko E.V., Chukhchin D.G., Lunin V.V. // Holzforschung, 2020.https://doi.org/10.1515/hf-2019-0168
Travaini R., Otero M.D.M., Coca M. et al. //Bioresour. Technol. 2013. V. 133. P. 332.
Yasuo Kojina, Seung-Lak Yoon // J. Mater Cycles Waste Manag. 2008. V. 10. P. 134.
Zhiying Yu, Hasan Jameel, Hou-min Chang et al. // Bioresource Technology. 2011. V. 102. P. 9083.
Ben’ko E.M., Manisova O.R., Lunin V.V. // Russ. J. Phys. Chem. A. 2013. V. 87. № 7. P. 1131.
Методы определения удельной поверхности. ГОСТ 13144-79 Графит. https://doi.org/wiki-numbers.ru/gost/gost-13144-79.
Holladay J.E., Bozell J.J., White J.F. et al. // Top Value-Added Chemicals from Biomass. V.II.2007. USA. https://doi.org/www.ntis.gov/ordering.htm
Derkacheva O.Yu., Sukhov D.A. // Modern Polymer Spectrosocopy, Macromol. Symp. Wiley-VCH. 2008. V. 265. № 1. P. 61.
Schwanninger M., Rodrigues J.C., Pereira H. et al. // Vibrational Spectroscopy. 2004. V. 36. P. 23. https://doi.org/1016/j.vibspec.2004.02.003
Худошин А.Г. Кинетика и механизм окисления лигнина и его модельных соединений озоном в присутствии ионов Mn(II): дис…. канд. хим. наук: 02.00.15. Моск. гос. ун-т им. М.В. Ломоносова. Москва 2008. 200 с. https://doi.org/mydisser.com/ru/catalog/view/120241.html
Когановский А.М., Клименко И.А., Левченко Т.М., Рода И.Г. Адсорбция органических веществ из раствора. Л.: Химия. 1990. 256 с.
Мамлеева Н.А., Лунин В.В. // Журн. физ. химии. 2016. Т. 90. № 3. С. 436.
Смит А. Прикладная ИК-спектроскопия. М.: Мир, 1982. 327 с.
Мамлеева Н.А., Бенько Е.М., Харланов А.Н. и др. // Журн. физ. химии. 2021. Т. 95. № 3.
Bailey P.S. Ozonation in Organic Chemistry. 1982. V. II. Acad Press, New York.
Аутлов С.А., Мамлеева Н.А., Базарнова Н.Г. и др. // Химия растительного сырья. 2007. № 1. С. 25.
Benko E.M., Chukhchin D.G., Mamleeva N.A. et al. // Russ. J. Phys. Chem. A. 2020 V. 94. № 8. P. 1535. https://doi.org/10.1134/S0036024420080038
Мамлеева Н.А., Кустов А.Л., Лунин В.В. // Журн. физ. химии. 2018. Т. 92. № 9. С. 1402.
Giummarella N., Henriksson G., Salmén L. et al. // Nordic Pulp Paper Res. J. 2017. V. 32. № 4. P. 542.
Pönni R., Galvis L., Vuorinen T. // Carbohydrate Polymers. 2014. V. 101. P. 792.
Wan J., Wang Y., Xiao Q. // Bioresour Technol. 2010. V. 101. № 12. P. 4577.
Bule M.V., Gao A.H., Hiscox B. et al. // J. Agric. Food Chemi. 2013. V. 61. P. 3916.
Ben’ko E.M., Manisova O.R., Murav’eva G.P. et al. // Russ. J. Phys. Chem. A. 2013. V. 87. № 7. P. 1118.
Колосовская Е.А., Лоскутов С.Р., Чудинов Б.С. Физические основы взаимодействия древесины с водой. Новосибирск: Наука, 1989. 216 с.
McKay G., Poots V. J. P. // J. Chem. Tech. Biotechnol. 1980. V. 30. № 1. P. 279. https://doi.org/10.1002/jctb.503300134
Wen Y., Yuan Z., Liu X. et al. // Chem. Eng. 2019. V. 7. P. 6131.
Ma M., Liu Z., Hui L. et al. // Int. J. Biol. Macromolecules. 2019. № 9. https://doi.org/10.1016/j.ijbiomac.2019.08.022
Feng Q., Cheng H., Li J. et al. // BioRes. 2014. V. 9. № 2. P. 3602.
Feng Q., Cheng H., Chen F. et al. // J. Wood Chem. Technol. 2015. V. 36. № 3. P. 173. https://doi.org/10.1080/02773813.2015.1104546
Consolin F.N., Venancio E.C., Barriquello M.F. et al. // Eclética Química. 2007. V. 32. № 4. P. 63
Zhang S., Wang Z., Zhang Y. et al. // Procedia Envir. Sci. 20016. V. 31. P. 3.
Ferrero F. // J. Hazardous Mater. 2007. V. 142. № 1–2. P. 144. https://doi.org/10.1016/j.jhazmat.2006.07.072
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии