Журнал физической химии, 2021, T. 95, № 8, стр. 1249-1254
Сорбция кофейной кислоты пирогенным оксидом алюминия из водных растворов
Н. А. Липковская a, *, В. Н. Барвинченко a
a Национальная академия наук Украины, Институт химии поверхности им. А.А.Чуйко
Киев, Украина
* E-mail: lipkovska@ukr.net
Поступила в редакцию 15.07.2020
После доработки 15.07.2020
Принята к публикации 29.09.2020
Аннотация
Проведены комплексные адсорбционные и спектральные исследования взаимодействия кофейной кислоты с пирогенным оксидом алюминия в водных растворах. Показано, что сорбция начинается при рН > 2.5 и достигает максимальных значений в нейтральной среде; изотерма сорбции кофейной кислоты относится к Н-типу, характерному для хемосорбции. Установлено, что адсорбция происходит одновременно по двум механизмам – за счет взаимодействия поверхностных групп сорбента с карбоксильной группой кофейной кислоты, а также с ее орто-гидроксильной группировкой с образованием хелатного комплекса, относительная доля которого растет с увеличением рН раствора.
Кофейная кислота (3,4-диоксикоричная кислота, КК) (HO)2C6H3CH = CHCOOH – представитель подкласса растительных фенилпропаноидов, а именно, гидроксипроизводных коричной кислоты, имеет широкий спектр фармакологических свойств [1–5], в частности, проявляет противовоспалительное, противоопухолевое, гепатопротекторное, кардиопротекторное, антибактериальное, противовирусное действие, что обусловлено, в основном, антиоксидантной активностью. В соответствии с ее различными применениями в пищевой, химической, фармацевтической промышленности и сельском хозяйстве, возрос интерес к методикам извлечения этого соединения из растений, биологически активных добавок, лекарственных препаратов и пищевых продуктов. Для выделения и концентрирования кофейной кислоты из объектов растительного происхождения преимущественно применяют сорбционно-хроматографические методы высокоэффективной жидкостной хроматографии с использованием мезопористых оксидов кремния [6], полимеров на основе стирола и дивинилбензола [7] и с молекулярными отпечатками КК [8], катионного крахмала с четвертичными аммониевыми группами [9].
Мы предположили, что перспективным сорбентом может оказаться оксид алюминия благодаря возможному комплексообразованию его поверхностных групп с КК, которая имеет два потенциальных сайта связывания и способна образовывать комплексы с ионами алюминия [10, 11] в растворах. Действительно, авторы работ [12–14] сделали вывод, что основную роль в закреплении органических аналитических реагентов, содержащих 1,2-дигидроксифенильный фрагмент (пирокатехинового фиолетового, бромпирогаллолового красного, тайрона) на оксиде алюминия, играет образование поверхностного комплекса, подобного существующему в растворе, однако экспериментальные доказательства приведены не были. Нами было показано [15, 16], что природные полифенолы кверцетин и рутин сорбируются на оксиде алюминия за счет взаимодействия пары расположенных рядом гидроксильной и карбонильной групп с недиссоциированной ≡AlOH-группой с образованием на поверхности сорбента хелата, аналогичного комплексам с Al (III) в растворах.
Сведений о сорбции кофейной кислоты, содержащей карбоксильную и две расположенных рядом фенольные ОН-группы, предполагающих возможность нескольких механизмов связывания с поверхностью оксида алюминия, в научной литературе обнаружено не было.
Цель настоящей работы – изучение закономерностей сорбции на поверхности оксида алюминия кофейной кислоты в зависимости от концентрации и кислотности ее водных растворов в широком диапазоне рН, установление взаимосвязи между процессами комплексообразования с ионами алюминия в растворе и на поверхности сорбента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали высокодисперсный пирогенный оксид алюминия Aeroxide Alu C с размером частиц 13 нм и удельной поверхностью 100 м2/г (Evonik Degussa AG) в форме 0.2% водной дисперсии (ионная сила 0.01 н.), которую готовили перемешиванием навесок сорбента (1.00 г) и NaCl (0.29 г) с водой (500 мл) магнитной мешалкой в течение 2 ч. Исходные растворы кофейной кислоты (≥98%, Sigma-Aldrich) готовили растворением точных навесок в горячей дистиллированной воде. Рабочие растворы готовили непосредственно перед экспериментом. Растворы хлористоводородной кислоты и щелочи готовили из концентрированных HCl и NaOH марки “ч.д.а.”. Кислотность растворов до и после сорбции контролировали с помощью стеклянного электрода универсального иономера Hanna instruments HI 221.
Электронные спектры растворов КК до и после смешивания с дисперсией оксида алюминия измеряли на спектрофотометре Specord M-40 (Сarl Zeiss, Jena, Германия) в ячейке для мутных растворов в кварцевых кюветах. С целью устранения влияния фона на аналитический сигнал, полученный при измерении спектров поглощения исследуемых растворов, использовали метод гетерохроматической экстраполяции при двух длинах волн [17].
Сорбцию кофейной кислоты из водных растворов на поверхности оксида алюминия изучали в статических условиях, для чего 10 мл раствора КК различной концентрации смешивали с 10 мл 0.2% водной дисперсии сорбента, устанавливали необходимое значение рН раствора, перемешивали до установления равновесия (2 ч при 20°С) и измеряли спектр поглощения дисперсии (Адисп), поскольку в области исследуемой концентрации (0.1%) она обладает высокой седиментационной устойчивостью и достаточной прозрачностью. Равновесный раствор отделяли центрифугированием (8000 об./мин, 15 мин) и измеряли его спектр (А[С]). Спектр поглощения сорбированной на оксиде алюминия КК (As) определяли как разность:
В качестве образца сравнения использовали дисперсию чистого оксида алюминия, проведенную через все те же стадии, что и исследуемые образцы.В центрифугат добавляли раствор HCl для установления значения рН < 2.5–3.0 (при котором светопоглощение кофейной кислоты практически не зависит от рН), измеряли оптическую плотность и рассчитывали равновесную концентрацию кислоты на основании соответствующего молярного коэффициента поглощения (ε), найденного экспериментально при указанных условиях. Для этого предварительно исследовали зависимость оптической плотности КК от ее концентрации, которая была линеаризована методом наименьших квадратов с коэффициентами корреляции r2 ≥ 0.9997. Величина молярного коэффициента поглощения составляла ε324нм = 1.63 × × 10 М–1 см–1.
Степень извлечения (Е, %) и величину сорбции (а, моль/г) рассчитывали по формулам:
где С и [C] – соответственно исходная и равновесная концентрации кофейной кислоты (М), V – объем раствора (л), m – масса сорбента (г).Изотерму сорбции анализировали с использованием уравнения Ленгмюра:
где a∞ – величина максимальной сорбции (моль/г); K – константа равновесия сорбционного процесса (л/моль). В линейной форме уравнение (1) имеет вид: Построеный в координатах [C]/a – [C] график представляет собой прямую линию, исходя из параметров которой рассчитывали величины максимальной сорбции а∞ и константу равновесия сорбционного процесса K.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектральные свойства сорбированной кофейной кислоты (КК/Al2O3) исследовали на основании непосредственного измерения спектров дисперсии оксида алюминия и соответствующего равновесного раствора, что позволило изучать в одинаковых условиях ее спектральные характеристики в растворах и на поверхности сорбента. На рис. 1 приведены спектры поглощения КК, сорбированной на оксиде алюминия при рН 3.5 (кривая 1), соответствующего равновесного раствора при том же рН (кривая 2), а также спектры поглощения раствора кофейной кислоты при рН 6.5 (кривая 3) и ее комплекса с ионами Al (III) (кривая 4).
Рис. 1.
Спектры кофейной кислоты, сорбированной на оксиде алюминия (1) и в соответствующем равновесном растворе (2), спектры поглощения раствора кофейной кислоты при рН 6.5 (3) и ее комплекса с ионами Al (III) (4); l = 0.1 см, С = 1 × 10–4 М, рН 3.5 (1, 2).
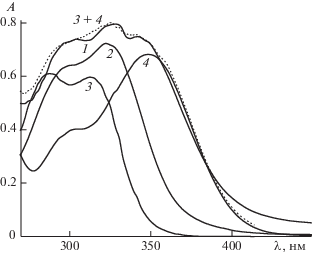
Можно видеть, что спектр КК/Al2O3 (кривая 1) существенно отличается от спектра кофейной кислоты в растворе (кривые 2 и 3) появлением полосы поглощения в области 350 нм. Известно, что максимум при λ = 350 нм характерен для спектра комплекса кофейной кислоты с ионами Al (III) в растворах (кривая 4). Анализ спектра сорбированной кофейной кислоты (кривая 1) показал, что он является суммой двух спектров – спектра раствора КК при рН 6.5 (кривая 3) и ее комплекса с ионами алюминия (ІІІ) (кривая 4). Правильность разложения спектра 1 подтверждается тем, что сумма спектров 3 и 4 практически совпадает с экспериментальной кривой 1.
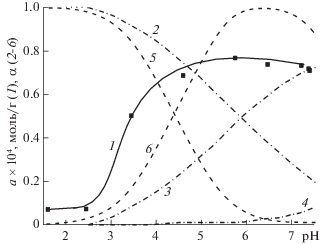
Для выяснения вопроса, какие именно функциональные группы кофейной кислоты являются сайтами связывания с поверхностью оксида алюминия, было детально изучено влияние рН на ее сорбцию, поскольку кислотность среды является важным параметром сорбционного процесса для соединений, содержащих карбоксильные и гидроксильные группы (рис. 2). Так, в водных растворах КК в зависимости от рН раствора существует в молекулярной и депротонированных формах и характеризуется константами pKCOOH, pKOH1 и pKOH2, величины которых, согласно [18], составляют 4.49, 8.72 и >10 соответственно.
На рис. 2 приведены диаграммы распределения относительной доли (α) поверхностных групп оксида алюминия: протонированных ≡AlОН$_{2}^{ + }$ (кривая 2), недиссоциированных ≡AlOH (кривая 3) и депротонированных ≡AlO– (кривая 4) в зависимости от рН раствора, которые построены на основе литературных данных о равновесиях протонирования и депротонирования поверхностных групп ≡AlOH с константами pK1 = = 6.8 и pK2 = 9.2 [19, 20]. Распределение молекулярной и депротонированной форм кофейной кислоты в растворах (рис. 2, кривые 5 и 6) рассчитывали, исходя из значения ее первой термодинамической константы диссоциации (рKСООН = 4.49 [18]). Из рис. 2 видно, что сорбция кофейной кислоты (рис. 2, кривая 1), начинается при рН ≥ 2, достигает максимальных значений при рН ~ 4.5 и, очевидно, коррелирует с депротонированием ее карбоксильной группы (кривая 6). В этой области рН на поверхности оксида алюминия доминируют протонированные группы ≡AlОН$_{2}^{ + }$, поэтому можно предположить, что сорбция КК происходит, в основном, за счет электростатических взаимодействий. В таком случае дальнейшее увеличение рН > 4.5, при котором происходит снижение доли положительно заряженных групп ≡AlОН$_{2}^{ + }$, должно было бы приводить к уменьшению сорбции кофейной кислоты. Однако полученная экспериментальная рН-зависимость характеризуется максимальными значениями сорбции КК в области рН 4.5–7.5 (кривая 1), что предполагает существование и другого механизма взаимодействия кофейной кислоты с поверхностью оксида алюминия, вероятно, за счет комплексообразования, что подтверждается появлением полосы с λмах = 350 нм в спектрах сорбированной КК (рис. 1, кривая 1). Для сопоставления условий сорбции кофейной кислоты на оксиде алюминия и ее комплексообразования в растворе и на поверхности сорбента было изучено влияние рН раствора на эти процессы в одинаковых экспериментальных условиях.
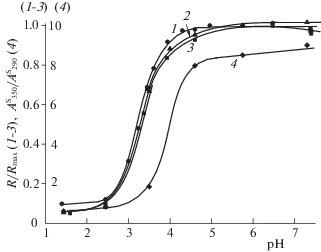
На рис. 3 приведены рН-зависимости нормированных величин оптической плотности комплекса кофейной кислоты с Al (III) в растворе (A/Amax) (кривая 1), сорбированной кофейной кислоты (Аs/$A_{{{\text{max}}}}^{{\text{s}}}$) (кривая 2), а также ее сорбции (a/amax) (кривая 3). Практически полное совпадение кривых 1–3 свидетельствует об одинаковом механизме взаимодействия кофейной кислоты с Al (III) в растворе и на поверхности сорбента с образованием хелатного комплекса. Однако разложение спектров сорбированной кофейной кислоты (пример приведен на рис. 1) показало, что во всем изученном интервале рН спектры поглощения КК/Al2O3 являются суммой двух спектров – раствора кофейной кислоты при рН 6.5 и ее комплекса с ионами алюминия (ІІІ). Это, очевидно, объясняется наличием двух сайтов связывания в молекуле КК, которая может сорбироваться на поверхности оксида алюминия одновременно за счет как карбоксильной группы, так и орто-фенольных гидроксилов с образованием хелатного комплекса. Соотношение этих двух механизмов условно можно представить как отношение величин оптической плотности растворов хелатного комплекса кофейной кислоты при λmax = 350 нм и самой кислоты при λmax = 290 нм (за вычетом светопоглощения комплекса при данной длине волны), которые были определены при анализе спектров поглощения КК, сорбированной на оксиде алюминия из растворов с различными значениями рН. На рис. 3 приведена рН-зависимость соотношения интенсивности полос А350/А290 (кривая 4), из которой видно, что в интервале рН 1.5–3 сорбция кофейной кислоты происходит преимущественно за счет ее депротонированной карбоксильной группы (А350/А290 < 1), хотя доля образования поверхностного комплекса с алюминием (ІІІ) тоже значительна и составляет ~ 30% от общей сорбции. Увеличение рН раствора приводит к резкому росту отношения А350/А290 до ~ 8 (рН 4.5), и дальнейшему постепенному увеличению до ~ 9 в интервале рН 4.5–7.3, т.е. в этих условиях сорбция за счет образования хелатного комплекса доминирует и составляет 80–90%. Таким образом, полученные данные подтверждают, что сорбция кофейной кислоты происходит одновременно по двум механизмами во всем исследованном интервале рН.
Рис. 3.
Нормированные рН-зависимости оптической плотности кофейной кислоты в растворе AlCl3 (1) и на поверхности Al2O3 (2), величины сорбции (3), соотношения интенсивности полос при λ = 350 и 290 нм спектров сорбированной кофейной кислоты после разложения на составляющие (4); λ = 350 нм (1, 2); R/Rmax : A/Amax (1), Аs/$A_{{{\text{max}}}}^{{\text{s}}}$ (2), a/amax (3), $А_{{350}}^{{\text{S}}}{\text{/}}А_{{290}}^{{\text{S}}}$ (4).
Зависимость сорбции кофейной кислоты от ее концентрации в водных растворах исследовали в области ее максимальной сорбции при рН 4.5 ± 0.1. Приведенную на рис. 4 изотерму сорбции КК (кривая 1) можно отнести к Н-типу, поскольку в области низких концентраций она имеет практически вертикальный участок, где а > 0 при [C] ~ 0. Такой тип изотермы характерен для хемосорбции, что подтверждает образование хелатного комплекса КК с поверхностными группами оксида алюминия. При исходных концентрациях (≤5 × 10–5 М) кофейная кислота извлекается из раствора на 80–100% (кривая 2), что важно с точки зрения разработки методик количественного выделения КК из препаратов лекарственных растений, в которых ее содержание, как правило, незначительно.
Рис. 4.
Изотерма сорбции (1), степень извлечения (2) кофейной кислоты оксидом алюминия; изотерма сорбции КК в координатах линейной формы уравнения Ленгмюра (3); отношение интенсивностей А350/А290 полос при λmax = 350 и 290 нм (4) в зависимости от концентрации кофейной кислоты в растворе; рН 4.5, m = 0.01 г, V = 10 мл.
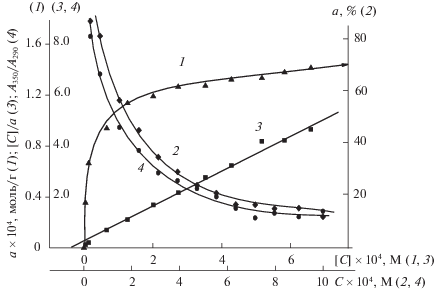
Изотерма сорбции кофейной кислоты была проанализирована с использованием уравнения Ленгмюра (уравнения (1), (2)). Построенный в координатах [C]/a от [C] график (кривая 3) представляет собой прямую линию (R = 0.990), исходя из параметров которой была рассчитана величина максимальной сорбции КК (а∞ = 1.48 × 10–4 моль/г), которая полностью совпала с экспериментально полученным значением (кривая 1), а также константа равновесия адсорбционного процесса (K = 2.73 × 104 л / моль).
С целью изучения влияния концентрации исходного раствора кофейной кислоты на механизм ее сорбции, были проанализированы соответствующие спектры поглощения КК/Al2O3 (рис. 5). Из сопоставления спектров видно, что при малой исходной концентрации (С = 0.4 × 10–4 М – кривая 1) спектр КК на поверхности оксида алюминия в основном совпадает со спектром ее комплекса с алюминием в растворе, т.е. сорбция происходит преимущественно за счет комплексообразования. С увеличением концентрации кофейной кислоты наблюдается гипсохромный сдвиг полосы λmax = 350 нм, очевидно, в результате роста полосы λmax = 290 нм, что влияет на суммарный спектр КК/Al2O3. Для интерпретации наблюдаемых изменений для каждого спектра (кривые 1–6) было рассчитано соотношение интенсивностей полос при 350 и 290 нм (как описано выше). Концентрационная зависимость отношения А350/А290 приведена на рис. 4 (кривая 4), из которой видно, что с увеличением концентрации величина А350/А290 уменьшается, т.е. увеличивается доля полосы при 290 нм и, следовательно, сорбция КК за счет карбоксильной группы. Следует отметить, что снижение доли кофейной кислоты, сорбированной на оксиде алюминия за счет образования хелатного комплекса (рис. 4, кривая 4), полностью коррелирует с уменьшением степени ее извлечения (рис. 4, кривая 2) при увеличении концентрации КК в растворе. Таким образом, на основе полученных данных можно заключить, что сорбция кофейной кислоты во всем исследованном концентрационном интервале происходит одновременно по двум механизмам, соотношение которых зависит как от рН раствора, так и от концентрации КК в растворе.
Рис. 5.
Спектры поглощения кофейной кислоты, сорбированной на поверхности оксида алюминия из растворов различной концентрации; С × 104 = 0.4 (1), 0.8 (2), 1.6 (3), 2.4 (4), 4.0 (5), 6.6 М(6).
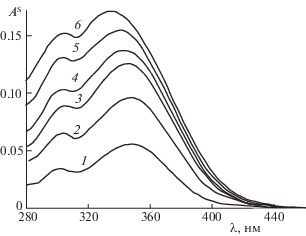
Полученные нами экспериментальные данные противоречат выводу, сделанному авторами работы [10] по итогам исследования комплексообразования Al (III) с кофейной кислотой в растворах с применением методов потенциометрического титрования, УФ- и 1Н-ЯМР-спектроскопии и теоретических расчетов о том, что сайтом комплексообразования является карбоксильная группа, а любое участие орто-фенольных гидроксилов исключено. В то же время авторы [21, 22] рассматривают именно пирокатехиновую группу как наиболее вероятный центр связывания ионов алюминия. Эти противоречия, возможно, обусловлены тем, что в каждом конкретном случае не учитывались величины рН и концентрации растворов кофейной кислоты.
Таким образом, установлены закономерности сорбции на поверхности пирогенного оксида алюминия кофейной кислоты в зависимости от ее химической структуры, концентрации и кислотности водных дисперсий в широком диапазоне значений рН. Показано, что сорбция КК на Al2O3 характеризуется изотермой Н-типа, которая характерна для хемосорбции. Взаимодействие кофейной кислоты с поверхностными группами сорбента происходит за счет как ее карбоксильной группы, так и орто-гидроксильной группировки, образующей с ними хелатный комплекс, относительная доля которого растет с увеличением рН раствора и уменьшением концентрации КК в исходном растворе. Найденные закономерности и параметры сорбции позволяют выработать практические рекомендации по использованию оксида алюминия в качестве сорбента для извлечения, концентрирования и количественного определения кофейной кислоты.
Список литературы
Toma L., Sanda G.M., Niculescu L.S. et al. // BioFactors. 2017. V. 43. P. 685.
Asano M., Iwahashi H. // Molecules. 2014. V. 19. P. 12486.
Chao C.Y., Mong M.C., Chan K.C., Yin M.C. // Mol. Nutr. Food Res. 2010. V. 54. P. 388.
Лукашов Р.И., Моисеев Д.В., Столярова В.Н., Макаренко М.Н. // Вестн. фармации. 2012. Т. 57. № 3. С. 61.
Gokcimen A., Cim A., Tola H.T. et al. // Hum. and Exp. Toxicol. 2007. V. 26. P. 519.
Moritz M., Geszke-Moritz M. // Mater. Sci. Eng. C. 2016. V. 61. P. 411.
Шилько Е.А., Милевская В.В., Темердашев З.А., Киселева Н.В. // Аналитика и контроль. 2018. Т. 22. № 3. С. 303. https://doi.org/10.15826/analitika.2018.22.3.013
Valero-Navarro Á., Gómez-Romero M., Fernández-Sánchez J.F. et al. // J. Chromatogr. A. 2011. V. 1218. P. 7289.
Simanaviciute D., Klimaviciute R., Rutkaite R. // Int. J. Biol. Macromol. 2017. V. 95. P. 788.
Beneduci A., Furia E., Russo N., Marino T. // New J. Chem. 2017. V. 41. P. 5182.
Lapouge C., Cornard J.P. // ChemPhysChem. 2007. V. 8. P. 473.
Тихомирова Т.И., Кубышев С.С., Иванов А.В. // Журн. физ. химии. 2013. Т. 87. № 8. С. 1366. https://doi.org/10.7868/80044453713070340
Тихомирова Т.И., Кубышев С.С., Иванов А.В., Нестеренко П.Н. // Журн. физ. химии. 2009. Т. 83. № 7. С. 1360.
Jiang L., Gao L. // Mater. Chem. Phys. 2003. V. 80. P. 157.
Липковская Н.А., Барвинченко В.Н. // Коллоид. журн. 2019. Т. 81. № 4. С. 472 (Lipkovskaya N.A., Barvinchenko V N. // Colloid J. V. 81. № 4. P. 411). https://doi.org/10.1134/S0023291219040086
Барвинченко В.Н., Липковская Н.А. // Журн. физ. химии. 2019. Т. 93. № 12. С. 1798 . https://doi.org/10.1134/S0044453719120033
Бернштейн И.Я., Каминский Ю.Л. Спектрофотометрический анализ в органической химии. Л.: Химия, 1986.
Linder P.W. // Polyhedron. 1987. V. 6. P. 53.
Tombácz E., Szekeres M. // Langmuir. 2001. V. 17. P. 1411.
Tombácz E., Szekeres M., Klumpp E. // Langmuir. 2001. V. 17. P. 1420.
Cornard J.P., Lapouge C. // J. Phys. Chem. A. 2004. V. 108. P. 4470.
Cornard J.P., Lapouge C. // J. Phys. Chem. A. 2006. V. 110. P. 7159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии