Журнал физической химии, 2021, T. 95, № 8, стр. 1216-1224
Исследование взаимодействий додецилсульфата натрия с L-триптофаном методами денсиметрии и компьютерного моделирования
М. С. Курбатова a, Г. Н. Тарасова a, Е. Ю. Тюнина a, *, Н. И. Гиричева b, **
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
b Ивановский государственный университет
Иваново, Россия
* E-mail: tey@isc-ras.ru
** E-mail: n.i.giricheva@mail.ru
Поступила в редакцию 01.10.2020
После доработки 12.11.2020
Принята к публикации 16.11.2020
Аннотация
Измерены плотности растворов L-триптофана (Trp) в воде и додецилсульфата натрия (SDS) в водных растворах Trp в широком диапазоне температур (293.15, 298.15, 303.15, 308.15 и 313.15) К с помощью денсиметра DMA 5000М (Anton Paar). Определены кажущиеся мольные объемы (${{V}_{{\varphi ,{\text{SDS}}}}}$) додецилсульфата натрия в области концентраций 0.0010–0.0199 моль кг–1 и его предельные кажущиеся мольные объемы при бесконечном разбавлении ($V_{{\varphi ,{\text{SDS}}}}^{^\circ }$) в растворах, содержащих аминокислоту (с фиксированной концентрацией 0.01 моль кг–1). Выявлено повышение первой критической концентрации мицеллообразования от m = 0.0080 для растворов SDS в воде до m = 0.0099 для растворов SDS с Trp. Вычислены значения производных ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p и (${{\partial }^{2}}V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T2)p, а также парциальные мольные объемы переноса SDS из воды в водные растворы аминокислоты. Полученные результаты обсуждены на основе рассмотрения различных типов межмолекулярных взаимодействий, действующих в исследуемых растворах. Методом DFT/B97D c использованием гибридного обменно-корреляционного функционала Гримма с дисперсионной поправкой в сочетании с базисным набором 6-311++G(2d,2p) выполнено квантово-химическое моделирование комплексов додецилсульфата натрия (SDS) с цвиттер-ионом L-триптофана. Строение и энергии образования комплексов SDS…Trp определены с учетом эффектов гидратации в рамках модели поляризуемого континуума (PCM).
Одна из фундаментальных задач современной химии – выявление закономерностей взаимодействия между протеинами и поверхностно-активными веществами, которые лежат в основе различных биохимических процессов в организме человека и в биотехнологии при производстве пищевых и косметических продуктов, лекарственных средств и др. [1–9]. Для описания сложных биологических систем важное значение имеют данные о свойствах их модельных соединений, в качестве которых могут быть использованы аминокислоты и мицеллы низкомолекулярных поверхностно-активных веществ (ПАВ), имеющие структурные фрагменты как для электростатических, так и для гидрофобных взаимодействий с растворенными веществами [10–13]. Анализ имеющихся литературных данных [11–20] показал, что до сих пор актуально изучение объемных свойств водных растворов ПАВ, содержащих аминокислоты, при изменении температуры и концентрации. До сих пор практически отсутствуют данные о стехиометрии образуемых молекулярных комплексов между биологически активными веществами и ПАВ, а также о влиянии структуры реагентов на характер их взаимодействия. Для решения поставленных задач все более широкое применение находят методы моделирования структуры и динамических свойств различных биомолекул [21–25].
Данная работа продолжает наши экспериментальные [26] и теоретические [27] исследования растворов ПАВ, содержащих аминокислоты и пептиды. Мы использовали анионное поверхностно-активное вещество – додецилсульфат натрия CH3(CH2)10CH2OSO3Na (SDS) и аминокислоту L-триптофан (Trp). Как известно, SDS диссоциирует в водных растворах с образованием поверхностно-активного аниона (CH3(CH2)10CH2OSO$_{3}^{ - }$) и катиона (Na+) (не обладающего поверхностно-активными свойствами). Поверхностно-активный анион имеет гидрофильную часть и длинный гидрофобный радикал [24, 28]. Состояние SDS в растворе зависит от его концентрации. Максимально возможная концентрация, при которой SDS находится в водном растворе в ионной форме, т.е. первая критическая концентрация мицеллообразования (ККМ) составляет 0.0083 моль кг–1 [28–31]. При достижении ККМ образуются мицеллы, которые находятся в термодинамическом равновесии с молекулами (ионами) ПАВ в растворе. При концентрации SDS выше ККМ избыток ПАВ переходит в мицеллы [28, 30, 31]. Область концентраций ниже ККМ характеризует предмицеллярное, а выше – мицеллярное состояние SDS в растворе. В области ККМ происходит наиболее значительное изменение физико-химических свойств растворов ПАВ, а на кривых, характеризующих эти свойства, появляются перегибы [28–31].
L-триптофан – это ароматическая гетероциклическая аминокислота с биполярной ионной структурой. Индольное кольцо, входящее в состав аминокислоты, – прекрасный донор π-электронов. В водных растворах (значение рН которых близко к нейтральным) и кристаллах L-триптофан находится в цвиттер-ионной форме (NH$_{3}^{ + }$–CH(R)–COO–), а в газовой фазе Trp существует преимущественно в виде нейтральных молекул. В центре внимания данной работы: во-первых, выявление основных типов взаимодействий между компонентами водного раствора анионного ПАВ с гетероциклической аминокислотой в широком интервале температур методом денсиметрии и, во-вторых, определение структурных и энергетических характеристик комплексов, образованных SDS с цвиттер-ионом Trp, методом компьютерного моделирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
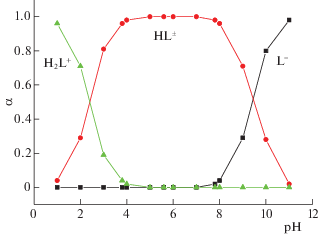
В работе использовали додецилсульфат натрия (Sigma-Aldrich, CAS 151-21-3), L-триптофан (Sigma, CAS 73-22-3). Содержание основного вещества составляло 99%. Аминокислоту сушили в вакуумном шкафу при 343 К в течение 48 ч непосредственно перед использованием. Додецилсульфат натрия (SDS) дополнительной очистке не подвергали. Для приготовления растворов использовали бидистиллированную воду (удельная электропроводность 1.5 × 10–6 Ом–1 см–1), значение рН 5.6. Отметим, что в водных растворах триптофан, имеющий концевые карбоксильную и аминогруппы, участвует в кислотно-основных равновесиях, константы которых определены ранее [32, 33]:
(1)
${{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }} \leftrightarrow {{{\text{H}}}^{ + }} + {\text{H}}{{{\text{L}}}^{ \pm }}\quad {\text{р}}K = 2.37,$(2)
${\text{H}}{{{\text{L}}}^{ \pm }} \leftrightarrow {{{\text{H}}}^{ + }} + {{{\text{L}}}^{ - }}\quad {\text{р}}K = 9.38.$Измерения плотности (ρ) исследуемых растворов выполняли на цифровом вибрационном плотномере DMA 5000 М (Anton Paar, Австрия) при температурах 293.15, 298.15, 303.15, 308.15 и 313.15 К. Два встроенных платиновых термометра Pt100 в сочетании с элементами Пельтье обеспечивали термостатирование образца внутри ячейки с погрешностью 1 × 10–3 К. Перед каждым измерением проводили калибровку по воздуху и бидистиллированной воде при атмосферном давлении. Значения плотности чистой воды при разных температурах брали из работы [35]. Погрешность измерения плотности исследуемых растворов не превышала 0.000007 г см–3.
Компьютерное моделирование исследуемых объектов выполняли методом DFT/B97D/6-311++G(2d,2p) [36] c использованием дисперсионной поправки, реализованным в пакете квантово-химических программ Gaussian09 [37]. Структура и энергии комплексов были рассчитаны с учетом эффектов гидратации в рамках модели поляризуемого континуума (PCM) [38]. Для подтверждения того, что все оптимизированные структуры являются минимумами на поверхности потенциальной энергии, проводили анализ нормальных колебаний; мнимых частот не обнаружено.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Объемные свойства. Экспериментальные значения плотности бинарных Trp–H2O и тройных SDS–Trp–H2O смесей при различных температурах и концентрациях ПАВ приведены в табл. 1 и 2. Значения плотности увеличиваются при увеличении концентрации SDS и уменьшаются с ростом температуры. На основе экспериментальных данных по плотности вычислен кажущийся мольный объем SDS (${{V}_{{\varphi ,{\text{SDS(Trp)}}}}}$ с использованием уравнения [39, 40]:
(3)
${{V}_{{\varphi ,{\text{SDS(Trp)}}}}} = (1000({{\rho }_{0}}--\rho ){\text{/}}\rho {{\rho }_{0}}m) + M{\text{/}}\rho ,$Таблица 1.
Плотность (ρ × 10–3, кг м–3) водных растворов L-триптофана при различных концентрациях и температурах
| mTrp, моль кг–1 | 293.15 К | 298.15 К | 303.15 К | 308.15 К | 313.15 К |
|---|---|---|---|---|---|
| 0 | 0.9982030 | 0.997043 | 0.9956450 | 0.9940290 | 0.992212 |
| 9.65000E-4 | 0.9982632 | 0.9971023 | 0.9957038 | 0.9940869 | 0.9922691 |
| 0.0030110 | 0.9983903 | 0.9972277 | 0.9958278 | 0.9942090 | 0.9923892 |
| 0.0049190 | 0.9985075 | 0.9973429 | 0.9959420 | 0.9943211 | 0.9924996 |
| 0.0069790 | 0.9986333 | 0.9974655 | 0.9960640 | 0.9944403 | 0.9926177 |
| 0.0099610 | 0.9988134 | 0.9976416 | 0.9962386 | 0.9946115 | 0.9927865 |
| 0.0152520 | 0.9991306 | 0.9979504 | 0.9965454 | 0.9949126 | 0.9930852 |
| 0.0152700 | 0.9991317 | 0.9979515 | 0.9965456 | 0.9949132 | 0.9930864 |
| 0.0196000 | 0.9993894 | 0.9982058 | 0.9967945 | 0.9951584 | 0.9933268 |
| 0.0198900 | 0.9994048 | 0.9982215 | 0.9968114 | 0.9951746 | 0.9933430 |
Таблица 2.
Плотность (ρ × 10–3, кг м–3) водных растворов додецилсульфата натрия в присутствии L-триптофана (m = 1.0 × 10–2 моль кг–1) при различных концентрациях SDS и температурах
| mSDS, моль кг–1 | 293.15 К | 298.15 К | 303.15 К | 308.15 К | 313.15 К |
|---|---|---|---|---|---|
| SDS–Trp–H2O | |||||
| 0 | 0.9987984 | 0.9976466 | 0.9962510 | 0.9946225 | 0.9927845 |
| 0.001033 | 0.9988626 | 0.9977065 | 0.9963066 | 0.9946735 | 0.9928314 |
| 0.001949 | 0.9989122 | 0.9977504 | 0.9963469 | 0.9947095 | 0.9928634 |
| 0.003962 | 0.9989887 | 0.9978260 | 0.9964199 | 0.9947763 | 0.9929282 |
| 0.005996 | 0.9990524 | 0.9978866 | 0.9964768 | 0.9948244 | 0.9929738 |
| 0.007932 | 0.9990982 | 0.9979390 | 0.9965296 | 0.9948715 | 0.9930232 |
| 0.009969 | 0.9991602 | 0.9979933 | 0.9965839 | 0.9949315 | 0.9930830 |
| 0.011967 | 0.9992556 | 0.9980733 | 0.9966370 | 0.9949765 | 0.9931256 |
| 0.014947 | 0.9994735 | 0.9983026 | 0.9968770 | 0.9952236 | 0.9933706 |
| 0.017969 | 0.9995895 | 0.9984156 | 0.9969850 | 0.9953306 | 0.9934766 |
| 0.019909 | 0.9996865 | 0.9985099 | 0.9970770 | 0.9954196 | 0.9935587 |
Рис. 2.
Концентрационные зависимости кажущегося мольного объема L-триптофана в воде (а) и додецилсульфата натрия в водных растворах L-триптофана (б) при разных температурах: 1 – 293.15, 2 – 295.15, 3 – 303.15, 4 – 308.15, 5 – 313.15 К.
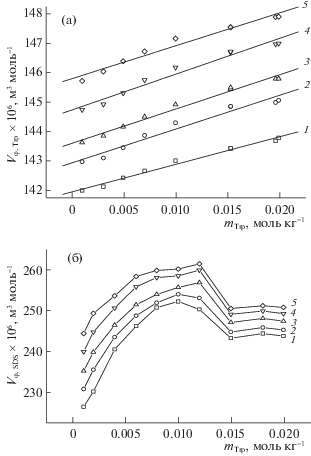
Таблица 3.
Предельные кажущиеся мольные объемы L-триптофана ($V{{_{{\varphi ,{\text{Trp}}}}^{^\circ }}_{{}}}$) в воде и додецилсульфата натрия ($V_{{\varphi ,{\text{SDS}}}}^{^\circ }$) в воде [23] и водных растворах Trp, молярные коэффициенты объемного расширения ($\alpha V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ = = ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p) при различных температурах
| Т, К | $V{{_{{\varphi ,{\text{Trp}}}}^{^\circ }}_{{}}}$ × 106, м3 моль–1 |
$V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ × 106, м3 моль–1 | ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p × 106, м3 моль–1 К–1 |
||
|---|---|---|---|---|---|
| Trp–H2O | SDS–H2O [23] | SDS–Trp–H2O | SDS–H2O [23] | SDS–Trp–H2O | |
| эксперимент | предмицеллярный раствор | ||||
| 293.15 | 141.9 | 205.7 | 219 | –1.89 | 1.27 |
| 298.15 | 143.0 | 197.2 | 225 | –1.78 | 1.18 |
| 303.15 | 143.6 | 187.3 | 231 | –1.67 | 1.10 |
| 308.15 | 144.7 | 180.2 | 236 | –1.56 | 1.01 |
| 313.15 | 145.8 | 172.3 | 241 | –1.45 | 0.92 |
| данные [35] | мицеллярный раствор | ||||
| 293.15 | – | 231.4 | 262 | 0.03 | 3.28 |
| 298.15 | 143.8 | 231.8 | 276 | 0.08 | 2.54 |
| 303.15 | – | 232.3 | 288 | 0.14 | 1.79 |
| 308.15 | 144.6 | 233.2 | 294 | 0.21 | 1.05 |
| 313.15 | 145.6 | 234.5 | 298 | 0.26 | 0.31 |
Примечание. Концентрация Trp m = 1.0 × 10–2 моль кг–1. Значение ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p вычислено по соотношению: ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p = = β + 2Tγ, где β and γ – константы уравнения (5). Погрешность экспериментальных значений $V{{_{{\varphi ,{\text{Trp}}}}^{^\circ }}_{{}}}$ ± 0.11 × 10–6 м3 моль–1 для водных растворов аминокислоты.
В случае трехкомпонентной системы SDS – Trp – H2O по излому на концентрационной зависимости ${{V}_{{\varphi ,{\text{SDS}}}}}$ = f(m) кажущегося мольного объема SDS в растворе Trp, представленной на рис. 2б, определено значение первой критической концентрации мицеллообразования (ККМ). Ранее нами показано [26], что добавление к водным растворам SDS глицина, диглицина и триглицина понижает значение критической концентрации мицелообразования до ~(0.006–0.004)m. В присутствии же L-триптофана наблюдается повышение значения ККМ от ~0.008 m для растворов SDS в воде до ~0.0099 m для растворов SDS с Trp. В предмицеллярной области молекулы SDS существуют в виде мономеров, взаимодействие которых с аминокислотой сопровождается повышением кажущегося мольного объема ${{V}_{{\varphi ,{\text{SDS}}}}}$ с ростом концентрации SDS. Критическая концентрация, при которой начинают формироваться локальные гидрофобные области в водном растворе аминокислоты, выше, чем ККМ SDS в воде, что может свидетельствовать об образовании смешанных мицелл SDS с участием активных фрагментов Trp [30, 31]. В дальнейшем с увеличением концентрации SDS наблюдается некоторое уменьшение кажущегося мольного объема ${{V}_{{\varphi ,{\text{SDS}}}}}$ в мицеллярной области. Обнаружено влияние температуры на ККМ для исследуемой системы H2O–SDS–Trp: с ростом температуры от 293.15 до 313.15 К наблюдается повышение границы области мицеллообразования c m = 0.0099 до m = 0.01197. По-видимому, это может быть связано с ослаблением гидрофобной ассоциации не только между молекулами SDS и аминокислотой, но и между молекулами SDS, т.е. имеет место большая доступность гидрофобной части SDS для воды при повышении температуры за счет структурной модификации, индуцированной на поверхности раздела углеводородный радикал–вода [42].
Парциальные мольные объемы SDS ($V_{{\varphi ,{\text{SDS}}}}^{^\circ }$) определяли при описании концентрационных зависимостей кажущихся мольных объемов (${{V}_{{\varphi ,{\text{SDS}}}}}$) уравнением типа Редлиха–Кистера [43, 44] в мицеллярной и предмицеллярной областях:
где B и C – постоянные величины, $V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ – предельный кажущийся мольный объем, равный парциальному мольному объему SDS при бесконечном разбавлении раствора (табл. 3). Значения $V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ положительны для всех исследуемых растворов как в предмицеллярной, так и в мицеллярной облястях. Значения $V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ додецилсульфата натрия в трехкомпонентных растворах, содержащих добавки Trp, выше, чем для двухкомпонентной системы SDS–вода. Полученные данные указывают на взаимодействие между цвиттер-ионами триптофана и анионным ПАВ, которое сопровождается дегидратацией молекул растворенных веществ, дающей положительный вклад в изменение объемных свойств растворов.С ростом температуры значения $V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ увеличиваются в предмицеллярной и мицеллярной областях для исследуемой тройной системы, что обусловлено тепловым расширением и понижением электрострикции молекул воды в гидратных сферах ионов SDS и цвиттер-ионов аминокислоты. Некоторое понижение значений $V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ в предмицеллярной области, наблюдаемое в бинарной системе SDS–вода [26], может отражать эффекты гидратации и упаковки гидратных сфер ионов SDS, а также влияние на них температуры [45].
Определены значения изменения парциального мольного объема (${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$) при переносе SDS из воды в водные растворы Trp (табл. 4):
(6)
$\begin{gathered} {{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ } = V_{{\varphi ,{\text{SDS}}}}^{^\circ }({{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} --{\kern 1pt} {\text{SDS}}{\kern 1pt} --{\kern 1pt} {\text{Тrp}})-- \\ - \;V_{{\varphi ,{\text{SDS}}}}^{^\circ }({{{\text{H}}}_{{\text{2}}}}{\text{O}}{\kern 1pt} --{\kern 1pt} {\text{SDS}}). \\ \end{gathered} $Таблица 4.
Значения предельного кажущегося мольного объема переноса (${{\Delta }_{{{\text{tr}}}}}\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$ × 106, м3 моль–1) додецилсульфата натрия (SDS) из воды в водные растворы L-триптофана (m = 1.0 × 10–2 моль/кг) при разных температурах
| Т, К | SDS–Trp | SDS–Trp |
|---|---|---|
| предмицеллярный раствор | мицеллярный раствор | |
| 293.15 | 13.3 | 30.6 |
| 298.15 | 27.8 | 44.2 |
| 303.15 | 43.7 | 55.7 |
| 308.15 | 55.8 | 60.8 |
| 313.15 | 68.7 | 63.5 |
Температурная зависимость парциальных мольных объемов SDS в водных растворах Тrp успешно описывается полиномом:
где α, β и γ – константы, Т – температура. В табл. 3 приведены значения первой производной парциального мольного объема по температуре при постоянном давлении для предмицеллярной и мицеллярной областей исследуемых растворов. Они отрицательны для предмицеллярного состояния SDS в воде [26] и становятся положительными для водных растворов SDS в присутствии Trp, тем самым подтверждая факт “вытеснения” молекул электрострикционно сжатой воды из гидратных оболочек растворенных веществ в раствор при взаимодействии ионов SDS с цвиттер-ионами аминокислоты, что сопровождается повышением объема системы.Влияние растворенного вещества на структуру растворителя может быть оценено с использованием уравнения Хеплера [51]:
(8)
${{(\partial C_{p}^{^\circ }{\text{/}}\partial T)}_{p}} = --T{{({{\partial }^{2}}V_{\varphi }^{^\circ }{\text{/}}\partial {{T}^{2}})}_{p}}.$Результаты квантово-химического исследования. В предыдущих работах [27, 52] нами были рассмотрены конформеры SDS. NBO-анализ распределения электронной плотности показал чисто ионный характер связи Na–O в исследуемой молекуле. Ион Na+ способен мигрировать в окрестностях ионного фрагмента ${\text{SO}}_{4}^{ - }$, при этом оставаясь с ним прочно связанным. Полученные результаты и наиболее устойчивый конформер SDS использованы в данной работе при моделировании комплексов с рассматриваемой аминокислотой.
Стартовая структура L-триптофана воспроизведена из кристаллографических данных [53], описывающих наиболее устойчивое конформационное состояние цвиттер-ионов в кристалле. В водном растворе в интервале рН от 3.8 до 7.8 триптофан также существует преимущественно в цвиттер-ионной форме (HL±) [54]. Поскольку рассмотрение канонической или молекулярной формы Trp не входило в цели данной работы, для оптимизации структуры аминокислоты методом DFT/B97D/6-311++G(2d,2p) в условиях поляризуемого континуума использовался только цвиттер-ион.
Межатомные расстояния в наиболее устойчивой конфигурации цвиттер-иона, оптимизированного для условий поляризуемого континуума, совпадают с аналогичными значениями в кристаллических аминокислотах с точностью до 0.01 Å [53]. Плоская конфигурация индольного фрагмента сохраняется как в кристалле, так и в полярном растворителе. Валентные и торсионные углы не претерпевают значительных изменений. Однако в условиях поляризуемого континуума по сравнению с кристаллической структурой наблюдается образование внутримолекулярной водородной связи типа N-H…O, длина которой составляет 1.930 Å. В работе [55] было установлено, что наиболее стабильные конформеры Trp имеют внутримолекулярную водородную связь между карбоксильными и амидными группами. На этом основании последующее моделирование комплексов SDS…Trp проведено с использованием оптимизированного нами конформера аминокислоты для условий поляризуемого континуума.
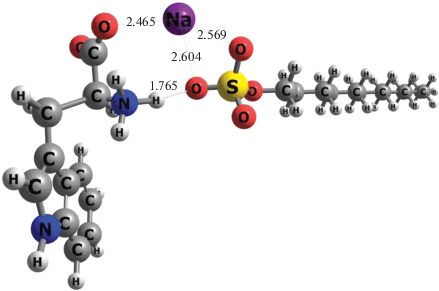
В состав цвиттер-иона L-триптофана входят зарядные группы ${\text{NH}}_{3}^{ + }$ и COO–, а также индольный фрагмент, содержащий гетероатом (N). В качестве стартовых структур комплексов использованы разные ориентации аминокислоты относительно молекулы SDS. Так, нами рассмотрены два комплекса. В комплексе I (рис. 3) Trp ориентируется группой ${\text{NH}}_{3}^{ + }$ к одному из атомов кислорода, принадлежащих фрагменту ${\text{SO}}_{4}^{ - }$ додецилсульфата натрия таким образом, что между группой COO– аминокислоты возникает электростатическое притяжение к иону натрия Na+. В результате такого взаимодействия образуется межмолекулярная H-связь средней силы (r = = 1.765 Å), и происходит разрыв внутримолекулярной водородной связи Trp. В комплексе II (рис. 4) L-триптофан ориентирован по отношению к SDS так, что индольный фрагмент аминокислоты приближен к атомам кислорода додецилсульфата натрия, а отрицательно заряженный полюс цвиттер-иона не взаимодействует с ионом натрия Na+. Здесь также наблюдаются разрыв внутримолекулярной водородной связи аминокислоты и образование слабой межмолекулярной H-связи, длина которой равна 1.946 Å.
Рис. 4.
Оптимизированная конфигурация комплекса II, образованного мономером SDS и цвиттер-ионом Trp.

Отметим, что плоская конфигурация индольного кольца L-триптофана сохраняется как в комплексе I, так и в комплексе II, что подтверждает “жесткую” структуру ароматического фрагмента данной аминокислоты. В табл. 5, наряду с геометрическими характеристиками H-связей, показаны и энергетические свойства образуемых комплексов SDS…Trp.
Таблица 5.
Изменение энергии (ккал/моль) в процессе комплексообразования (Еcomp) молекулы SDS с L-триптофаном и геометрические характеристики межмолекулярных водородных связей N–H…O в образуемых комплексах
| Комплекс | Еcomp | r(N–H…O), Å | ∠N–H…O |
|---|---|---|---|
| I | –35.8 | 1.765 | 165.4° |
| II | –30.4 | 1.946 | 149.9° |
Изменение энергии в процессе образования комплексов рассчитывалось по уравнению
(9)
${{Е}_{{{\text{comp}}}}} = {{E}_{{{\text{Trp}} + {\text{SDS}}}}}--{{E}_{{{\text{isol}}\;{\text{Trp}}}}}--{{E}_{{{\text{isol}}\;{\text{SDS}}}}},$Как видно из табл. 5, энергия комплексообразования более отрицательна для комплекса I, чем для комплекса II. По-видимому, это обусловлено тем, что в первом случае во взаимодействии Trp с молекулой додецилсульфата натрия принимают участие как положительно заряженный полюс аминокислоты (${\text{NH}}_{3}^{ + }$), так и ионизированная группа COO–. Следовательно, вероятность реализации комплекса I в растворе выше, чем комплекса II.
Таким образом, вычисленные значения предельных кажущихся мольных объемов додецилсульфата натрия ($V_{{\varphi ,{\text{SDS}}}}^{^\circ }$) в водных растворах Trp в изученном интервале температур, а также параметров ($\partial V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T)p и (${{\partial }^{2}}V_{{\varphi ,{\text{SDS}}}}^{^\circ }$/∂T2)p и мольного объема переноса ${{\Delta }_{{{\text{tr}}}}}V_{\varphi }^{^\circ }$ SDS из воды в водные растворы аминокислоты свидетельствуют о существенном вкладе электростатических, сольватационных эффектов и водородных связей во взаимодействие между растворенными веществами. Показано, что добавление гетероциклической аминокислоты Trp вызывает уменьшение склонности молекул SDS к агрегации в растворах и приводит к изменению ККМ.
Методом квантовой химии – DFT/B97D/6-311++G(2d,2p) – проведено моделирование комплексов додецилсульфата натрия (SDS) с цвиттер-ионом L-триптофана. Строение и энергии образования двух комплексов SDS…Trp определены с учетом эффектов гидратации в рамках модели поляризуемого континуума (PCM). Показано, что более стабильный комплекс характеризуется не только наличием межмолекулярной водородной связи, но и большим вкладом электростатических взаимодействий в исследуемые процессы.
Работа выполнена при финансовой поддержке РФФИ (грант № 18-03-01032).
Денсиметрические исследования проведены на оборудовании ЦКП “Верхневолжского регионального центра физико-химических исследований” ИХР РАН (http://www.isc-ras.ru/ru/struktura/ckp).
Список литературы
Antimicrobial Peptides: Methods and Protocols / Ed. by A. Giuliani, A.C. Rinaldi. USA, New York: Humana Press, 2010.
Bozorgmehr M.R., Saberi M., Chegini H. // J. Mol. Liq. 2014. V. 199. P. 184.
Ding Y., Shu Y., Ge L., Guo R. // Colloids and Surfaces A: Physicochem. Eng. Aspects. 2007. V. 298. P. 163.
Liu Z., Guo X., Feng Z., Jia L. // J. Solution Chem. 2015. V. 44. P. 293.
Thaker H.D., Sgolastra F., Clements D., Scott R.W., Tew G.N. // J. Med. Chem. 2011. V. 54. P. 2241.
Ермак И.М., Давыдова В.Н. // Биологические мембраны: Журнал мембранной и клеточной биологии. 2008. Т. 25. № 5. С. 323.
Сумина Е.Г., Штыков С.Н., Тюрина Н.В. // Журн. аналит. химии. 2003. Т. 58. № 8. С. 808.
Brash J.L., Horbett T.A. Proteins at interfaces II: Fundamentals and applications. 602. Washington, DC: American Chemical Society, 1995.
Sumina E.G. // In: Nanoanalytics, nanoobjects and nanotechnologies in analytical chemistry. Ed. by S. Shtykov. Berlin, Germany: De Gruyter, 2018. P. 411–441.
Khaledi M.G., Rodgers A.H. // Anal. Chim. Acta. 1990. V. 239. P. 121.
Badarayani R., Kumar A. // J. Chem. Thermodynamics. 2004. V. 36. P. 49.
Чернышева О.С., Маслова Я.А. // Коллоид. журн. 2016. Т. 78. № 3. С. 396.
Sumina E.G., Sorokina O.N., Uglanova V.Z., Sorokina T.E. // Italian Sci. Rev. 2015. V. 26. № 5. P. 101.
Singh S.K., Kundu A., Kishore N. // J. Chem. Thermodynamics. 2004. V. 36. P. 7.
Chauhan S., Chauhan M.S., Sharma P., Rana D.S., Umar A. // Fluid Phase Equilib. 2013. V. 337. P. 39.
Yan Z., Sun X., Li W.-W., Li Y., Wang J. // J. Chem. Thermodynamics. 2011. V. 13. P. 1468.
Ali A., Malik N.A., Uzair S., Ali M. // Mol. Phys. 2014. V. 112. P. 2681.
Hossain M.S., Biswas T.K., Kabiraz D.Ch., Islam Md.N., Huque M.E. // J. Chem. Thermodynamics. 2014. V. 71. P. 6.
Bello M., Gutierres G., Garcia-Hernandez E. // Biophys. Chem. 2012. V. 165−166. P. 79.
Talele P., Kishore N. // J. Chem. Thermodynamics. 2014. V. 70. P. 182.
Заводинский В.Г., Гниденко А.А., Давыдова В.Н. // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. № 2. С. 11.
Нольде Д.Е., Волынский П.Е., Арсеньев А.С., Ефремов Р.Г. // Биоорг. химии. 2000. Т. 26. № 2. С. 130. [Nolde D.E. // Russ. J. Bioorg. Chem. 2000. V. 26. P. 115.]
Khamidullina A.S., Vakulin I.V., Talipov R.F., Shepelevich I.S. // J. Struct. Chem. 2005. V. 46. № 6. P. 985.
Qiu Z., Xia Y., Wang H., Diao K. // J. Struct. Chem. 2011. V. 52. № 3. P. 462.
Бродская Е.Н. // Коллоид. журн. 2012. Т. 74. № 2. С. 167.
Баделин В.Г., Тюнина Е.Ю., Тарасова Г.Н. // Журн. физ. химии. 2017. Т. 91. № 5. С. 862.
Гиричева Н.И., Курбатова М.С., Тюнина Е.Ю., Баделин В.Г. // Журн. структ. химии. 2017. Т. 58. № 8. С. 1648.
Зимон А.Д., Евтушенко А.М., Крашенинникова И.Г. Физическая и коллоидная химия. Учебно-практическое пособие. М.: МГУТУ, 2004. 81 с.
Tang X., Koenig P.H., Larson R.G. // J. Phys. Chem. B. 2014. V. 118. P. 3864.
Ершов Ю.А. Коллоидная химия. Физическая химия дисперсных систем. М.: ГЭОТАР-Медиа, 2013. 352 с.
Холмберг К., Йенссон Б., Кронберг Б., Линдман Б. Поверхностно-активные вещества и полимеры в водных растворах. М.: БИНОМ. Лаборатория знаний, 2007.
Nagai H., Kuwabara K., Carta G. // J. Chem. Eng. Data. 2008. V. 53. P. 619.
Chemistry and Biochemistry of the Amino Acids / Ed. by G.C. Barrett. London–N.Y.: Chapman and Hall, 1985. 684 p.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993. 112 с.
Kell G.S. // J. Chem. Eng. Data. 1975. V. 20. P. 97.
Ditchfield R., Hehre W.J., Pople J.A. // J. Chem. Phys. 1971. V. 54. P. 724.
Frisch M.J., Truck G.W., Schlegel H.B. et al. Gaussian09, Revision D.01. Gaussian, Inc., Wallingford CT, 2013.
Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005. V. 105. P. 2999.
Харнед Г., Оуэн Б. Физическая химия растворов электролитов. М.: Изд-во иностр. лит., 1952. 628 с. [Harned H.S., Owen B.B. The physical chemistry of electrolytic solutions. New York, 1950.]
Millero F.J. // Chem. Rev. 1971. V. 71. P. 147.
Zhao H. // Biophys. Chem. 2006. V. 122. P. 157.
Forgács E. // Fresenius J. Anal. Chem. 1994. V. 349. P. 743.
Теоретические и экспериментальные методы химии растворов (Проблемы химии растворов) / Под ред. А.Ю. Цивадзе. М.: Проспект, 2011. 688 с.
Masson D.O. // Phyl. Mag. 1929. V. 8. P. 218.
Lepori L., Gianni P. // J. Sol. Chem. 2000. V. 29. P. 405.
Franks F. Water: A Comprehensive Treatise. Vol. 3. New York: Plenum Press, 1973.
Gurney R.W. Ionic processes in solution. New York: McGraw Hill, 1953.
Singh S.K., Kundu A., Kishore N. // J. Chem. Thermodynamics. 2004. V. 36. P. 7.
Yan Z., Zhang Q., Li W.-W., Wang J. // J. Chem. Eng. Data. 2010. V. 55. P. 3560.
Harutyunyan N.G., Harutyunyan L.R., Harutyunyan R.S. // Thermochim. Acta. 2010. V. 498. P. 124.
Hepler L.G. // Can. J. Chem. 1969. V. 47. P. 4613.
Усольцева Н.В., Смирнова А.И., Жарникова Н.В. и др. // Жидк. крист. и их практич. использ. 2016. Т. 16. С. 70.
The Cambridge Crystallographic Data Centre, Leibniz Institute for Information Infrastructure, https://www.ccdc.cam.ac.uk/structures/search?id=doi:10.5517/cc123lsk&sid=DataCite
Badelin V.G., Tyunina E.Yu., Mezhevoi I.N., Tarasova G.N. // Russ. J. Phys. Chem. A. 2015. V. 89. № 12. P. 2229.
Dunaeva V.V., Girichev G.V., Giricheva N.I. // Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. 2020. V. 63. № 3. P. 37.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии