Журнал физической химии, 2021, T. 95, № 8, стр. 1211-1215
Собственное излучение водных растворов сильных кислот в миллиметровой области спектра
А. К. Лященко a, *, И. М. Каратаева a, В. С. Дуняшев a, А. Ю. Ефимов a
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Россия
* E-mail: aklyas@mail.ru
Поступила в редакцию 13.10.2020
После доработки 17.10.2020
Принята к публикации 20.10.2020
Аннотация
Рассмотрены экспериментальные и расчетные методы определения радиояркостных контрастов водных растворов в миллиметровой области спектра. В качестве модельных систем использованы растворы соляной и азотной кислот. Выделены особенности данного диапазона частот. Исследованы связи СВЧ- и КВЧ-диэлектрических спектров с изменениями квазиоптических параметров растворов и их радиояркостных характеристик. На основании обобщения материала и сравнения с данными для других водных растворов электролитов и неэлектролитов обоснован новый метод дистанционного изучения свойств растворов.
С расширением возможностей радиотехнической аппаратуры и появлением высокочувствительных радиометров миллиметрового (мм) диапазона проявляется еще одно аномальное свойство водных растворов, связанное с изменением коэффициентов собственного излучения и радиояркостных контрастов в растворах электролитов. Специфика мм-диапазона здесь выступает достаточно наглядно как с теоретических, так и с прикладных позиций. В последнем случае это связано с биологическими и медицинскими эффектами мм-волн и экологическим мониторингом [1–5]. В теоретическом плане анализ поляризации водного диэлектрика позволяет выделить гидратационные составляющие и раздельно оценить вклады ориентационной поляризации и поляризационные эффекты динамики ионной атмосферы в комплексной диэлектрической проницаемости раствора. В работах [6–9] радиояркостные характеристики были изучены экспериментально с помощью радиометра на частоте 61.2 ГГц для растворов с одно- и многозарядными ионами в растворе. Они определяются квазиоптическими коэффициентами растворов. В начальной области концентраций в согласии с экспериментом их значения были рассчитаны из экспериментальных данных о дипольных и ионных потерях в области основного максимума дисперсии комплексной проницаемости растворов и исходных данных электропроводности растворов. Представляет интерес оценить рассматриваемые эффекты в случае водных растворов сильных кислот, обладающих аномально высокой электропроводностью, связанной с эстафетным механизмом подвижности протона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования образцов воды и растворов в лабораторных условиях проводили с использованием высокочувствительного радиометра с фиксированной частотой 61.2 ГГц (ИРЭ РАН, НПО Исток, Фрязино). Устройство радиометра и методики проведения измерений и расчетов описаны ранее [6, 7, 10, 11]. Показания прибора оцифровывают и передают на ПК, где с помощью специальной программы ведется запись и дальнейшая обработка сигнала. Измеряется радиофизический отклик U (напряжение на выходе рупора в вольтах). Эффект перехода от воды к раствору проявляется в виде величин ∆U = Uраствора– Uводы. На рис. 1 представлены измеренные значения ∆U для растворов HCl и HNO3 разных концентраций. Градуировка шкалы прибора с использованием эталонов описана в [7]. Исходя из нее, можно рассчитать относительные изменения излучения растворов по сравнению с водой. Интенсивность собственного излучения раствора χ целесообразно выражать через квазиоптические коэффициенты и радиояркостную температуру Тя (Тя= χT, где Т – термодинамическая температура). В данной работе весь эксперимент проведен при Т = = 298.15 К. Соответствующие параметры радиояркости, полученные методом радиометрии, представлены в табл. 1.
Рис. 1.
Разности показаний радиометра ∆U = Uраствора– Uводы в зависимости от концентраций HNO3 ($\blacksquare $) и HCl ($ \bullet $) на частоте 61.2 ГГц.
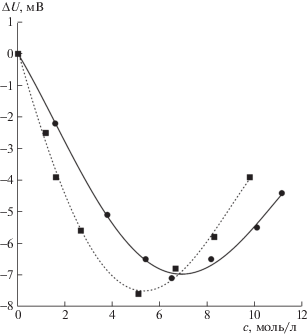
Таблица 1.
Разность сигналов ∆U = Uраствора– Uводы, коэффициенты излучения χ и радиояркостные температуры Тя растворов HCl и HNO3, полученные с помощью радиометра на частоте 61.2 ГГц (с – концентрация кислоты)
| Система | с, моль/л | ΔU, мВ | χ | Тя, К |
|---|---|---|---|---|
| H2O | 0 | 0 | 0.506 | 150.9 |
| HCl | 1.17 | –2.5 | 0.479 | 142.8 |
| 1.60 | –3.9 | 0.465 | 138.8 | |
| 2.65 | –5.6 | 0.448 | 133.70 | |
| 5.09 | –7.6 | 0.428 | 127.67 | |
| 6.66 | –6.8 | 0.436 | 129.9 | |
| 8.29 | –5.8 | 0.446 | 132.9 | |
| 9.80 | –3.9 | 0.465 | 138.76 | |
| HNO3 | 1.58 | –2.2 | 0.482 | 143.71 |
| 3.76 | –5.1 | 0.453 | 135.1 | |
| 5.39 | –6.5 | 0.439 | 130.9 | |
| 6.49 | –7.1 | 0.433 | 129.1 | |
| 8.17 | –6.5 | 0.439 | 130.9 | |
| 10.10 | –5.5 | 0.449 | 133.9 | |
| 11.14 | –4.4 | 0.460 | 137.1 |
МЕТОДИКА РАСЧЕТОВ
Существует связь между диэлектрическими свойствами и квазиоптическими характеристиками растворов. Зная комплексную диэлектрическую проницаемость водных растворов ε*(ν) на частоте ν, можно найти их квазиоптические параметры. Коэффициент отражения R(ν) рассчитывается из ε*(ν) с помощью формулы Френеля (случай нормально падающей волны):
При полном поглощении излучения образцом коэффициент отражения (в условиях термодинамического равновесия) будет связан с измеряемым в радиометрическом эксперименте коэффициентом излучения χ(ν) простым соотношением: χ(ν) = 1 – R(ν). Основной радиометрический показатель – радиояркостная температура Тя(ν) на частоте ν находится из выражения: Тя(ν) = χ(ν)T.
По техническим причинам прямые измерения диэлектрических параметров на интересующей нас частоте затруднены. Поэтому использовали экстраполяцию известных диэлектрических данных для частот 7–25 ГГц на частоту 61.2 ГГц.
Комплексная диэлектрическая проницаемость на частоте ν определяется как ε*(ν) = ε'(ν) – ‒ iε''(ν), где ε' – диэлектрическая проницаемость, ε'' – диэлектрические потери, i – мнимая единица. В случае неэлектролитов для воспроизведения спектра ε*(ν) в диапазоне частот обычно используют функцию Дебая, модифицированную Коулом и Коулом [12]:
(1)
$\varepsilon {\kern 1pt} {\text{*}}{\kern 1pt} (\nu ) = {{\varepsilon }_{\infty }} + \frac{{{{\varepsilon }_{S}} - {{\varepsilon }_{\infty }}}}{{1 + {{{(i{\kern 1pt} 2\pi \nu \tau )}}^{{1 - \alpha }}}}},$Ранее проведенные измерения комплексной диэлектрической проницаемости растворов HCl и HNO3 в области максимума дисперсии растворов (7–25 ГГц) были использованы для определения параметров функции (1) [14, 15]. Полученные значения приведены в табл. 2.
Таблица 2.
Значения параметров моделей диэлектрических спектров, использованных при экстраполяции диэлектрических данных из диапазона частот 7–25 ГГц на частоту 61.2 ГГц
| Система | с, моль/л | σ, Cм/м | εS | τ, пс | α |
|---|---|---|---|---|---|
| H2O | 0 | 0 | 78.4 | 8.25 | 0 |
| HCl | 0.25 | 9.35 | 70.7 | 8.0 | 0.02 |
| 0.50 | 18.00 | 65.0 | 7.9 | 0.08 | |
| 1.00 | 33.84 | 51.4 | 7.2 | 0.17 | |
| 1.50 | 44.80 | 39.8 | 6.5 | 0.15 | |
| HNO3 | 0.25 | 9.80 | 70.36 | 7.74 | 0 |
| 0.50 | 20.04 | 63.04 | 7.23 | 0.02 | |
| 1.00 | 37.41 | 49.76 | 6.51 | 0.07 |
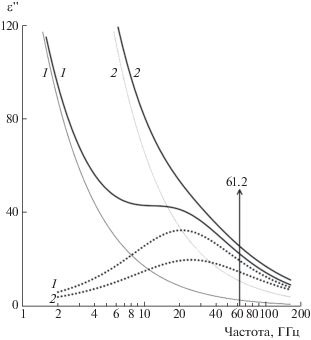
Оба вклада в ε''(ν) зависят от частоты, при этом вид зависимостей $\varepsilon _{d}^{{''}}(\nu )$ и $\varepsilon _{i}^{{''}}(\nu )$ различен. Ионные потери превалируют на низких частотах, сравнимы с дипольными в области максимума дисперсии воды и заметно меньше дипольных потерь в миллиметровой области. На рис. 2 это показано на примере двух растворов с разными концентрациями HNO3. Там же указана частота 61.2 ГГц, на которой были проведены радиометрические измерения.
Рис. 2.
Частотные зависимости разных вкладов диэлектрических потерь в 0.25 M (1) и 1.0 M (2) водных растворах HNO3: ионные потери (сплошные линии), дипольные потери (пунктирные линии), полные диэлектрические потери (утолщенные сплошные линии). Показана частота радиометрических экспериментов.
Ионный вклад в ε''(ν) быстро уменьшается с ростом частоты, поэтому им часто пренебрегают в миллиметровой области частот. В связи с этим представляет интерес сопоставить оба варианта расчета радиояркостных характеристик растворов. В одном случае учитываются как ионные, так и дипольные диэлектрические потери (χ, Тя), а в другом – только дипольный вклад в ε" (χ(d), Тя(d)). В табл. 3 приведены рассчитанные из имеющихся экспериментальных данных по ε* коэффициенты излучения и радиояркостные температуры для дипольных и полных потерь.
Таблица 3.
Коэффициенты излучения χ и радиояркостная температура Тя водных растворов HCl и HNO3 на частоте 61.2 ГГц, полученные экстраполяцией диэлектрических данных из диапазона частот 7–25 ГГц
| Система | с, моль/л | χ(d)* | χ | Тя(d)*, К | Тя, К |
|---|---|---|---|---|---|
| H2O | 0 | 0.506 | 0.506 | 150.9 | 150.9 |
| HCl | 0.25 | 0.520 | 0.496 | 155.0 | 148.0 |
| 0.50 | 0.534 | 0.491 | 159.3 | 146.2 | |
| 1.00 | 0.567 | 0.485 | 169.1 | 144.7 | |
| 1.50 | 0.604 | 0.481 | 180.0 | 143.4 | |
| HNO3 | 0.25 | 0.516 | 0.491 | 153.8 | 146.5 |
| 0.50 | 0.528 | 0.479 | 157.5 | 142.9 | |
| 1.00 | 0.561 | 0.469 | 167.3 | 139.7 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
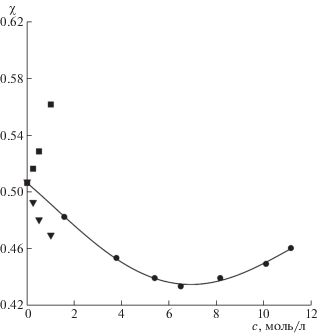
Имеющийся экспериментальный материал и оценки параметров из диэлектрических данных в области максимума дисперсии воды растворов позволяют более подробно рассмотреть изменения χ в начальной области концентраций. Как видно из рис. 3 и 4 при невысоких концентрациях наблюдается согласие этих величин с расчетными значениями. Это свидетельствует о правильности выбора релаксационных моделей и значений параметров для ионных и гидратационных вкладов на рассматриваемых частотах мм диапазона. Тем самым, в начальной области концентраций они оказываются пригодными и для растворов кислот с высокими ионными потерями. Для растворов HNO3 согласие несколько хуже. В то же время следует отметить, что оно определяется не только экспериметальными радиояркостными характеристиками, но и точностью подбора релаксационной модели для описания спектров в см-области.
Рис. 3.
Концентрационные зависимости коэффициента излучения χ на частоте 61.2 ГГц для растворов HCl: экспериментальные измерения ($ \bullet $), расчеты χ из диэлектрических данных с учетом ионных потерь ($\blacktriangledown $) и без учета ионных потерь ($\blacksquare $).
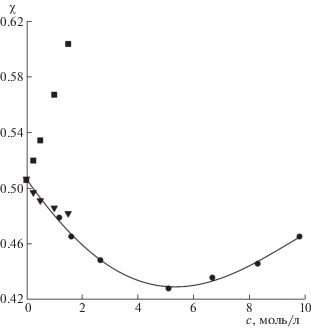
Рис. 4.
Концентрационные зависимости коэффициента излучения χ на частоте 61.2 ГГц для растворов HNO3: экспериментальные измерения ($ \bullet $), расчеты χ из диэлектрических данных с учетом ионных потерь ($\blacktriangledown $) и без учета ионных потерь ($\blacksquare $).
Сравнение с данными для других растворов электролитов показывает, что наблюдается падение излучения при переходе от воды к раствору, как и в растворах хлорида калия. Причем здесь оно проявляется даже в большей степени, чем в случае других систем. В случае растворов солей такое уменьшение связано со слабой гидратацией ионов. В то же время гидратацию иона H+ ни в коей мере нельзя считать слабой. Здесь образуются устойчивые гидратные комплексы. С другой стороны, аномально высокая подвижность протона определяет повышенную электропроводность и большие ионные потери (понижающая составляющая в χ). Отмеченное относится к первой области концентраций, где присутствует исходная тетраэдрическая структура воды и аномальная подвижность протона. Минимум на зависимостях χ объясняется с этих позиций. Как и в случае электропроводности, он определяется, в первую очередь, образованием сложных ионно-водных агрегатов в условиях отсутствия исходной структуры воды и пониженных значениях диэлектрических констант [16]. Этот эффект проявляется при концентрации растворов HCl 5–6 M, а для растворов HNO3 – при 6–7 M. При больших концентрациях низкочастотная электропроводность падает при увеличении концентрации, так же, как и величины χ. Таким образом, в концентрированных растворах кислот проявляется добавочный механизм взаимодействий, определяющий изменения радиояркостных контрастов. Развиваемый подход создает возможности развития нового метода дистанционного исследования свойств агрессивных водных сред в широкой области концентраций.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований и при частичной поддержке РФФИ (грант № 19-03-00033а).
Список литературы
Бецкий О.В., Кислов В.В., Лебедева Н.Н. Миллиметровые волны и живые системы. М.: “Сайнс-Пресс”, 2004. 271 с.
Тамбиев А.Х., Киркоров Н.Н., Бецкий О.В. Миллиметровые волны и фотосинтезирующие организмы. Монография / Под ред. Ю.В. Гуляева и А.Х. Тамбиева. М.: Радиотехника, 2003. 175 с.
Лященко А.К. // Биомедицинская радиоэлектроника. 2007. № 8–9. С. 62.
Шутко А.М. СВЧ-радиометрия водной поверхности. М.: Наука, 1986. 188 с.
Садовский И.Н., Шарков Е.А., Кузьмин А.В. и др. // Исследование земли из космоса. 2014. № 6. С. 79. https://doi.org/10.7868/S0205961414060050
Лященко А.К., Каратаева И.М., Козьмин А.С., Бецкий О.В. // Докл. АН. 2015. Т. 462. № 5. С. 561. https://doi.org/10.7868/S0869565215170168
Лященко А.К., Каратаева И.М., Дуняшев В.С. // Журн. физ. химии. 2019. Т. 93. № 4. С. 552. https://doi.org/10.1134/S0044453719040204
Лященко А.К., Ефимов А.Ю., Дуняшев В.С., Каратаева И.М. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 237. https://doi.org/10.31857/S0044457X20020099
Лященко А.К., Ефимов А.Ю., Дуняшев В.С., Ефименко И.А. // Там же. 2020. Т. 65. № 11. С. 1565. https://doi.org/10.31857/S0044457X20110112
Криворучко В.И. // Изв. вузов. Радиофизика. 2003. Т. 46. № 8–9. С. 782.
Козьмин А.С. Низкоинтенсивное электромагнитное излучение миллиметрового диапазона воды и водных растворов. Дисс. … канд. физ.- мат. наук. Волгоград, 2011. 180 с.
Cole K.S., Cole R.H. // J. Chem. Phys. 1942. V. 10. P. 98. https://doi.org/10.1063/1.1723677
Hasted J.B. Aqueous Dielectics. L.: Chapman and Hall, 1973. 302 p.
Lileev A.S., Loginova D.V., Lyashchenko A.K. // Mendeleev Commun. 2007. № 17. P. 364. https://doi.org/10.1016/j.mencom.2007.11.024
Lyashchenko A.K., Lileev A.S. // J. Chem. Eng. Data. 2010. V. 55. № 5. P. 2008. https://doi.org/10.1021/je900961m
Лященко А.К., Иванов А.А. // Журн. структур. химии. 1981. Т. 22. № 5. С. 69.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


