Журнал физической химии, 2021, T. 95, № 8, стр. 1241-1248
Термическое разложение [Cu(H2O)2(C8H4O4)], [CuNi(H2O)4(C8H4O4)2] и [Ni(H2O)2(C8H4O4)2](H2O)2 с образованием металлических и биметаллических наночастиц
Л. И. Юданова a, *, **, А. В. Ищенко b, Н. А. Рудина b
a Российская академия наук, Сибирское отделение, Институт неорганической химии им. А.В. Николаева
Новосибирск, Россия
b Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
* E-mail: judanova@niic.nsc.ru
** E-mail: judanova@ngs.ru
Поступила в редакцию 15.10.2020
После доработки 15.10.2020
Принята к публикации 03.11.2020
Аннотация
Проведено сравнение термоаналитических характеристик, а также состава и строения твердых продуктов термического разложения орто-фталатов [Cu(H2O)2(C8H4O4)], [CuNi(H2O)4(C8H4O4)2] и [Ni(H2O)2(C8H4O4)](H2O)2. Установлено, что процесс термического разложения этих соединений при нагревании до 500°C в атмосфере He условно можно разделить на две стадии: дегидратацию и декарбоксилирование. В полимерную матрицу композита, полученного термическим разложением [Cu(H2O)2(C8H4O4)], внедрены полимерные конгломераты, содержащие наночастицы Cu без оболочки, размер которых достигает 75 нм. Термолизом [CuNi(H2O)4(C8H4O4)2] получены наночастицы, внедренные в полимерную матрицу композитов, трех видов размером: 40–85, 15–25 и 10–15 нм, являющиеся твердыми растворами Cux/Ni1 – x различого состава. Установлено, что температура начала декарбоксилирования [CuNi(H2O)4(C8H4O4)2] на третьей ступени второй стадии с образованием трехфазной области коррелирует с температурой распада твердых растворов Cux/Ni1 – x в бинарной системе металлов, по-видимому, вследствие квантово-размерного эффекта.
Активно развивающееся в последние два десятилетия направление для создания новых конструкционных материалов – получение металлических и биметаллических наночастиц (НРЧ), последние из которых подразделяются на несколько типов, например, содержащие частицы металлов в оболочке из другого металла (“ядро–оболочка”), наносплавов с хаотичным или упорядоченным чередованием атомов металлов, а также однородных твердых растворов металлов, с характеристиками (например, проводимость, каталитическая активность, магнитные свойства), отличными от индивидуальных металлических НРЧ [1–4].
В качестве примера получения НРЧ типа “ядро–оболочка” можно привести термическое разложение гликолятов Cu/Ni. Способ основан на различной температуре разложения гликолятов, образующихся в кипящем щелочном растворе хлоридов (или нитратов) этих металлов в этиленгликоле. При варьировании условий разложения раствора получают почти сферические наночастицы Cu в оболочке Ni или наночастицы Ni в оболочке Cu. Данный способ позволяет получать НРЧ достаточно большого размера: диаметр частиц Cu/Ni составляет 550–620 нм, а Ni/Cu – 270–290 нм [5]. Уменьшение размера наночастиц достигается при термическом разложении солей карбоновых непредельных (акриловой, малеиновой) или ароматических (орто-, терефталевой) кислот переходных металлов [1, 6, 7].
Установлено, что наиболее подходящими прекурсорами для получения биметаллических наночастиц служат твердые растворы состава [(CoxNi1 – x)(H2O)4(С4H3O4)2] (система I), [(NixZn1 – x)(H2O)4(С4H3O4)2] (система II) (0 < x < < 1), кристаллизующиеся в триклинной сингонии: пр. гр. Pī, Z = 1. Например, при нагревании образцов в системе I до 500°C средний размер наночастиц CoxNi1 – x (x = 0.5), внедренных в матрицу композитов, составляет 15 нм, до 850°C – 25 нм, до 1200°C – 250 нм, тогда как диаметр сферических наночастиц NixZn1 – x (x = 0.9), полученных разложением при 500°C образцов в системе II уменьшается до 6.5 нм [7].
Синтез двойных орто-фталатов переходных металлов или гомогенных твердых растворов этих соединений, термическим разложением которых возможно получение биметаллических НРЧ, достаточно затруднителен. Причиной этого, как показало структурное исследование кислых фталатов [M(H2O)6](C8H5O4)2 (M = Fe(II), Co(II), Ni(II)), [Cu(H2O)2(C8H5O4)2], является наличие для каждого из них нескольких полиморфных модификаций одинакового состава с близкими условиями кристаллизации (например, для кислого фталата Co(II) найдены три модификации [8–10], для кислых фталатов Ni(II) и Cu(II) – по две модификации [11–14]). Поэтому поиск способа получения двойных орто-фталатов переходных металлов, которые могут быть использованы в качестве прекурсоров для синтеза биметаллических НРЧ, остается актуальным до сих пор.
Задача настоящей работы – оптимизация условий синтеза, исследование и сравнение термоаналитических характеристик и продуктов разложения орто-фталатов [Cu(H2O)2(C8H4O4)], [CuNi(H2O)4(C8H4O4)2] и [Ni(H2O)2(C8H4O4)](H2O)2 с целью разработки способа получения биметаллических (Cu/Ni) НРЧ при термолизе [CuNi (H2O)4(C8H4O4)2].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При синтезе [Cu(H2O)2(C8H4O4)] и [Ni(H2O)2(C8H4O4)](H2O)2 стехиометрические количества CuSO4 ⋅ 5H2O или NiSO4 ⋅ 6H2O (марки не ниже “ч.д.а.”) соответственно растворяли в минимальном количестве горячей дистиллированной воды и приливали горячий раствор свежеприготовленного фталата натрия (для получения которого использовали бикарбонат NaHCO3 и фталевую кислоту H6C8O4 или фталевый ангидрид H4C8O3). Кристаллы выращивали на воздухе в течение 2–3 недель; выделяли на воронке Бюхнера и промывали несколько раз холодной дистиллированной водой. Полученные соединения окрашены в цвета соответствующих ионов: синий – для соли меди и зеленый – для соли никеля.
Кристаллы [CuNi(H2O)4(C8H4O4)2] получали длительным выдерживанием (~30 суток) суспензии [Cu(H2O)2(C8H4O4)] в насыщенном растворе [Ni(H2O)2(C8H4O4)](H2O)2 при температуре 30–40°C с периодическим перемешиванием раствора. Синтезированные кристаллы темно-зеленого цвета выделяли на воронке Бюхнера и промывали несколькими порциями холодной дистиллированной воды: в воде они практически нерастворимы. Выход продукта составил 90–95%.
Содержание металлов в исходных соединениях и получающихся при их разложении композитах определяли методом комплексонометрического титрования (точность ±0.25 мас. %) или атомно-абсорбционным методом на АА спектрофотометре Z-8000, углерода и водорода – на CHN-анализаторе (серия Euro EA 3000) (точность определения ±0.5 мас. %). Для [Cu(H2O)2 (C8H4O4)], найдено, %: C 36.1, H 3.2, Cu 24.0; вычислено, %: C 36.4, H 3.0, Cu 24.1. Для [CuNi (H2O)4(C8H4O4)2], найдено, %: C 36.5, H 3.0, Cu 12.8, Ni 11.1; вычислено, %: C 36.8, H 3.0, Cu 12.2, Ni 11.2. Для [Ni(H2O)2(C8H4O4)](H2O)2, найдено, %: C 31.5, H 4.4, Ni 19.8; вычислено, %: C 31.6, H 4.1, Ni 19.9.
Рентгенографическое исследование, как исходных соединений, так и продуктов их разложения проводили на дифрактометрах ДРОН-УМ1, Shimadzu XRD–7000 (CuKα-излучение, Ni-фильтр, комнатная температура). Показано, что [Cu(H2O)2(C8H4O4)] (I) и [CuNi(H2O)4(C8H4O4)2] (II) кристаллизуются в моноклинной сингонии с различными параметрами. Для соединения I: пр.гр. P21, Z = 2; a = 10.263(7), b = 6.540(9), c = = 6.795(8) Å, β = 94.8 (1)°, V = 454.5 (9) Å3, dизм = = 1.93 г/см3 [15]. Для соединения II: пр. гр. P21/n, Z = 4, a = 13.2079(13) Å, b = 8.0371(6) Å, c = = 18.1794(15) Å, β = 96.744(9)°, V = 1655.8 Å3, dизм = = 1.870 г/см3, dрент = 1.873 г/см3.
Процесс термического разложения соединений исследовали в токе He (60 см3/мин) комплексом методов: термогравиметрическим (ТГ), дифференциально-термического анализа (ДТА) и дифференциально-термогравиметрическим (ДТГ) на дериватографе (МОМ, Венгрия) при нагревании до температуры 500°C (точность измерения температуры ±10 К). Масса образцов в опытах 20–50 мг при точности определения потери массы ±0.1%, скорость нагрева 2–10 K/мин, держатель образца – керамический микротигель.
Инфракрасные спектры солей и получаемых их разложением композитов регистрировали на фурье-спектрометре Scimitar FTS 2000 в области волновых чисел 400–4000 см–1. Образцы готовили в виде таблеток с KBr.
Газообразные продукты разложения орто-фталатов исследовали на масс-спектрометре MИ–1201 в вакууме 5 × 10–8–10–7 Торр при повышении температуры до ~350°C.
Твердые продукты термического разложения изучали методами электронной сканирующей микроскопии (СЭМ) на микроскопе JSM-6460LV (JEOL-Япония) и просвечивающей электронной микроскопии высокого разрешения (ПЭМ) на микроскопе JEM-2010 (JEOL, Япония) с ускоряющим напряжением 200 кэВ и разрешением по решетке 1.4 Å.
Энергодисперсионный рентгеновский микроанализ (ЭДРМА) элементного состава образцов проводили на спектрометре “Phoenix” с Si(Li) детектором и разрешением по энергии ~130 эВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процесс термического разложения [Cu(H2O)2 (C8H4O4)] (I), [CuNi(H2O)4(C8H4O4)2] (II) и [Ni(H2O)2(C8H4O4)](H2O)2 (III) при нагревании до 500°C в атмосфере He условно можно разделить на две стадии: дегидратацию и декарбоксилирование (рис. 1). При дегидратации соединений I и II элиминирование координированной воды начинается при температуре 150 и 140°C соответственно и протекает в две ступени (для соединения I потеря массы составляет 13.8%; расчетное количество – 13.7%; для соединения II – 14 и 13.8%). Показана корреляция между дегидратацией воды в две ступени и структурными характеристиками соединения I. В структуре этого соединения различие длин связей Cu–Oводы в координационном октаэдре (1.980(5), 2.007(5) Å) составляет 0.027 Å [15].
Рис. 1.
Термические кривые процесса разложения [Cu(H2O)2(C8H4O4)] (а), [CuNi(H2O)4(C8H4O4)2] (б) и [Ni(H2O)2(C8H4O4)](H2O)2 (в).
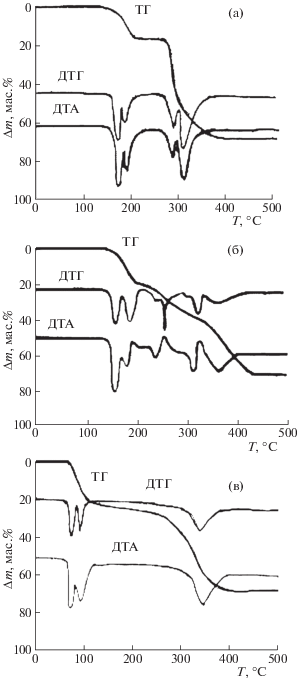
При разложении соединения III дегидратация кристаллизационной и координированной H2O протекает в две ступени. Первая ступень начинактся при 85°C, вторая – при 120°C. Потеря массы при дегидратации составляет 23.2%, расчетное количество – 24.4%.
Химический, ИК-спектроскопический анализ промежуточной фазы и сравнение потери массы по термогравиметрической кривой с рассчитанной теоретически показывают, что по окончании дегидратации соединений I и II вода (ν(OH) = 3400 см–1) удаляется практически полностью. Методом РФА установлено образование в обоих случаях кристаллических орто-фталатов состава [Cu(C8H4O4)] или [CuNi(C8H4O4)2] соответственно, тогда как элиминирование кристаллизационной и координированной H2O при разложении соединения III приводит к образованию аморфной фазы [12].
Декарбоксилирование соединений I и III на второй стадии протекает в две, соединения II – в три ступени. Начало первой ступени разложения соединения I соответствует 275°C. Промежуточной фазой, образующейся при термолизе, является фталат одновалентной Cu(I), так же, как при разложении изученных ранее орто-фталатов [Cu(H2O)(C8H4O4)] и [Cu(H2O)2(C8H5O4)2] [12]. Об этом свидетельствует расчет степени превращения вещества (α) по формуле: α = (m0 – ‒ mt)/(m0 – mf); mt – масса вещества в произвольный момент времени t (или температуры T), m0 и mf – масса вещества в начале и в конце стадии соответственно. Потеря массы – 30.0% (расчетное количество при элиминировании половины фталат-анионов – 31.1%). Разложение на второй ступени начинается при 300°C, потеря массы – 24.4%. Общая потеря массы вещества по окончании процесса составляет 68.2%.
При декарбоксилировании соединения II, которое начинается при температуре 225°C, к разложению соли на первой ступени второй стадии добавляется восстановление Cu2+ → Cu+, проходящее, по-видимому, с образованием промежуточной фазы, содержащей ион одновалентной меди. В пользу такого предположения свидетельствуют как присутствие экзотермического эффекта на кривых ДТА этого соединения, так и то, что практическая потеря массы (17.8%), рассчитанная по кривой ТГ на первой ступени, незначительно превышает потерю массы при элиминировании половины фталат-анионов, принадлежащих в соединении II катиону меди (15.7%) (коррелирует с восстановлением Cu2+ → Cu+). На второй ступени при температуре 300°C начинаются разложение этой фазы (с проявлением экзотермического эффекта на кривой ДТА) и образование второй промежуточной фазы, разложение которой начинается при 340°C. Потеря массы на второй и третьей ступенях составляет 38.2%, при общей потере массы ~ 70.0%.
Декарбоксилирование соединения III начинается при 300°C и протекает в две ступени [12]. Потеря массы на II стадии составляет 43.8%; общая потеря массы процесса – 68.2%.
Следует отметить уменьшение температуры начала второй стадии разложения в ряду орто-фталатов: Ni (300°C) > Cu (275°C) > CuNi (225°C).
Методом масс-спектрометрии установлено, что термическое разложение соедиений I, II и III [12] на второй стадии сопровождается выделением CO2, дифенилена C12H8 и флуорена (C6H4)2CH2.
Продуктом термического разложения всех соединений являются композиты, имеющие вид коричневого (для соединений I и II) или черного (для соединения III) порошка, состоящего из металлической или биметаллической фазы, соответственно органического полимера и аморфного углерода. Состав композитов при разложении соединения I,%:
C 24.4, H 1.5, Cu 74.1; соединения II: C 23.1, H 1.3, Cu 39.2, Ni 36.3; соединения III: C 31.3, H 1.3, Ni 67.3. Расчеты (по остатку) содержания кислорода показывают его осутствие в композите, полученном разложением соединения I, и присутствие в виде примеси (0.1% в обоих случаях) в композитах при разложении соединений II и III.
В ИК-спектрах всех композитов содержатся полосы поглощения в области 3030 см–1 (ν(C–H)). Слабые полосы поглощения в области 1730 см–1 во всех спектрах можно объяснить окислением углеродных групп, находящихся на поверхности композита. Полосы в области 1620 см–1 относятся к колебаниям кратной связи ν(C=C) алкенов, в то время, как полосы в области 1585, 1485 см–1 (ν(C=C)) обусловлены колебаниями ароматического цикла, а полосы в области 750 см–1 можно соотнести с колебаниями деформационной связи δ(C–H).
Присутствие в композитах углеродно-полимерной матрицы подтверждено методами сканирующей (СЭМ) и просвечивающей (ПЭМ) электронной микроскопии, а также рентгеновской спектроскопии.
Сферические конгломераты, внедренные в углеродно-полимерную матрицу композита, полученного разложением соединения I, содержат сферические частицы Cu, диаметр которых достигает 75 нм (рис. 2а и 3). В рентгеновских спектрах этого композита обнаружены линии, соответствующие CuK, CuL и CL.
Рис. 2.
СЭМ-микрофотографии композитов, полученных при разложении [Cu(H2O)2(C8H4O4)] (а), [CuNi(H2O)4(C8H4O4)2] (б) и [Ni(H2O)2(C8H4O4)](H2O)2 (в).

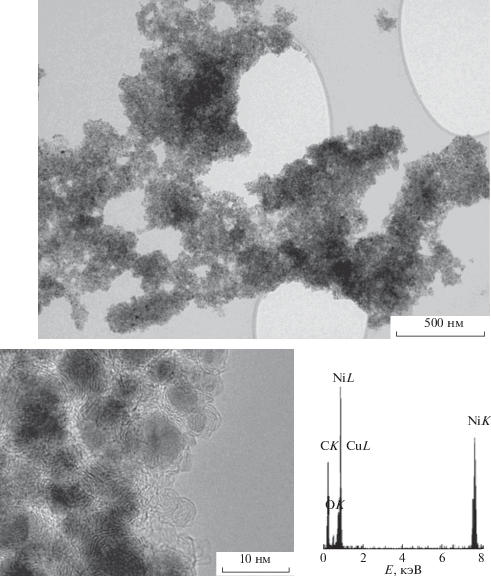
В полимерную матрицу композита, полученного разложением соединения III, внедрены сферические частицы Ni размером 6–8 нм, окруженные от 2 до 5 неупорядоченных графеновых слоев (рис. 2в и 4). Сферы из нескольких графеновых слоев на поверхности не содержат Ni. В рентгеновских спектрах композита обнаружены линии, соответствующие CK, NiL, NiK, слабые линии OK. (Линии CuL относятся к медной подложке, на которую нанесены исследуемые образцы.)
В полимерную матрицу композита, полученного разложением соединения II, внедрены конгломераты трех видов: кубические со сглаженными вершинами; эллипсоидной и сферической формы, часть из которых вынесена на поверхность композита (рис. 2б).
Рис. 3.
ПЭМ-изображение конгломератов (а), НРЧ Cu (б) и рентгеновский спектр (в) композита, полученного разложением [Cu(H2O)2(C8H4O4)].
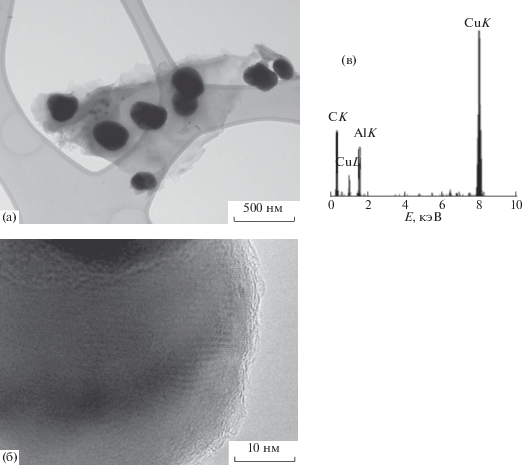
Рис. 4.
ПЭМ-изображение НРЧ Ni и рентгеновский спектр композита, полученного разложением [Ni(H2O)2(C8H4O4)](H2O)2.
Исследования, проведенные методом ПЭМ, указывают на присутствие в этих конгломератах НРЧ разного диаметра, которые можно подразделить, по крайней мере, на три группы: 40–85, 15–25 и 10–15 нм. В рентгеновских спектрах этих композитов обнаружены линии, соответствующие CuK, CuL, NiK, NiL, CK, CL (рис. 5). (Рефлексы Al в рентгеновских спектрах композитов при разложении соединений I и II можно отнести к алюминиевой подложке, на которую нанесены образцы.)
Рис. 5.
ПЭМ-изображения биметаллических НРЧ CuxNi1 – x (x = 0.7 (а), 0.5 (б) и 0.3(в)), внедренных в полимерную матрицу композитов, и рентгеновский спектр этих композитов при разложении [CuNi(H2O)4(C8H4O4)2].

На дифрактограмме композита, полученного разложением соединения I обнаружены рефлексы Cu, соединеня III – Ni. Оба металла имеют гранецентрированную кубическую (ГЦК) решетку с объемом VCu= 47.242 Å3 и VNi = 43.800 Å3 соответственно. На дифрактограмме композита, полученного разложением соединения II, обнаружены рефлексы, по крайней мере, трех биметаллических фаз. Структура твердых растворов, составляющих эти фазы, может быть расшифрована в рамках ГЦК-сингонии с объемом решетки V = 46.270, 45.500 и 44.740 Å3 соответственно. Согласно фазовой диаграмме, в бинарной системе металлов Cu–Ni выше температуры 340°C должен существовать непрерывный ряд твердых растворов [16]. Однако интерполяция зависимости объема решетки от концентрации растворов указывает на присутствие дискретного ряда твердых растворов состава CuxNi1 – x (x = 0.3, 0.5 и 0.7).
Соотношение интенсивности рефлексов в рентгеновских спектрах композитов, содержащих НРЧ с различными твердыми растворами, коррелирует с предложенным составом (рис. 5а–5в).
Таким образом, температура начала термического разложения [CuNi(H2O)4(C8H4O4)2] на третьей ступени декарбоксилирования (340°C) коррелирует с температурой начала распада твердых растворов CuxNi1 – x на бинодальной кривой в бинарной системе металлических Cu–Ni и совпадает с температурой критической точки несмешиваемости, которая реализуется (согласно фазовой диаграмме системы Cu–Ni) при 342°C и концентрации Ni 69.7 ат. % [16]. Распад происходит с образованием трехфазной области, содержащей, по крайней мере, три несмешивающихся твердых раствора состава CuxNi1 – x (x = 0.3, 0.5 и 0.7).
Следует отметить, что распад твердых растворов в биметаллических наночастицах CuxNi1 – x, по-видимому, происходит вследствие проявления квантово-размерного эффекта [17].
Авторы выражают глубокую благодарность В.А. Логвиненко и Л.А. Шелудяковой – за полезное обсуждение результатов работы; Н.Ф. Бейзель, А.П. Зубаревой – за проведение элементного анализа.
Список литературы
Pomogailo A.D., Kestelman V.N. Metallopolymer nanocomposites. Berlin, Heidelberg, New York: Springer, 2005. 564 p.
Низкоразмерный магнетизм / А.Н. Васильев, О.С. Волкова, Е.А. Зверева, М.М. Маркина. М.: Физматлит, 2018. 300 с.
Попов Ю.В., Мохов В.М., Небыков Д.Н. и др. Нанокатализ в современной химии и химической технологии. Волгоград: ВолгГТУ, 2016. 272 с.
Физика на переломе тысячелетий. Физические явления микро- и наномасштаба: учебник / В.К. Воронов, А.В. Подоплелов, Р.З. Сагдеев. М.: URSS: Ленанд, 2018. 365 с.
Carrol K.J. Calvin S., Ekiert T.F. et al. // Chem. Mater. 2010. V. 22. P. 2175.
Юданова Л.И., Логвиненко В.А., Шелудякова Л.А. и др. // Коорд. химия. 2017. Т. 43. № 7. С. 421.
Юданова Л.И., Логвиненко В.А., Ищенко А.В. и др. // Журн. физ. химии. 2020. Т. 94. № 10. С. 1539.
Adiwidjaja G., Rossmanith E., Küppers H. // Acta Cryst. 1978. V. B34. P. 3079.
Küppers H. // Z. fur Kristallographie. 1990. V. 192. P. 97.
Karjuki B.M. and Jones W. // Acta Cryst. 1993. V. C. 49. P. 2100.
Adiwidjaja G., Küppers H. // Ibid. 1976. V. B32. P. 1571.
Юданова Л.И., Логвиненко В.А., Юданов Н.Ф. и др. // Журн. физ. химии. 2016. Т. 90. № 6. С. 896.
Cingi M., Guastini C., Musatti A., Nardelli M. // Acta Cryst. 1969. B25. P. 1833.
Rodrigues B.N., Costa M.D.D., Fernandes N.G. // Ibid. 1999. V. C55. P. 1997.
Cingi M.B., Lanfredi A.M.M., Tiripicchio A., Camellini M.T. // Ibid. 1978. V. B34. P. 134.
Диаграммы состояния двойных металлических систем: справочник / Под общей ред. Н.П. Лякишева. М.: Машиностроение, 2001. Т. 2.
Chou Fang-Cheng // Appl. Phys. Rev. 2019. V. 6. P. 011304; https://doi.org/10.1063/1.5066031
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


