Журнал физической химии, 2021, T. 95, № 8, стр. 1171-1174
Теплоемкость системы этиленгликоль–диметилсульфоксид
А. В. Тюрин a, И. А. Солонина a, М. Н. Родникова a, *, Д. А. Сироткин a
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
* E-mail: rodnikova@igic.ras.ru
Поступила в редакцию 18.08.2020
После доработки 30.09.2020
Принята к публикации 01.10.2020
Аннотация
С целью выявления сольвофобного эффекта в жидкой системе этиленгликоль (ЭГ)–диметилсульфоксид (ДМСО) была измерена теплоемкость системы в области малых концентраций ДМСО от 0 до ~15 мол. % ДМСО, а также при 50 мол. % ДМСО и чистого ДМСО в интервале температур 300–340 К. Рассчитана концентрационная зависимость кажущейся и избыточной кажущейся теплоемкости ДМСО при исследованных пяти температурах. Полученные результаты объяснены с позиции слабого сольвофобного эффекта в исследованной системе ЭГ–ДМСО.
Водные растворы этиленгликоля (ЭГ) и диметилсульфоксида (ДМСО) широко используются в криобиологии как охлаждающие смеси для длительного хранения клеток и органов при трансплантации [1, 2]. В растворах ЭГ это связано с наличием устойчивой пространственной сетки водородных связей [3], в растворах ДМСО – со строением и химизмом молекулы [1].
В водных растворах ДМСО обнаружены эффекты: гидрофобная гидратация и гидрофобное взаимодействие [4–6]. В работах [3, 7, 8] гидрофобный эффект объясняется наличием в воде пространственной сетки Н-связей: ее лабильностью – способностью образовывать необходимые для гидрофобной гидратации пустоты, и упругостью – способностью выталкивать гидрофобные частицы или гидрофобные части молекул и объединять их гидрофобными частями, что ведет к микрорасслаиванию. Встал вопрос – есть ли сольвофобные эффекты в растворах неэлектролитов в других, кроме воды, растворителях с пространственной сеткой водородных связей, в частности, в растворах ЭГ. С этим вопросом связана постановка данной работы. Ранее одним из авторов были обнаружены сольвофобные эффекты в этиленгликолевых растворах тетраметилмочевины [9–11].
Концентрационная зависимость теплоемкости является одним из признаков сольвофобного эффекта. Наиболее ярко это проявляется на концентрационных зависимостях кажущихся, избыточных кажущихся и молярно-парциальных теплоемкостях неэлектролита: наличие максимума при малых концентрациях неэлектролита [12–14] и сильное падение этой величины в области концентрации неэлектролита, меньше 0.1 мол. доли. Объяснения этого эффекта противоречивы [14–16]. Мы придерживаемся объяснения, данного в работе [16], в которой исследована теплоемкость в системе ЭГ–трет-бутанол. Это объяснение связано с наличием в ЭГ пространственной сетки водородных связей и наличия в растворе недостижимой критической точки расслаивания, объясняемой сольвофобным эффектом [17, 18].
В табл. 1 приведем физико-химические свойства ЭГ и ДМСО – компонентов исследуемой нами системы [19].
Таблица 1.
Физико-химические характеристики ЭГ и ДМСО при 298 К [19]
| Параметры | ДМСО | ЭГ |
|---|---|---|
| М | 78 | 62 |
| Тпл, К | 291 | 260 |
| Ткип, К | 462 | 470 |
| Тпереохл, К | 9 | 31 |
| ρ × 10–3, кг/м3 | 1.0955 | 1.113 |
| η × 103, Па с | 2298 К | 58273 К 34283 К 16298 К 11308 К |
| D × 105, см2/c | 0.72 | 0.083 |
| ε | 46.4 | 40 |
| μ, D | 3.96 | 2.88 |
| $D{{N}_{{{\text{SbC}}{{{\text{l}}}_{{\text{5}}}}}}}$ | 29.8 | 18.5 |
| ∆vapH, кДж/моль | 54.39 | 50 |
| βТ × 1011, Па–1 | 37.4 | |
| Обозначения: η − вязкость, βТ − изотермическая сжимаемость | ||
Обращает на себя внимание малая сжимаемость, малый коэффициент самодиффузии и большая вязкость, сильно зависящая от температуры ЭГ, объясняющие сравнительно малую лабильность его пространственной сетки Н-связей, повышающуюся с возрастанием температуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворы ДМСО в ЭГ готовили гравиметрически в сухой камере в токе азота. Для приготовления образцов использовали ЭГ 99% и ДМСО 99% марки “Acros”. Содержание воды в образцах не превышало 0.1% (метод Фишера).
Для измерения теплоемкости системы ЭГ–ДМСО в интервале температур 130–340 К использовали адиабатический вакуумный калориметр БКТ-3 (АБК), сконструированный и изготовленный в АОЗТ “Термис” (г. Менделеево Московской обл.). Измерения проводились автоматически и контролировались компьютерно-измерительной системой. Калориметрическая ампула представляла собой тонкостенный цилиндрический титановый сосуд с внутренним объемом 1 см3 и массой 1.6 г с завинчивающейся бронзовой крышкой с индиевым уплотнением для герметизации. Температура измерялась железо-родиевым термометром сопротивления (R ≈ ≈ 100 Ом). Чувствительность термометрической схемы 1 × 10–3 К, абсолютная погрешность измерений температуры ±5 × 10–3 К в соответствии с МТШ-90. Конструкция и принцип работы калориметра описаны в [20]. Надежность измерительной процедуры проверена путем измерения теплоемкости меди марки особой чистоты, стандартного синтетического корунда и бензойной кислоты марки К-2, приготовленных в метрологических учреждениях Госстандарта России. Установлено, что погрешность измерений теплоемкости веществ в области температур 40–350 К составляет 0.2%. Измерения проводились в режиме ступенчатого нагревания с шагом 3К. Необходимо отметить, что изменение регулярного хода теплоемкости (скачки, перегиб, пики) хорошо коррелирует с экстремумами на зависимости дрейфа температуры с течением времени при выравнивании температуры в калориметре после выключения нагрева в каждом калориметрическом опыте, что косвенно свидетельствует об изменении теплообмена в образце в случае превращения в этих интервалах температур.
Экспериментальные значения концентрационной зависимости теплоемкости системы ЭГ–ДМСО в интервале температур 300–340 К представлены в табл. 2. Рассчитанные концентрационные зависимости кажущейся теплоемкости (φ2, Дж/(моль К)) и избыточной кажущейся теплоемкости ($\varphi _{2}^{{\text{Е}}}$, Дж/(моль К)) ДМСО в этиленгликоле в интервале температур 300–340 К показаны в табл. 3.
Таблица 2.
Концентрационная зависимость теплоемкости системы ЭГ–ДМСО в интервале температур 300–340 К
| Концентрация, (моль % ДМСО) |
300 К | 310 К | 320 К | 330 К | 340 К |
|---|---|---|---|---|---|
| 0 | 149.3 | 151.9 | 154.6 | 157.7 | 160.5 |
| 1.13 | 149.3 | 152.6 | 155.9 | 159.0 | 162.0 |
| 3.51 | 149.9 | 152.9 | 156.1 | 159.1 | 162.0 |
| 4.70 | 149.3 | 152.2 | 155.1 | 158.0 | 160.9 |
| 9.98 | 148.5 | 151.7 | 154.6 | 157.2 | 159.9 |
| 13.55 | 145.5 | 147.3 | 148.8 | 150.3 | 153.0 |
| 49.56 | 147.4 | 149.4 | 151.6 | 153.4 | 155.7 |
| 100 | 152.3 | 153.3 | 154.4 | 155.5 | 156.5 |
Таблица 3.
Концентрационная зависимость кажущейся теплоемкости ($\varphi _{2}^{{}}$, Дж/(моль К)) и избыточной кажущейся теплоемкости ($\varphi _{2}^{{\text{Е}}}$, Дж/(моль К)) ДМСО в этиленгликолевом растворе в интервале температур 300–340 К
| мол. % ДМСО |
φ2, Дж/(моль К) | ||||
|---|---|---|---|---|---|
| 300 К | 310 К | 320 К | 330 К | 340 К | |
| 1.13 | 151 | 216 | 267 | 277 | 296 |
| 3.51 | 165 | 180 | 196 | 197 | 204 |
| 4.7 | 150 | 158 | 166 | 165 | 169 |
| 9.98 | 141 | 150 | 154 | 153 | 154 |
| 13.55 | 121 | 118 | 112 | 103 | 105 |
| 49.56 | 145 | 147 | 149 | 149 | 151 |
| 100 | 152 | 153 | 154 | 155 | 156 |
| мол. % ДМСО |
$\varphi _{2}^{{\text{Е}}}$, Дж/(моль К) | ||||
| 300 К | 310 К | 320 К | 330 К | 340 К | |
| 1.13 | –1 | 63 | 113 | 122 | 140 |
| 3.51 | 13 | 27 | 42 | 42 | 48 |
| 4.7 | –2 | 5 | 12 | 10 | 13 |
| 9.98 | –11 | –3 | 0 | –2 | –2 |
| 13.55 | –31 | –35 | –42 | –52 | –51 |
| 49.56 | –7 | –6 | –5 | –6 | –5 |
Из табл. 2 можно сделать следующие выводы. Теплоемкость ЭГ меньше теплоемкости ДМСО в интервале температур 300 К–320 К. Вернее, при 320 К эти теплоемкости становятся равными. В температурном интервале 320 К–340 К теплоемкость ЭГ больше теплоемкости ДМСО. Таким образом, температурная зависимость теплоемкости ЭГ больше чем температурная зависимость теплоемкости ДМСО.
Мы указывали, что сольвофобный эффект лучше проявляется на концентрационной зависимости кажущейся и избыточной кажущейся теплоемкости неэлектролита в растворе. Поэтому мы рассчитали концентрационную зависимость кажущейся и избыточной кажущейся теплоемкости ДМСО в растворе ЭГ. Результаты представлены в табл. 3 и на рис. 1.
Рис. 1.
Концентрационные зависимости избыточной кажущейся теплоемкости ($\varphi _{2}^{{\text{Е}}}$, Дж/(моль К)) ДМСО в этиленгликоле в интервале температур 300–340 К.
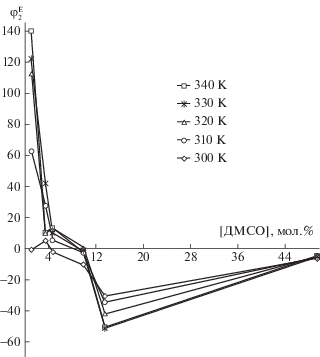
К сожалению, мы рассматриваем небольшой интервал температур. С одной стороны, мы ограничены температурой плавления ДМСО (291 К), с другой – параметрами прибора. При 300 К замечен небольшой пик избыточной кажущейся теплоемкости ДМСО при 3.51 мол. % ДМСО (рис. 1). Заметим, что в этой области концентрации при этой температуре был обнаружен слабый сольвофобный эффект, увеличивающийся с возрастанием температуры, что противоречит основным положениям о сольвофобных эффектах, стабилизирующих структуру растворителя [21, 22]. В наших результатах виден небольшой пик, но только при температуре 300 К. При дальнейших температурах его нет, а наблюдается резкое падение избыточной кажущейся теплоемкости ДМСО, наибольшее при ~14 мол. % ДМСО при 340 К. К сожалению, мы не можем сказать при какой концентрации должен быть минимум, но при ~50 мол. % ДМСО значение этой величины в 10 раз большее. Значит, есть концентрация, при которой начинается резкий подъем избыточной кажущейся теплоемкости ДМСО, показывающий, что пространственная сетка водородных связей в ЭГ разрушена [14].
Заметим, что фазовая диаграмма системы ЭГ–ДМСО [23] показывает падение базовой линии в интервале концентраций ~5–50 мол. % ДМСО (наибольшее падение от 5 до 20 мол. % ДМСО) в интервале температур от 281 К при 5 мол. % ДМСО до 268 К при 50 мол. % ДМСО. Авторы [23] связывают этот результат с жидкофазным расслаиванием в системе, проявляющимся только при медленном нагревании после быстрого охлаждения до 153 К (температура стеклования). Заметим, что система чувствует расслаивание по температуре и концентрации задолго от условий жидкофазного перехода [17, 18, 24]. Авторы работы [21] по динамическому рассеянию света в жидкой системе ЭГ–ДМСО связали образование наноразмерных ассоциатов в этиленгликолевых растворах, проявляющихся с течением времени, с микрорасслаиванием вследствие сольвофобного эффекта. Наноразмерные ассоциаты (302 К, 322 К [21]) были обнаружены в метастабильной области жидкой системы, образовавшейся из-за жидкофазного расслаивания (281 К, 268 К).
Небольшое увеличение теплоемкости раствора и кажущихся и избыточных кажущихся теплоемкостей ДМСО при концентрации 3.51 мол. % ДМСО, которое проявляется только при 300 К, мы объясняем некоторым нарушением пространственной сетки водородных связей ЭГ молекулами ДМСО для создания пустот, необходимых для сольвофобной сольватации молекул ДМСО в ЭГ. Но затем, сразу начинается падение кажущейся и избыточной теплоемкостей, что говорит о стабилизации сетки ЭГ молекулами ДМСО. При более высоких температурах, когда сетка более лабильна, падение значений теплоемкостей начинается сразу, как в водных растворах тетрагидрофурана и диоксана [14]. Жаль, что мы не вышли дальше по концентрации и фиксируем только ~50 мол. % ДМСО, когда теплоемкости близки к чистой жидкой ДМСО, а избыточные малы и сравнимы при всех измеренных температурах. Вероятно, в области средних концентраций концентрационная зависимость избыточной кажущейся теплоемкости ДМСО линейна, что указывает на микрорасслаивание в системе [14], которое связано с настоящим жидкофазным расслаиванием [23, 24].
Таким образом, пространственная сетка водородных связей в ЭГ, так же, как и в воде, играет большую роль в растворах неэлектролитов, несмотря на то, что в ЭГ она более дефектна: две СН2-группы в молекуле, образована разными конформерами с внутримолекулярной Н-связью, и поэтому менее лабильна, что затрудняет образование нужных для неэлектролита пустот. Кроме того, ЭГ обладает большой вязкостью, сильно зависящей от температуры, что также сказывается на лабильности сетки.
Авторы благодарят Ю.И. Наберухина за обсуждение данной работы и ценную дискуссию.
Исследование выполнено в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-03-00215.
Список литературы
Awan M., Buriak, I., Fleck R. et al. // Regenerative Medicine. doi: 2020. https://doi.org/10.2217/rme-2019-0145
Baudot A., Odagescu V. // Cryobiology. 2004. V. 48 (3) P. 283.
Родникова М.Н. // Журн. физ. химии. 1993. Т. 67. № 2. С. 275
Егоров Г.И.‚ Макаров Д.М. // Там же. 2009. Т. 83. № 5. С. 805.
Родникова M.H., Захарова Ю.А., Солонина И.А., Сироткин Д.А. // Там же. 2012. Т. 86. № 5. С. 993.
Kaatze U., Pottel R., Schäfer M. // J. Phys. Chem. 1989. V. 93. № 14. P. 5623.
Родникова М.Н. в кн. “Структурная самоорганизация в растворах и на границе раздела фаз” М.: Издательство ЛКИ, 2008. 544 с.
Rodnikova M.N. // J. Mol. Liquids 2007. V. 136. P. 211.
Афанасьев В.Н., Каюмова Д.Б., Чекунова М.Д., Родникова М.Н. // Журн. физ. химии. 2005. Т. 79. № 5. С. 941.
Родникова М.Н., Каюмова Д.Б., Доброхотова Ж.В., и др. // Там же. 2007. Т. 81. № 11. С. 2107.
Чабан И.А., Родникова М.Н., Чайков Л.Л. и др. // Там же. 1997. Т. 71. № 12. С. 2183.
Avedikian L., Perron G., Desnoyer J.E. // J. Solution Chem. 1975. V. 4. P. 331.
Roux G., Perron G., Desnoyers J.E. // J. Phys. Chem. 1978. V. 82. P. 966.
Наберухин Ю.И. Континуальная концепция строения воды и водных растворов неэлектролитов. Докт. дисс. Новосибирск. 1984. С. 234, 251.
Анисимов М.А., Заугольникова Н.С., Оводов Г.И. // Письма в ЖЭТФ 1975. Т. 21. С. 476.
Чабан И.А., Родникова М.Н. // Журн. физ. химии. 2008. Т. 82. № 12. С. 2244.
Родникова М.Н., Ланшина Л.В., Чабан И.А. // Докл. АН СССР 1990. Т. 315. С. 148.
Ланшина Л.В., Родникова М.Н., Чабан И.А. // Журн. физ. химии. 1992. Т. 66. № 1. С. 204.
Кононова Е.Г., Родникова М.Н., Солонина И.А., Сироткин Д.А. // Там же. 2018. Т. 92. № 7. С. 1071.
Малышев В.В., Мильнер Г.А., Соркин Е.Л., Шибакин В.Ф. Автоматический низкотемпературный калориметр // Приборы и техника эксперимента. 1985. № 6. С. 195.
Солонина И.А., Лаптинская Т.В., Родникова М.Н., Широкова Е.В. // Журн. физ. химии. 2021. Т. 95. № 7. https://doi.org/10.31857/S0044453721070244
Егоров Г.И., Макаров Д.М. // Там же. 2008. Т. 82. № 10. С. 1982.
Солонина И.А., Родникова М.Н., Киселев М.Р. и др. // Там же. 2016. Т. 92. № 5. С. 751.
Rodnikova M.N. // Acta Chim. Slov. 2009. V. 56. P. 215.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


