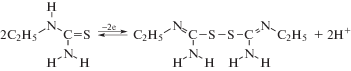Журнал физической химии, 2021, T. 95, № 8, стр. 1175-1179
Влияние температуры на устойчивость комплексных соединений Re(V) с N-этилтиомочевиной
Ф. Дж. Джамолиддинов a, *, С. М. Сафармамадзода a, Дж. А. Давлатшоева a
a Таджикский национальный университет
734025 Душанбе, Республика Таджикистан
* E-mail: Jamoliddinov_F_90@mail.ru
Поступила в редакцию 11.09.2020
После доработки 11.09.2020
Принята к публикации 15.01.2021
Аннотация
Потенциометрическим методом исследована окислительно-восстановительная система N-этилтиомочевина (Etu) – симметричный диэтилформамидиндисульфид. С помощью платинового электрода найдены значения потенциала системы в интервале температур 273–338 К. Для реакции [ReOCl5]2– + iEtu = [ReOCl5-iEtui]– + iCl–; Ki, (i = 0–5) в среде 6 моль/л HCl рассчитана функция образования Бьеррума. Определены значения констант устойчивости оксохлоро-N-этилтиомочевинных комплексов Re(V). Установлена закономерность в изменении ступенчатых констант устойчивости комплексов при повышении температуры и определены термодинамические величины процессов комплексообразования.
Для изучения процессов образования координационных соединений ряда металлов в растворе и определения констант образующихся комплексных форм широко используются окислительно-восстановительные электроды. В данном случае выбранный металл или лиганд в исследуемых условиях должны иметь окисленную и восстановленную формы.
В работе [1] спектрофотометрическим методом при ионной силе 2 моль/л перхлората натрия (Na(H)ClO4) и температуре 293 К определены константы устойчивости монокоординированных комплексов Вi(III) типа (BiL3+) с тиомочевиной (Tu), N-фенилтиомочевиной (Ptu), N-фенил-N'-пропилтиомочевиной (Pptu), N,N'-дифенилтиомочевиной (Вptu), N-алил-N'-пропилтиомочевиной (Аptu), а также константы протонирования этих лигандов в растворах хлорной кислоты. Установлено, что устойчивость комплексов (BiL3+) изменяется в ряду лигандов: Аptu > Tu > Pptu > Ptu > > Вptu, который совпадает с рядом изменения константы протонирования этих лигандов. Значение констант протонирования N,N'-дифенилтиомочевиной (Вptu), N-фенилтиомочевиной (Ptu),N-фенил-N'-пропилтиомочевиной (Pptu) оказались меньше, чем константы протонирования тиомочевиной (Tu), что связано с сильными электроотрицательными свойствами фенильного радикала.
Спектрофотометрическим методом определены константы устойчивости монокомплексов Вi(III), In(III), Pb(II) и Cd(II) с селеномочевиной (seu) и тиомочевиной (tu) при ионной силе 1.0 (0.5 моль/л НСlO4 + NaСlO4) или 2.0 (1 моль/л НСlO4 + NaСlO4) при температурах 276 и 298 К. Для всех металлов константы устойчивости комплексов (β1) с seu выше, чем с tu, они изменяются в ряду: Вi3+ > Cd2+ ≈ In3+ > Pb2+. Установлена корреляция между $\lg {{\beta }_{1}}$(S) и $\lg {{\beta }_{1}}$(Se) [2].
В работах [3–7] было изучено комплексообразование Re(V) с тиомочевиной и ряд его производных в HCl с использованием их окисленно-восстановленной формы. В [3] исследовано комплексообразование Re(V) с тиомочевиной при температуре 298 К. Установлено, что комплексообразование проходит ступенчато и образуются четыре комплексные формы, а в [4] изучено влияние температуры на этот процесс в интервале температур 273–338 К. Показано, что с ростом температуры число координированных лигандов, а также значения констант устойчивости полученных комплексов уменьшаются.
Анализ литературных данных показывает, что устойчивость комплексных соединений Re(V) с этими лигандами зависит от их состава. Другими словами, включение различных радикалов в состав тиомочевины изменяет устойчивость комплексных соединений.
В работах [5, 6] мы исследовали комплексообразование Re(V) с N-этилтиомочевиной в среде 6 моль/л HCl при температурах 298 и 308 К. Выявлено, что значение констант образующихся комплексов при 298 К больше, чем при 308 К. Это связано с отрицательным влиянием температуры на процесс комплексообразования, так как реакция комплексообразования экзотермична.
Цель данной работы – исследование процесса комплексообразования Re(V) с N-этилтиомочевиной в среде 6 моль/л HCl, установление влияния темпратуры на устойчивость комплексных соединений в интервале 273–338 К и определение термодинамических характеристик ионных равновесий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходного реагента использовали Н2[RеОСl5] (методика получения описана в работе [6]) и N-этилтиомочевину марки “х.ч.”. Потенциометрическое титрование проводили с использованием компаратора напряжения Р-3003. Индикаторным электродом служила окислительно-восстановительная система, состоящая из N-этилтиомочевины и ее окисленной формы. В качестве вспомогательного электрода использовали платиновую пластинку, а электрод сравнения – хлорсеребряный. Различную концентрацию окисленной и восстановленной форм N-этилтиомочевины создавали окислением части исходной N-этилтиомочевины в среде 6 моль/л HCl 0.05 н. раствором I2. После установления постоянного значения потенциала систему титровали раствором Н2[RеОСl5]. Равновесные концентрации лиганда при каждой точке титрования и определение функции образования Бьеррума рассчитывали по формулам, приведенным в работах [5–7]. Потенциометрическое титрование при каждой температуре проводили 4 раза. При расчетах применяли среднее значение величин из четырех. Статистическую обработку результатов проводили по методике, рекомендованной в работе [8].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для установления процесса обратимости N-этилтиомочевины в среде 6 моль/л HCl сначала определяли количество электронов, участвующих в процессе окисления. Затем изучали зависимости равновесного потенциала окислительно-восстановительной системы от lg([R–S–S–]/ [RS]2). Потенциометрическим методом с использованием I2 установили, что окисление каждой молекулы N-этилтиомочевины сопровождается потерей одного электрона в соответствии со следующей схемой реакции:
Во второй серии экспериментов в среде 6 моль/л HCl, создавая различные концентрации окисленной и восстановленной форм N-этилтиомочевины, измеряли равновесные потенциалы. Зависимости Е = ƒ(lg([R–S–S–R]/[R–S]2)) во всем интервале температур (273–338 К) имели прямолинейный характер (рис. 1).
Рис. 1.
Зависимости равновесного потенциала системы от логарифма отношения окисленной и восстановленной форм N-этилтиомочевины при различных температурах: 1 – 273, 2 – 288, 3 – 298, 4 – 308, 5 – 318, 6 – 328, 7 – 338 К.
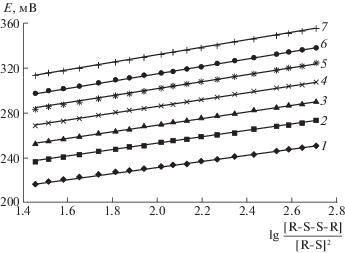
Тангенсы угла наклона этих прямых в зависимости от температуры опыта имели величины, равные от 27.07 до 33.52 мВ и близкие к теоретическим, что еще раз подтверждает достоверность полученных результатов. Равновесие в системе устанавливается быстро, что свидетельствует об истинной обратимости процесса окисления N-этилтиомочевины. В табл. 1 представлены величины стандартных окислительных потенциалов (Е0) и углов наклона экспериментальных зависимостей ($\operatorname{tg} \alpha $), найденные в результате обработки данных регрессионным методом [8] с использованием коэффициента Стьюдента при вероятности Р = 0.95.
Таблица 1.
Значения Е0 (мВ) и tgα для окислительно-восстановительной системы R–S–S–R/RS (RS–N-этилтиомочевина) среде 6 моль/л HCl при различных температурах
| №, п/п | Т, K | Е0, мВ | $\operatorname{tg} \alpha $, мВ |
|---|---|---|---|
| 1 | 273 | 177.3 ± 0.2 | 27.07 ± 0.01 |
| 2 | 288 | 196.1 ± 0.1 | 28.56 ± 0.04 |
| 3 | 298 | 210.5 ± 0.3 | 29.49 ± 0.14 |
| 4 | 308 | 225.2 ± 0.2 | 30.55 ± 0.12 |
| 5 | 318 | 238.7 ± 0.3 | 31.54 ± 0.13 |
| 6 | 328 | 250.6 ± 0.7 | 32.53 ± 0.32 |
| 7 | 338 | 265.1 ± 0.3 | 33.52 ± 0.15 |
Установление факта обратимости процесса окисления N-этилтиомочевины позволило исследовать процессы комплексообразования рения(V) с этим лигандом при различных температурах в среде 6 моль/л HCl. В процессе потенциометрического титрования окислительно-восстановительной системы R-S-S-R/RS, где RS – N-этилтиомочевина, раствором Н2[RеОСl5] наблюдается последовательное изменение цвета раствора от прозрачного к малиновому, затем к сиреневому и светло-зеленому. Это свидетельствует о ступенчатом процессе комплексообразования. При титровании системы, состоящей из N-этилтиомочевины и ее окисленной формы, раствором Н2[RеОСl5] наблюдается возрастание величины равновесного потенциала, что свидетельствует об участии в реакции комплексообразования с рением(V) N-этилтиомочевины, а не ее окисленной формы.
По данным потенциометрического титрования, определив ΔЕ, вычисляли значения равновесной концентрации лиганда, с использованием которой рассчитывали функцию образования. Для определения численных значений констант устойчивости использован графический метод Бьеррума (рис. 2). Из рис. 2 следует, что при приведенных температурах в среде 6 моль/л НСl рений(V) с N-этилтиомочевиной образует одинаковое количество комплексных форм.
Рис. 2.
Кривые функции образования хлоро-N-этилтиомочевинных комплексов Re(V) в среде 6 моль/л НСl при различных температурах: 1 – 273, 2 – 288, 3 – 298, 4 – 308, 5 – 318, 6 – 328, 7 – 338 К.

Из полученных кривых при 0.5, 1.5, 2.5, 3.5 и 4.5 выбраны значения констант образующихся комплексов, из которых видно, что при всех температурах образуются пять комплексных частиц. В табл. 2 приведены значения констант устойчивости комплексных соединений Re(V) с N-этилтиомочевиной.
Таблица 2.
Значения констант устойчивости комплексных соединений Re(V) с N-этилтиомочевиной в среде 6 моль/л HCl при различных температурах
| №, п/п | Т, K | pK1 | pK2 | pK3 | pK4 | pK5 |
|---|---|---|---|---|---|---|
| 1 | 273 | 4.29 ± 0.04 | 3.39 ± 0.03 | 2.57 ± 0.04 | 2.35 ± 0.03 | 2.26 ± 0.03 |
| 2 | 288 | 4.16 ± 0.05 | 3.23 ± 0.03 | 2.50 ± 0.04 | 2.31 ± 0.03 | 2.22 ± 0.03 |
| 3 | 298 | 4.00 ± 0.06 | 3.09 ± 0.04 | 2.43 ± 0.02 | 2.26 ± 0.02 | 2.19 ± 0.02 |
| 4 | 308 | 3.77 ± 0.08 | 2.84 ± 0.08 | 2.36 ± 0.03 | 2.12 ± 0.03 | 2.16 ± 0.01 |
| 5 | 318 | 3.59 ± 0.04 | 2.70 ± 0.05 | 2.29 ± 0.02 | 2.19 ± 0.03 | 2.14 ± 0.02 |
| 6 | 328 | 3.46 ± 0.03 | 2.54 ± 0.06 | 2.24 ± 0.03 | 2.16 ± 0.03 | 2.11 ± 0.01 |
| 7 | 338 | 3.26 ± 0.05 | 2.43 ± 0.05 | 2.20 ± 0.03 | 2.12 ± 0.03 | 2.09 ± 0.02 |
Из табл. 2 видно, что с ростом температуры значение констант устойчивости комплексов Re(V) с N-этилтиомочевиной уменьшаются. Такая закономерность соответствует теории влияния температуры на устойчивость координационных соединений, а также данным [4, 7].
Используя значения констант образующихся комплексов, можно рассчитать термодинамические характеристики реакций комплексообразования. На рис. 3 представлены зависимости рКi = = f(1/T), которые носят прямолинейный характер. По тангенсу угла наклона прямых определяли величину ΔН, а величину изменения энтропии по отрезку, отсекаемому на оси ординат. Энергию Гиббса рассчитывали по уравнению:
Рассчитанные значения термодинамических характеристик процесса комплексообразования Re(V) с N-этилтиомочевиной представлены в табл. 3.Рис. 3.
Зависимости значения констант образования комплексов (рКi) от обратной температуры; 1 – рК1, 2 – рК2, 3 – рК3, 4 – рК4, 5 – рК5.
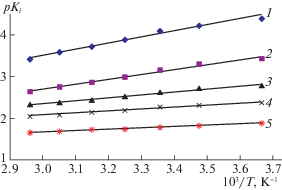
Таблица 3.
Значения термодинамических функций процессов комплексообразования Re(V) с N-этилтиомочевиной в среде 6 моль/л НСl
| № п/п | Состав соединения | –ΔН, кДж/моль | –ΔG, кДж/моль | ΔS, Дж/(моль К) |
|---|---|---|---|---|
| 1 | [ReOСl4Etu]– | 27.83 | 22.94 | –16.42 |
| 2 | [ReOСl3Etu2] | 22.18 | 17.73 | –14.92 |
| 3 | [ReOСl2Etu3]+ | 13.08 | 14.76 | 5.65 |
| 4 | [ReOСlEtu4]2+ | 8.72 | 12.82 | 13.74 |
| 5 | [ReOEtu5]3+ | 6.15 | 10.23 | 13.70 |
Из табл. 3 видно, что значения ΔН и ΔG всех пяти комплексных частиц отрицательны. Отрицательный знак ΔН указывает на то, что реакция Re(V) с N-этилтиомочевиной экзотермична. Увеличение значения ΔН показывает на постепенное уменьшение внутренней энергии системы. При координировании первой молекулы лиганда выделяется наибольшее количество энергии, которое последовательно уменьшается.
Полученные значения ΔG свидетельствуют о том, что реакция комплексообразования рения(V) с исследованным лигандом в изученном интервале температур является самопроизвольным процессом. Увеличение значения ΔG может означать, что легко соединяется первый лиганд, за которым следуют второй, затем последовательно третий, четвертый и пятый. Вхождение каждой последующей молекулы лиганда во внутреннюю координационную сферу становится все труднее, так как появляются новые пространственные затруднения, а сама система стремится к восстановлению равновесия. Кроме того, с увеличением числа молекул лиганда во внутренней сфере комплекса, как видно из табл. 3, увеличиваются значения ΔН и ΔG.
Величина энтропии ΔS постепенно возрастает от отрицательного до положительного значения (табл. 3). Отрицательные значения ΔS связаны с уменьшением беспорядочности в системе из-за координации молекулы N-этилтиомочевиной к рению(V). Положительные значения энтропии связаны с возрастанием беспорядочности в системе из-за высвобождения более лабильного хлоридного иона, находящегося в оксохлороренильном комплексе. Энергетически это благоприятствует процессу комплексообразования.
На основании значений ступенчатых констант образования координационных соединений построены кривые распределения всех комплексных форм, образующихся в системе (рис. 4). Найденные из кривых распределения величины максимумов степеней накопления (мольных долей) комплексных форм приведены в табл. 4.
Рис. 4.
Кривые распределения хлоро-N-этилтиомочевинных комплексов рения(V) в среде 6 моль/л НСl при 298 К; 1 – [ReOСl5]2−, 2 – [ReOLСl4]ˉ, 3 – [ReOL2Сl3], 4 – [ReOL3Сl2]+, 5 – [ReOL4Сl]2+, 6 – [ReOL5]3+.

Таблица 4.
Величины максимумов степеней накопления (мол. доли) комплексных форм при различных температурах
| № п/п | Состав комплексов | Значения –lg[L] при $\alpha _{i}^{{{\text{max}}}}$ | ||||||
|---|---|---|---|---|---|---|---|---|
| 273 К | 288 К | 298 К | 308 К | 318 К | 328 К | 338 К | ||
| 1 | [ReOСl4Etu]– | 3.9 | 3.8 | 3.7 | 3.5 | 3.3 | 3.2 | 3.1 |
| 2 | [ReOСl3Etu2] | 3.1 | 3.0 | 2.9 | 2.8 | 2.7 | 2.6 | 2.5 |
| 3 | [ReOСl2Etu3]+ | 2.6 | 2.5 | 2.4 | 2.4 | 2.3 | 2.2 | 2.2 |
| 4 | [ReOСlEtu4]2+ | 2.1 | 2.0 | 1.9 | 1.9 | 1.8 | 1.8 | 1.8 |
| 5 | [ReOEtu5]3+ | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
Как видно, из данных табл. 4, с увеличением температуры мольная доля образующихся координационных соединений незначительно уменьшается. С увеличением температуры (средней энергии каждой молекулы) увеличивается вероятность их столкновения, и появляются пространственные затруднения.
Таким образом, на основании проведенных исследований установлено, что процесс образования комплексов протекает ступенчато и с выделением теплоты. Выявлено, что величина энтальпии независимо от количеств координированных молекул отрицательна. С увеличением числа координированных органических лигандов во внутренней координационной сфере величина ΔН становится более положительной. Такая же закономерность наблюдается для термодинамических величин ΔG и ΔS.
Список литературы
Головнев Н.Н., Новикова Г.В., Лешок А.А. // Журн. неорган. химии. 2009. Т. 54. № 2. С. 374.
Головнев Н.Н., Лешок А.А., Новикова Г.В., Петров А.И. // Там же. 2010. Т. 55. № 1. С. 133.
Котегов К.В., Зегжда Т.В., Фадеева Н.В., Кукушкин Ю.Н. // Там же. 1974. Т. 19. № 3. С. 737.
Аминджанов А.А., Махмуд Мухамад Машали, Котегов К.В. // Межчастичные взаимодействия в растворах. Душанбе, 1991. С. 109–115.
Джамолиддинов Ф.Дж. //Вестн. ТНУ. Серия естественных наук. Душанбе: Сино, 2016. № 1/4 (216), С. 88.
Аминджанов А.А., Джамолиддинов Ф.Дж., Сафармамадов С.М., Давлатшоева Дж.А. // Журн. неорган. химии. 2017. Т. 62. № 11. С. 1544.
Аминджанов А.А., Сафармамадов С.М., Гозиев Э.Д. // Химия и хим. технология. 2007. Т. 50. № 7. С. 20.
Доерфель К. Статистика в аналитической химии. М.: Мир, 1994. 268 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии