Журнал физической химии, 2021, T. 95, № 9, стр. 1339-1344
Активность кислорода на цеолите типа HZSM-5 в реакциях окисления бензола и его производных
Л. М. Кустов a, b, *, А. Л. Тарасов a, А. Л. Кустов a, b
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, Россия
* E-mail: lmkustov@mail.ru
Поступила в редакцию 30.10.2020
После доработки 30.10.2020
Принята к публикации 02.11.2020
Аннотация
Методом ЭПР-спектроскопии изучена реакция окисления бензола, фторбензола, хлорбензола и фенола в присутствии О2 и N2O на цеолите типа HZSM-5 с отношением Si/Al = 24. Показано, что при термическом разложении закиси азота на цеолите образуется молекулярный и хемосорбированный атомарный кислород. Установлено, что каталитические реакции окисления бензола, фторбензола, хлорбензола и фенола под действием О2 и N2O протекают на льюисовских кислотных центрах и приводят к образованию феноксильных катион-радикалов с характерными g-факторами и параметрами сверхтонкой структуры ЭПР-спектра.
Применение метода ЭПР-спектроскопии при изучении адсорбции углеводородов на активных центрах катализаторов позволяет сделать некоторые выводы о механизме превращений углеводородов. Известно, что образование катион-радикалов при адсорбции ароматических углеводородов на Н-формах цеолитов связано с присутствием в них сильных льюисовских кислотных центров (ЛКЦ) [1–3]. Ранее было показано, что в цеолитах существуют два типа апротонных центров, участвующих в образовании катион-радикалов [1]. Центрами первого типа могут быть примесные ионы Fe3+, способные окислять бензол до катион-радикалов ${{{\text{С}}}_{{\text{6}}}}{\text{Н}}_{6}^{{ + \bullet }}$ в присутствии окислителей. Центры второго типа – льюисовские кислотные центры, адсорбция бензола на которых приводит к образованию катион-радикалов при комнатной температуре в присутствии молекулярного кислорода. Обнаруженная корреляция между концентрациями ЛКЦ и радикальных частиц, образующихся в реакции окисления бензола на цеолите в присутствии кислорода, подтверждает этот вывод. Адсорбция бензола на ЛКЦ не приводит к формированию катион-радикалов в отсутствие кислорода вследствие высокого потенциала ионизации бензола и слабых окислительных свойств ЛКЦ. В то же время высокая прочность этой формы адсорбции позволяет предположить, что при адсорбции С6Н6 на ЛКЦ образуется комплекс с переносом заряда либо σ-комплекс с участием решеточного иона, обладающего свойствами ЛКЦ. Эти комплексы характеризуются значительным батохромным сдвигом в УФ-спектрах [1, 4, 5]. Последующая адсорбция О2 приводит к окислению комплекса с образованием продуктов, которые характеризуются более низким потенциалом ионизации.
Настоящая работа продолжает исследования, связанные с изучением окислительно-восстановительных свойств цеолитов [1–3, 6, 7]. Методом ЭПР-спектроскопии исследовали окисление бензола и его производных в присутствии О2 и N2O. Известно [5–8], что закись азота может быть использована как достаточно сильный окислитель, позволяющий проводить реакцию окисления ароматических углеводородов в мягких условиях. Реакцию термического разложения N2O используют также в качестве модельной для изучения окислительных свойств цеолитов и оксидов [6]. В работе [6] методом ИК-спектроскопии диффузного рассеяния, а также на основе неэмпирических квантово-химических расчетов комплексов N2O с ЛКЦ было показано, что при температуре ниже 150°С ЛКЦ ответственны за прочную адсорбцию N2O. При 200–350°С эти комплексы разлагаются с образованием хемосорбированного атомарного кислорода с концентрацией ∼1019 г–1, что соответствует ∼20% от числа ЛКЦ. Реакция прямого окисления бензола в фенол в присутствии N2O исследовалась ранее в работах [7, 8]. Наибольшей эффективностью в данной реакции обладают цеолиты типа HZSM-5, на которых окисление бензола протекает с селективностью, близкой к 100%. Окисление бензола в фенол в присутствии молекулярного кислорода на Cu-цеолитном катализаторе исследовали также в работе [9]. Реакцию проводили в жидкой фазе при комнатной температуре, используя Cu-содержащий цеолитный катализатор в присутствии аскорбиновой кислоты, выполняющей роль восстанавливающего агента по отношению к катионам меди.
В настоящей работе мы использовали цеолит типа HZSM-5, который проявляет высокую активность в окислении бензола в присутствии N2O [7]. Была предпринята попытка изучить методом ЭПР-спектроскопии механизм протекания каталитической реакции окисления бензола и его производных на цеолите с участием О2 и N2O и установить роль ЛКЦ в этой реакции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали цеолит Н-ЦВМ (отечественный аналог цеолита HZSM-5, SiO2/Al2O3 = 48), полученный обработкой Na-формы цеолиты 1 N водным раствором HCl в течение 1 ч. Предварительная активация образцов заключалась в термовакуумной обработке при 850°С в течение 4 ч с последующей прокалкой в присутствии О2 при 850°С в течение 4 ч. Бензол, фторбензол, хлорбензол, фенол очищали многократным перемораживанием в вакууме. Адсорбцию этих соединений проводили при комнатной температуре в вакуумной установке. Избыток физически сорбированных соединений удаляли вакуумированием при 20°С в течение 1 ч; О2 и N2O адсорбировали при давлении 5–20 Торр. Все обработки и спектральные измерения проводили в кварцевых ампулах, предназначенных для измерения ЭПР-спектров. ЭПР-спектры регистрировали на спектрометре ERS-220 (λ = 3.2 см) при 77 и 295 К.
Для определения абсолютной концентрации радикалов использовали точечный эталонный образец CuSO4 с известной концентрацией спинов. Были проведены две серии экспериментов. В первой серии органические соединения адсорбировали на дегидроксилированный цеолит, затем в образец вводили кислород либо N2O при давлении 5–20 Торр, и образец далее нагревали при различных температурах. Во второй серии экспериментов проводили адсорбцию органических соединений на дегидроксилированном образце, который предварительно обрабатывали при различных температурах кислородом или закисью азота.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 представлены ЭПР-спектры дегидроксилированного цеолита до и после введения небольших количеств кислорода (0.1–0.5 Торр) при комнатной температуре. В спектре, измеренном после адсорбции О2, наблюдаются линии с g = 2.1096, 2.0964, 2.0830 и 2.0656. При длительном вакуумировании при 300 К в течение 2 ч, а также после нагревания и одновременного вакуумирования (500°С, 30 мин) сигналы полностью исчезают. Таким образом, спектр, представленный на рис. 1б, можно отнести к адсорбированному молекулярному кислороду. Аналогичный спектр был получен в работе [10], где исследовалась адсорбция О2 на цеолите Na-ZSM-5. Измеренные в [10] значения g = 2.119, 2.107, 2.090, 1.976, 1.888 отличаются от значений g-факторов, полученных в настоящей работе. Видимо, это связано с тем, что резонансные переходы молекулярного кислорода расщепляются за счет квадратичного эффекта Зеемана, и компоненты спектра оказываются разнесенными по полю [11]. После адсорбции бензола при давлении насыщенных паров на образец, содержащий адсорбированный О2, интенсивность сигналов с g = 2.1096, 2.0964, 2.0830, 2.0656 медленно уменьшалась, и появлялся дополнительный широкий сигнал с g = 2.003, связанный с образованием катион-радикалов [1]. Нагревание образца с адсорбированным кислородом и бензолом до 400°С в течение 1–2 мин с одновременным вакуумированием приводит к тому, что в спектре, измеренном при 77 К, наблюдается малоинтенсивный анизотропный сигнал с g = 2.0006 (рис. 2а–2е). На рис. 2а–2е показан рост интенсивности сигнала радикалов, образующихся при нагревании цеолита с адсорбированным молекулярным кислородом. Из рисунка видно, что с увеличением температуры обработки дегидроксилированного цеолита, на который был предварительно адсорбирован молекулярный кислород, концентрация радикальных форм кислорода увеличивается, что подтверждает способность цеолита активировать кислород.
Рис. 2.
ЭПР-спектры дегидроксилированного цеолита Н-ЦВМ после адсорбции: О2 при 275 (a), 373 (б), 463 (в), 493 (г), 623 (д) и 773 К (е); после адсорбции N2O при 473 К (ж).

Выдерживание образца при комнатной температуре в течение 10 мин приводит к медленному уменьшению интенсивности сигнала. В отсутствие кислорода и бензола при нагревании образца до 500°С сигнал с g = 2.0006 не проявляется, что может свидетельствовать о том, что этот сигнал не связан с парамагнитными примесями в самом цеолите.
Мы провели аналогичные эксперименты с закисью азота. N2O вводился в ампулу с предварительно дегидроксилированным цеолитом при давлении 5–10 Торр в течение 10 мин. Затем образец нагревали до 150°С и вакуумировали при этой температуре в течение 15 мин. В спектре ЭПР, измеренном при 77 К, проявляется анизотропный сигнал с g|| = 2.0075 и g⊥ = 2.0006 (рис. 2ж). Аналогичный спектр был получен в работе [10] при разложении N2O на SiO2–Al2O3 при 573 К в течение 3 ч: наблюдались сигналы с g = 2.005 и g = 2.038.
Механизм образования хемосорбированного атомарного кислорода на ЛКЦ при термическом разложении N2O был предложен нами ранее [2, 3]:
При дальнейшем нагревании образца до 200°С с одновременным вакуумированием наблюдается рост интенсивности сигнала от Z–O. Максимальная интенсивность сигнала отмечена при температурах обработки образца с адсорбированной закисью азота 200–250°С. Было обнаружено, что нагревание образца с адсорбированным N2O без вакуумирования приводит к заметному падению интенсивности сигнала с g⊥ = 2.0006 и появлению линий адсорбированного молекулярного кислорода с g = 2.1096, 2.0964, 2.0830, 2.0656. Образование молекулярного кислорода связано с реакцией рекомбинации Z–O или взаимодействием Z–O с N2O.
Концентрацию хемосорбированного кислорода, образующегося при термическом разложении N2O, оценивали из сравнения с эталонным образцом, концентрация центров Z–O составила 2 × × 1015 г–1. В работе [10] также наблюдали активацию О2 и образование О– на SiO2–Al2O3, причем была найдена прямая корреляция между концентрациями О2 и О–. При введении небольших количеств углеводородов (бензола и др.) сигнал от Z–O полностью исчезал, что связано с высокой реакционной способностью хемосорбированного кислорода.
При нагревании образца, обработанного кислородом, мы также наблюдали аналогичный сигнал с g = 2.0006, связанный с активацией адсорбированного О2 и образованием радикальных форм атомарного кислорода. Концентрация этих частиц составляла 4 × 1013 г–1, что значительно меньше концентрации центров Z–O, образующихся при термическом разложении N2O.
В работах [12, 13] активность цеолитов в образовании активных форм кислорода объясняется действием сильных бренстедовских кислотных центров. Авторы работы [8] предположили, что окислительные свойства цеолитов связаны с наличием так называемых α-центров, состоящих из ионов железа (примесных или специально введенных в состав цеолита) и ведущих разложение N2O с образованием специфических форм адсорбированного кислорода.
После адсорбции бензола, фторбензола, хлорбензола или фенола на дегидроксилированном цеолите Н-ЦВМ никаких ЭПР-сигналов не наблюдается. Был обнаружен лишь малоинтенсивный сигнал с g = 4.31, который можно отнести к примесным ионам Fe3+ в координации, близкой к тетраэдрической [14]. Реакция окисления бензола в присутствии О2 при комнатной температуре сопровождается появлением синглетного сигнала с g = 2.0035 и ΔН = 18 Гс (рис. 3). Интенсивность сигнала медленно увеличивается в течение 10–15 ч, достигая концентрации 8 × 1018 спин/г и далее остается неизменной. Полученный спектр полностью совпадает с зарегистрированным ранее спектром катион-радикала бензола, образующегося на цеолите Н-ЦВМ [1]. Сигнал от катион-радикалов ${{{\text{С}}}_{{\text{6}}}}{\text{Н}}_{6}^{{ + \bullet }}$ не наблюдается в спектре, что связано, по-видимому, с низкой концентрацией примесных ионов Fe3+, на которых эти ион-радикалы образуются в отсутствие кислорода.
При замене О2 на N2O наблюдается аналогичный синглетный широкий сигнал с g = 2.0035 и ΔН = 18 Гс с концентрацией 4 × 1017 спин/г, которая значительно ниже, чем в случае окисления бензола молекулярным кислородом (рис. 3). Отметим, что сигнал возникает сразу и практически не меняется в течение 2–3 ч. Нагревание образца до 80°С значительно уменьшает интенсивность этого сигнала. Можно предположить, что такой характер изменения интенсивности сигнала обусловлен как взаимодействием радикальных продуктов с N2O с образованием диамагнитных продуктов, так и образованием стабильных нерадикальных продуктов окисления бензола. Вероятно, полученные катион-радикалы близки по своему строению к феноксильным катион-радикалам ${\text{R}}{{{\text{O}}}^{{ + \bullet }}}$.
Реакция окисления фторбензола при 295 К сопровождается появлением интенсивного сигнала с g = 1.9803 с сильным проявлением сверхтонкого взаимодействия c а1 = 33.4 Гс ($g_{1}^{'}$ = 2.0095, $g_{2}^{{''}}$ = = 1.9889) и а2 = 7.4 Гс ($g_{1}^{'}$ = 1.9933, $g_{2}^{{''}}$ = 1.9889) (рис. 4). Концентрация радикалов составила 3 × × 1018 спин/г. Две различные пары линий СТС с расщеплением 33.4 и 7.4 Гс могут быть обусловлены суперпозицией сигналов от двух радикальных частиц, имеющих разное геометрическое расположение атома фтора по отношению к неспаренному электрону. Остается неясной делокализация неспаренного электрона на атомах водорода, однако, можно полагать, что наблюдаемая СТС в спектре ЭПР обусловлена сильным электроотрицательным влиянием атома фтора. Замена молекулярного кислорода на N2O приводит к тому, что наблюдается аналогичный, но малоинтенсивный сигнал (как и в случае с бензолом) с характерной СТС (рис. 4б). Концентрация радикалов в этом случае составила 2 × 1017 спин/г.
Рис. 4.
ЭПР-спектр дегидроксилированного цеолита Н-ЦВМ после адсорбции С6Н5F и О2 (а) и N2O (б) при 295 К.

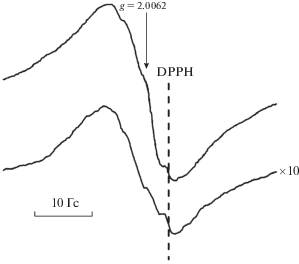
При окислении хлорбензола кислородом наблюдается интенсивный синглетный сигнал с g = = 2.0062, ΔН = 10 Гс с плохо разрешенной СТС (рис. 5а). Концентрация спинов составила 4 × × 1018 1/г. Полученный спектр представляет собой, по-видимому, суперпозицию сигналов радикальных частиц, имеющих в своем строении изотопы 35Cl (I = 3/2) и 37Cl (I = 3/2). Кроме того, различное положение атома хлора по отношению к неспаренному электрону может усложнять спектральную картину. Интенсивность сигнала остается неизменной в течение нескольких суток при комнатной температуре. Замена О2 на N2O приводит к появлению сигнала с концентрацией спинов 3 × 1017 1/г с идентичной СТС, как и в случае с О2 (рис. 5б). При увеличении температуры до 100°С наблюдалось значительное уменьшение интенсивности сигнала.
Рис. 5.
ЭПР-спектр дегидроксилированного цеолита Н-ЦВМ после адсорбции С6Н5Cl и О2 (а) и N2O (б) при 295 К.
На рис. 6 показан спектр ЭПР после адсорбции фенола и кислорода на дегидроксилированном цеолите Н-ЦВМ. Широкий анизотропный сигнал с g = 2.0035, ΔН = 19 Гс имеет малую интенсивность. Концентрация спинов составила 6 × 1016 1/г. Низкая концентрация спинов обусловлена, по-видимому, молекулярно-ситовым эффектом цеолита и, как следствие, стерическими затруднениями, возникающими при диффузии фенола в каналы цеолита. Кроме того, вследствие значительной полярности фенол способен взаимодействовать и с центрами иной природы, имеющимися в цеолите (катионы, ОН-группы).
Идентификация типа образующегося на поверхности цеолита катион-радикала основана обычно на сопоставлении числа компонент СТС и их относительной интенсивности. Как видно из спектров ЭПР, для феноксильного катион-радикала, возникающего при адсорбции фторбензола, наиболее сильно проявляется СТС вследствие электроотрицательного влияния атома фтора. Уменьшение относительной интенсивности СТС для феноксильных радикалов в ряду фторбензол > хлорбензол > бензол, фенол, вероятно, отражает индуктивное влияние заместителей в перераспределении спиновой плотности между феноксильным атомом кислорода и ароматическим кольцом. Снижение подвижности феноксильного катион-радикала в каналах цеолита может приводить к частичному или полному подавлению СТС в спектре ЭПР. Связь радикала с цеолитом, по-видимому, осуществляется за счет частичного затягивания неспаренного электрона атома кислорода феноксильного радикала на льюисовский кислотный центр. Методом ИК- и ЭПР-спектроскопии в работе [1] было показано, что с увеличением концентрации льюисовских кислотных центров в цеолите типа HZSM-5 растет концентрация катион-радикалов, образующихся в реакции окисления бензола в присутствии кислорода. Это позволяет нам предположить, что образование феноксильного катион-радикала связано с действием льюисовского кислотного центра, который способствует активации молекулярного кислорода или закиси азота с последующим взаимодействием радикальных форм кислорода с бензольным кольцом.
Существующие в литературе данные показывают, что окислительные реакции на цеолитах типа HZSM-5 протекают с участием активного кислорода [1–4, 6–8]. Нами было показано, что при окислении бензола и его производных под действием N2O образуются радикалы, концентрация которых значительно ниже, чем концентрация радикалов, образующихся в реакциях с участием молекулярного кислорода. Механизм окисления ароматических углеводородов можно представить следующим образом. Активные радикальные формы кислорода, образующиеся при взаимодействии кислорода или N2O с ЛКЦ при комнатной температуре, взаимодействуют с углеводородами с образованием катион-радикалов. При окислении углеводородов закисью азота часть радикалов может взаимодействовать с Z–O или N2O с образованием диамагнитных соединений. В случае окисления углеводородов под действием О2 наиболее медленной стадией процесса является реакция образования активных радикальных форм кислорода. При этом, как показали проведенные исследования, вторичные реакции увода радикалов не происходят из-за низкой концентрации хемосорбированного кислорода. Медленный рост интенсивности сигнала ЭПР от продуктов окисления углеводородов в присутствии О2 подтверждает этот вывод.
Авторы благодарны Российскому научному фонду за финансовую поддержку (грант № 17-13-01526).
Список литературы
Жолобенко В.Л., Кустов Л.М., Казанский В.Б. // Кинетика и катализ. 1989. Т. 30 (4). С. 901.
Жолобенко В.Л., Кустов Л.М., Казанский В.Б. // Тр. 4-й Всесоюзн. конф. по цеолитам. М., 1989. С. 33.
Zholobenko V.L., Kustov L.M., Kazansky V.B. // Proc. 9th Int. Conf. on Zeolites. Butterworth. Montreal, 1992. P. 299.
Das M., Basu S. // Spectrochim. Acta 1961. V. 71. P. 897.
Perkampus H.-H., Kranz Th. // Z. Phys. Chem. 1962. V. 34. P. 213.
Жолобенко В.Л., Сенченя И.Н., Кустов Л.М., Казанский В.Б. // Кинетика и катализ. 1991. Т. 32 (1). С. 151.
Zholobenko V.L. // Mendeleev Commun. 1993. V. 1. P. 28.
Харитонов А.С., Александрова Т.Н., Панов Г.И. и др. // Кинетика и катализ. 1995. Т. 35 (2). С. 296.
Ohtani T., Nishigama S., Tsuruya S., Masai M. // J. Catal. 1995. V. 155. P. 153.
Tagawa T., Hatton T., Murakami Y. // Ibid. 1982. V. 75. P. 66.
Гершензон Ю.М., Розенштейн В.Б., Налбандян А.Б. // Магнитный резонанс в газах. Ереван: Изд-во АН Арм. ССР, 1987. 371 с.
Suzuki E., Nakashito K., Ono Y. // Chem. Soc. Japan. Chem. Lett. 1988. P. 9537.
Tirel P.J., Gubelman M.N., Popa J.M. // Proc. Int. Conf. on Zeolites, Montreal, 1992. P. RP61.
Wichterlova B. // Zeolites. 1983. V. 3. P. 181.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии





