Журнал физической химии, 2021, T. 95, № 9, стр. 1332-1338
Термодинамические константы основности высокозамещенных порфиразинов марганца и их связь со структурой молекул
Е. Н. Овченкова a, *, Т. Н. Ломова a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
Иваново, Россия
* E-mail: enk@isc-ras.ru
Поступила в редакцию 17.11.2020
После доработки 18.12.2020
Принята к публикации 21.12.2020
Аннотация
Методом спектрофотометрического титрования определены термодинамические константы равновесий протонирования (aцетато)(октакис(4-трет-бутилфенил)- и (ацетато)(октакис(3-трифторметилфенил)тетраазапорфинато)марганца(III) в среде трифторуксусная кислота – дихлорметан с использованием функций кислотности Гаммета H0 для данного смешанного растворителя. Установлен и объяснен с привлечением ранее опубликованных данных для тетраазапорфириновых аналогов эффект усиления основности монопротонированных форм по сравнению с нейтральными. Определена роль функционального замещения и электронного строения координационного центра в формировании кислотно-основного поведения комплексов порфиразинов. Полученные данные актуальны для развития теории реакционной способности макрогетероциклических соединений и практики формирования надмолекулярных 2D- и 3D-структур на основе порфиразинов.
Тетраазапорфирины (порфиразины, H2TAP) и их металлические производные (MTAP) привлекают внимание исследователей как соединения, свойствами которых можно управлять, варьируя катион металла и систему функционального замещения на периферии макроцикла [1–4]. Имеются в виду электронно-оптические и электрохимические свойства порфиразинов, обеспечивающие полезность этих макроциклических соединений как высокоэффективных и селективных катализаторов [1, 5, 6], фотосенсибилизаторов для фотодинамической терапии рака [7, 8], химических сенсоров [9, 10] и магнитных материалов [11]. Для расширения практики использования порфиразинов в свободном и координационно-связанном состоянии необходимы данные о количественных параметрах свойств новых замещенных структур с высокими растворимостью, реакционной активностью по аксиальной оси, диапазоном оптического поглощения, спиновой мультиплетностью.
К порфиразиновым комплексам марганца проявляется повышенный интерес, уже начиная с момента синтеза первого представителя этого класса [12]. Устойчивые комплексы порфиразинов с марганцем могут быть получены, по меньшей мере, для Mn в двух степенях окисления и нескольких спиновых состояний [13]. Благодаря множественным окислительно-восстановительным переходам и большой координационной емкости марганца, эти производные способны образовывать термодинамически стабильные смешанно-лигандные соединения, содержащие по аксиальной оси анионы и нейтральные молекулы [14–17]. Порфиразины, имея в своей структуре центры основности, образуют протонированные формы в среде кислот [2, 18]. Сведения о кислотно-основных свойствах порфиразинов способствуют развитию их практического применения и прогрессу в изучении теории реакционной способности макрогетероциклических соединений.
С целью получения достоверных термодинамических констант основности новых порфиразинов и понимания их зависимости от природы функционального замещения в макрогетероцикле мы синтезировали ацетаты октакис(4-трет-бутилфенил)- и октакис(3-трифторметилфенил)тетраазапорфина марганца(III), (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 соответственно (рис. 1), установили их химическое строение и исследовали поведение в смесях трифторуксусная кислота – дихлорметан переменного состава. Для нейтральных и протонированных форм определили параметры оптических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез
(AcO)MnTAP(4-tBuPh)8 синтезирован по реакции бис(4-трет-бутилфенил)фумаронитрила с ацетатом марганца(II) в среде 2-диметиламиноэтанола при 150°C, (AcO)MnTAP(3-CF3Ph)8 – по реакции H2TAP(3-CF3Ph)8 с Mn(AcO)2 ⋅ 4H2O в кипящем ДМФА при комнатной температуре. Полученные соединения выделены и очищены хроматографически [19].
(AcO)MnTAP(4-tBuPh)8. ЭСП в CH2Cl2 (λmax, нм ($\lg \varepsilon $)): 13 (4.42), 493 (4.38), 674 (4.58); ИК-спектр в KBr (ν, см–1, интенсивность с – сильная, ср – средняя и сл – слабая полоса): 2962 с, 2905 ср, 2868 ср, 1717 сл, 1609 ср, 1477 ср, 1463 ср, 1384 ср, 1364 ср, 1299 сл, 1269 ср, 1197 сл, 1147 сл, 1109 ср, 997 с, 891 с, 850 сл, 839 ср, 811 с, 751 с, 635 сл, 599 сл, 585 сл, 563 ср. Найдено, %: C 78.82, H 7.47, N 7.31. Вычислено для C98H107N8O2Mn, %: C 79.32, H 7.27, N 7.55. Масс-спектр (MALDI-TOF) (m/e): 1423.78 [M-AcO]+ (вычислено для C96H104N8Mn 1423.0).
(AcO)MnTAP(3-CF3Ph)8. ЭСП в CH2Cl2 (λmax, нм (lg ε)): 406 (4.57), 461 (4.32), 654 (4.71); ИК-спектр в KBr (ν, см–1): 1719 сл, 1620 сл, 1481 сл, 1420 сл, 1384 сл, 1330 сл, 1312 с, 1279 сл, 1169 с, 1128 с, 1098 ср, 1076 с, 1016 ср, 920 ср, 810 ср, 762 ср, 722 ср, 699 с. Найдено, %: C 54.33, H 2.40, N 6.95. Вычислено для C74H35N8F24O2Mn, %: C 56.29, H 2.23, N 7.10. Масс-спектр (MALDI-TOF) (m/e): 1519.95 [M-AcO]+ (вычислено для C72H32N8F24Mn 1519.0).
Оборудование
Использованы спектрофотометр Agilent 8454, спектрометр VERTEX 80v, спектрометр Bruker Autoflex (MALDI-TOF) для получения ЭСП, ИК‑ и масс-спектров соответственно и элементный анализатор Euro EA 3000.
Термодинамика
Кислотно-основные свойства (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 изучены при 298 K методом время-зависимого спектрофотометрического титрования [20] трифторуксусной кислотой растворов с постоянной концентрацией соединений (2 × 10-5 моль/л) в CH2Cl2. Использованы трифторуксусная кислота (УФ, фирма Panreac) и дихлорметан, очищенный перегонкой над карбонатом калия (т. кип. 313 K).
Численные значения констант протонирования и число присоединяемых протонов определены оптимизацией линейных зависимостей в координатах уравнения Гаммета для времени установления равновесий 0 и τ:
(1)
${\text{p}}K = n{{H}_{0}} + \lg (({{A}_{{\text{p}}}}--{{A}_{0}}){\text{/}}({{A}_{\infty }}--{{A}_{{\text{p}}}})).$Для оптимизации констант использован метод наименьших квадратов (МНК) в программе Microsoft Excel. Относительная ошибка в определении K не превышала 20%. Неизменностью полученных термодинамических констант равновесий в зависимости от времени доказано мгновенное установление равновесий и отсутствие дальнейших превращений протонированных форм без проведения дополнительных экспериментов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Определение химического строения синтезированных порфиразинов
Твердые образцы комплексов представляют собой кристаллические порошки зеленого цвета, растворимые в органических растворителях (CH2Cl2, CHCl3, толуол). Химическое строение (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8, представленное формулами на рис. 1, соответствует данным спектральных исследований (Экспериментальная часть). Масс-спектры обоих соединений содержат только сигнал молекулярного иона с ионизированным аксиальным ацетат-ионом. Явление отщепления аксиальных фрагментов в условиях MALDI-TOF-эксперимента хорошо описано в химии тетрапиррольных макрогетероциклов [22]. Наличие ацетат-иона в структуре синтезированных соединений доказывается методом ИК-спектроскопии. Характерные колебания ацетатной группы, νas(O–C–O) и νs(O–C–O), наблюдаются в области 1609–1620 и 1384 см–1 соответственно. ЭСП (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 в малополярных растворителях содержат в видимой и УФ-областях интенсивные полосы π → π*-переходов хромофора макроциклического лиганда, типичные для порфиразинов марганца(III) [17, 23, 24]. Положение длинноволновой полосы поглощения значительно изменяется при введении заместителей на периферию макроцикла. Максимум этой полосы наблюдается при 674 и 654 нм для трет-бутильных и трифторметильных производных соответственно. В среде кислотных растворителей, индивидуальных и смешанных, синтезированные комплексы проявляют свойства оснований, переходя в протонированные формы, отличающиеся положением и интенсивностью максимумов полос поглощения в ЭСП (рис. 2, 3).
Результаты спектрофотометрического титрования
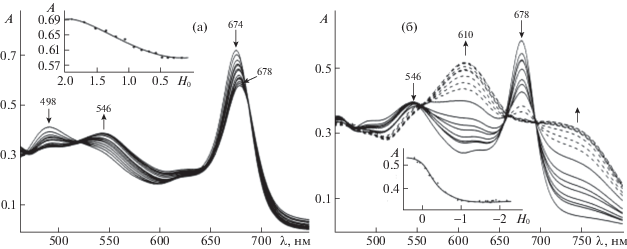
Теоретически порфиразины могут протонироваться по мере увеличения кислотности среды по двум внутрициклическим и четырем внешнециклическим атомам N в молекуле [25]. Когда в центре молекулы порфиразина присутствует катион металла, φN-орбитали внутрициклических атомов азота образуют с ним прочные донорно-акцепторные связи и поэтому не участвуют в процессе кислотно-основного взаимодействия. Исследование кислотно-основных взаимодействий (AcO)MnTAP(4-tBuPh)8 в системе CF3COOH–CH2Cl2 показало, что протонирование сопровождается последовательным образованием двух семейств спектральных кривых, каждому из которых соответствует свой набор изобестических точек (рис. 2). При титровании в области концентраций трифторуксусной кислоты 0.006–0.072 моль/л (H0 = 1.88–0.40) происходит уменьшение интенсивности полосы поглощения при 674 нм и ее смещение до 678 нм (рис. 2а). При увеличении концентрации CF3COOH до 6.42 моль/л (H0 = –2.19) полоса поглощения при 678 нм постепенно исчезает, растет поглощение в области 750 нм, и появляется новый максимум при 610 нм (рис. 2б). Такой спектр остается неизменным как при концентрациях CF3COOH, превышающих 6.4 моль/л (вплоть до 12.93 моль/л, H0 = –3.21), так и во времени.
Таким образом, протонирование (AcO)MnTAP(4-tBuPh)8 проходит в две стадии, что согласуется с видом кривых спектрофотометрического титрования – кривая с изломом в нелогарифмических координатах (рис. 2). На каждой стадии присоединяется один протон (рис. 4). Аналогичные спектральные изменения наблюдаются при протонировании незамещенного по фенильным остаткам (Cl)MnTAP(Ph)8 [24], образование монопротонированной формы которого с λmax = 560 и 706 нм в ЭСП наблюдается в диапазоне ${{С}_{{{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH}}}}}$ 0.05–0.5 моль/л (H0 от 0.77 до –1.23). Указанные характеристики для дважды протонированной формы: λmax = 590 нм, ${{С}_{{{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH}}}}}$ = 0.5–5.8 моль/л (H0 от –1.23 до –2.13).
Рис. 4.
Зависимости логарифмов индикаторных отношений для растворов (AcO)MnTAP(4-tBuPh)8 (1) и (AcO)MnTAP(3-CF3Ph)8 (2) от функции кислотности H0 смешанного растворителя для первой (а) и второй (б) ступеней протонирования.

Стехиометрия протонирования (AcO)MnTAP(3-CF3Ph)8 в среде CF3COOH–CH2Cl2 аналогична (рис. 3б), однако образование монопротонированной формы происходит в диапазоне ${{С}_{{{\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH}}}}}$ от 0.006 до 0.23 моль/л (H0 от 1.88 до ‒0.73) и сопровождается батохромным смещением на 3 нм длинноволновой полосы и ростом ее интенсивности относительно поглощения в чистом растворителе (рис. 3а). При увеличении концентрации CF3COOH до 6.4 моль/л (H0 = –2.19) наблюдаются уменьшение интенсивности полосы поглощения при 658 нм и гипсохромный сдвиг коротковолновой полосы до 401 нм (рис. 3б). Исходя из рассмотренных данных, ступенчатый процесс протонирования изученных органических оснований можно записать в виде уравнений:
(2)
$\begin{gathered} ({\text{AcO}}){\text{MnTAP}}{{({\text{R}})}_{8}} + {{{\text{H}}}^{ + }}\;\mathop \rightleftharpoons \limits^{{{K}_{1}}} \\ \mathop \rightleftharpoons \limits^{{{K}_{1}}} \;{{{\text{[}}({\text{AcO}}){\text{MnTAP}}{{({\text{R}})}_{8}}{\text{H}}]}^{ + }}, \\ \end{gathered} $(3)
$\begin{gathered} {{{\text{[}}({\text{AcO}}){\text{MnTAP}}{{({\text{R}})}_{8}}{\text{H}}]}^{ + }} + {{{\text{H}}}^{ + }}\;\mathop \rightleftharpoons \limits^{{{K}_{2}}} \\ \mathop \rightleftharpoons \limits^{{{K}_{2}}} \;{{{\text{[}}({\text{AcO}}){\text{MnTAP}}{{({\text{R}})}_{8}}{{{\text{H}}}_{2}}]}^{{2 + }}}. \\ \end{gathered} $Таблица 1.
Значения констант образования (устойчивости) протонированных форм марганец(III) тетраазапорфириновых комплексов в CF3COOH–CH2Cl2
| Соединение | K1, л/моль | K2, л/моль |
|---|---|---|
| (AcO)MnTAP(4-tBuPh)8 | (4.94 ± 0.6) × 10–2 | 2.41 ± 0.32 |
| (AcO)MnTAP(3-CF3Ph)8 | 0.29 ± 0.04 | 94.75 ± 20.44 |
| (Cl)MnTAP(Ph)8 [24] | 0.51 | 4.17 |
Таким образом, в смешанных растворителях CF3COOH–CH2Cl2 переменного состава наблюдается образование двух протонированных форм соединений (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 – с одним и двумя дополнительными протонами. Как видно из табл. 1, константы устойчивости K2 превосходят K1 на два и три порядка в случае (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 соответственно. Повышение основности марганец(III) тетраазапорфиринов при переходе от первой стадии (1) ко второй (2) (табл. 1) можно объяснить возрастанием роли эффекта стабилизации протонированной молекулы. Авторы работы [26] методом поляризованной люминесценции установили более высокую ароматичность двукратно протонированных аналогов тетраазапорфиринов – порфиринов (H2P) – по сравнению с однократно протонированной формой, связав это с ростом симметрии π-системы макроцикла и возможностью делокализации заряда на его атомах. Несмотря на различие центров протонирования (H2P протонируются по центральным атомам N), поведение порфиринов в кислотах можно сравнить с таковым для изученных комплексов (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 благодаря структурному сходству их ароматических макроциклов.
Электронное влияние восьми электронодонорных групп (4-tBuPh, 3-CF3Ph) на состояние ароматической системы в целом и на Nмезо в частности также находит отражение в кислотно-основных превращениях изучаемых комплексов. Из табл. 1 видно, что константы протонирования по обеим ступеням выше у (AcO)MnTAP(3-CF3Ph)8. Аналогично при наличии заместителей 3-CF3Ph, 3-CF3PhO и 3,5-di-tBuPhO в макроцикле фталоцианинов марганца(III) наиболее оснóвными комплексами оказались (AcO)MnPс(3-CF3Ph)8 и (AcO)MnPс(3-CF3PhО)8 [27]. Однако и основность обсуждаемого здесь (AcO)MnTAP(3-CF3Ph)8 оказывается ниже в сравнении с незамещенным по фенилам (Cl)MnTAP(Ph)8 [24] (рис. 5). 3-CF3Ph, как и при электрофильном замещении в ряду бензола, относят к мета-ориентантам [28]. Различное положение указанных групп в бензольном кольце, соответственно мета- и пара-положение, не приводит к противоположному влиянию на основность молекул по сравнению с (Cl)MnTAP(Ph)8. В отличие от 4-tBuPh-производного, в структуре молекулы (AcO)MnTAP(3-CF3Ph)8 присутствие группы CF3 обусловливает появление отрицательного заряда в мета-положении, т.е. на атоме C фенила, связанном с тетраазапорфириновым макроциклом. Значит, учет только электронных эффектов не объясняет направление, в котором изменяется основность изучаемых комплексов по сравнению с аналогом без указанных заместителей второго рода [28] (Этот вывод сделан без учета влияния аксиального лиганда). Преобладает, по-видимому, структурный эффект усиления взаимного отталкивания фенильных групп (см. рис. 1) при введении в них заместителей 4-tBuPh и 3-CF3Ph, приводящий к понижению ароматичности макроцикла, а значит, π-электронных зарядов на его атомах. Как следствие, наблюдается дополнительная делокализация n-электронной пары, отвечающей за основность молекулы, что приводит к понижению основности.
Рис. 5.
Диаграмма устойчивости монопротонированных форм тетраазапорфириновых комплексов с p- и d-металлами.

Влияние аксиального лиганда на основность металлопорфиразинов изучалось в работе [29] на примере галогенидных комплексов октафенилтетраазапорфина с Al, In и Ga. Сравнение констант протонирования по первой ступени (pK1) показало, что изменение основных свойств порфиразинов коррелирует с изменением ионной составляющей связи металл–аксиальный лиганд (F, Cl, Br).
Диаграмма устойчивости первых протонированных форм (рис. 5), построенная по нашим и данным работ [24, 29–31], показывает, что основность комплекса (Cl)MnTAP(Ph)8 выше, чем в случае октафенилтетраазапорфиновых комплексов с In, Al, Ir, Ga и Rh. Такое соотношение отражает вклад прямой дативной π-связи азот → металл (a2u → dπ) и σ-связи (Nσ → ${{d}_{{{{x}^{{\text{2}}}} - {{y}^{{\text{2}}}}}}}$) в случае комплекса марганца(III). Таким образом, формирование кислотно-основного поведения комплексов тетраазапорфирина оказывается чувствительным как к функциональному замещению, так и к природе связей в координационном узле, что можно использовать в направленном изменении основности подобных молекул.
В заключение подчеркнем, что марганец(III)тетраазапорфирины (AcO)MnTAP(4-tBuPh)8 и (AcO)MnTAP(3-CF3Ph)8 имеют свойства оснований и независимо от природы заместителя последовательно протонируются с образованием однократно и дважды протонированных форм. Повышение основности дважды протонированных форм по сравнению с монопротонированными объясняется эффектом стабилизации протонированной формы за счет делокализации положительного заряда. Полученные результаты вносят вклад в дальнейшее развитие теории реакционной способности макрогетероциклических соединений и могут быть использованы для объяснения и прогнозирования процессов с участием тетраазапорфириновых комплексов. Прикладные свойства изученных комплексов, а именно магнитокалорическая активность и способность к самосборке в системах с пиридилзамещенными фуллеропирролидинами, обладающими свойством фотоиндуцированного переноса электрона (PET, photoinduced electron transfer), уже обнаружены в работах [11, 15, 32].
Работа выполнена на оборудовании Центра коллективного пользования научным оборудованием “Верхневолжский региональный центр физико-химических исследований” в рамках Программы государственных академий наук (Тема № 0092-2014-0002).
Список литературы
Sorokin A.B. // Coord. Chem. Rev. 2019. V. 389. P. 141. https://doi.org/10.1016/j.ccr.2019.03.016.1
Lebedeva (Yablokova) I.A. Ivanova S.S., Novakova V. et al. // J. Fluorine Chem. 2018. V. 214. P. 86. https://doi.org/10.1016/j.jfluchem.2018.08.006
Rodríguez-Morgade M.S., Stuzhin P.A. // J. Porphyrins Phthalocyanines. 2004. V. 8. P. 1129. https://doi.org/10.1142/s1088424604000490
Koczorowski T., Szczolko W., Burda K. et al. // Dyes Pigments. 2015. V. 112. P. 138. https://doi.org/10.1016/j.dyepig.2014.06.033
Koczorowski T., Ber J., Sokolnicki T. et al. // Dyes and Pigments. 2020. V. 178. P. 108370. https://doi.org/10.1016/j.dyepig.2020.108370
Rebis T., Lijewski S., Nowicka J. et al. // Electrochim. Acta. 2015. V. 168. P. 216. https://doi.org/10.1016/j.electacta.2015.03.191
Piskorz J., Skupin P., Lijewski S. et al. // J. Fluorine Chem. 2012. V. 135. P. 265.
Mlynarczyk D.T., Lijewski S., Falkowski M. et al. // ChemPlusChem. 2016. V. 81. P. 460. https://doi.org/10.1002/cplu.201600051
Koczorowski T., Rębiś T., Szczolko W. et al. // J. Electroanal. Chem. 2019. V. 848. P. 113322. https://doi.org/10.1016/j.jelechem.2019.113322
Koca A., Gonca E., Gül A. // J. Electroanal. Chem. 2008. V. 612. P. 231. https://doi.org/10.1016/j.jelechem.2007.09.028
Королев В.В., Арефьев И.М., Ломова Т.Н. и др. // Журн. физ. химии. 2012. Т. 86. № 7. С. 1285. https://doi.org/10.1134/S0036024412070102
Camenzind M.J., Hill C.L. // Inorg. Chim. Acta. 1985. V. 99. P. 63. https://doi.org/10.1016/S0020-1693(00)86049-1
Walker F.A. In: The Porphyrin Handbook (Kadish K.M., Smith K.M., Guilard R., Eds.) San Diego: Academic Press, CA, 2000. V. 5. Ch. 36. P. 81.
Овченкова Е.Н., Ломова Т.Н. // Журн. орган. химии. 2011. Т.47. № 10. С. 1551. https://doi.org/10.1134/S107042801110023X
Ovchenkova E.N., Bichan N.G., Kudryakova N.O. et al. // Dyes Pigments. 2018. V. 153. P. 225. https://doi.org/10.1016/j.dyepig.2018.02.023
Ovchenkova E.N., Bichan N.G., Lomova T.N. // Tetrahedron. 2015. V. 71. P. 6659. https://doi.org/ 15https://doi.org/10.1016/j.tet.2015.07.054
Stuzhin P.A., Hamdush M., Homborg H. // Mendeleev Commun. 1997. V. 7. P. 196. https://doi.org/10.1070/MC1997v007n05ABEH000819
Petrik P., Zimcik P., Kopecky K. et al. // J. Porphyrins Phthalocyanines. 2007. V. 11. P. 487. https://doi.org/10.1142/S1088424607000564
Ovchenkova E.N., Lomova T.N., Hanack M. // Macroheterocycles. 2010. V. 3. № 1. P. 63. https://doi.org/10.6060/mhc2010.1.63
Ломова Т.Н. // В кн. Теоретические и экспериментальные методы химии растворов (Проблемы химии растворов) / Ред. А.Ю. Цивадзе. М.: Проспект, 2011. 688 с. С. 309.
Суслова Е.Е., Овченкова Е.Н., Ломова Т.Н. // Журн. физ. химии. 2013. Т. 87. № 10. С. 1693.
Silverstein R., Bassler G., Morrill T. Mass Spectrometry. Spectrometric Identification of Organic Compounds, 5th ed.; John Wiley & Sons: New York, 1991; 3–89.
Клюева М.Е., Репина Н.В., Чижова Н.В. и др. // Коорд. химия. 2005. Т. 31. № 1. С. 22. https://doi.org/10.1007/s11173-005-0005-6
Клюева М.Е., Стужин П.А., Березин Б.Д. // Коорд. химия. 2003. Т. 29. № 3. С. 201. https://doi.org/10.1023/A:1022831714285
Стужин П.А. Синтез, строение и физико-химические свойства азапорфиринов и порфиразинов: Дис….докт. хим. наук. Иваново: ИГХТУ, 2004. 362 с.
Гуринович Г.П., Севченко А.Н., Соловьев К.Н. Спектроскопия хлорофилла и родственных соединений. Минск: Наука и техника, 1968. 517 с.
Овченкова Е.Н., Ломова Т.Н. // Журн. физ. химии. 2015. Т. 89. № 2. С. 207. https://doi.org/10.1134/S0036024415020193
Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. Кн. 1. М.: Химия, 1969. 624 с.
Иванова С.С., Стужин П.A. // Коорд. химия. 2004. Т. 30. № 11. С. 813. https://doi.org/10.1023/B:RUCO.0000047462.95197.26
Стужин П.А., Кабешева Е.В., Хелевина О.Г. // Коорд. химия. 2003. Т. 29. № 5. С. 377. https://doi.org/10.1023/A:1023632019623
Стужин П.А., Мигалова И.С., Хомборг Х. // Коорд. химия. 2000. Т. 26. № 1. С. 9.
Lomova T.N., Korolev V.V., Ramazanova A.G., Ovchenkova E.N. // J. Porphyrins Phthalocyanines. 2015. V. 19. P. 1262. https://doi.org/10.1142/S1088424615501114
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии