Журнал физической химии, 2021, T. 95, № 9, стр. 1379-1384
Межмолекулярные взаимодействия яблочного пектина с L-фенилаланином и L-гистидином в водных растворах
Р. Х. Мударисова a, *, О. С. Куковинец b, С. В. Колесов a, И. В. Новоселов c
a Российская академия наук, Уфимский научный центр, Уфимский институт химии
Уфа, Россия
b Башкирский государственный университет
Уфа, Россия
c Уфимский государственный нефтяной технический университет
Уфа, Россия
* E-mail: mudarisova@anrb.ru
Поступила в редакцию 25.11.2020
После доработки 15.01.2021
Принята к публикации 16.01.2021
Аннотация
Спектрально изучено комплексообразование яблочного пектина с L-фенилаланином и L-гистидином в водных растворах. Определены стехиометрические составы комплексов и константы устойчивости. Рассчитаны стандартные термодинамические характеристики (ΔH°, ΔG°, ΔS°) комплексообразования.
Пектины (ПК) обладают разнообразной биологической активностью и широко используются для создания новых высокоэффективных препаратов, обладающих низкой токсичностью, иммуномодулирующим, антибактериальным, гепатопротекторным действием [1–7]. Изучение взаимодействия ПК с биологически активными соединениями, в частности, аминокислотами (АК) важно для моделирования многих биохимических процессов, а также для синтеза новых многофункциональных биоматериалов. Одним из методов получения подобных материалов является комплексообразование макромолекул полисахаридов с амфифильными соединениями различной природы [8–12]. Известно, что АК широко востребованы в пищевых и фармацевтических производствах в качестве добавок, активных компонентов лекарственных препаратов нового поколения [13–18]. Среди незаменимых АК можно выделить аминокислоты с ароматическим и имидазольным радикалами (фенилаланин, гистидин), которые играют значительную роль в химических и биохимических процессах. Так, фенилаланин (Phe) является кодируемой АК, одной из восьми незаменимых для человека, которые не могут синтезироваться его организмом из других соединений. Phe принимает участие в процессах формирования и стабилизации пространственной трехмерной структуры белков, которая необходима для их корректной работы в организме [19, 20]. Гистидин (His) входит в состав активных центров многих ферментов и является предшественником биогенного амина – гистамина [13, 21]. Это одна из важнейших аминокислот, которая способствует росту и восстановлению тканей, а также в большом количестве содержится в гемоглобине.
Однако ароматические и гетероциклические АК в составе фармацевтических композиций химически неустойчивы и разрушаются под действием света и влаги, а также сильно агрегируют [19, 20]. В последнее время для стабилизации и предотвращения агрегирования АК предлагается использовать биополимеры [22–24], комплексообразование с которыми может повысить стабильность и биологическую активность полученных продуктов.
Целью данной работы является изучение взаимодействия яблочного пектина с L-фенилаланином и L-гистидином и получение на их основе новых комплексных соединений, обладающих физиологической активностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах использовали ПК товарной марки Unipectine XPP 240 с молекулярной массой 26000 Дa и степенью этерифицирования 66%. Phe, His марки “х.ч.” использовали без дополнительной очистки и высушивали в вакуумном шкафу перед взятием навесок до постоянной массы при 343 К. Спектры ЯМР 13C растворов образцов в D2O регистрировали на спектрометре Bruker Avance III 500 MHz. ИК-спектры образцов записывали на спектрометре Shimadzu IR-Prestige-21 (700–3600 см–1, вазелиновое масло). Величину удельного вращения измеряли на поляриметре “Perkin-Elmer” (модель 141). УФ-спектры водных растворов соединений снимали в кварцевых кюветах толщиной 1 см на спектрофотометре UV-VIS SPECORD M-40. Кислотность растворов контролировали на pH-метре “АНИОН 4100”. Необходимую кислотность раствора создавали растворами НCl и NaOH.
Состав образующихся соединений при взаимодействии ПК с АК определяли спектрофотометрическими методами изомолярных серий и мольных отношений при рН 7.0 [25]. Суммарная концентрация полисахарида и аминокислоты в изомолярной серии составляла 1 × 10–4 моль/л. Молярные отношения [ПК] : [АК] варьировали от 50 : 1 до 1 : 20. В сериях растворов с постоянной концентрацией АК, равной 1 × 10–4 моль/л, концентрацию ПК изменяли от 1 × 10–5 до 1 × × 10–3 моль/л. Ионную силу поддерживали постоянной, равной 0.1 моль/л (NaCl, “х.ч.”).
По методу мольных отношений [25] спектральные изменения для раствора ПК + АК описываются уравнением:
где А и А0 – оптические плотности растворов в присутствии и отсутствии ПК, [АК]0 –начальная концентрация соответствующей аминокислоты, ε и ε0 – молярные экстинкции соответствующего состава, βk – константа устойчивости, [ПК] – концентрация пектина.
Из графика зависимости [АК]0/(А – А0) от 1/[ПК] по тангенсу угла наклона находили константу устойчивости комплексов.
Тепловые эффекты реакции образования комплексов были вычислены по уравнению Вант-Гоффа в интегральной форме [25]:
Изменение энтропии вычислено по формуле:
где ΔH – тепловой эффект реакции, ΔS – энтропия реакции, ΔG – изменение свободной энергии, T – средняя температура, βk – константа устойчивости.Общая методика получения комплекса ПК-АК : ПК в количестве 5.5 осново-ммоль растворяли в 20 мл воды. АК в количестве 5.5 ммоль растворяли в 20 мл воды и доводили рН до 7.0. К раствору ПК при интенсивном перемешивании прикапывали раствор АК при комнатной температуре. Реакцию проводили в течение 3 ч. По окончании реакции продукт выделяли осаждением этиловым спиртом, переосаждали снова из воды в спирт, осадок отделяли и промывали 3 раза спиртом, затем диэтиловым эфиром и высушивали в вакууме. Полученные комплексы анализировали на содержание углерода, водорода и азота на анализаторе марки EUKO EA-3000.
ПК–Phe. Выход 83.4%. ИК-спектр, ν, см–1: 3050–2400 ν(OH), 3390, 3337 ν(N–H), 3049–3028 ν(CH–Ar), 1605 ν(N–H) , 1582 ν(C=O в СОО–), 1144–1019 ν(С–О, С–С). УФ-спектр, λmax, нм: 249, 254, 260, 266. Найдено, %: С 52.13; Н 5.81; N 5.01. Вычислено, %: С 53.45; Н 5.75; N 4.02. $\alpha _{{\text{D}}}^{{20}}$, (Н2О): +144.
ПК–His. Выход 85.6%. ИК-спектр, ν, см–1: 3127–3560 ν(ОН), 1635 ν(C=O в СОО–), 1148–1018 ν(С–О, С–С), 1593–1568 ν(N=H), 1085 ν(N–H) УФ-спектр, λmax, нм: 206. Найдено, %: С 42.83; Н 5.23; N 11.25. Вычислено, %: С 44.38; Н 5.33; N 11.40. $\alpha _{{\text{D}}}^{{20}}$, (Н2О): +99.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Взаимодействие ПК с АК изучалось методами УФ-, ИК-13С ЯМР-спектроскопии, поляриметрии и элементного анализа. Были исследованы спектры поглощения АК и смесей АК с ПК в водных растворах при изменении рН среды. УФ-спектр поглощения молекулы Phe характеризуется серией пиков в виде зубцов, где основной максимум приходится на длину волны 262 нм, а остальные полосы поглощения (ПП) с разной степенью разрешения имеют следующие максимумы 249, 255 и 267 нм (рис. 1). Добавление увеличивающихся количеств ПК к раствору Phe приводит к смещению максимума ПП (262 нм) на 2 нм в коротковолновую область спектра и значительному увеличению ее интенсивности (рис. 1). Необходимо отметить, что характер спектральных изменений слабо зависит от рН: небольшие изменения происходят при проведении реакции в нейтральной и слабощелочной среде (рис. 2).
Рис. 1.
Электронные спектры поглощения водных растворов ПК (1), Phe (2), смеси ПК и Phe (3); CПК = = 1.0 × 10–4 моль/л, СPhe = 1.0 × 10–4 моль/л, рН 7.0, l = 1.0 см, Т = 298 К.

Рис. 2.
Зависимости оптической плотности соединений от рН водных растворов Phe, His, ПК–Phe, ПК–His; СPhe = 2 × 10–4 моль/л, СHis = 2.0 × 10–5 моль/л, СПК–Phe = 2 × 10–4 моль/л, СПК–His = 2 × 10–5 моль/л 298 К, l = 1 см, λ (ПК–His) = 206 нм; λ (ПК–Phe) = 260 нм.

В УФ-спектре His наблюдается одна интенсивная ПП при 211 нм, которая относится к n-π-переходу шестиэлектронной системы ядра [26]. УФ-спектр водных растворов смеси ПК–His в кислой среде (рН 1.0–3.0) практически идентичен спектру His в этих же условиях с незначительным гипсохромным сдвигом полосы поглощения (1 нм), что говорит о слабом взаимодействии при данных значениях рН (рис. 2). Спектральные изменения в растворах наблюдаются, начиная с рН > 4.0, и сопровождаются гиперхромным эффектом и сдвигом полосы поглощения смеси ПК–His в коротковолновую область спектра на 5 нм (рис. 3). Данные изменения в спектрах систем ПК–Phe и ПК–His, согласно [27], могут быть объяснены образованием комплексных соединений.
Рис. 3.
Электронные спектры поглощения водных растворов ПК (1), His (2), смеси ПК и His (3); CПК = 2.0 × 105 моль/л, СHis = 2.0 × 10–5 моль/л, рН 7.0, l = 1.0 см, Т = 298 К.

Состав и константу устойчивости образующихся комплексов определяли методами изомолярных серий и мольных отношений при рН 7.0 (табл. 1). Согласно полученным обоими методами результатам, ПК образует с АК комплексы состава 1 : 1. Из табл. 1 видно, что устойчивость комплексов прежде всего зависит от строения АК и температуры процесса. Очевидно, присутствие различных по своему характеру функциональных групп в боковой цепи аминокислот обусловливает изменение эффективного заряда на атоме азота амино-группы, что приводит к перераспределению электронной плотности на данном атоме и отражается на устойчивости образующихся комплексов. Так, для системы ПК–Phe значения величин констант устойчивости, полученные для различных температур, имеют одинаковый порядок и невелики. Тогда как комплекс ПК–His оказался примерно в 20–50 раз более устойчивым, чем ПК–Phe, что обусловлено строением молекулы гистидина, в состав которой входит имидазольное кольцо, в котором атомы азота отличаются электронным окружением. Это влияет на их участие в процессе комплексообразования и может приводить к дополнительной стабилизации комплексного соединения.
Таблица 1.
Термодинамические характеристики и константы устойчивости комплексов
| Образец | T, K | βk × 10–3, Л моль–1 |
∆H°, кДж/моль |
∆S°, Дж/(моль К) |
∆G°, кДж/моль |
|---|---|---|---|---|---|
| ПК–Phe | 273 297 313 |
0.6 ± 0.1 0.2 ± 0.1 0.1 ± 0.1 |
–25.7 ± 2.0 | –41.6 ± 2.0 | –13.5 ± 1.0 |
| ПК–His | 273 297 313 |
13.3 ± 2.0 11.0 ± 1.5 6.9 ± 1.5 |
–13.7 ± 1.0 | 30.6 ± 1.5 | –22.7 ± 1.0 |
Данные ИК-спектров подтверждают это предположение. В ИК-спектре ПК–His по сравнению со спектрами нативного пектина и His наблюдаются следующие изменения: резко уменьшается интенсивность ПП в области 3150–3560 см–1, характерных для ПП ν(О–Н) и при 1741 см–1 для ПП ν(С=О) пектина. Кроме того, исчезают ν(N–H)-связи в области 3125–3004 см–1, уменьшается интенсивность ПП δ (N–H) при 1087 см–1, тогда как интенсивность и положение ПП ν(СОО–) His при 1635 см–1 практически не изменяется. По данным ИК-спектров, в первую очередь, можно предположить, что в координации с полисахаридом участвует азот в положении 3 гетероциклического кольца, о чем свидетельствуют наблюдаемые максимальные изменения в области деформационных колебаний N=CH-фрагмента (1572 см–1) кольца His, ПП которого сдвигается до 1593 см–1. Нельзя исключить и дополнительное связывание кислородсодержащих групп ПК с амино-функцией His, что подтверждается сглаживанием полос поглощения +NН3-группы аминокислоты в области 2300–2800 см–1.
В спектре комплекса ПК–Phe ПП ν(С=О) при 1741 см–1 пектина уменьшается, также уменьшается интенсивность и происходит низкочастотный сдвиг ПП ν(–ОН) в области 3050–2400 см–1 и высокочастотный сдвиг ν(–С–О–С) пиранозного кольца в области 1019–1144 см–1. Подтверждением участия амино-функции Phe в комплексообразовании является изменение характера ИК-спектра в области 2400–3600 см–1. Исчезают характерные ПП ν(+NН3), появляется ПП ν(N–H) при 3337 см–1, а ПП ν(N–H) при 1626 см–1 сдвигается до 1605 см–1.
Таким образом, в системах ПК-АК имеет место взаимодействие достаточно сложного характера, учитывая возможность образования различных типов координационных связей у компонентов. Очевидно, формирование комплексов ПК-АК протекает через координацию одной молекулы аминокислоты и одного углеводного звена полисахарида с образованием между ними межмолекулярных связей с участием кислородсодержащих функциональных групп основной цепи пектина и азотсодержащих групп АК.
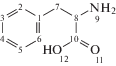
Спектры ЯМР 13С также подтверждают координацию карбонильных групп пектина с азотсодержащими группами АК (табл. 2). Так, при взаимодействии ПК с Phe в спектре 13С ЯМР наблюдается незначительный сдвиг сигналов всех атомов углеродов ароматического кольца на 0.01–0.03 м.д. Наиболее значительное смещение на 0.05 м.д. можно отметить для атома углерода С8 непосредственно связанного с амино-функцией Phe. Из совокупности спектральных данных следует, что ароматическое кольцо Phe не принимает непосредственного участия в комплексообразовании, но изменяется характер ауксохрома у Ar, приводя к существенному гиперхромному эффекту при незначительном гипсохромном сдвиге в электронных спектрах ПК–Phe. Изоэлектрическая точка (pl) Phe равна 5.5, вследствие этого в кислой и слабокислой среде атом азота находится в кватернизированной форме, что снижает его способность к комплексообразованию. В условиях эксперимента при рН 7.0 количество свободной NH2-группы увеличивается и за счет нее образуется малоустойчивый комплекс, структуру которого можно представить следующей схемой:
Таблица 2.
Значения химических сдвигов 13С СHn-групп индивидуальных веществ и их комплексов
| № С | Phe | Комплекс ПК–Phe | Δδ, м.д. | His | Комплекс ПК– His | Δδ, м.д. |
|---|---|---|---|---|---|---|
 |
 |
|||||
| С1 | 138.11 | 135.09 | –0.02 | – | – | |
| С2 | 129.37 | 129.37 | 0 | 136.17 | 136.29 | 0.12 |
| С3 | 129.11 | 129.12 | 0.01 | – | – | |
| С4 | 127.69 | 127.70 | 0.01 | 117.06 | 117.02 | 0.04 |
| С5 | 129.11 | 129.12 | 0.01 | 132.55 | 132.50 | 0.05 |
| С6 | 129.37 | 129.37 | 0 | 29.25 | 28.94 | 0.31 |
| С7 | 36.35 | 36.33 | –0.02 | 55.14 | 55.05 | 0.09 |
| С8 | 56.04 | 55.99 | –0.05 | 176.30 | 175.57 | 0.27 |
| С10 | 173.89 | 173.84 | –0.03 | – | – | – |
Как видно из приведенных в табл. 2 данных хим. сдвиги всех ядер 13С His смещаются в сторону высокого поля. Изменения хим. сдвигов для С2 и С5 гетероцикла His (Δδ = 0.12, 0.05 м.д. соответственно) говорят о координации за счет азота в третьем положении гетероцикла с карбонильной группой полисахарида. Изменения хим. сдвига для С8 на 0.27 м.д. в сильное поле свидетельствуют о возможной координации СОО–-группы His, потому что при pl His 7.58, аминокислота существует в виде цвиттер-иона и карбокси-анион вносит вклад в устойчивость комплекса за счет слабого электростатического взаимодействия с гидроксильными группами ПК, как показано на схеме:
По уравнению Вант-Гоффа определены термодинамические параметры процесса комплексообразования. Знак и величина термодинамических параметров, связанных с различными индивидуальными видами взаимодействий в процессах ассоциации с биополимерами, были охарактеризованы в работе [28]. Положительное значение ΔS часто считается свидетельством гидрофобного взаимодействия. Взаимодействие через водородные связи между молекулами характеризуется отрицательными значениями ΔS и ΔН, а электростатическое взаимодействие – положительным значением ΔS. Так, комплексообразование Phe с ПК характеризуется отрицательными значениями изменения энтальпии и энтропии, что может быть связано с ограничениями свободы колебательных и вращательных движений молекулы АК при ее взаимодействии с полисахаридом. Вероятно, в связывании ПК с Phe основную роль играют ван-дер-ваальсовые взаимодействия и водородные связи, причем это связывание контролируется энтальпийной составляющей. Отрицательные значения изменения энергии Гиббса свидетельствуют о самопроизвольной реакции комплексообразования между Phe и ПК. Процессы комплексообразования ПК с His характеризуются отрицательными значениями энтальпии и положительными значениями энтропии, т.е. связывание пектина с аминокислотой является энтальпийно-энтропийно благоприятным (∆H° < 0, ∆S° > 0) (табл. 1). Видимо, в случае комплексообразования ПК с His основной вклад вносят не только электростатические силы и водородные связи, но и гидрофобные взаимодействия.
Синтезированные соединения были выделены путем осаждения спиртом из водного раствора, очищены и исследованы спектральными методами. Все полученные комплексные соединения хорошо растворимы в воде и практически нерастворимы в спирте, ацетоне, эфире. Об изменении качественного состава продуктов комплексообразования также свидетельствует изменение величины удельного угла вращения полученных полимерных комплексов. Продукты взаимодействия ПК с АК имеют удельные углы вращения, существенно отличающиеся от $\alpha _{{\text{D}}}^{{20}}$ исходного полисахарида.
Таким образом, спектральными методами показано образование межмолекулярных комплексов яблочного пектина с аминокислотами – L-фенилаланином и L-гистидином за счет взаимодействия гидроксильных и карбонильных групп полисахарида с амино-функциями АК и дополнительной стабилизации посредством слабых водородных связей. Показано, что образование молекулярных комплексов состава 1 : 1 для системы ПК–Phe контролируется только энтальпийной составляющей (∆H° < 0, ∆S° < 0), а связывание ПК с His энтальпийно-энтропийно благоприятно (∆H° < 0, ∆S° > 0). Полученные результаты подтверждают образование “мягких” комплексов, что принципиально важно при создании лекарственных полимерсодержащих препаратов с быстрым высвобождением действующего компонента из комплексного соединении. Пектины, модифицированные Phe и His могут быть предложены в качестве лекарственных средств пролонгированного действия и активных пищевых добавок.
Статья подготовлена в рамках выполнения программы ФНИ государственных академий на 2013–2020 гг. Гос. задание № АААА-А20-120012090024-5. Анализы (измерения и расчеты) выполнены на оборудовании ЦКП “Химия” УфИХ РАН и РЦКП “Агидель” УФИЦ РАН.
Список литературы
Донченко Л.В., Фирсов Г.Г. Пектин: основные свойства, производство и применение. М.: Де Ли, 2007. 276 с.
Кайшева Н.Ш., Кайшев А.Ш. Фармакохимические основы применения пектинов и альгинатов. Пятигорск: РИА-КМВ, 2016. 260 с.
Thakur B.R., Singh R.K., Handa A.K. // Critical Reviews in Food Science and Nutrition. 1997. V. 37. P. 47. https://doi.org/10.1080/10408399709527767
Хотимченко Ю.С., Одинцова М В., Ковалев В.В. Полисорбовит. Томск: Изд-во НТЛ, 2001. 132 с.
Минзанова С.Т., Миронов В.Ф., Выштакалюк А.Б. и др. // Докл. АН. 2013. Т. 452. № 2. С. 177. https://doi.org/10.1134/S0012500813090048
Патова О.А., Головченко В.В., Оводов Ю.С. // Изв. АН. Сер. Хим. 2014. Т. 63. № 9. С. 1901. https://doi.org/10.1007/s11172-014-0681-9
Sriamornsak P. // Silpakorn University International J. 2003. V. 3. P. 206. https://www.researchgate.net/publication/215872059.
Mudarisova R., Kukovinets O., Sagitova A., Novoselov I. // Biointerface Researche in Applied Chemistry. 2020. V. 10. № 4. P. 5724. https://doi.org/10.33263/BRIAC104.724732
Васильева С.Ю., Левданский А.В., Казаченко А.С. и др. // Журн. Сибирского федерального ун-та. Серия: Химия. 2016. Т. 9. № 3. С. 318. https://doi.org/0.17516/1998-2836-2016-9-3-318-325
Мударисова Р.Х., Бадыкова Л.А., Фатыхов А.А. и др. // Журн. физ. химии. 2008. Т. 82. № 8. С. 1566. https://doi.org/10.1134/S003602440808027X
Aree T., Arunchai R., Koonrugsa N. // Amarawan Intasiri Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 2012. V. 96. P. 736. https://doi.org/10.1016/j.saa.2012.07.049
Григорьев Т.Е., Гринберг Н.В., Гринберг В.Я. и др. // Высокомолекуляр. соединения. Сер. А. 2007. Т. 49. № 6. С. 969. https://doi.org/10.1134/S0965545X0706003X
Машковский М.Д. Лекарственные средства. М.: Медицина, 1984. Т. 2. 405 с.
Ляпина Л.А., Оберган Т.Ю., Григорьева М.Е., Майстренко Е.С. // Вестн. Моск. ун-та. Сер. 16. Биология. 2013. № 2. С. 3. https://doi.org/10.3103/S0096392513030073
Stief T.W. // Clin. Appl. Thromb. Hemost. 2007. V. 13. № 2. P. 146.
Смирнов В.С., Зарубаев В.В., Анфимов П.М., Штро А.А. // Вопросы вирусологии. 2012. № 3. С. 23.
Бушов А.В., Тен Э.В., Логинов Г.П. // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. Казань. 2005. Т. 180. С. 21.
Галочкин В.А., Малиненко П.Е., Майстров В.И. // Сб. науч. тр. ВНИИФБиП с.-х. животных. 2005. Т. 24. С. 97.
Якубке Х.Д., Ешкайт Х. Аминокислоты, пептиды, белки. М.: Мир, 1985. 82 с.
Хазова О.А. Аминокислоты. М.: Предтеча, 2010. 64 с.
Болотин С.Н., Буков Н.Н., Волынкин В.А., Панюшкин В.Т. Координационная химия природных аминокислот. М.: Изд. ЛКИ, 2008. 240 с.
Samra S., He F., Bhambhani A. et al. // J. of Pharmaceutical Sciences 2010. V. 99. № 6. P. 2800. https://doi.org/10.1002/jps.22053
Brewster M.E., Hora M.S., Simpkins J.W., Bordor N. // Pharm. Res. 1991. V. 8. № 6. P. 792. https://www.researchgate.net/publication/21092840
Serno T., Geidobler R., Winter G. // Advanced Drug Delivery Rev. 2011. V. 63. P. 1086. https://doi.org/10.1016/j.addr.2011.08.003
Булатов И.П., Калинкин М.И. Практическое руководство по фотометрическим методам анализа. Л.: Химия. 1986, 432 с.
Tang S.H., Huang J.B. // Acta Chim. Sinica. 2001. V. 59. P. 1258.
Эндрюс Л., Кифер Р. Молекулярные комплексы в органической химии. М.: Мир, 1967. 206 с.
Ross P.D., Subramanian S. // Biochemistry. 1981. V. 20. P. 3096.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




