Журнал физической химии, 2021, T. 95, № 9, стр. 1385-1389
Исследование процесса комплексообразования меди(II) с тиосемикарбазидом в водном растворе
А. С. Самадов a, *, И. Г. Горичев a, Г. З. Казиев a, Э. Ф. Файзуллозода b, А. Ф. Степнова a
a Московский педагогический государственный университет
129164 Москва, Россия
b Таджиксий национальный университет, Республика Таджикистан
734025 Душанбе, Таджикистан
* E-mail: s.s.rasul@mail.ru
Поступила в редакцию 26.11.2020
После доработки 28.12.2020
Принята к публикации 11.01.2021
Аннотация
Потенциометрическим и спектрофотометрическим методами изучен процесс комплексообразования меди(II) с тиосемикарбазидом (Tsc) в водном растворе при t = 25°С (в среде 0.1 М HClO4 и 1.0 М HCl). Установлено, что в среде 0.1 М HClO4 и 1.0 М HCl образуются стабильные тиосемикарбазидные комплексы состава CuTsc$_{2}^{{2 + }}$ при соотношении СTsc/$С_{{{\text{Cu}}}}^{{2 + }}$ ≥ 2.0. В среде хлороводородной кислоты проходит ступенчатое замещение лигандов по уравнению: [CuClx]$^{{ + 2--x}}$ + iTsc = [CuCl${{_{x}}_{{--1}}}$Tsci]$^{{ + 2--(x--1)}}$ + xCl–, βi. Рассчитанные константы устойчивости тиосемикарбазидных и хлорозамещенных тиосемикарбазидных комплексов меди(II) из спектрофотометрических данных равны $\lg {{\beta }_{1}}$ = 3.96 ± 0.10, $\lg {{\beta }_{2}}$ = 8.01 ± ± 0.10 (0.1 М HClO4); $\lg {{\beta }_{1}}$ = 4.19 ± 0.06, $\lg {{\beta }_{2}}$ = 7.87 ± 0.08 (1.0 М HCl).
Тиосемикарбазид (NH2NH–(C=S)–NH2) является бидентатным лигандом, координируется с переходными металлами через атомы азота и серы как в нейтральной, так и в анионной формах [1–3]. Тиосемикарбазид и его производные (основания Шиффа) представляют особый интерес исследователей из различных областей, таких как катализ, фармацевтическая химия и электрохимия. Они обладают широким спектром свойств, применяются в качестве катализаторов окислительно-восстановительных реакций, как антибактериальные, противогрибковые, противоопухолевые и противомалярийные средства и используются в качестве электрохимических сенсоров [4–10]. Комплексы меди (II) с семикарбазидом и тиосемикарбазидом привлекают большое внимание из-за их применения в качестве противовирусных агентов, демонстрируя более высокую активность по сравнению с лигандами, не входящими в комплекс. Их также используют при лечении опухолей, в том числе болезни Ходжкина (лимфогранулематоз) [11]. Антимикробные свойства тиосемикарбазидных комплексов меди(II) изучены в работе [12]. Оказалось, что комплексы меди(II) проявляют более эффективную антибактериальную и противогрибковую активность в отличие от лиганда.
Авторы работ [13–17] синтезировали и структурно охарактеризовали ряд комплексов меди(II) с тиосемикарбазидом и различными анионами, такими как 1,5-нафталиндисульфонат ([Cu(Тsc)2](Nds)), салициловая кислота ([Cu(Tsc)2](HSal)2), цистеинат и 5-сульфосалицилат ([Cu(Tsc)2](H2SSal)2). При взаимодействии цистеината меди(II) с тиосемикарбазидом (Tsc) в воде образуется роданидный тиосемикарбазидный комплекс меди(II) состава [Cu(Tsc)2(SCN)2] [15]. В работах [12, 18] описаны синтезы комплексных соединений хлорида, нитрата и ацетата меди(II) с тиосемикарбазидом. Во всех случаях атом меди(II) координирован по квадратичной геометрии бидентатно-хелатно (N, S) с тиосемикарбазидом. Таким образом, в литературе мы не обнаружили данные о равновесиях комплексообразования в системе меди(II) с тиосемикарбазидом.
Цель настоящей работы заключается в исследовании процессов комплексообразования ионов меди(II) с тиосемикарбазидом в среде 0.1 М HClO4 и 1.0 М HCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали оксид меди(II) “ч.д.а.”, хлорную кислоту “х.ч.”, двухлористую медь(II) “х.ч.”, соляную кислоту “х.ч.”, тиосемикарбазид (Tsc) “ч.д.а.” и прокипяченную дистиллированную воду. Раствор Cu(ClO4)2 готовили из оксида меди(II) в хлорной кислоте (СuO + HClO4). Исследование проводили потенциометрическим и спектрофотометрическим методами. Потенциометрическое исследование системы “Cu(ClO4)2 + Tsc + HClO4 + вода” выполняли с переносчиками. Для этого измеряли ЭДС цепей:
|
Cu |
${{C}_{{{\text{Cu(Cl}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{2}}}}}}}$, CTsc |
KNO3 нас. |
КCl нас. |
AgCl, Ag |
| 0.1 M HClO4, |
В качестве электрода сравнения использовали насыщенный хлорсеребряный электрод, и все потенциалы в работе приведены относительно данного электрода (≈200 мВ). Индикаторным электродом служила медная проволока (99.999). Потенциометрические исследования проведены только в среде хлорной кислоты. Величина E∅ из уравнения E = E∅ + θ$\lg {{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ (θ = 29.58 ± 2) в среде хлорной кислотой равна 130.0 мВ, что с учетом потенциала НХСЭ соответствует стандартному потенциалу пары Cu2+/Cu. Перед каждым экспериментом медный электрод очищали концентрированной азотной кислотой. ЭДС измеряли c помощью прибора ЭКСПЕРТ-001. Все измерения потенциалов проводились при температуре 25.0 ± ± 0.1°С в термостатированной ячейке. В ходе эксперимента раствор с заданной $C_{{{\text{Cu}}}}^{0}$ титровали раствором тиосемикарбазида с измерением потенциала медного электрода.
В работе использовались растворы CuX2 (X = = ${\text{ClO}}_{4}^{ - }$ и Cl–) и тиосемикарбазид (Tsc) c концентрациями ${{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ = 1 × 10–3–5 × 10–2 моль/л и СTsc = = 2 × 10–4–1 × 10–1 моль/л. Для поддержания постоянства ионной силы раствора использовали 0.1 М HClO4 и 1.0 М HCl.
Спектры поглощения записывали на спектрофотометре “UV-1700 SHIMADZU” при длине волны 190–900 нм, для растворов с СCu и CTsc от 2 × 10–4 до 1 × 10–1 моль/л, l = 0.1–1.0 см.
Константы устойчивости комплексов из потенциометрических данных были рассчитаны итерационно с использованием функции Ледена, имеющей вид [19]:
(1)
$F({\text{Tsc}}) = \sum {{{\beta }_{i}}} {{[{\text{Tsc]}}}^{{i - 1}}} = \frac{{{{C}_{{{\text{C}}{{{\text{u}}}^{{{\text{2 + }}}}}}}} - [{\text{C}}{{{\text{u}}}^{{{\text{2 + }}}}}]}}{{{\text{[C}}{{{\text{u}}}^{{{\text{2 + }}}}}{\text{][Tsc]}}}},$Расчет константы комплексов из спектрофотометрических данных проводился по методу соответственных растворов (МСР) [20, 21]. В соответствии МСР растворы, характеризующиеся одним и тем же значением ε* (ε* – молярный коэффициент поглощения частицы в растворе) имеют одинаковые концентрации лиганда [L]. Поскольку ε* = A/CM зависит только от [Tsc], то [Tsc] можно легко рассчитать из МСР. В качестве вспомогательных функций определены функции образования $\bar {n} = ({{С}_{{{\text{Tsc}}}}} - [{\text{Tsc]}}){\text{/}}{{C}_{{{\text{C}}{{{\text{u}}}^{{{\text{2 + }}}}}}}}$ (Бьеррума), значение которых варьировалось от 0 до 2 в среде хлорной и хлороводородной кислоты. Стандартные отклонения $\lg {{\beta }_{i}}$ оценивали с доверительными интервалами P = 0.95. Расчет констант равновесия из экспериментальных данных проводился с использованием программ Excel.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Комплексы Cu(ClO4)2 с тиосемикарбазидом (Tsc). При титровании раствора тиосемикарбазида в системе, содержащей Cu(ClO4)2, происходят комплексообразовательные реакции в соответствии с уравнением:
(2)
${\text{C}}{{{\text{u}}}^{{2 + }}} + i{\text{Tsc}} = {\text{CuTsc}}_{i}^{{2 + }},\;{{\beta }_{i}},$Рис. 1.
Зависимости потенциала медного электрода (Е) от $\lg {{C}_{{{\text{Tsc}}}}}$ для ${{С}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$: 1 – 0.05 М, 2 – 0.01 М, 3 – 0.005 М (в среде 0.1 М HClO4).

Следует отметить, что потенциал данной системы в отличие от систем Cu2+ с тиомочевиной [22] стабильный и проявляет воспроизводимый характер. Полученные потенциометрическим методом константы устойчивости комплексов имеют значения: $\lg {{\beta }_{1}}$ = 3.31, $\lg {{\beta }_{2}}$ = 7.90.
Спектрофотометрические исследования проведены методом сдвига равновесия, т.е. при постоянной концентрации комплексообразователя (Сu2+) варьировали СTsc с соотношением лиганда к металлу от 0.2 до 10.0. Исследование проводилось в области ${{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ = (1.0–10.0) × 10–3 и СTsc = = (0.02–10) × 10–2 моль/л. На основе спектральных данных построили зависимость А – СTsc/CCu. Наблюдающийся на кривой излом при соотношении концентраций СTSС/CCu = 2 хорошо согласуется с потенциометрическими данными (рис. 1). Зависимость оптической плотности от длины волны приведена на рис. 2.
Рис. 2.
Зависимости А от λnm при образовании тиосемикарбазидных комплексов меди(II) в среде 0.1 моль/л HClO4; ${{С}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ = 0.01 моль/л = const, 1 – 0.01 моль/л Cu2+, 2–15 – соотношение СTsc/${{С}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ от 0.19 до 10, l = 1 см.

Из рис. 2 видно, что в системе преобладают две формы комплексных частиц, спектры поглощения которых равны при длине волны 675.0 (CuTsc2+) и 565.0 (CuTsc$_{2}^{{2 + }}$) нм, где металл и лиганд не поглощают света. Полоса d-d-перехода для ионов Cu2+ наблюдалась при λ = 807.0 нм. Коэффициенты экстинкции (ε) комплексов равны: ε1 = 5070 и ε2 = 6280 моль/(л см).
Полученные константы комплексов равны: $\lg {{\beta }_{1}}$ = 3.96 ± 0.10, $\lg {{\beta }_{2}}$ = 8.01 ± 0.10.
Комплексы CuCl2 с тиосемикарбазидом (Tsc). Исследование процессов комплексообразования проведены в среде 1.0 моль/л HCl спектрофотометрическим методом. При такой кислой водной среде ионы меди(II) находятся в координированном состояний с хлорид-ионами и при добавлении раствора Tsc в системе проходит замещение лигандов
(3)
$\begin{gathered} {{[{\text{CuC}}{{{\text{l}}}_{{\text{x}}}}]}^{{ + 2--x}}} + i{\text{Tsc}} = \\ = {{[{\text{CuC}}{{{\text{l}}}_{x}}_{{--1}}{\text{Ts}}{{{\text{c}}}_{i}}]}^{{ + 2--(x - 1)}}} + x{\text{C}}{{{\text{l}}}^{--}},\;{{\beta }_{i}}. \\ \end{gathered} $Рис. 3.
Зависимости А от λnm при образовании тиосемикарбазидных комплексов меди(II) в среде 1.0 моль/л HCl, ${{С}_{{{\text{CuC}}{{{\text{l}}}_{{\text{2}}}}}}}$ = 1 × 10–3 моль/л = const, 1 – 1 × 10–3 моль/л Cu2+, 2–14 – соотношение СTsc/${{С}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ от 0.19 до 10. l = 0.1 см.
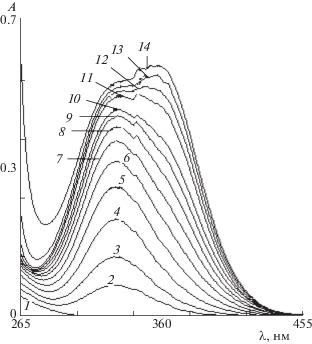
В данной системе при ${{С}_{{{\text{СuC}}{{{\text{l}}}_{{\text{2}}}}}}}$ ≥ 0.005 моль/л и СTsc/${{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ ≥ 2.0 через 5–7 мин выпадают нерастворимые коричневые кристаллы, состав [CuTsc2Cl2] которых определен в работе [12]. Спектры раствора хлорозамещенного комплекса меди (II) с Tsc можно снимать в диапазонах, аналогичных для исследования системы Cu(ClO4)2 + Tsc, т.е. при λ 450–200 нм и λ 900–450 нм. Выбор диапазона длины волны объясняется тем, что в системе хлорозамещенного комплекса меди (II) с Tsc с ростом концентрации хлорида меди(II) в растворе при СTsc/${{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ ≥ 2.0 выпадают в осадок нерастворимые соединения ([CuTsc2Cl2]), что затрудняет снятие спектров при 900–450 нм. При ${{С}_{{{\text{CuC}}{{{\text{l}}}_{{\text{2}}}}}}}$ ≤ ≤ 0.001 М осадок выпадает через 30 мин. Соответственно исследование системы CuCl2 + Tsc проводили в диапазоне λ 450–200 (${v}$ = (22.2–50.0) × × 103 см–1) нм. Комплексы CuTsc2+ и CuTsc$_{2}^{{2 + }}$ в среде хлорной кислоты поглощают свет максимально при λ 321.0 и 356.0 нм, соответственно. В системе СuCl2 + Tsc появляется два пика при λ 328.5 и 356.0 нм, которые соответствуют соотношению СTsc/${{C}_{{{\text{C}}{{{\text{u}}}^{{2 + }}}}}}$ 1:1 и 1:2. Таким образом, экспериментальные данные указывают на то, что в начале происходит ступенчатое вытеснение хлорид иона из внутренних координационных сфер с образованием комплексного иона состава CuTsc$_{2}^{{2 + }}$, а затем на образование со временем комплекса [CuTsc2Cl2]. Сдвиг длины волны с 321.0 и 675.0 до 328.5 и 705.0 свидетельствует о существовании комплексного иона состава [CuTscCli]$^{{ + 2--i}}$.
Обработка данных проведена по методу соответственных растворов. На рис. 4 приведены зависимости функций образования от lg[Tsc] для хлорозамещенного комплексообразования.
Рис. 4.
Зависимость функции образования ($\bar {n}$) от lg[Tsc]. Точки – экспериментальные данные, линии –расчет.

Величины ${{\bar {n}}_{{{\text{расч}}}}}$ – были рассчитаны с помощью уравнения ${{\bar {n}}_{{{\text{расч}}}}} = ({{\beta }_{1}}[{\text{Tsc}}] + 2{{\beta }_{2}}{{[{\text{Tsc}}]}^{2}}){\text{/}}(1 + {{\beta }_{1}}[{\text{Tsc}}] + $ $ + \;{{\beta }_{2}}{{[{\text{Tsc}}]}^{2}})$. Рассчитанные константы равновесия хлорозамещенных комплексов равны: $\lg {{\beta }_{1}}$ = 4.19 ± ± 0.06, $\lg {{\beta }_{2}}$ = 7.87 ± 0.08. Коэффициент экстинкции комплексов ε1 = 5150 и ε2 = 5540 моль/(л см).
На рис. 5 представлены спектры форм существующих частиц в системе с хлороводородной кислотой, которые можно наблюдать в области ${v}$ = (22.2–50.0) × 103 см–1 (λ = 450–200 нм). Они были получены на основе их оптической плотности Аi и концентрации Сx (ε = Ai/Cxl). Спектры форм тиосемикарбазида (Tsc) наблюдаются при длине волны 241.0 нм с коэффициентом экстинкции ε = 12.16 × 103.
Рис. 5.
Спектры форм: 1 – Cu2+; 2 – [CuCli]$^{{ + 2--i}}$; 3 – Tsc; 4 – [CuTscCli]$^{{ + 2--i}}$; 5 – CuTsc$_{2}^{{2 + }}$ в среде 1.0 М HCl, l = 0.1 см.

Таким образом, рассчитанные приведенными обоими методами константы устойчивости комплексов в перхлоратной системе обнаруживают удовлетворительную сходимость результатов, за исключением некоторых системных ошибок.
Таким образом, исследование процесса комплексообразования ионов меди(II) с тиосемикарбазидом (Tsc) в кислой водной среде (0.1 М HClO4 и 1.0 М HCl) изучено потенциометрическим и спектрофотометрическим методами. По данным спектрофотометрических исследований определено, что в среде 1.0 М HCl молекулы тиосемикарбазида ступенчато вытесняют хлорид ионы из внутренних координационных сфер ионов меди(II). Результаты исследования показали, что использование медного электрода в данной системе удовлетворительно в отличие от системы Cu2+ с тиомочевиной (Tu).
Список литературы
Metwally M.A., Khalifa M.E., Koketsu M. // American J. of Chemistry. 2012. V. 2. P. 38. https://doi.org/10.5923/j.chemistry.20120202.09
Lobana T.S., Sharma R., Bawa G., Khanna S. // Coord. Chem. Rev. 2009. V. 253. P. 977. https://doi.org/10.1016/j.ccr.2008.07.004
Kasuga N.C., Sekino K., Ishikawa M. et al. // J. Inorg. Biochem. 2003. V. 96. P. 298.https://doi.org/10.1016/S0162-0134(03)00156-9
Rodrıguez-Arguelles M.C., Touron-Touceda P., Cao R. et al. // J. Inorg. Biochem., 2009. V. 103. P. 35.
Chandra S., Gupta L.K. // Spectrochim. Acta. Part A. 2005. V. 62. P. 1089. https://doi.org/10.1016/j.saa.2005.04.005
Bhasin H., Bhatt V. // J. of Chemistry and Chemical Sciences. 2018. V. 8. P. 595.
Ewelina N., Marta S., Magdalena M. et al. // Current Medicinal Chemistry. 2019. V. 26. № 4. P. 664. https://doi.org/10.2174/0929867325666180228164656
Gholivand M.B., Niroomandi P., Yari A. et al. // Anal. Chim. Acta. 2005. V. 538. P. 225. https://doi.org/10.1016/j.aca.2005.01.059
Echegoyen Y., Suelves I., Lazaro M.J. et al. // Appl. Cat. A. 2007. V. 333. P. 229. https://doi.org/10.1016/j.apcata.2007.09.012
Brindha G., Vijayanthimala R. // J. Chem. Pharm. Res. 2015. V. 7. P. 225.
Chandra S., Raizada S., Verma R. // J. chem. and pharm. res. 2012. V. 4. P. 1612.
Shikha Parmar S., Kumar Y. // Chem. Pharm. Bull. 2009. V. 57. № 6. P. 603.
Сергиенко В.С., Кокшарова Т.В., Суражская М.Д. и др. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 26. https://doi.org/10.7868/S0044457X18010038
Садиков Г.Г., Анцышкина А.С., Кокшарова Т.В. и др. // Кристаллография. 2012. Т. 57. № 4. С. 597.
Анцышкина А.С., Садиков Г.Г., Кокшарова Т.В. и др. // Журн. неорган. химии. 2012. Т. 57. № 4. С. 570.
Анцышкина А.С., Садиков Г.Г., Кокшарова Т.В. и др. // Там же. 2012. Т. 57. № 2. С. 210.
Chattopadhyay S.K., Seth S., Thomas C. W. Mak. // J. of Coordination Chemistry. 2002. V. 55. P. 259. https://doi.org/10.1080/00958970211894
Нуралиева Г.А., Пиримова М.А. // Universum: Химия и биология : электрон. научн. журн. 2020. № 2(68). URL: http://7universum.com/ru/nature/archive/item/8758.
Самадов А.С., Миронов И.В., Горичев И.Г., Степнова А.Ф. // Журн. неорган. химии. 2020. Т. 65. № 7. С. 995.https://doi.org/10.31857/S0044457X2007017X
Хартли Ф., Бергес К., Олкок Р. Равновесия в растворах / М.: Мир, 1983. 365 с.
Mironov I.V., Kal’nyi D.B., Kokovkin V.V. // J. Solution Chem. 2017. V. 46. P. 989. https://doi.org/10.1007/s10953-017-0616-9
Mironov I.V., Tsvelodub L.D. // Journal of Solution Chemistry. 1996. V. 25. P. 315. https://doi.org/10.1007/BF00972529
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


