Физика и химия стекла, 2019, T. 45, № 5, стр. 425-431
Электронные спектры ионов Er(III) в натриевоборатных расплавах
А. А. Хохряков 1, 2, *, А. С. Пайвин 1, М. А. Самойлова 1, В. В. Рябов 1
1 ИМЕТ УрО РАН
620014 Екатеринбург, ул. Амундсена, 101, Россия
2 ФГАУ ВО УрФУ им Б.Н. Ельцина
620002 Екатеринбург, ул. Мира 19, Россия
* E-mail: 9221717036@mail.ru
Поступила в редакцию 08.08.18
После доработки 05.02.19
Принята к публикации 06.06.19
Аннотация
В работе представлены результаты спектральных исследований расплавов xNa2O · (100 – x)B2O3 · Er2O3 (x = 0–45) при 1273 К. С увеличением концентрации Na2O в расплавах наблюдаются циклические изменения координационных чисел атомов бора. Показано, что координационные числа ионов Er(III) увеличиваются с 6 до 8 в интервале от 0 до 12 мол. % Na2O.
ВВЕДЕНИЕ
Боратные расплавы, содержащие ионы Er(III) являются основой для синтеза специальных стекол, флюсов и других функциональных материалов. Физико-химические свойства этих расплавов зависят от межчастичных взаимодействий, которые формируют структурные единицы расплавов. В настоящей работе методом электронной спектроскопии исследована координационная структура расплавов xNa2O · (100 – x)B2O3 · Er2O3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах использовали Er2O3, B2O3 и Na2O марки “о. с. ч.”. Оксид европия предварительно механоактивировали в течение 3 мин в планетарном активаторе АГО-2С. Перемешивание смесей проводили в центробежной мельнице “FRITISCH” в течении 5 мин. Смеси сплавляли в платиновом тигле при температуре 1700 К в течении 2 ч и выливали на медную плиту. Стеклообразные образцы массой 3.5 г загружали в платинородиевый контейнер с внутренним диаметром 20 мм. На дно контейнера помещали платинородиевое зеркало. Контейнер устанавливали в печь, где создавали вакуум до 1 Па в течении 0.5 ч с последующим нагреванием до температуры плавления. Печь-ячейку заполняли гелием. Регистрацию спектров производили на спектрально-аналитическом комплексе [1]. Все эксперименты проводили при температуре 1273 К. Концентрация оксида эрбия в расплавах составляла 0.184 мол. %. Концентрация оксида натрия варьировалась от 0 до 45 мол. %. Составы расплавов по синтезу xNa2O · (100 – x)B2O3 представлены в табл. 1.
Таблица 1.
Составы экспериментальных расплавов xNa2O · (100 – x)B2O3
| № | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| [Na2O] | 4 | 6 | 8.7 | 12 | 18 | 21 | 22.7 | 27 | 30 | 35 | 40 | 45 |
| [B2O3] | 95 | 93 | 90.3 | 87 | 91 | 78 | 76.3 | 72 | 69 | 64 | 59 | 54 |
Методами колебательной спектроскопии было установлено [2, 3], что борокислородная сетка расплава B2O3 состоит из бороксольных колец B3O6 и неупорядоченных тригональных единиц BO3, не участвующих в образовании кольцевых структур. Соотношение между тригональными единицами и бороксольными кольцами зависит от температуры расплава. При температуре 1273 К доля бороксольных колец по данным [3] составила примерно 30%.
Введение оксида натрия в В2О3 вызывает изменение координационных чисел атомов бора с 3 до 4 [2–5]. В электронных спектрах расплава Na2O–B2O3 в ближней УФ-области выделяется широкая ассиметричная полоса поглощения (рис. 1), которая разлагается на две гауссовские кривые. Расплавленный B2O3 в этой спектральной области собственных полос поглощения не имеет. Наблюдаемые переходы
были отнесены к переносу заряда с молекулярных орбиталей борокислородных групп, содержащих
ВIV, на s-уровни ионов натрия (IV-координационное число атомов бора). Сетка натриевоборатных
расплавов, состоящая из базовых единиц ВØ3 и  представлена моделью из мостиковых цепочек и немостиковых связей кислорода с бором:
ВIV–O–BIV, BIV–O–BIII, BØ2O–, BIII–O–BIII. Наиболее высокоэнергетическая орбиталь принадлежит мостиковой связи BIV–O–BIV. Полосы поглощения на рис. 1 представляют собой электронные переходы с орбитали О2рπ на s-уровни ионов натрия. Энергетические состояния s-уровней зависят от положения ионов натрия в борокислородной сетке расплава. В области
составов 0 < x < 8 ионы натрия занимают катионные вакансии в борокислородной сетке расплава. Электростатические
поля лигандов, связанные с двумя координационными состояниями иона натрия формируют
две зоны, которые приводят к двум полосам переноса заряда. На рис. 2 показано положение полос поглощения бинарных боратных расплавов в зависимости от
содержания оксида натрия. Из рисунка видно, что центры тяжести полос поглощения испытывают
сдвиг в сторону высоких волновых чисел. Этот сдвиг обратнопропорционален длине связи
Na–O. Все оксидные лиганды ионов натрия принадлежат мостиковым структурам BIV–O–BIV и BIII–O–BIII.
представлена моделью из мостиковых цепочек и немостиковых связей кислорода с бором:
ВIV–O–BIV, BIV–O–BIII, BØ2O–, BIII–O–BIII. Наиболее высокоэнергетическая орбиталь принадлежит мостиковой связи BIV–O–BIV. Полосы поглощения на рис. 1 представляют собой электронные переходы с орбитали О2рπ на s-уровни ионов натрия. Энергетические состояния s-уровней зависят от положения ионов натрия в борокислородной сетке расплава. В области
составов 0 < x < 8 ионы натрия занимают катионные вакансии в борокислородной сетке расплава. Электростатические
поля лигандов, связанные с двумя координационными состояниями иона натрия формируют
две зоны, которые приводят к двум полосам переноса заряда. На рис. 2 показано положение полос поглощения бинарных боратных расплавов в зависимости от
содержания оксида натрия. Из рисунка видно, что центры тяжести полос поглощения испытывают
сдвиг в сторону высоких волновых чисел. Этот сдвиг обратнопропорционален длине связи
Na–O. Все оксидные лиганды ионов натрия принадлежат мостиковым структурам BIV–O–BIV и BIII–O–BIII.
Рис. 2.
Положения полос поглощения расплава xNa2O · (100 – x)B2O3 в зависимости от концентрации Na2O.

Увеличение содержания оксида натрия свыше 8 мол. % приводит к снижению концентрации
группировок  в расплаве и к снижению содержания мостиковых связей BIV–O–BIV. Наблюдаемый сдвиг полос переноса заряда О2рπ → Na3s в область более низких волновых чисел (рис. 2) связан с увеличением координационных характеристик ионов натрия. Детальный анализ
спектральных и координационных характеристик расплава Na2O–B2O3 рассмотрен в [6].
в расплаве и к снижению содержания мостиковых связей BIV–O–BIV. Наблюдаемый сдвиг полос переноса заряда О2рπ → Na3s в область более низких волновых чисел (рис. 2) связан с увеличением координационных характеристик ионов натрия. Детальный анализ
спектральных и координационных характеристик расплава Na2O–B2O3 рассмотрен в [6].
Электронный спектр расплава xNa2O · (100 – x)B2O3, активированный ионом Er(III), показан на рис. 3, а значения максимумов приведены в табл. 2. Выделяются узкие полосы внутри конфигурационных f–f переходов ионов Er(III) с основного состояния 4I15/2 на уровни возбужденных состояний. В ближней УФ-области присутствуют широкие интенсивные полосы электронных переходов матрицы расплава О2рπ → Na3s [6].
Рис. 3.
Электронный спектр поглощения расплавленной системы xNa2O · (100 – x)B2O3 · Er2O3, 1273 K, [Na2O] = 6 мол. %.

Таблица 2.
Полосы поглощения расплава xNa2O · (100 – x)B2O3 · Er2O3
| 4I13/2 4I11/2 4F9/2 |
6550, 7118 10 472 15 352 |
| 2H11/2 | 19 048, 19 260 |
| 4F7/2 4F5/2 4F3/2 4F9/2 |
20 165 22 008 23 500 24 582 |
| 4G11/2 | 26 160, 26 609 |
| 4G9/2 | 27 545 |
На рис.4 приведены интегральные интенсивности полос поглощения О2рπ → Na3s в зависимости от состава расплавов xNa2O · (100 – x)B2O3 · Er2O3. В интервале 0 < х < 6 оба катиона модификатора (натрий и эрбий) выступают компенсаторами зарядов группировок
 При 6 < х < 15, также как и в бинарном расплаве xNa2O · (100 – x)B2O3 происходит снижение концентраций полиэдров
При 6 < х < 15, также как и в бинарном расплаве xNa2O · (100 – x)B2O3 происходит снижение концентраций полиэдров 
Рис. 4.
Интегральные нтенсивности полос межзонного перехода О2рπ → Na3s в зависимости от концентрации Na2O в расплаве xNa2O · (100 – x)B2O3 · Er2O3.

Снижение количества полиэдров наблюдается в области 25 мол. % Na2O [7]. В [7] уменьшение количества тетраэдров  в этой области было объяснено реакцией диспропорционирования:
в этой области было объяснено реакцией диспропорционирования:
(1)
${{\left( {{\text{B}}{{{\text{O}}}_{{4/2}}}} \right)}^{--}} \leftrightarrow {\text{B}}{{{\text{O}}}_{{{\text{2/2}}}}}{{{\text{O}}}^{--}}.$Область трансформации кольцевых полиборатных групп, в состав которых входят полиэдры
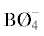 зависит как от температуры, так и от концентрации оксида натрия [8, 9]. По-видимому, эти процессы идут и в малощелочной области расплава (0 < х < 15), то есть в области некольцевых структурных единиц.
зависит как от температуры, так и от концентрации оксида натрия [8, 9]. По-видимому, эти процессы идут и в малощелочной области расплава (0 < х < 15), то есть в области некольцевых структурных единиц.
Резкое снижение интенсивности полосы поглощения О2рπ → Na3s в расплаве Na2O–B2O3–Er2O3 в области 35 мол. % Na2O не наблюдалось в расплаве xNa2O · (100 – ‒ x)B2O3. Увеличение концентрации оксида натрия в присутствии оксида эрбия приводит к изменению
равновесия между надструктурными единицами расплава (триборатные, диборатные кольца)
[8] и их трансформации в метаборатные кольцевые группировки [5]. Это снижает концентрацию полиэдров  В результате реакции диспропорционирования (1) освобождающиеся оксидные ионы увеличивают
координационное состояние ионов натрия. Координационная сфера трехвалентных ионов
эрбия при концентрациях свыше 15 мол. % заполнена максимально.
В результате реакции диспропорционирования (1) освобождающиеся оксидные ионы увеличивают
координационное состояние ионов натрия. Координационная сфера трехвалентных ионов
эрбия при концентрациях свыше 15 мол. % заполнена максимально.
Редкоземельные ионы имеют частично заполненную 4f-оболочку, экранированную заполненными 5s2 и 5р6 оболочками. Экранирующее влияние наружных оболочек приводит к слабому взаимодействию внутриконфигурационных переходов с борокислородной сеткой расплавов. Вследствие этого сдвиги f-f переходов при изменении состава расплава незначительны. Следует отметить, что f-f переходы запрещены по правилу Лапорта (переходы с одинаковой четностью и между состояниями с разной мультиплетностью). На рис. 3 наблюдаются интенсивные полосы поглощения, наиболее значительные из них – гиперчувствительные: 4G11/2 ← 4I15/2 и 2H11/2 ← 4I15/2 (рис. 3, табл. 2). Основные причины нарушений правил отбора в расплавах: высокотемпературные флуктуации зарядовой плотности, сильный ангармонизм колебаний, асимметрия комплексов ионов Er(III). Асимметрия комплексов связана с тем, что оксидные лиганды входят в состав разных фрагментов сетки расплава: BIV–O–BIV, BIV–O–BIII и BØ2O–. Для ионов Er(III) с нечетным числом электронов (f 11) количество подуровней мультиплета различно для кубического и некубического окружения [10]. Выделить необходимое количество линий в спектре Er(III) невозможно из-за сильного фононного вклада в контуры полос поглощения.
Наиболее чувствительными к окружению являются интенсивности гиперчувствительных переходов. Это позволяет использовать их для корреляционных оценок положения ионов Er(III) в расплавах. В [11] было установлено, что изменение интенсивности гиперчувствительных переходов, обусловленных изменением координационных чисел, происходит в ограниченном концентрационном интервале в пределах 0–10 мол. % Na2O. Эти изменения демонстрируют изовалентный изоморфизм ионов РЗЭ. Замена одного иона другим ионом РЗЭ при полном соответствии состава расплавленной матрицы приводит к образованию группировок одного типа: ReO6 и ReO8 (Re = Pr, Nd, Еu) [11]. Из рис. 5, кривая 1 следует, что в интервале 0–12 мол. % Na2O изменение интенсивности перехода 4I15/2 → 2H11/2 почти полностью совпадает с изменениями интенсивности гиперчувствительных переходов легких РЗЭ [6]. Максимальная интенсивность полос поглощения ионов Er(III) наблюдается вблизи 6–8 мол. % Na2O. Увеличение интенсивности в интервале 0 < x < 6 связано с увеличением симметрии группировок ErO6, а снижение с увеличением его координационного числа и значительной деформации группировок ErO8. При х > 12 интенсивности гиперчувствительных переходов претерпевают изменения, которые не связаны с изменением их координационных чисел, а связаны с изменением степени основности кислородов мостиковых BIV–O–BIV, BIV–O–BIII и немостиковых связей BØ2O–. Это подтверждается изменением интенсивности обычных электронных переходов, которые происходят в интервале от 0 до 12 мол. % (рис. 5, кривая 2). Интенсивность этого перехода 4I15/2 → 4F9/2 уменьшается с повышением симметрии группировок ErO6 и повышаются с их понижением от 6 < х < 12. При дальнейшем увеличении содержания Na2O в расплавах интенсивность перехода 4I15/2 → 4F9/2 выходит практически на постоянное значение, указывая на отсутствие изменений координационных чисел ионов Er(III) (рис. 5, кривая 3). Стоит отметить, что максимальное поглощение гиперчувствительных полос ионов Er(III) приходится на максимальные концентрации фрагментов BIV–O–BIV (рис. 4 и 5) в расплавах.
Рис. 5.
Интегральная интенсивность гиперчувствительного перехода: (1) 4I15/2 → 2H11/2 и интенсивность не гиперчувствительного перехода: (2) 4I15/2 → 4F9/2 на волновом числе ν = 15 350 cм–1, при различных составах расплава xNa2O · (100 – x)B2O3 · Er2O3.

ЗАКЛЮЧЕНИЕ
Методом электронной спектроскопии показано, что в расплавах xNa2O · (100 – ‒ x)B2O3 · Er2O3 координационное число Er(III) увеличивается с 6 до 8 в интервале 0 < < x < 12. При х > 12 наблюдается два минимума, связанных со снижением концентраций кольцевых групп,
содержащих  и трансформацией их в метаборатные группы, содержащие немостиковый кислород. Сделано
предположение, что снижение концентрации полиэдров
и трансформацией их в метаборатные группы, содержащие немостиковый кислород. Сделано
предположение, что снижение концентрации полиэдров 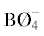 в малощелочной области связано с преобразованием некольцевых группировок с мостиковыми
связями BIV–O–BIV в некольцевые группировки, содержащие немостиковый кислород.
в малощелочной области связано с преобразованием некольцевых группировок с мостиковыми
связями BIV–O–BIV в некольцевые группировки, содержащие немостиковый кислород.
Работа выполнена в рамках исполнения государственного задания ИМЕТ УрО РАН и комплексной программы УрО РАН № 18-10-3-28 с использованием оборудования ЦКП “Урал-М”.
Список литературы
Хохряков А.А., Пайвин А.С., Норицын С.И. Спектрально-аналитический комплекс для регистрации электронных спектров высокотемпературных расплавов и границы его применимости // Расплавы. 2014. Т. 1. С. 62–70.
Krough-Moe J. The structure of vitreous and liquid boron oxide // J. non-cryst solids. 1969. V. 1. P. 269–284.
Walrafen G.E., Krishnau G.E., Walrafen S.R., Samanta P.N. Raman investigation of vitreous and molten boric oxide // J. Chem. Phys.1980. V. 72. P.113–120.
Бобович Я.С. Спектроскопическое проявление координационных переходов бора в некоторых стеклообразных системах // Оптика и спектроскопия. 1963. Т. XV. № 6. С. 759–765.
Осипов А.А., Осипова Л.М., Быков В.Н. Спектроскопия и структура щелочноборатных стекол и расплавов. Екатеринбург – Миасс: УрО РАН, 2009. 174 с.
Хохряков А.А., Вершинин А.О., Пайвин А.С., Истомин С.А. Электронные спектры расплавленных смесей xNa2O–(100 – x)B2O3 и xNa2O–(100 – x)B2O3–Re2O3 (Re = Pr, Nd) // Расплавы. 2018. № 2. С. 53–59.
Yano T., Kunimine N., Shibata S., Yumane M. Structural investigation of sodium borate glasses and melts by Raman spectroscopy. II. Conversion between BO4 and BO2O– units at high temperature // J. Non-Crystalline Solids. 2003. V. 321. P. 147–156.
Райт А., Синклер Р., Гримли Д., Хюльме Р., Ведищева Н.М., Шахматкин Б.А., Хэннон А., Фуллер С., Мейер Б., Ройль М., Вилкурсон Д. Боратные стекла, надструктурные группы и теория беспорядочной сетки // Физика и химия стекла. 2006. Т. 22. № 4. С. 364–383.
Sen S. Temperature induced structure changes and transport mechanisms in borate, borosilicate and boraluminate liquids: high-resolution and high temperature NMR results // J. Non-Crystalline Solids. 2009. V. 253. P. 84–93.
Барбанель Ю.А. Координационная химия f-элементов в расплавах // Москва: Энергоатомиздат. 1986. С. 220.
Хохряков А.А., Вершинин А.О., Пайвин А.С., Истомин С.А. Электронные спектры расплавленных смесей xNa2O–(100 – x)B2O3 и xNa2O–(100 – x)B2O3–Re2O3 (Re = Sm, Eu) // Расплавы. 2017. № 6. С. 538–549.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла



