Физика и химия стекла, 2020, T. 46, № 1, стр. 99-107
Разработка и исследование электроактивной пасты электрода псевдоконденсатора на основе MnO2
А. Г. Иванова 1, *, Л. В. Карасев 2, М. С. Масалович 1, 2, О. А. Загребельный 1, С. В. Мякин 2, Н. Н. Сапрыкина 3, А. Е. Баранчиков 4, И. Ю. Кручинина 1, 5, О. А. Шилова 1, 2, 5
1 Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
2 Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский просп., д. 26, Россия
3 Институт высокомолекулярных соединений РАН
199034 Санкт-Петербург, В. О. Большой пр., 31, Россия
4 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр., 31, Россия
5 Санкт-Петербургский государственный электротехнический университет “ЛЭТИ”
197376 Санкт-Петербург, ул. Проф. Попова, 5, Россия
* E-mail: agp-13@inbox.ru
Поступила в редакцию 27.11.18
После доработки 26.08.19
Принята к публикации 08.10.19
Аннотация
Получен электроактивный материал электрода псевдоконденсатора на основе высокодисперсных порошков MnO2 и его композитов. Исследованы состав и морфология поверхности этих материалов. Определены условия изготовления электроактивной пасты из синтезированных порошков. Разработаны технологические приемы изготовления электродов псевдоконденсатора, состоящих из электроактивной пасты, нанесенной на проводящую подложку (стальная сетка). Проведены электрохимические испытания разработанных электродов в электрохимической ячейке с использованием метода циклической вольтамперометрии.
ВВЕДЕНИЕ
Псевдоконденсаторы (ПК) – это электрохимические устройства, которые запасают свою энергию, в основном, за счет быстрых обратимых окиcлительно-восстановительных реакций, протекающих на границе раздела электрод/электролит [1]. Такие быстрые обратимые реакции возможны благодаря наличию в составе электрода ПК электроактивного материала (ЭМ). Преимущественно к ним относятся материалы, состоящие из оксидов переходных металлов (MnO2, Co2O3, Ni2O3, Fe2O3 и т.д.) и/или проводящих полимеров (политиофен, полианилин, полипиррол и др.). Среди перечисленных ЭМ, оксид марганца(IV), является достаточно перспективным материалом [2]. Он имеет хорошие электрохимические характеристики (широкое потенциальное окно – до 0.9 В в водном электролите, высокую скорость заряда–разряда), является дешевым материалом, технология получения которого достаточно проста и эффективна. Расчетное значение удельной емкости для MnO2 составляет 1380 Ф/г [3], которое на сегодняшний момент не достигнуто. Поскольку существенным недостатком MnO2 является низкая электронная проводимость 10−5–10−6 См/см, что ограничивает его практическое применение [4].
В связи с этим можно выделить несколько путей усиления эффективности передачи электронов от/к MnO2 к/от проводящей подложке. Первый путь – получение диоксида марганца электролитическим способом осаждения на проводящую подложку [5, 6]. В результате диоксид марганца покрывает тонким слоем (толщиной до 300 нм) проводящую подложку. Второй путь – синтез диоксида марганца химическим осаждением с образованием порошкообразного MnO2 и изготовление из него гомогенизированной электроактивной пасты (ЭП). Помимо диоксида марганца паста содержит диоксид марганца, углерод-электропроводящий компонент, фторопласт-связующее и органический растворитель, который необходим для придания пастообразной консистенции [7]. Третий путь – разработка ЭМ композитного cостава “MnO2@C”. Получить его можно в процессе синтеза диоксида марганца в результате добавления проводящего углерода к прекурсору диоксида марганца [8, 9]. Затем, из этого композита изготавливают электроактивную пасту без добавления электропроводящей компоненты.
В настоящее время известно, что эффективность работы электрода ПК существенно зависит от условий и способа синтеза MnO2, “MnO2@C”, аллотропной модификации углерода, а также от технологии изготовления и массовой загрузки электроактивной пасты на электропроводящую подложку [10]. Электроды, имеющие тонкопленочное покрытие из диоксида марганца, как правило, полученное электроосаждением, имеют значение удельной емкости до 1000 Ф/г, тогда как для электродов с толстопленочными покрытиями значение удельной емкости изменяется в пределах 100–250 Ф/г [11–13]. Толщина электроактивного покрытия коррелируется с величиной массовой загрузки ЭМ на проводящую подложку. Удельная емкость электродов с покрытием из ЭП варьирует от 100 до 350 Ф/г в зависимости от методов синтеза ЭМ и способов изготовления ЭП из него. Так, Редди и др. [14] получили MnO2, используя золь–гель технологию, и приготовленa ЭП с добавлением 23 мас. % сажи и 9 мас. % политетрафторэтилена. ЭП была нанесена на титановую пластинку. Максимальная удельная емкость разработанного электрода составила 138 Ф/г в 1М растворе NaCl при скорости развертки напряжения 5 мВ/с. Авторы [15] получили с помощью гидротермального синтеза MnO2 в виде полых сфер. Электроды представляли собой спрессованную пеноникеливую подложку с покрытием из ЭП, содержащей 80 мас. % MnO2, 15 мас. % ацетиленовой сажи и 5 мас. % политетрафторэтилена. Измерение электродов в гальваностатическом режиме показало наибольшее значение удельной емкости в пределах 167 Ф/г в 1 М растворе Na2SO4. Значение удельной емкости ЭП с ЭМ композитного состава “MnO2@C” зависит в первую очередь от природы углеродного материала. Так, электроды с ЭП в состав которых входит композит – диоксид марганца@нанотрубки углерода, имеют значение удельной емкости до 300 Ф/г, в отличие от электродов с ЭП, имеющей в своем составе композит – диоксид марганца@графен, их значение удельной емкости изменяется в пределах 300–400 Ф/г [16–19]. Необходимо отметить, что электрохимическая стабильность электродов ПК прежде всего зависит от состава ЭМ и увеличивается в ряду электродов с ЭМ: MnO2–ЭП на основе MnO2–ЭП на основе композита с MnO2@C.
Целью настоящей работы является синтез нового ЭМ (“MnO2@C-157М” и “MnO2@C–сажа”) и исследование влияния его состава, и технологии изготовления ЭП из ЭМ на электрическую емкость и электрохимическую стабильность электрода модельного ПК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
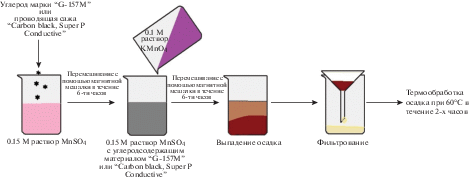
ЭМ был получен жидкофазным методом синтеза – химическим осаждением. На рис. 1 представлена краткая схема получения композитов “MnO2@C-157М” и “MnO2@C–cажа”, где С-157 – мезопористый углеродный материал марки “G-157М”, 98.5 мас. %, изготовитель “НаноТехЦентр”, г. Тамбов и C–сажа – проводящая сажа “Carbon black, Super P Conductive”, 99 мас. %, изготовитель Alfa Aesar. Углерод добавлялся расчета, что в композите на диоксид марганца должно приходиться 75 мас. %, а на углерод – 25 мас. %. Маркировка композитов обозначена по типу углеродсодержащего материала. Аналогичным способом был получен MnO2, за исключением первой стадии синтеза – добавление углеродсодержащего материала. Моногидрат сульфата марганца(II) и перманганат калия необходимые для получения диоксида марганца имели квалификацию “х. ч.”.
Исследование состава и морфологии поверхности диоксида марганца и его композитов осуществляли с помощью рентгенофазового анализа (РФА, на приборе D8 ADVANCE, счетчик – Vantec), ИК – спектроскопии (ИК – Фурье спектрометр ФСМ 2202) и метода растровой электронной микроскопии (СЭМ NVision 40-38-5011, IVS Supra 55VP-324922 (ИВС РАН) и TESCAN VEGA 3 SBH33).
ЭП на основе MnO2 получали смешиванием порошков MnO2 (75 мас. %), проводящей сажи (20 мас. %) и фторопласта – поливинилиденфторида (5 мас. %) с добавлением 2-3-х капель этанола или 1-метил-2-пирролидона (1-М-2-ВП). Пасту гомогенизировали с помощью ультразвуковой обработки (УЗО, ультразвуковой диспергатор УЗДН-2Т) при частоте 22 КГц в течение 10, 20, 30, 60 и 120 мин. ЭП на основе композитов получали аналогичным образом, с добавлением к композиту (75 мас. %) проводящей сажи (20 мас. %) и фторопласта (5 мас. %), а также без добавления этой сажи. Если сажа не добавлялась, то на композит приходилось 95 мас. %. Помимо этого, несколько образцов ЭП на основе композитов не гомогенизировали с помощью ультразвуковой обработки.
Разработанные электроды представляют собой стальную сетку – подложку, на которую лакокрасочным способом наносили ЭП в отсутствие или при наличии дополнительной обработки, в качестве которой применяли сушку при 60°С, горячее или холодное прессование электродов. Электроды обозначили в соответствии с их составом: “MnO2–ЭП–стальная сетка”, “MnO2@C-157М–ЭП–стальная сетка” и “MnO2@C–сажа–ЭП–стальная сетка”.
Исследование функционального состава поверхности электрода “MnO2–ЭП–стальная сетка” осуществляли с помощью метода адсорбции кислотно-основных индикаторов [20, 21]. Электрохимические исследования всех электродов ПК проводили в трехэлектродной ячейке, в 1М растворе KNO3 с использованием метода с использованием метода циклической вольтамперометрии (потенциостат-гальваностат P-30J). В качестве электрода сравнения использовалась серебряная проволока, платиновая сетка использовалась как вспомогательный электрод.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ ИК-спектров полученных порошков подтвердил наличие оксида марганца(IV) по характеристической полосе поглощения, отражающей колебание связи Mn–O в области 600 см–1 [22]. Интересно отметить, что углерод марки “G-157М” и проводящая сажа “Carbon black, Super P Conductive” на ИК-спектрах, в области 500–4500 см–1 имеет полное поглощение без характерных полос, отражающих колебание связи С–С, С–Н и С–О. Подобный ИК-спектр характерен также для графита и графена при условии, что все их атомы находятся в sp2-гибридизации [23].
Диоксид марганца в исследуемых порошках “MnO2”, “MnO2@C-157М” и “MnO2@C–сажа” является рентгеноаморфным.
На рис. 2а–в представлено изображение порошкового материала на основе диоксида марганца и его композитов. Как видно из рис. 2б, в композиты “MnO2@C-157М” и “MnO2@C–сажа” имеют более упорядоченную структуру, с минимальным количеством агломератов по сравнению с MnO2.
Рис. 2.
СЭМ-изображение поверхности порошков: MnO2 (а), “MnO2@C-157М” (б), “MnO2@C–сажа” (в). Бар-линия – 1 мкм.

Помимо этого, рис. 2в отражает наиболее высокодисперсное состояние композитного порошка (до 0.5 мкм).
Полученные высокодисперсные порошки на основе MnO2 и его композитов “MnO2@C-157М” и “MnO2@C–сажа” были использованы для приготовления ЭП, которые затем наносились на проводящую подложку.
Варьирование условий изготовления электродов ПК рассматривалось на примере электрода “MnO2–ЭП–стальная сетка”. Было выявлено, что значение удельной емкости электрода “MnO2–ЭП–стальная сетка” повышается с 30 Ф/г до 150 Ф/г при следующих условиях его изготовления:
1. Использование в качестве растворителя 1-М-2-ВП взамен этилового спирта;
2. УЗО воздействие в течение 30 мин.
Как видно на рис. 3а, б УЗО ЭП способствует более равномерному распределению ее компонентов. Помимо этого, методом адсорбции кислотно-основных индикаторов с различными значениями величины константы кислотности (рКа) изучены особенности функционального состава поверхности полученной композитной пасты электрода “MnO2–ЭП–стальная сетка” под влиянием УЗО. Установлена корреляционная зависимость между функциональным составом поверхности электрода и значением его удельной емкости. Выявлено, что УЗО ЭП в течение 30 мин способствует снижению содержания льюисовских кислотных центров – ЛКЦ (атомы или ионы элемента, образующего оксид) и бренстедовских кислотных центров – БКЦ (гидроксильные группы кислотного характера). При этом увеличивается содержание активных центров по основному льюисовскому типу (атомы или ионы кислорода) и основному бренстедовскому типу (гидроксильные группы основного характера). В результате повышается значение удельной емкости электрода “MnO2–ЭП–стальная сетка” с 30 Ф/г (без УЗО) до 70 Ф/г (с УЗО). Тогда как при увеличении длительности УЗО до 120 мин, наблюдается снижение значения удельной емкости электрода “MnO2–ЭП–стальная сетка” до 20 Ф/г. Анализ функциональной поверхности этого электрода выявил прямо противоположный результат – примерно 10-ти кратное увеличение содержания ЛКЦ в сочетании с 2-х кратным увеличением содержания БКЦ и снижением содержания бренстедовских и льюисовских основных центров;
Рис. 3.
СЭМ-изображение состояния поверхности: электрода “MnO2–ЭП–стальная сетка”, ЭП которого изготовлена под воздействием УЗ (10 мин) (а); электрода “MnO2–ЭП–стальная сетка”, ЭП которого изготовлена под воздействием УЗ (30 мин) (б). Агломераты до 500 мкм – диоксид марганца, широкие тяжи – фторопласт.

3. Температурная обработка электрода при 60°С в течение 1 ч, после нанесения ЭП на проводящую подложку;
4. Холодное прессование электрода при комнатной температуре в течение 1 мин и нагрузки 0.3 т;
5. Массовая загрузка ЭП на подложку 0.5–1 мг.
При изготовлении электродов с ЭП в состав, которой входят композитные порошки, были выбраны оптимальные условия изготовления электрода “MnO2–ЭП–стальная сетка”. При этом для сравнения было изготовлено несколько образцов ЭП с композитами “MnO2@C-157М” и “MnO2@C–сажа”, которые были получены или без ее ультразвуковой гомогенизации, или без дополнительного добавления проводящей сажи (табл. 1).
Таблица 1.
Условия изготовления электродов ПК и их удельная емкость
| Название электрода | Условия изготовления электрода ПК | Значение удельной емкости (С/m)*, Ф/г при разной скорости развертки напряжения, мВ/с | |||
|---|---|---|---|---|---|
| 10 | 30 | ||||
| проводящая сажа – “C–сажа” 20 мас. % |
УЗО 30 мин |
без УЗО |
|||
| “MnO2 –ЭП–стальная сетка” | + | + | 145 | 130 | |
| “MnO2@C-157М –ЭП–стальная сетка” | + | + | 60 | 20 | |
| “MnO2@C-157М –ЭП–стальная сетка” | + | 10 | 1 | ||
| “MnO2@C-157М –ЭП–стальная сетка” | + | 5 | 0.5 | ||
| “MnO2@C–сажа–ЭП–стальная сетка” | + | + | 80 | 65 | |
| “MnO2@C–сажа–ЭП–стальная сетка” | + | 120 | 105 | ||
| “MnO2@C–сажа–ЭП–стальная сетка” | + | 175 | 160 | ||
Как видно из табл. 1, электрод “MnO2@C-157М–ЭП–стальная сетка” обладает наибольшим значением удельной емкости при добавлении в ЭП проводящей сажи, которая увеличивает его электроактивность.
Для электрода “MnO2@C–сажа–ЭП–стальная сетка” наиболее благоприятными условиями его изготовления являются: отсутствие дополнительной добавки в ЭП проводящей сажи и отсутствие УЗО обработки в течение 30 мин. По-видимому, избыток проводящей сажи не способствует усилению передачи электронов от/к диоксиду марганца, а интенсивная УЗО обработка, вероятно, разрушает сам композит MnO2@C–сажа, или в силу высокой активности поверхности ЭМ способстует его агрегации. Полученное значение удельной емкости (175 Ф/г) соответствует значению емкости для ЭП с подобными композитными материалами. Так, авторы [24] разработали ЭП, содержащую композит MnO2@C (где диоксид марганца имеет химическую связь с модифицированным углеродом), удельная емкость которой составляет 185 Ф/г в 5М растворе LiNO3.
Необходимо отметить, что с увеличением скорости развертки напряжения, значение удельной емкости у большинства образцов электродов снижается примерно на 15 Ф/г. Это является неплохим показателем электрохимической стабильности электродов, т. к. для большинства электродов других авторов, изготовленных при иных условиях, удельная емкость может снижаться на 30 Ф/г и более [24, 25]. Более того, при циклировании этих электродов (900 циклов, скорость развертки напряжения 100 мВ/с) значения удельной емкости не изменяются, что также подтверждает их высокую электрохимическую стабильность.
ЗАКЛЮЧЕНИЕ
В настоящей работе были получены и исследованы порошки MnO2 и композиты на их основе: “MnO2@C-157М” и “MnO2@C–сажа”. Выявлено, что композитный порошок “MnO2@C–сажа” является наиболее высокодисперсным (до 0.5 мкм).
Определены оптимальные условия изготовления электрода “MnO2–ЭП–стальная сетка” с ЭП на основе диоксида марганца, которые способствуют увеличению значений удельной емкости этого электрода с 30 до 150 Ф/г.
Электрод “MnO2@C–сажа–ЭП–стальная сетка” с ЭП, в состав которой входит композит MnO2@C–сажа, имеет наибольшее значение удельной емкости до 170 Ф/г. Для ЭП этого электрода не требуется дополнительное введение проводящий сажи и 30 мин УЗО в отличие от ЭП электрода “MnO2–ЭП–стальная сетка”.
Разработанные электроды ПК имеют высокую электрохимическую стабильность по сравнению с современными аналогами: значение удельной емкости уменьшается только на 15 Ф/г при повышение скорости развертки напряжения с 10 до 30 мВ/с; при циклировании (до 900 циклов и скорости развертки напряжения 100 мВ/с) значение удельной емкости не изменяется.
Список литературы
Zhang L.L, Zhao X.S. Carbon-based materials as supercapacitor electrodes // Chem. Soc. Rev. 2009. V. 38. P. 2520–2531.
Yan J., Sumboja A., Wang X., Fu C.P. Insights on the Fundamental Capacitive Behavior: A Case Study of MnO2 // Small. 2014. V. 10. P. 3568–3578.
Lv P., Zhang P., Feng Y.Y., Li Y., Feng W. High-performance electrochemical capacitors using electrodeposited MnO2 on carbon nanotube array grown on carbon fabric // Electrochim. Acta. 2012. V. 78. P. 515–523.
Zhu G.Y, He Z., Chen J., Zhao J., Feng X.M., Yanwen M., Quli F., Lianhui W., Wei H. Highly conductive three-dimensional MnO2–carbon nanotube–graphene–Ni hybrid foam as a binder-free supercapacitor electrode // Nanoscale. 2014. V. 6. P. 1079–1085.
Broughton J.N., Brett M.J. Variations in MnO2 electrodeposition for electrochemical capacitors // Electrochimica Acta. 2005. V. 50. P. 4814–4819.
Иванова А.Г., Загребельный О.А., Цигас А.А., Шилова О.А. Синтез и электрофизические свойства нанооксидного слоя псевдоконденсатора // Журн. физ. и хим. стекла. 2012. Т. 38. № 6 (письма в редакцию). С. 433–439.
Subramanian V., Zhu Hongwei, Wie Bingqing. Nanostructured manganese oxides and their composites with carbon nanotubes as electrode materials for energy storage devices // Pure and Applied Chemistry. 2008. Bып. № 11. C. 2327–2343.
Tan D.Z.W., Cheng H., Nguyen S.T., Duong H.M. Controlled synthesis of MnO2/CNT nanocomposites for supercapacitor applications // Materials Technology: Advanced Functional Materials. 2014. V. 29. № A2. P. 107A–113A.
Wang K., Gao S., Du Z., Yuan A., Lu W., Chen L. MnO2-Carbon nanotube composite for high-areal-density supercapacitors with high rate performance // J. Power Sources. 2016. V. 305. P. 30–36.
Wang J.-G., Yang Y., Huang Z.-H., Kang F. Synthesis and electrochemical performance of MnO2/CNTs–embedded carbon nanofibers nanocomposites for supercapacitors // Electrochim. Acta. 2012. V. 75. P. 213–219.
Daniel B., Thierry B., Jerey W.L. Manganese oxides: Battery materials make the leap to electrochemical capacitors // The Electrochem. Soc. Interface Spring. 2008. V. 17. P. 49–52.
Broughton J.N., Brett M.J. Investigation of thin sputtered Mn films for electrochemical capacitors // Electrochim. Acta. 2004. V. 49. P. 4439–4446.
Yang J., Lian L., Ruan H., Xie F., Wei M. Nanostructured porous MnO2 on Ni foam substrate with a high mass loading via a CV electrodeposition route for supercapacitor application // Electrochim. Acta. 2014. V. 136. P. 189–194.
Reddy R.N., Reddy R.G. Sol–gel MnO2 as an electrode material for electrochemical capacitors // J. Power Sources. 2003. V. 124(1). P. 330–337.
Xu M., Kong L., Zhou W., Li H. Hydrothermal Synthesis and Pseudocapacitance Properties of α-MnO2 Hollow Spheres and Hollow Urchins // J. Phys. Chem. 2007. V. 111(51). P. 19141–19147.
Li L., Hu Z.A., An N., Yang Y.Y., Li Z.M., Wu H.Y.J. Facile Synthesis of MnO2/CNTs Composite for Supercapacitor Electrodes with Long Cycle Stability // Phys. Chem. C. 2014. V. 118. № 40. P. 22 865–22 872.
Shi K., Ren M., Zhitomirsky I. Activated Carbon-Coated Carbon Nanotubes for Energy Storage in Supercapacitors and Capacitive Water Purification // ACS Sustainable Chem. Eng. 2014. V. 2. P. 1289–1298.
Feng X., Yan Z., Chen N., Zhang Y., Ma Y., Liu X., Fan Q., Wang L., Huang W. The synthesis of shape-controlled MnO2/graphene composites via a facile one-step hydrothermal method and their application in supercapacitors // J. Mater. Chem. A. 2013. V. 1. P. 12 818–12 825.
Zhao Y., Ran W., He J., Huang Y., Liu Z., Liu W., Tang Y., Zhang L., Gao D., Gao F. High-Performance Asymmetric Supercapacitors Based on Multilayer MnO2/Graphene Oxide Nanoflakes and Hierarchical Porous Carbon with Enhanced Cycling Stability // Small. 2015. V. 11. P. 1310–1319.
Сычев М.М. Кислотно-основные характеристики поверхности твердых тел и управление свойствами материалов и композитов. Санкт-Петербург: Химиздат, 2016. С. 271.
Нечипоренко А.П. Донорно-акцепторные свойства поверхности твердофазных систем. Индикаторный метод. Лань, 2017. 284 с.
Hashem A.M., Abuzeid H.M, Abdel-Latif A.M., Abbas H.M., Ehrenberg H., Indris S., Mauger A., Groult H., Julien C.M. MnO2 Nano-Rods Prepared by Redox Reaction as Cathodes in Lithium Batteries // ECS Transactions. 2013. V. 50. P. 125–130.
Ţucureanu V., Matei A., Avram A.M. FTIR Spectroscopy for Carbon Family Study // Critical Reviews in Analytical Chemistry. 2016. V. 46. № 6. P. 502–520.
Ramirez-Castro C., Crosnier O., Athouel L., Retoux R., Belanger D., Brousse T. Electrochemical Performance of Carbon/MnO2 Nanocomposites Prepared via Molecular Bridging as Supercapacitor Electrode Materials // J. The Electrochemical Society. 2015. V. 162. № 5. P. A5179–A5184.
Shin J., Shin D., Hwang H., Yeo T., Park S., Choi W. One-step transformation of MnO2 into MnO2 –x carbon nanostructures for high-performance supercapacitors using structure-guided combustion waves // J. Mater. Chem. A. 2017. V. 5. P. 13488–13498.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла