Физика и химия стекла, 2020, T. 46, № 1, стр. 90-98
Реакционная способность и эволюция агрегативной устойчивости коллоидного кремнезема
Н. А. Шабанова 1, *, И. А. Белова 1, М. Н. Маркелова 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: nash@muctr.ru
Поступила в редакцию 12.07.19
После доработки 26.09.19
Принята к публикации 08.10.19
Аннотация
Свойства коллоидного кремнезема рассмотрены с учетом реакционной способности кремнезема, кинетики поликонденсации и деполимеризации. Разрыв силоксановых связей при деполимеризации приводит к появлению реакционноспособных групп Si–OH и Si–O–Me+, разрушению структуры кремнезема, образованию гелеобразных слоев на поверхности и в объеме частиц (при высокой щелочности), росту их гидрофильности, растворению кремнезема (предельная деполимеризация). Образование гелеобразных структур сопровождается увеличением гидродинамических радиусов частиц, ростом вязкости агрегативно устойчивых золей, уменьшением их мутности при переходе из кислой в щелочную области, разбавлении золя и введении электролитов. Гидроксиды щелочных металлов влияют на твердофазный процесс деполимеризации соответственно росту основности катионов в ряду K+ > Na+ > Li+. Формирование гелеобразных структур вызывает рост агрегативной устойчивости золя при рН > 5.5−6.0. При достижении рН 9.0−9.5 квазиравновесие скоростей реакций поликонденсации и деполимеризации обеспечивает высокую агрегативную стабильность золя. При дальнейшем увеличении щелочности (рост рН, силикатного модуля) в водной фазе возрастает концентрация продуктов деполимеризации – силикатных анионов, содержащих ионизированные и неионизированные силанольные группы. В этих условиях в ходе “вторичной” поликонденсации в водной среде образуются олиго- и полимерные молекулы кремниевых кислот и на их основе линейные супрамолекулярные (надмолекулярные) структуры, растет вязкость коллоидной системы, образуются гели.
ВВЕДЕНИЕ
В течение многих десятилетий интерес к коллоидному кремнезему постоянно растет в связи с развитием нанотехнологий [1–6]. Многие свойства материалов (механические, электрические, оптические, трибологические) могут быть существенно модифицированы аморфным нанодисперсным кремнеземом [7–9]. В этой связи актуальными остаются вопросы зависимости всех свойств коллоидного кремнезема от реакционной способности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования были выбраны гидрозоли кремнезема марки Людокс (табл. 1). Поверхность частиц золя заряжена отрицательно (при рН > рНиэт ~ 2.2). Людокс AS-40 стабилизирован аммиаком. Противоионы двойного электрического слоя включают ионы аммония и незначительное количество ионов натрия.
Таблица 1.
Характеристика исходных золей
| Гидрозоль | Концентрация SiO2, г/л | Радиус частиц, нм* | рН | Стабилизатор |
|---|---|---|---|---|
| TM-40 | 519.6 | 11.0 | 9.5 | NaOH |
| AS-40 | 532.7 | 8.4 | 9.4 | NH4OH |
| SM-30 | 364.5 | 3.5 | 9.4 | NaOH |
* Радиус частиц определен по методу Сирса [10].
Колориметрический анализ. Для контроля над процессами перехода золя в растворы силикатов использовали метод колориметрического анализа, основанный на реакции взаимодействия кремниевых кислот с гептамолибдатом аммония (ГМА), приводящей к образованию окрашенного β-кремнемолибденового комплекса [11]. Исходный золь (Людокс AS-40) разбавляли до нужной концентрации и добавляли гидроксиды щелочных металлов (марки “х. ч.”) в количествах, необходимых для установления заданного силикатного модуля (М = 3.0 и M = 50.0) при перемешивании. Силикатный модуль (М) рассчитывали как отношение концентраций (моль/моль) [SiO2]/[Me2O], где Ме – катионы K+, Na+, Li+.
Реакционные смеси выдерживали в герметичных полиэтиленовых сосудах при температуре окружающей среды (19−25°С) с периодическим отбором проб для анализа. Добавление растворов щелочных металлов в золи сопровождается образованием агрегатов частиц, которые постепенно самопроизвольно редиспергируются (пептизируют). Пробы для анализа отбирали после осветления золей. Глубокое осветление золей (концентрация 41.0 г/л SiO2, модуль М = 3.0) после введения гидроксида калия наступает примерно за 1.5 ч, гидроксида натрия – 22 ч, гидроксида лития – 40 ч [12]. Для колориметрического анализа пробы отбирали через 60 мин после смешения компонентов. Предварительно получали калибровочную зависимость оптической плотности от концентрации растворенного кремнезема. Измерения оптической плотности проводили на фотоэлектрическом колориметре ФЭК-2МП при длине волны 400 нм. Ошибка в измерении оптической плотности не превышала 0.01 оптической единицы. За 40 мин проведения реакции определяли суммарное содержание “активного” кремнезема – мономера, димеров и той части кремнезема, которая успевает деполимеризоваться за это время [13, 14].
Фотонная корреляционная спектроскопия. Размер частиц золя определяли методом динамического рассеяния света – фотонной корреляционной спектроскопии (ФКС) [2, 3]. В золь Людокс ТМ-40 добавляли навески гидроксидов калия, натрия или лития в количествах, необходимых для достижения необходимого силикатного модуля М = 50. Поток светового излучения обеспечивали He–Ne лазером (19 мВт, 632.8 нм) под углом 90°. Набор автокорреляционной функции в гомодинном режиме проводили на фотонном корреляционном спектрометре PhotoCor Complex (с использованием мультифункционального коррелятора). Исходя из экспериментально определяемой величины характеристического времени автокорреляционной функции, рассчитывали коэффициенты диффузии и гидродинамические радиусы частиц исследуемых золей по уравнению Эйнштейна–Стокса:
где D − коэффициент диффузии, η – вязкость дисперсионной среды, T – температура, kб– константа Больцмана, r –радиус частиц.Золь предварительно обрабатывали Н+-катионитом для удаления катионов натрия и установления рН = 5.2, разбавляли дистиллированной водой для достижения нужных концентраций кремнезема. При перемешивании и комнатной температуре добавляли 0.1 М растворы гидроксидов щелочных металлов для установления силикатного модуля М = 50. Ошибка определения радиуса частиц не превышала 0.3 нм [14].
Вискозиметрия. Для определения вязкости золей использовали капиллярный вискозиметр Уббелоде. Значения рН устанавливали добавлением необходимых количеств гидроксидов щелочных металлов в золи после предварительной обработки в статических условиях Н+-катионитом КУ-2. Кривые течения золей Людокс SM-30 сразу после доведения рН проявляют свойства ньютоновских жидкостей [15]. Для обработки экспериментальных данных использовали уравнение Эйнштейна:
(2)
${\eta } = {{{\eta }}_{0}}(1 + {{a}_{0}}{\varphi })\,\,\,\,{\text{или}}\,\,\,\,{{{\eta }}_{{{\text{уд}}}}} = {{a}_{0}}{\varphi },$Можно учесть увеличение объемной доли дисперсной фазы φ на величину φдоп.:
(3)
${{{\eta }}_{{{\text{уд}}}}} = 2.5({\varphi } + {{{\varphi }}_{{{\text{доп}}{\text{.}}}}}) = 2.5K{\varphi ,}$(4)
$K = \frac{{({\varphi } + {{{\varphi }}_{{{\text{доп}}{\text{.}}}}})}}{{\varphi }} = 1 + \frac{{{{{\varphi }}_{{{\text{доп}}{\text{.}}}}}}}{{\varphi }},$Такой подход позволяет оценить приращения радиусов частиц Δ из уравнения:
Величины a1 определяли по начальным линейным участкам зависимостей удельной вязкости ɳуд от объемной доли твердой фазы φ.
Оптические свойства. Оптическую плотность D золей (Людокс AS-40) измеряли при длине волны 540 нм на фотоэлектроколориметре ФЭК-2МП. Мутность τ рассчитывали по формуле ${\tau } = \frac{{2.3D}}{l},$ где l – толщина кюветы. Ошибка в измерении оптической плотности не превышала 0.01 оптической единицы. Золь предварительно разбавляли. В разбавленные золи добавляли определенные количества HCl (или NaOH) для установления рН. В опытах с электролитами величину рН устанавливали после добавления солей, чтобы исключить дрейф рН в ходе ионообменных процессов. Контроль рН проводили на рН метре марки Hanna рН 213.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
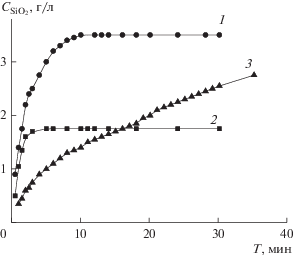
Взаимодействие кремнезема с гидроксидами щелочных металлов приводит к расщеплению силоксановых связей ≡Si–O–Si≡ и образованию ионизированных Si–O– и неионизированных Si–OH силанольных групп [16–18]. Твердофазная реакция взаимодействия со щелочью вызывает активацию кремнезема. Этот процесс контролировали по кинетике взаимодействия кремнезема с ГМА. Характер полученных зависимостей зависит от продолжительности выдерживания золя в щелочной среде (рис. 1). При анализе щелочных систем после старения в течение 4 и 7 ч (рис. 1, кривые 1 и 2) кинетические зависимости имеют вид кривых насыщения. В образце с более длительным сроком старения (рис. 1, кривая 3) концентрация “активного” кремнезема во времени непрерывно растет, что характеризует предельную степень разрушения структурной сетки кремнезема.
Рис. 1.
Кинетические кривые взаимодействия “активных” форм кремневой кислоты с гептамолибдатом аммония. Время старения 4 ч (1); 7 ч (2); двое суток (3). М = 3.0[SiO2]/[K2O], моль/моль. ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 112 г/л.
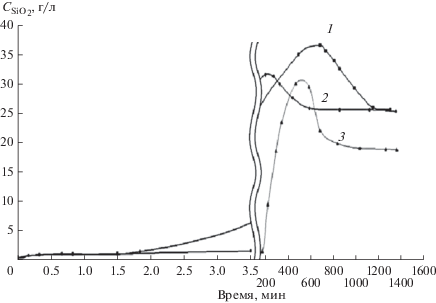
Как следует из анализа кинетических зависимостей роста концентрации активного кремнезема (рис. 2), существует индукционный период (стадия твердофазной реакции), после которого концентрация “активного” кремнезема в водной фазе заметно растет. Силоксановые связи кремнезема под действием OH– ионов расщепляются, вследствие этого полисиликатные ионы появляются как в твердой фазе кремнезема так и сопряженной водной среде [19–21]. Продолжительность индукционного периода увеличивается при переходе от KOH к NaOH примерно в 10 раз и в 100 раз при переходе от KOH к LiOH (KOH ~ 2 ч, NaOH ~ 22 ч, LiOH − 200 ч). По окончании индукционного периода концентрация “активного” кремнезема растет, достигает максимума, затем уменьшается. Подобные зависимости получены ранее для различных фракций кремниевых кислот (мономеров, димеров и олигомеров). В условиях, когда кинетика твердофазных процессов смещена в сторону деполимеризации, становятся возможными процессы в водной фазе – вторичная поликонденсация ‘активных” форм кремниевых кислот, содержащих реакционно-способные силанольные группы [12, 14, 20]. Продукты “вторичной поликонденсации” представляют жесткоцепные макромолекулы, из которых формируются надмолекулярные (супрамолекулярные) структуры линейного типа. Агрегативная устойчивость силикатной системы уменьшается, происходит образование геля.
Рис. 2.
Кинетика роста взаимодействия “активной” фракции кремнезема. М = [SiO2]/[Me2O] = = 3 моль/моль, ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 41 г/л. Щелочные гидроксиды: NaOH (1); KOH (2); LiOH (3).
Исследования методом ФКС показали, что щелочная активация кремнезема приводит к росту гидродинамических радиусов частиц золей (табл. 2).
Таблица 2.
Влияние концентрации кремнезема Людокс TM-40, [SiO2]/[Ме2O] = 50 и природы гидроксида щелочных металлов на гидродинамические радиусы частиц
| Исходный золь | [SiO2]/[Na2O] | [SiO2]/[K2O] | [SiO2]/[Li2O] | ||||
|---|---|---|---|---|---|---|---|
| ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$, г/л | r, нм | ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$, г/л | r, нм | ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$, г/л | r, нм | ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$, г/л | r, нм |
| 36.0 | 12.5 | 22.7 | 15.9 | 24.3 | 15.5 | 26.0 | 16.6 |
| 91.0 | 11.5 | 37.8 | 15.2 | 48.6 | 15.2 | 63.0 | 15.2 |
| 151.0 | 7.8 | 63.0 | 15.2 | 56.0 | 15.2 | 105.0 | 14.2 |
| 252.0 | 8.1 | 104.0 | 15.1 | 77.7 | 15.1 | 210.0 | 12.7 |
| 420. | 6.7 | – | – | 93.3 | 14.2 | – | – |
| – | – | – | – | 155.5 | 13.2 | – | – |
| – | – | – | – | 194.3 | 12.2 | – | – |
В табл. 2 приведены результаты измерения радиусов частиц золей, содержащих гидроксид натрия после старения в течение одной недели (примерно 150 ч). Видно, что при уменьшении концентрации (разбавлении) золя, радиусы частиц возрастают (частицы набухают). Этот процесс продолжается во времени (табл. 3).
Таблица 3.
Влияние времени старения на гидродинамический радиус частиц золя Людокс AS-40, [SiO2]/[Na2O] = 50
| ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 20.6 г/л | ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ = 41.0 г/л | ||
|---|---|---|---|
| радиус частиц, нм | время старения системы, ч |
радиус частиц, нм | время старения системы, ч |
| 13.5 | 0.2 | 11.6 | 0.2 |
| 13.8 | 4.5 | 12.0 | 6.0 |
| 14.0 | 7.0 | 12.0 | 7.0 |
| 14.0 | 8.0 | 12.0 | 8.0 |
| 14.3 | 18.0 | 13.0 | 16.0 |
| 14.7 | 25.0 | 13.8 | 25.0 |
| 14.4 | 35.0 | 13.1 | 37.0 |
Следует отметить идентичный характер влияния щелочных гидроксидов на закономерности изменения гидродинамических радиусов (набухаемость) частиц [14] и кинетику деполимеризации кремнезема (данные колориметрического анализа) (рис. 2) [12]. Закономерности этих процессов соответствуют росту основности гидроксидов в лиотропном ряду: KOH > NaOH > LiOH.
Влияние деполимеризации на свойства коллоидного кремнезема заметно проявляется при переходе из кислой области в щелочную. По данным вискозиметрических исследований разбавленные золи (Людокс SM-30) представляют ньютоновские жидкости, вязкость которых в широком интервале концентраций заметно возрастает при увеличении рН > 7.0 (рис. 3).При обработке данных вискозиметрии с учетом набухания частиц, в широком диапазоне рН коэффициенты a1, рассчитанные по уравнениям (2−5), превышают значение 2.5 (см. табл. 4).
Рис. 3.
Влияние рН на вязкость золя Людокс SM-30, ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ г/л: 2.5 (1); 5.3 (2); 10.5 (3); 15.6 (4); 20.8 (5); 31.5 (6).

Таблица 4.
Влияние рН на вискозиметрические параметры. Золь Людокс SM-30
| Величина рН | a1 | ∆, нм |
|---|---|---|
| 2.0 | 2.9 | 0.3 |
| 4.4 | 2.9 | 0.3 |
| 7.0 | 3.4 | 0.4 |
| 8.0 | 3.6 | 0.7 |
| 9.0 | 4.1 | 1.2 |
| 9.5 | 3.8 | 0.9 |
Величины a1 и Δ особенно заметно возрастают при увеличении рН > 7.0. Подобные данные получены и другими авторами. Так, Гринбергом для золя с размером частиц d ~ 20 нм получены значения a1 от 5 при рН 2.7 до 11.57 при рН 9.3 [22, 23]. Отклонения экспериментально определяемого коэффициента a1 от значения 2.5 авторы объясняют существованием на частицах кремнезема граничных гидратных слоев [13] или гелеобразных структур на поверхности твердой фазы [6] обеспечивающих гидрофильность поверхности.
Структурные изменения в кремнеземе при изменении рН влияют на оптические свойства золей. В образцы Людокс SM-30 добавляли соляную кислоту или щелочь, а также хлорид или фторид натрия. Измерения оптической плотности проведены через 5 мин после введения соли. Расчеты показали, что в исследованных системах оптическая константа уравнения Рэлея мало зависит от состава раствора, следовательно, влияние оптических свойств среды на светорассеивающие свойства золей ничтожно малое.
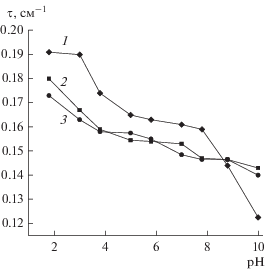
На рис. 4 показано, что мутность золей возрастает при уменьшении рН. Вблизи нейтральной области в (рН 5.0−7.5) на полученных зависимостях появляется платообразный участок, а помутнение золей наибольшее вблизи изоэлектрической области рН. Подобный характер влияния рН на оптические свойства золей получен Гринбергом [22, 23]: показатель диссиметрии светорассеяния золей Людокс больше единицы в широком диапазоне рН. По нашим данным осветление агрегативно устойчивых золей продолжается во времени (до 18 сут). Этому способствует уменьшение концентрации золя, введение электролитов, а также щелочная среда. Как показали опыты, в области концентрации соли от 1 × 10–3 до 5 × 10–2 М мутность остается ниже уровня для исходных золей. При концентрациях соли >10–2 M после первоначального уменьшения мутность во времени начинает изменяться. В щелочных золях мутность начинает на более ранних стадиях старения. Согласно ранее полученным результатам, мутность золей (практически не содержащих солей после обработки Н+-катионитом), уменьшается не только на стадии образования гелей, но и при их упрочнении [24].
Рис. 4.
Влияние рН на мутность золя. Электролит: исходный золь (1), ${{C}_{{{\text{Si}}{{{\text{O}}}_{{\text{2}}}}}}}$ =2.5 г/л; 0.005 моль/л NaCl (2); 0.005 моль/л NaF (3).
Учет реакционной способности кремнезема позволяет понять характер влияния рН на природу лиофильности, свойства и агрегативную устойчивость коллоидной системы. Частицы кремнезема состоят из трехмерного гетероцепного полимера, содержащего группы ≡Si–OH≡Si–O–Si≡. Вблизи изоэлектрической области частицы аморфного кремнезема предельно гидратированы, т. к. силанольные группы способны к образованию водородных связей, дипольных и других взаимодействий с водой, образующей граничные полимолекулярные гидратные слои. С ростом рН на поверхности частиц возрастает количество заряженных центров в результате роста степени диссоциации силанольных групп, формируется двойной электрический слой. Уменьшается количество центров образования водородных связей. В диапазоне рН < 5.5−6.0 разрушение молекулярно-сольватного слоя приводит к уменьшению агрегативной устойчивости золя. Последующий рост агрегативной устойчивости при рН > 5.5−6.0 является следствием кинетических закономерностей поликонденсации и деполимеризации, имеющих характер твердофазных реакций, катализатором которых при рН > рНиэт выступают ионы гидроксила [1–3]. Скорость поликонденсации в интервале рН 2−8 монотонно растет и пропорциональна [OH]0.85, при рН 8.0−9.0 – [OH]0.45, при рН ~ 9.5 достигает максимального значения, а далее уменьшается [25]. Уменьшение степени зависимости скорости поликонденсации от концентрации гидроксил ионов указывает на смещение химического равновесия в сторону деполимеризации. При оптимальном количестве щелочи (рН 9.0−9.5) скорости реакций гетерофазных процессов поликонденсации и деполимеризации становятся близкими, достигается стационарная растворимость кремнезема, а также высокая агрегативная устойчивость (к коагуляции) золя [14]. В этих условиях укрупнение частиц возможно лишь в процессе изотермической переконденсации.
По схеме деполимеризации [16–18] разрыв силоксановых связей приводит к разрушению структуры кремнезема, появлению гидрофильных Si–OH и Si–O−Me+ групп, формированию гелеобразной пористой структуры на поверхности частиц и в их объеме, ростом лиофильности и агрегативной устойчивости системы при рН > 5.5−6.0. Уменьшение степени зависимости скорости поликонденсации от концентрации гидроксилионов указывает на смещение химического равновесия в сторону деполимеризации. По данным вискозиметрии гидродинамические радиусы частиц растут с ростом рН и при разбавлении золя (по данным ФКС). Характерно, что при этом мутность агрегативно устойчивых золей уменьшается.
Деполимеризация и, как следствие, лиофилизация частиц обеспечивают скачкообразный механизм смены стабилизирующих факторов и рост агрегативной устойчивости коллоидного кремнезема при рН > 5.5−6.0. Как отмечено выше, появляющиеся в процессе деполимеризации растворимые силикаты содержат ионизированные (Si−O–) и неионизированные (Si–OH) силанольные группы. Появление максимума на концентрационных зависимостях “активного” кремнезема характеризует переход системы в качественно новое состояние (рис. 2) [12]. Кинетика гелеобразования и свойства гелей будут определяться соотношением концентраций набухших (неразложившихся) частиц и формирующихся надмолекулярных структур, следовательно, от начальных свойств системы (концентрации и размера частиц золя, природы щелочи, силикатного модуля). Эти процессы характерны для сильно щелочных сред. При рН 9.0−9.5 золи сохраняют высокую агрегативную устойчивость (к коагуляции) в течение длительного времени. На рис. 3 видно, что при повышении щелочности до рН = 10 вязкость золя растет. При длительном хранении система теряет текучесть. Переход золя в гель ускоряется при повышении силикатного модуля. Уменьшение агрегативной устойчивости щелочного коллоидного кремнезема является следствием набухания исходных частиц золя и одновременно с этим образования супрамолекулярных структур. Соотношение этих структурных элементов во многом определяет свойства формирующихся гелевых структур, которые можно рассматривать как структуры типа “гель в геле”.
ЗАКЛЮЧЕНИЕ
Агрегативная устойчивость гидрозолей рассмотрена в контексте реакционной способности кремнезема. Агрегативная устойчивость и свойства золей зависят от кинетики реакций поликонденсации и деполимеризации. Деполимеризация разрушает структуру силоксановых связей кремнезема, вследствие чего растут гидродинамические радиусы (набухаемость) частиц, увеличивается проницаемость молекул воды и ионов солей через гелеобразные структуры, уменьшается мутность золя при переходе из кислой области в щелочную, а также в присутствии электролитов. При высоких концентрациях щелочей в процессе деполимеризации в водной фазе появляются растворимые силикаты, содержащие реакционно-способные силанольные группы, в ходе вторичной поликонденсации которых образуются супрамолекулярные (надмолекулярные) структуры, агрегативная устойчивость коллоидной системы уменьшается, растет вязкость, образуются гели.
Список литературы
Шабанова Н.А., Саркисов П.Д. Основы золь-гель технологии нанодисперсного кремнезема: Учебное пособие. М.: ИКЦ Академкнига, 2004. 208 с.
Шабанова Н.А., Саркисов П.Д. Золь-гель технология. Нанодисперсный кремнезем. М.: Бином. Лаборатория знаний, 2012. 328 с.
Шабанова Н.А., Попов В.В., Саркисов П.Д. Химия и технология нанодисперсных оксидов: Учебное пособие. М.: ИКЦ Академкнига, 2006. 309 с.
Duc M., Adekola F., Lefèvre G., Fédoroff M. Influence of kinetics on the determination of the surface reactivity of oxide suspensions by acid–base titration // J. Colloid Interface Sci. 2006. V. 303. P. 49–55.
Böschel D., Janich M., Roggendorf H. Size distribution of colloidal silica in sodium silicate solutions investigated by dynamic light scattering and viscosity measurements // J. Colloid Interface Sci. 2003. V. 267. P. 360–368.
Laven J., Stein H.N. The Electroviscous Behavior of Aqueous Dispersions of Amorphous Silica (Ludox) // J. Colloid Interface Sci. 2001. V. 238. P. 8–15.
Taran E., Kanda Y., Vakarelski I.U., Higashitani K. Nonlinear friction characteristics between silica surfaces in high pH solution // J. Colloid InterfaceSci. 2007. V. 307. P. 425–432.
Артемов А.С. Химико-механическое полирование материалов // Российские нанотехнологии. 2011. Т. 4. № 7–8. С. 54−73.
Lu Zh., Lee S.-Ho., Babu1 S.V., Matijevic E. The use of monodispersed colloids in the polishing of copper and tantalum // J. Colloid Interface Sci. 2003.V. 261. P. 55–64.
Sears G.W.Jr. Determination of specific surface area of colloidal silica by titration with sodium hydroxide // Anal. Chem. 1956. V. 28. № 12. P. 1981–1983.
Alexander G.B. The polymerization of monosilicic acid // J. Amer. Chem. Soc. 1954. V. 76. № 8. P. 2094–2096.
Шабанова Н.А. Кинетические закономерности получения щелочных силикатов из гидрозолей кремнезема // Журн. прикл. химии. 2011. Т. 84. № 3. С. 356−364.
Айлер Р.К. Химия кремнезема / Пер. с англ. Т. 1, 2. М.: Мир. 1982. 712 с.
Шабанова Н.А., Маркелова М.Н. Влияние реакционной способности кремнезема на свойства сопряженных фаз // Физ. и хим. стекла. 2016. Т. 42. № 4. С. 565−573
Фролов Ю.Г., Шабанова Н.А., Молодчикова С.И. Закономерности изменения вязкости гидрозолей кремнезема // Коллоид. журн. 1983. Т. 45. № 5. С. 970−976.
Воронков М.Г. О гетероциклических реакциях расщепления силоксанов // Химия и практическое применение кремнеорганических соединений. М.: Изд-во АН СССР, 1961. В. 6. С. 136–153.
Воронков М.Г., Южелевский Ю.А. Силоксановая связь. Новосибирск: Наука. СО, 1976. 413 с.
Ласкорин Б.Н. Сорбенты на основе силикагеля в радиохимии. М.: Атомиздат, 1977. 303 с.
Шабанова Н.А., Айтжанова О.Г., Спорыхина В.И., Романова Н.Н. Кинетика деполимеризации кремнезема при получении полисиликатов из гидрозолей // Коллоид. журн. 1998. Т. 60. № 5. С. 705−708.
Шабанова Н.А., Айтжанова О.Г. Влияние природы щелочных гидроксидов на кинетику деполимеризации коллоидного кремнезема // Коллоид. журн. 1999. Т. 61. № 4. С. 567−671.
Шабанова Н.А., Сергеева М.Н. Закономерности изменения коллоидно-химических свойств гидрозолей кремнезема при введении гидроксидов щелочных металлов // Журн. прикл. химии. 2009. Т. 82. № 5. С. 778−781.
Greenberg S.A., Chang T.N., Jarnitowski R.J. The behavior of polysilic acid.1. Surface charge effects // J. Polymer Sci. 1962. V. 58. № 16. P. 147−184.
Greenberg S.A., Jarnitowski R.J., Chang T.N. The behavior of polysilic acid.2.The rheology of silica suspensions // J. Colloid Sci. 1965. V. 20. № 1. P. 20−43.
Шабанова Н.А., Кодинцева Е.Ю. Влияние начальных условий на кинетику гелеобразования в гидрозолях кремнезема // Коллоидн. журн. 1990. Т. 52 № 3. С. 553−558.
Шабанова Н.А., Попов В.В., Фролов Ю.Г. Кинетика поликонденсации и коагуляции в гидрозоле кремнезема // Коллодн. журн. 1984. Т. 46. № 5. С. 986−993.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла


