Физика и химия стекла, 2020, T. 46, № 3, стр. 300-306
Нуклеация CuCl в стекле на стадии нагревания образца
А. Л. Ашкалунин 1, Е. С. Деркачева 2, В. О. Кабанов 1, В. И. Лейман 1, *
1 Санкт-Петербургский государственный университет промышленных технологий и дизайна. Высшая школа технологии и энергетики
198095 Санкт-Петербург, ул. Ивана Черных, 4, Россия
2 Институт химии силикатов им. И.В. Гребенщикова РАН
199034 Санкт-Петербург, наб. Макарова, 2, Россия
* E-mail: leiman@inbox.ru
Поступила в редакцию 05.03.2018
После доработки 08.06.2019
Принята к публикации 07.08.2019
Аннотация
Методом экситонно-термического анализа изучены особенности нуклеации наночастиц CuCl на стадии нагревания в натриевоалюмоборосиликатном стекле. Установлено, что при данном процессе концентрация частиц CuCl достигает своего максимума. Концентрация частиц CuCl возрастает с увеличением времени нагревания, при этом уменьшается средний радиус. Численное моделирование показало, что при нагревании образуется максимальное количество зародышей новой фазы, что обусловлено быстрым ростом критического радиуса. С некоторого момента нагревания наблюдается растворение ранее образовавшихся зародышей. Концентрация фазы CuCl и средний радиус распределения по радиусам частиц при нагревании больше 5 мин стремятся к равновесному значению для соответствующей температуры нуклеации.
ВВЕДЕНИЕ
Ранее были изучены процессы образования двойного распределения наночастиц CuCl в стекле при использовании двухстадийного отжига при температурах 700 и 500°С. Снижение температуры приводит к уменьшению критического радиуса частиц новой фазы. В образцах после двухстадийного отжига получены двойные распределения наночастиц CuCl со значительно отличающимися средними радиусами [1]. В работе [2] показано, что многостадийный отжиг позволяет не только управлять параметрами частиц новой фазы, но и определять критические параметры начальной стадии нуклеации. В работе [3] было исследовано влияние условий охлаждения на формирование нанокристаллов CuCl. Обнаружено, что в твердых растворах после термообработки при температуре 740°С и последущей обработке образца при температурах 500–600°С, можно эффективно управлять концентрацией зародышей, средним радиусом и шириной распределения зародышей по радиусам. В зависимости от температуры обработки были получены узкие распределения частиц CuCl в стекле [3]. Влияние скорости линейного нагревания на формирование фазы CuCl было рассмотрено в [4]. Выявлено, что при медленном нагревании концентрация зародышей фазы CuCl достигает максимума при 540°С. Распределение по размерам наночастиц CuCl в стекле на различных стадиях нуклеации изучено в [5], кинетика нуклеации в [6].
В настоящей работе на примере промышленного фотохромного стекла типа ФХС7 [7], исследуется нуклеация в условиях разной скорости нагревания образцов. Распределения фазы CuCl по радиусам частиц определяли по экспериментальной кривой их плавления методом экситонно-термического анализа (ЭТА). Метод ЭТА основан на обработке данных изменения поглощения при плавлении нанокристаллов (НК) CuCl, имеющихся в образце, с использованием зависимости температуры плавления НК от их размера.
НУКЛЕАЦИЯ ФАЗЫ CuCl ПРИ ЛИНЕЙНОМ НАГРЕВАНИИ ОБРАЗЦА
Для исследования формирования распределения наночастиц CuCl на стадии нагревания и последующего отжига был взят ряд одинаковых исходных образцов стекла, которые отжигали и вынимали из печи в разное время в соответствии с режимом нагревания. При линейном нагревании образца регистрировались кривые изменения K(E0, T) (E0 – энергии “узловой точки” [5]) коэффициента поглощения НК CuCl в области температур плавления частиц CuCl. K(E0, T) пропорционален концентрации нерасплавленных нанокристаллов CuCl, результирующие распределения представлены как fV(r) – распределение объема фазы CuCl по радиусам частиц.
В [5] были показаны изменения распределений fV(r) в образцах через каждые 10 мин увеличения их времени отжига. На вставке рис. 1 точками обозначены времена отжига образцов. Кривые 1–6 показывают распределения fV(r) в образцах в процессе медленного (60 мин) нагревания до температуры 650°С и выдержке 30 мин. Для кривых 7–9 характерно распределение fV(r) в образцах в режиме быстрого нагревания (2 мин) до температуры 650°С и выдержке 30 мин через каждые 10 мин отжига (рис. 1).
Рис. 1.
Изменения распределения объема фазы CuCl по радиусам частиц в образцах в режиме медленного (60 мин) нагрева (кривые 1–6) и быстрого (2 мин) нагрева (кривые 7–9) до температуры 650°С и выдержке 30 мин. Режим отжига образцов показан на вставке, номера у точек соответствуют номерам распределений. Точка 0 на вставке означает отсутствие фазы CuCl в образце.

В случае медленного нагревания за первые 20 мин НК CuCl в образце не образуется (точка 0 на вставке). Температура возрастает с 500 до 550°С. На 30-ой минуте (температура 575°С) образуется распределение CuCl (кривая 1) со средним радиусом 2.6 нм. За следующие 10 мин (кривая 2) средний радиус распределения в образце растет до 3.3 нм. Высота кривой распределения резко увеличивается (в 2.4 раза). Следующие 20 мин продолжается рост температуры образца и, соответственно, рост R до 4.17 нм (кривые 3 и 4). Высота распределений резко уменьшается. При неизменной температуре 650°С в образцах (кривые 5 и 6) средний радиус возрастает до 4.2 нм и 6.0 нм соответственно.
При быстром (2 мин) нагревании до 650°С (кривые 7–9) за первые 10 мин средний радиус распределения CuCl в образце достигает 9.7 нм (кривая 7). За 30 мин обработки при 650°С максимум распределения сдвигается до 11.7 нм (кривая 9). Концентрация НК CuCl в образцах в 4 раза меньше чем при медленном нагревании, а распределения становятся более узкими.
На рис. 2 показаны изменения среднего радиуса R и концентрации N частиц CuCl в образцах в условиях медленного (кривые 1–2) и быстрого нагревания до 650°С (кривые 3–4), которые получены из анализа данных рис. 1 [2]. Значения N определяли делением площади под кривой fV(r) на рис. 1 на соответствующий средний радиус распределения.
Рис. 2.
Изменения среднего радиуса R (кривая 1) и концентрации N частиц CuCl (кривая 2) в условиях медленного (60 мин) нагрева и (кривые 3–4) в условиях быстрого (2 мин) нагрева до 650С и выдержке 30 мин.

При режиме медленного нагревания за 30 мин средний радиус R быстро вырастает до 2.62 нм (см. кривую 1). Концентрация N к 40-ой минуте вырастает почти в два раза. С увеличением времени отжига следует резкий спад N, который происходит вследствие растворения некоторого количества наночастиц CuCl из-за роста критического радиуса с ростом температуры и падением пересыщения [2].
В быстром режиме (2 мин) нагревания до 650°С средний радиус R (кривая 3) уже за 10 минут достигает 9.73 нм, в конце отжига вырастает до 11.7 нм. Концентрация N при этом (кривая 4) много меньше, чем при медленном режиме.
ЧИСЛЕННОЕ МОДЕЛИРОВАНИЕ ОБРАЗОВАНИЯ ФАЗЫ CuCl В СТЕКЛЕ
Для лучшего понимания процессов формирования новой фазы в твердых растворах в условиях разной скорости разогревания было проведено численное моделирование процесса нуклеации новой фазы в твердом растворе по методике, изложенной в [6]. Численное моделирование позволяет подробнее исследовать происходящие процессы на стадии нагревания образцов. При этом растет коэффициент диффузии и критический радиус. Пересыщение падает, а критический радиус дополнительно возрастает из-за обеднения раствора в процессе нуклеации. Изменение этих параметров существенно влияет на образование закритических зародышей новой фазы.
На рис. 3 показаны расчетные изменения концентрация N частиц CuCl и среднего радиуса R распределений fV(r) с увеличением времени разогрева до 650°С от 2 до 60 мин и выдержке 30 мин (кривые 1–8). На рис. 3 видны два эффекта. Изменение критического радиуса от пересыщения и от температуры [2]. За 60 мин образуется большое количество закритических зародышей новой фазы (Нmax = 64, кривая 8, рис. 3a). Из-за уменьшения пересыщения (обеднение раствора) критический радиус возрастает. Растворение ранее созданных ансамблей начинается уже при 542°С (пустые кружки и цифры у них). Уменьшение времени нагревания раствора от 30 до 5 мин приводит к уменьшению концентрации зародышей и, соответственно, уменьшению критического радиуса из-за уменьшения пересыщения. Максимум N наступает при более высокой температуре. При 560 и 650°С, когда температурный рост критического радиуса связано с началом растворения ранее образовавшихся зародышей. На рис. 3а показаны моменты достижения раствором температуры начала изотермического отжига (650°С – заполненные кружки). На рис. 3б показаны (пустыми кружочками) средние радиусы распределений, при которых начинается растворение ранее созданных зародышей. Конечный средний радиус распределений R увеличивается почти в два раза при уменьшении времени нагревания с 5 до 2 мин (рис. 3б, кривые 1–3).
Рис. 3.
Расчетные зависимости изменения (a) концентрации N частиц CuCl и (б) среднего радиуса распределений R при изменении времени разогрева раствора до 650°С от 2 до 60 мин и отжиге 30 мин (кривые 1–8). Время разогрева, мин: 2 (1), 4 (2), 5 (3), 6 (4), 10 (5), 20 (6), 30 (7), 60 (8). Точками обозначено начало изотермического отжига при 650°С.
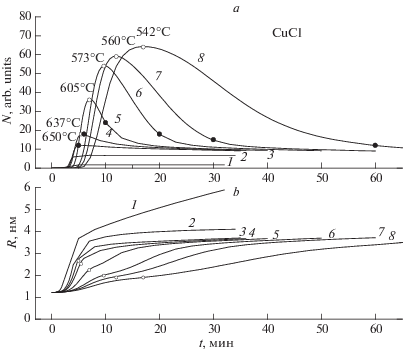
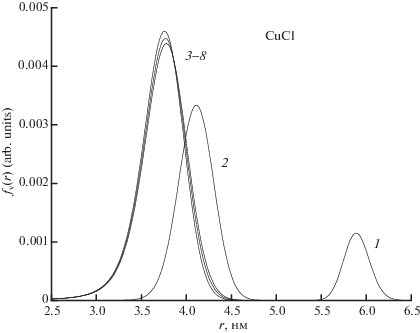
При нагревании 5 мин и более концентрация N частиц CuCl и их средний радиус R стремятся к квазиравновесному (мало изменяющемуся) значению (кривые 3–8 в конце нуклеации, рис. 3) и, скорее всего, определяются конечной температурой изотермического отжига. Распределения частиц CuCl по радиусам также стремятся к некоторому одному квазиравновесному распределению для данной температуры нуклеации (кривые 3–8, рис. 4).
Рис. 4.
Расчетные конечные распределения фазы CuCl по радиусам частиц при изменении времени разогрева раствора 2 мин (кривая 1), 4 мин (кривая 2) и 5–60 мин (кривые 3–8).
ЗАВИСИМОСТЬ НУКЛЕАЦИИ ОТ КОНЕЧНОЙ ТЕМПЕРАТУРЫ РАЗОГРЕВАНИЯ
Эксперименты были проведены на образце с размерами 60 × 15 × 1 мм3, помещенном в градиентную печь при температуре 500–640°С. Разогревание каждого участка образца до соответствующей температуры составлял более 5 мин, затем проводили отжиг в течение 3 ч. На рис. 5 показаны полученные квазиравновесные значения среднего радиуса R распределения, концентрации N частиц CuCl и общая концентрация фазы CuCl, определяемой по оптическому поглощению K(E0). Из рис. 5 видно, что начиная с 560°С изменение R и N происходят в условиях сохранения концентрации (K, см–1) выделившейся фазы CuCl в стекле, что характерно для стадии переконденсации [8].
Рис. 5.
Изменения среднего радиуса R распределения, концентрации N частиц CuCl и общей концентрации K(cм–1) фазы CuCl при отжиге протяженного образца в течение 3 часов в зависимости от температуры изотермической нуклеации.

ЗАКЛЮЧЕНИЕ
На практике при изотермическом отжиге экспериментальных образцов необходимо учитывать условия нагревания до заданной температуры нуклеации. При достаточно быстром разогревании твердого раствора средний радиус наночастиц новой фазы может отличаться до 2 раз, а значения концентраций могут быть на порядок меньше по сравнению с медленным нагреванием. Полученные результаты важны для теории процессов нуклеации, учитывающих стадию нагревания и для практического управления размером и концентрацией частиц новой фазы в образцах различного назначения.
Список литературы
Валов П.М., Лейман В.И., Деркачева О.Ю., Максимов В.М., Марков Е.С. Образование двух распределений наночастиц новой фазы в твердом растворе // Письма в ЖЭТФ. 2012. Т. 5. № 5. С. 273–276
Валов П.М., Лейман В.И. Создание и распад докритических зародышей в твердом растворе // Письма в ЖЭТФ. 2010. Т. 91. № 11. С. 656–658.
Лейман В.И., Ашкалунин А.Л., Валов П.М., Деркачева О.Ю., Максимов В.М. Неизотермическая нуклеация в твердом растворе CuCl в стекле: температурная область образования закритических зародышей фазы CuCl // ФТТ. 2018. Т. 60. № 5. С. 984–988.
Ашкалунин А.Л., Деркачева Е.С., Лейман В.И., Осовская И.И., Герасин Н.А. Особенности образования наночастиц CuCl в стекле // Физ. и хим. стекла. 2017.Т. 43. № 4. С. 373–381.
Валов П.М., Лейман В.И. Распределение по размерам наночастиц CuCl в стекле на различных стадиях нуклеации // ФТТ. 2009. Т. 51. № 8. С. 1607–1612.
Валов П.М., Лейман В.И., Максимов В.М., Деркачева О.Ю. Кинетика нуклеации в твердом растворе CuCl в стекле: расчет и сравнение с экспериментом // ФТТ. 2011. Т. 53. № 3. С. 446–451.
Голубков В.В., Екимов А.И., Онущенко А.А., Цехомский В.А. Кинетика роста монокристаллов CuCl в стеклообразной матрице // Физ. и хим. стекла. 1981. Т. 7. № 4. С. 397–401.
Slezov V.V. Kinetics of First-order Phase Transitions. Wiley-Blackwell, Hardbak (2009). 429 p.
Дополнительные материалы отсутствуют.
Инструменты
Физика и химия стекла


