Физика металлов и металловедение, 2022, T. 123, № 6, стр. 630-636
Моделирование процесса кристаллизации в малоуглеродистых низколегированных сталях
И. И. Горбачев a, *, Е. И. Корзунова a, В. В. Попов a
a Институт физики металлов им. М.Н. Михеева УрО РАН
620108 Екатеринбург, ул. С. Ковалевской, 18, Россия
* E-mail: gorbachev@imp.uran.ru
Поступила в редакцию 25.02.2022
После доработки 17.03.2022
Принята к публикации 18.03.2022
- EDN: TMZVDY
- DOI: 10.31857/S0015323022060079
Аннотация
Предложен алгоритм для прогнозирования фазового состава низколегированных титансодержащих сталей после затвердевания. Алгоритм учитывает возможность выделения четырех фаз: TiN, TiS, MnS и TiC0.5S0.5. Выполнены расчеты, в которых исследовано изменение фазового состава стали в процессе кристаллизации, а также влияние содержания Ti, N и S в сплаве на количество образующихся фаз-выделения.
ВВЕДЕНИЕ
Малоуглеродистые низколегированные стали широко используются для изготовления труб для магистральных трубопроводов высокого давления [1–3]. Современные технологии производства низколегированных сталей должны обеспечивать управление структурообразованием на всех этапах их производства. Формирование фазового состава и структуры сталей начинается уже при кристаллизации.
Знание интервала затвердевания необходимо для управления технологическим процессом непрерывного литья. Качество и эффективность производства могут быть улучшены, если температуры ликвидуса и солидуса могут быть предсказаны с высокой степенью точности.
Для выбора оптимального состава стали и режимов последующей обработки необходимо знать фазовый состав сталей, формирующийся в процессе кристаллизации, поскольку он может в значительной степени определять структуру и свойства сталей при последующей термической и термомеханической обработке.
В состав низколегированных сталей практически всегда входит марганец и в небольшом количестве присутствуют титан, сера и азот. Поэтому в процессе кристаллизации в сталях этого класса могут образовываться нитриды, сульфиды и карбосульфиды титана, а также сульфиды марганца [4–6]. Необходимо уметь прогнозировать долю этих соединений, поскольку они могут оказывать значительное влияние на структуру и свойства сталей, получаемые при последующей обработке. Так крупные нитриды, сформировавшиеся при кристаллизации, являются концентраторами напряжений. Сульфиды марганца при горячей прокатке вытягиваются в строчки, что может приводить к различной степени охрупчиванию стали в листах и прутках в зависимости от направления прилагаемой нагрузки.
К настоящему времени разработаны численные методы, позволяющие проследить пути превращения и формирования фазового состава на основании термодинамических расчетов. Обычно расчеты проводятся для двух классических пределов: приближение правила рычага и приближение Гулливера–Шейла [7, 8]. В первом случае предполагается полное равновесие между присутствующими фазами. Это означает, что все химические элементы могут быстро диффундировать как в жидкой, так и в твердых фазах. При использовании приближения Гулливера–Шейла предполагается, что диффузия в твердых фазах заморожена.
На практике большинство промышленных сталей содержат в своем составе элементы внедрения и замещения. Элементы внедрения, такие как углерод и азот, имеют высокую диффузионную подвижность в твердой фазе, в то время как элементы замещения имеют низкую диффузионную подвижность. Таким образом, приближения правила рычага и Гулливера–Шейла подходят не полностью. Чтобы преодолеть эту проблему, было разработано приближение частичного равновесия [9, 10], которое предполагает быструю диффузию элементов внедрения в твердой фазе при замороженной диффузии элементов замещения.
Большинство исследований, посвященных моделированию процесса кристаллизации стали, нацелены на определение температурного интервала кристаллизации и не рассматривают образование избыточных фаз в процессе затвердевания расплава [11–13].
Имеются две работы, в которых сделана попытка учесть образование избыточных фаз при кристаллизации [4, 14], но при этом сделаны серьезные упрощения и допущения. В частности, не учитывали тот факт, что азот характеризуется быстрой диффузией в твердой фазе, а также возможность образования карбосульфида титана, и использовали устаревшие термодинамические параметры.
Целью настоящей работы было разработать алгоритм, актуализировать термодинамическое описание и выполнить моделирование процесса кристаллизации в малоуглеродистых низколегированных сталях.
ОПИСАНИЕ АЛГОРИТМА
Предлагаемый алгоритм применим для моделирования процесса кристаллизации в малоуглеродистых сталях, содержащих менее 0.1 мас. % C, которые кристаллизуются с образованием δ-феррита. Разработанная в настоящей работе модель кристаллизации была построена на основе приближения частичного равновесия. Предполагается, что реализуется быстрая диффузия всех элементов в жидкой фазе, тогда как диффузия элементов замещения в феррите подавлена, а диффузия углерода и азота протекает быстро. При этом учтена возможность выделения из жидкой фазы в процессе кристаллизации нитрида титана TiN, карбосульфида титана TiC0.5S0.5, сульфида титана TiS и сульфида марганца MnS.
В первую очередь оценивается температура начала затвердевания и температуры начала выделения избыточных фаз.
В первом приближении температуры начала затвердевания феррита оценивали по формулам, полученным на основании анализа диаграмм состояния двойных систем, приведенных в [15], а также на основе термодинамических расчетов:
(1)
$\begin{gathered} {{T}^{{L \to \delta }}}(K) = 1811 - 75.69{{[\% \,C]}_{L}} - 11.72[\% \,C]_{L}^{2} - \\ - \,\,4.8{{[\% \,Mn]}_{L}} - 11.4{{[\% \,Si]}_{L}} - 14.3{{[\% \,S]}_{L}}, \\ \end{gathered} $Используя значение, определяемое выражением (1), в качестве первого приближения, температура кристаллизации рассчитывается более точно с помощью решения системы балансовых и термодинамических уравнений (подробно описаны далее, см. (8)–(15)), а также дополнительного условия равенства нулю доли феррита. В результате решения этой системы уравнений находили такую температуру, при которой начинается образование феррита.
В связи с тем, что нитриды, карбосульфиды и сульфиды титана и сульфиды марганца могут образовываться до начала затвердевания, рассчитывали температуры начала выделения из расплава этих соединений. Для этого использовали температурные зависимости констант равновесия TiN, TiC0.5S0.5, TiS и MnS с расплавом.
Выражения для температурных зависимостей констант равновесия TiN, TiS и MnS с расплавом были взяты из работ [4, 16, 17]:
(2)
$\lg {{K}_{{{\text{TiN}}}}} = \lg \frac{{a_{{{\text{Ti}}}}^{L}a_{{\text{N}}}^{L}}}{{{{a}_{{{\text{TiN}}}}}}} = - \frac{{15780}}{T} + 5.63,$(3)
$\lg {{K}_{{{\text{TiS}}}}} = \lg \frac{{a_{{{\text{Ti}}}}^{L}a_{{\text{S}}}^{L}}}{{{{a}_{{{\text{TiS}}}}}}} = - \frac{{8000}}{T} + 4.00,$(4)
$\lg {{K}_{{{\text{MnS}}}}} = \lg \frac{{a_{{{\text{Mn}}}}^{L}a_{{\text{S}}}^{L}}}{{{{a}_{{{\text{MnS}}}}}}} = - \frac{{8236}}{T} + 5.03.$Температурная зависимость константы равновесия карбосульфида TiC0.5S0.5 с расплавом была рассчитана из выражения для произведения растворимости карбосульфида в аустените, полученного в работе [5]:
(5)
$\begin{gathered} \lg {{K}_{{{\text{Ti}}{{{\text{C}}}_{{0.5}}}{{{\text{S}}}_{{0.5}}}}}} = \lg \frac{{a_{{{\text{Ti}}}}^{L}{{{\left( {a_{{\text{C}}}^{L}} \right)}}^{2}}{{{\left( {a_{{\text{S}}}^{l}} \right)}}^{2}}}}{{{{a}_{{{\text{Ti}}{{{\text{C}}}_{{0.5}}}{{{\text{S}}}_{{0.5}}}}}}}} = - \frac{{12\,748}}{T} + \\ + \,\,8.442 - 0.98\lg T + 1.09 \times {{10}^{{ - 4}}}T. \\ \end{gathered} $Активности продуктов реакции aTiN, aTiS, aMnS и ${{a}_{{{\text{Ti}}{{{\text{C}}}_{{0.5}}}{{{\text{S}}}_{{0.5}}}}}}$ принимали равными единице. Активности титана (aTi), азота (aN), углерода (aC), марганца (aMn) и серы (aS) в расплаве рассчитывали по формулам вида:
где [% i] – концентрация i-го элемента в расплаве, ${}^{L}e_{i}^{j}$ – коэффициенты взаимодействия элементов в расплаве.Моделирование процесса кристаллизации происходит на основе пошаговой процедуры, т.е. на каждом температурном шаге текущее значение температуры уменьшается на величину ΔT, и рассчитывается состояние системы, соответствующее новой температуре. Для начала расчетов выбирается температура на несколько градусов выше наибольшей из температур: начала затвердевания или начала выделения избыточных фаз и запускается пошаговая процедура. На каждом шаге проверяется возможность образования избыточных фаз и при выполнении условия их образования рассчитывается количества избыточных фаз, формирующихся на каждом шаге, и состав жидкости.
Начиная с температуры начала кристаллизации, на каждом (k-ом) температурном шаге рассчитываются массовые доли жидкой фазы $Q_{L}^{k}$ и феррита $Q_{\delta }^{k}$ и соответствующее этому увеличение массовой доли δ-феррита на величину δQδ, а также изменение состава расплава. Расчет выполняется на основе приближения частичного равновесия, то есть по углероду и азоту предполагается равновесие между всем δ-ферритом и расплавом, а по остальным элементам – только между расплавом и очередной порцией феррита.
Балансовые уравнения для углерода и азота имеют вид:
(7)
$[\% \,{\text{C}}]_{L}^{k}Q_{L}^{k} + [\% \,{\text{C}}]_{\delta }^{k}Q_{\delta }^{k} = {{{\text{C}}}_{{\text{C}}}} - [\% \,{\text{C}}]_{{{\text{Ti}}{{{\text{C}}}_{{0.5}}}{{{\text{S}}}_{{0.5}}}}}^{{k - 1}},$(8)
$[\% N]_{L}^{k}Q_{L}^{k} + [\% N]_{\delta }^{k}Q_{\delta }^{k} = {{{\text{C}}}_{{\text{N}}}} - [\% \,{\text{C}}]_{{{\text{TiN}}}}^{{k - 1}}.$Для остальных элементов балансовые уравнения имеют вид:
(9)
$[\% X]_{L}^{{k{\kern 1pt} '}}Q_{L}^{k} + [\% 'X]_{\delta }^{{k{\kern 1pt} '}}Q_{\delta }^{k} = [\% X]_{L}^{{k - 1}}.$Здесь $[\% '{\kern 1pt} {\text{X}}]_{\delta }^{k}$ – концентрация элемента X Xi в очередной порции δ-феррита на шаге k; $'{\kern 1pt} Q_{L}^{k}$ и $'{\kern 1pt} Q_{\delta }^{k}$ – относительные массовые доли жидкой фазы и феррита, образовавшиеся на k-ом температурном шаге:
Частичное термодинамическое равновесие формулируется как равенство химических потенциалов в расплаве и δ-феррите для быстро диффундирующих элементов внедрения (углерода и азота), а для медленно диффундирующих элементов замещения – как равенство химических потенциалов в расплаве и очередной порции δ-феррита.
Разработанная термодинамическая модель создана для моделирования формирования фазового состава при кристаллизации низколегированных сталей. Поэтому при термодинамическом описании фаз использовали приближение разбавленных растворов. С учетом этого условия равновесия между расплавом и δ-ферритом для углерода и азота записывали в виде:
(12)
$\begin{gathered} \lg [\% \,{\text{C}}]_{L}^{k} + \sum\limits_j {{}^{L}e_{{\text{C}}}^{j}[\% \,j]_{L}^{k} + \lg {}^{L}f_{{\text{C}}}^{o}} = \\ = \lg [\% \,{\text{C}}]_{\delta }^{k} + \sum\limits_j {{}^{\delta }e_{{\text{C}}}^{j}[\% \,j]_{\delta }^{k} + \lg {}^{\delta }f_{{\text{C}}}^{o}} , \\ \end{gathered} $(13)
$\begin{gathered} \lg [\% N]_{L}^{k} + \sum\limits_j {{}^{L}e_{{\text{N}}}^{j}[\% \,j]_{L}^{k} + \lg {}^{L}f_{{\text{N}}}^{o}} = \\ = \lg [\% N]_{\delta }^{k} + \sum\limits_j {{}^{\delta }e_{{\text{N}}}^{j}[\% \,j]_{\delta }^{k} + \lg {}^{\delta }f_{{\text{N}}}^{o}} , \\ \end{gathered} $При расчетах частичного равновесия для углерода и азота между расплавом и твердыми фазами для всех фаз в качестве стандартного состояния этих элементов принимали графит и газообразный азот N2.
Для элементов замещения условия равновесия между расплавом и очередной порцией δ-феррита имели вид:
(14)
$\begin{gathered} \lg [\% \,i]_{L}^{k} + \sum\limits_j {{}^{L}e_{i}^{j}} [\% \,j]_{L}^{k} + \lg {}^{L}f_{i}^{0} = \\ = \lg [\% \,i]_{\delta }^{k} + \sum\limits_j {{}^{L}e_{i}^{j}} [\% \,j]_{\delta }^{k} + \lg {}^{\delta }f_{i}^{0} + \frac{{\Delta G_{i}^{{L \to \delta }}}}{{2.3026RT}}, \\ \end{gathered} $Для основного элемента (Fe) условие равновесия между расплавом и очередной порцией δ-феррита имело вид:
ПОСТРОЕНИЕ ТЕРМОДИНАМИЧЕСКОГО ОПИСАНИЯ
Необходимыми параметрами являются коэффициенты активности компонентов в расплаве и δ-феррите, коэффициенты взаимодействия компонентов в этих фазах и изменения свободной энергии компонентов при фазовом превращении L → δ.
Нами были проанализированы имеющиеся на сегодняшний день опубликованные термодинамические параметры.
В табл. 1 приведены выражения для температурных зависимостей логарифмов коэффициентов активности элементов в расплаве и δ-феррите и изменений свободных энергий при фазовом превращении L → δ. Параметры взаимодействия элементов в расплаве и δ-феррите приведены в табл. 2, 3.
Таблица 1.
Коэффициенты активности элементов в расплаве и δ-феррите и изменения свободной энергии при фазовом превращении L → δ
| Элемент | $\lg {}^{L}f_{i}^{0}$ | $\lg {}^{\delta }f_{i}^{0}$ | $\Delta G_{i}^{{L \to \delta }}$ |
|---|---|---|---|
| C | 1201/T – 2.12 [18] | 5608/T – 3.32 [15] | – |
| N | 523/T + 1.056 [19] | 1620/T + 1.475 [19] | – |
| S | –2007/T – 8.857 + + 1.96lgT – 0.218 × 103T [20] |
–1414/T – 2.186 [20] | 34357 – 115.39T + 13.513TlnT [24] |
| Mn | –147/T – 1.967 [21] | –144/T – 1.928 [21] | –12194.93 + 8.6683T + 1.265152 × 1030T–9 [24] |
| Si | –9065/T + 0.519 [22] | –9571/T + 0.726 [22] | –2827.165 + 7.058387T–4.2037 × 1030T–9 [24] |
| Ti | –2704/T–1.724 [23] | –2888/T – 1.097 [23] | –362851.813 + 2659.389T – 364.436TlnT + + 164.626 × 10–3T2 –13.302 × 10–6T3 + + 65031766T–1 [24] |
Таблица 2.
Коэффициенты взаимодействия элементов в расплаве $\left( {^{L}e_{i}^{j}} \right)$
| i | ||||||
|---|---|---|---|---|---|---|
| j | C | N | Mn | Si | Ti | S |
| C | –311/T + 0.32 [18] | 0.11 [25] | –53/T + 0.02 [25] | 89/T + 0.06 [25] | –480/T + 0.22 [25] | 0.09 [1] |
| N | 191/T – 0.01 [25] | 8/T + 0.05 [19] | –61/T – 0.01 [25] | 77.9/T [25] | –8507/T + 4.18 [16] | 0.01 [26] |
| Mn | –242/T + 0.09 [25] | –240/T + 0.05 [25] | 1.76/T [21] | –0.01 [26] | 0.02 [26] | –0.05 [26] |
| Si | 209/T + 0.14 [25] | 156/T + 0.05 [25] | –0.01 [26] | 460/T – 0.17 [22] | –0.03 [26] | 0.06 [4] |
| Ti | –1916/T + 0.86 [25] | 29110/T + 14.3 [16] | 0.017 [26] | –0.04 [26] | 24/T [23] | –0.11 [26] |
| S | 0.24 [4] | 0.0234 [26] | –0.03 [26] | 0.07 [1] | –0.05 [26] | 0.06 [26] |
Таблица 3.
Коэффициенты взаимодействия элементов в δ-феррите $\left( {^{{{\delta }}}e_{i}^{j}} \right)$
| i | ||||||
|---|---|---|---|---|---|---|
| j | C | N | Mn | Si | Ti | S |
| C | 0.31 [18] | 0.351 [25] | – | 4.153/T + 0.099 [27] | – | – |
| N | 0.41 [25] | 0 [19] | –216/T + 0.053 [22] | 138/T + 0.1 [25] | –0.59 [25] | – |
| Mn | – | –847/T + 0.208 [25] | 2.93/T – 0.0013 [21] | –0.12 [4] | – | – |
| Si | 9.71/T + 0.23 [27] | 270/T + 0.021 [25] | –0.057 [4] | 313.8842 – 0.096 [22] | – | 0.19 [4] |
| Ti | – | –2.01 [25] | – | 55.84/T – 0.027 [23] | – | |
| S | – | – | – | 0.22 [4] | – | 50.7/T + 0.015 [20] |
РЕЗУЛЬТАТЫ РАСЧЕТОВ
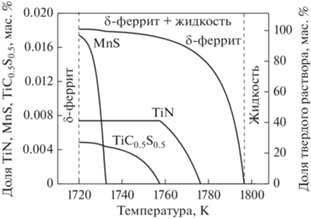
Моделирование процесса кристаллизации на основе предложенного алгоритма было проиллюстрировано (рис. 1) на примере расчета низколегированной малоуглеродистой стали состава 0.08 мас. % С, 1.5 мас. % Mn, 0.01 мас. % S, 0.04 мас. % Si, 0.02 мас. % Ti и 0.005 мас. % N, которая кристаллизуется с образованием δ-феррита. Из рис. 1 видно, что в стали данного состава до начала кристаллизации ни одна из четырех фаз-выделения не образуется. Вторые фазы появляются лишь при дальнейшем охлаждении системы после начала кристаллизации и выделяются в следующей последовательности: TiN, затем карбосульфид титана TiC0.5S0.5 и под конец затвердевания появляется MnS.
Как можно заметить, сульфид титана TiS не появляется, что согласуется с утверждением авторов работы [5], что образование сульфидов титана в обычных низколегированных сталях маловероятно, и вместо них выделяются карбосульфиды TiC0.5S0.5. Хотя ранее предполагали, что в стали с содержанием Ti менее 0.1 мас. % образуются сульфиды титана, а при большем его количестве могут образовываться карбосульфиды TiC0.5S0.5 или сульфиды типа Ti2S.
Помимо приведенных выше результатов исследования изменения фазового состава стали в процессе кристаллизации с помощью данного алгоритма нами были выполнены расчеты влияния содержания Ti, N и S в стали на конечный фазовый состав после завершения затвердевания. Для этого состав стали при моделировании варьировали для указанных элементов в диапазонах (в мас. %): 0–0.01 по N, 0–0.02 по S и 0–0.05 по Ti. Для остальных элементов задавали средний состав (мас. %) – 0.08 С, 0.005 N, 1.5 Mn, 0.02 Ti, 0.04 Si, 0.01 S, который соответствует типовому составу выпускаемых малоуглеродистых низколегированных сталей. Результаты расчетов представлены на рис. 2–4.
Из расчетов по влиянию азота в стали (см. рис. 2) видно, что после достижения некоторого количества азота, он начинает связывать Ti в TiN. И далее, чем больше азота в стали, тем больше доля TiN, а содержание Ti в твердом растворе, соответственно, тем меньше. Одновременно с этим уменьшается доля TiC0.5S0.5, а доля MnS растет. Последнее, очевидно, происходит из-за перехода серы из TiC0.5S0.5, которая и связывает Mn в сульфид марганца MnS.
Содержание S в стали (см. рис. 3) в первую очередь влияет на количество фаз-выделения, в состав которых входит сера – MnS и TiC0.5S0.5, их доля в сплаве после завершения кристаллизации возрастает с увеличением количества S в стали, для MnS – линейно, а для TiC0.5S0.5 – более плавно. Доля TiN с увеличением количества S в сплаве несколько уменьшается, хотя зависимость явно выражена слабее, чем для долей MnS и TiC0.5S0.5. Концентрация Ti в твердом растворе почти не зависит от содержания S в сплаве.
Из зависимостей, приведенных на рис. 4, видно, что увеличение количества Ti в стали приводит к возрастанию массовых долей TiN и TiC0.5S0.5 и к линейному росту финального содержания Ti в твердом растворе. Доля MnS с появлением TiC0.5S0.5 при увеличении содержания Ti в твердом растворе уменьшается.
ЗАКЛЮЧЕНИЕ
Разработан алгоритм для моделирования процесса кристаллизации и прогнозирования фазового состава низколегированных титансодержащих сталей после затвердевания.
Выполнены расчеты процесса кристаллизации, на основании которых проанализировано изменение фазового состава стали в процессе кристаллизации и влияние содержания в стали азота, серы и титана на фазовый состав, формирующийся в процессе затвердевания.
Работа выполнена в рамках государственного задания Минобрнауки России (тема “Функция” № 122021000035-6).
Список литературы
Пышминцев И.Ю., Смирнов М.А. Структура и свойства сталей для магистральных трубопроводов. Екатеринбург: УМЦ УПИ, 2019. 242 с.
Урцев В.Н., Корнилов В.Л., Шмаков А.В., Краснов М.Л., Стеканов П.А., Платов С.И., Мокшин Е.Д., Урцев Н.В., Счастливцев В.М., Разумов И.К., Горностырев Ю.Н. Формирование структурного состояния высокопрочной низколегированной стали при горячей прокатке и контролируемом охлаждении // ФММ. 2019. Т. 120. № 12. С. 1335–1344.
Шиляев П.В., Денисов С.В., Стеканов П.А., Корнилов В.Л., Краснов М.Л., Урцев В.Н., Капцан Ф.В.О., Шмаков А.В, Счастливцев В.М., Горностырев Ю.Н., Лобанов М.Л., Платов С.И. Производство стального проката нового поколения в условиях ПАО “ММК” // Металлург. 2020. № 9. С. 47–54.
Herman J.C., Messien P., Greday T. Inclusion Globularisation by Precipitation of Titanium Compounds // Met. Repts C.R.M. Benelux. 1982. № 59. P. 11–24.
Liu W.J., Yue S., Jonas J.J. Characterization of Ti Carbosulfide Precipitation in Ti Microalloyed Steels // Metallurgical Transactions A. 1989. V. 20A. P. 1989–1907.
Гольдштейн М.И., Житова Л.П., Попов В.В. Влияние карбонитридов титана на структуру и свойства малоуглеродистых сталей // ФММ. 1981. Т. 51. № 6. С. 1245–1252.
Gulliver G.H. The Quantitative Effect of Rapid Cooling Upon the Constitution of Binary Alloys // Inst. Met. 1913. V. 9. № 1. P. 120–157.
Scheil E.Z. Bemerkungen zur schichtkristallbildung. // Metallkd. 1942. V. 34. P. 70–72.
Chen Q., Sundman B. Computation of partial equilibrium solidification with complete interstitial and negligible substitutional solute back diffusion // Materials Transactions. 2002. V. 43. № 3. P. 551–559.
Zhang H., Nakajima K., Gandin C.A., He J. Prediction of carbide precipitation using partial equilibrium approximation in Fe–C–V–W–Cr–Mo high speed steels // ISIJ. 2013. V. 53. № 3. P. 493–501.
Kozeschnik E., Rindler W., Buchmayr B. Scheil–Gulliver simulation with partial redistribution of fast diffusers and simultaneous solid–solid phase transformations // Int. J. Mat. Res. 2007. V. 98. № 9. P. 826–831.
Koshikawa T., Gandin C.-A., Bellet M., Yamamura H., Bobadilla M. Computation of Phase Transformation Paths in Steels by a Combination of the Partial- and Para-equilibrium Thermodynamic Approximations. // ISIJ International. 2014. V. 54. № 6. P. 1274–1282.
Schaffnit P., Stallybrass C., Konrad J., Stein F., Weinberg M. A Scheil–Gulliver model dedicated to the solidification of steel // CALPHAD. 2015. V. 48. P. 184–188.
Попов В.В., Хоменко А.О. Моделирование фазообразования в литых сталях с титаном// Металлы. 1994. № 4. С. 82–88.
Диаграммы состояния двойных металлических систем / Справочник в 3 т. / Под общей ред. Н.П. Лякишева. М.: Машиностроение, 1996.
Kim Wan-Yi. Thermodynamics of Titanium, Nitrogen, and TiN formation in liquid iron // ISIJ International. 2007. V. 47. № 8. P. 1082–1089.
Kor G.J.W., Turkdogan E.T. Sulfides and oxides in Fe–Mn alloys: Part III. Formation of oxisulfides during freezing of steel // Met. Trans. 1972. V. 3. № 5. P. 1269–1278.
Gustafson P. A Thermodynamic Evaluation of Fe–C System // Scandinavian Journal of Metallurgy. 1985. V. 14. P. 259–267.
Frisk K. A thermodynamic evaluation of the Cr–N, Fe–N, Mo–N and Cr–Mo–N systems // CALPHAD. 1991. V. 15. № 1. P. 79–106.
Guillermet A.F., Hillert M., Jansson B., Sundman B. An Assessment of the Fe–S System Using a Two-Sublattice Model for the Liquid Phase // Met. Trans. B. 1981. V. 12(B). P. 745–754.
Qiu C. A thermodynamic evaluation of the Fe–Mn–N system// Met. Trans. A. 1992. V. 24(A). P. 629–645.
Lacaze J., Sundman B. An Assessment of the Fe–C–Si System // Met. Trans. A. 1991. V. 22A. P. 2211–2223.
Dumitrescu L.F.S., Hillert M, Saunders N. Comparison of Fe–Ti Assessments // J. Phase Equilibria. 1998. V. 19. № 5. P. 441–448.
Dinsdale A.T. SGTE data for pure elements // CALPHAD. 1991. V. 15. № 4. P. 317–425.
Kunze, J. Nitrogen and Carbon in iron and steel thermodynamics. Berlin: Akademie Verlag, 1990. 245 p.
Балковой Ю.В., Алеев П.А., Баканов В.К. Параметры взаимодействия первого порядка в твердых растворах на основе железа / Черная металлургия: обзорная информация. М.: Черметинформация, 1987. 41с.
Nishizawa, T., Ishida K., Ohtani H., Kami C., Suwa M. Experimental study on interaction parameter for carbon and alloying elements in austenite and ferrite // Scandinavian J. Metallurgy. 1991. V. 20. № 1. P. 62–71.
Дополнительные материалы отсутствуют.
Инструменты
Физика металлов и металловедение