Физиология растений, 2019, T. 66, № 1, стр. 35-45
Накопление биомассы и фенольных соединений каллусами Oxycoccus palustris Pers. и O. macrocarpus (Ait.) Pers. в присутствии разных цитокининов
Е. В. Березина a, А. А. Брилкина a, А. В. Щурова a, А. П. Веселов a
a Федеральное государственное образовательное учреждение высшего образования
Национальный исследовательский Нижегородский государственный университет
им. Н.И. Лобачевского
Нижний, Новгород, Россия
Поступила в редакцию 05.09.2017
После доработки 26.12.2017
Принята к публикации 14.01.2018
Аннотация
Цель данной работы – сравнить каллусы клюквы болотной (Oxycoccus palustris Pers.) и крупноплодной (O. macrocarpus (Ait.) Pers.) по способности к накоплению биомассы и фенольных соединений в присутствии разных цитокининов в питательной среде. У клюквы болотной каллусогенез активнее протекал на среде с кинетином (Кин), а накопление фенольных соединений и биомассы – на среде с изопентениладенином (иП). У клюквы крупноплодной каллусогенез оказался интенсивней при добавлении в среду иП; в плане накопления биомассы и фенольных соединений (в начале культивирования) несколько более высокие значения были получены при добавлении бензиламинопурина (БАП). Максимум накопления соединений фенольной природы отмечен при переходе каллусных культур к стационарной фазе (в среднем на 5 неделе пассажа; исключение – среда с БАП). Содержание растворимых фенольных соединений в каллусах клюквы болотной не превышало 11 мг/г сырой массы, в каллусах клюквы крупноплодной – 17 мг/г сырой массы. Длительно пассируемые каллусные культуры клюквы демонстрировали снижение уровня всех групп фенольных соединений (в большей степени флавоноидов); для каллусов клюквы болотной после 6–10 пассажа намечена стабилизация вторичного синтеза (в первую очередь на среде с иП). В целом, более стабильным накопление фенольных соединений у каллусов двух видов клюквы было в присутствии Кин.
ВВЕДЕНИЕ
Культуры клеток растений in vitro являются удобными системами для выяснения особенностей вторичного метаболизма и используются для получения биологически активных веществ [1–3]. Среди достоинств культивирования in vitro – преодоление сезонных и географических ограничений, возможность масштабирования и промышленного производства ценных биологически активных соединений вторичного синтеза [1, 4]. Однако содержание вторичных метаболитов в стерильных микрорастениях, каллусных и суспензионных культурах чаще всего ниже по сравнению с растениями, произрастающими в естественных условиях. Прежде всего, это может быть связано с функциональной ролью веществ вторичного синтеза. Вторичный метаболизм необходим для существования растения в реальной экологической ситуации, а в условиях in vitro клетки дедифференцируются и выходят из-под организменного контроля, присущего целому растению [1, 5]. Исследование возможности регуляции синтеза вторичных метаболитов в клеточных культурах является актуальной задачей.
К вторичным метаболитам относятся фенольные соединения, характерные для всех высших растений [1]. Фенольный метаболизм и ростовые характеристики каллусных и суспензионных культур активно изучаются для многих растительных объектов. Достаточно высок интерес к вторичному метаболизму представителей семейства вересковые (Ericaceae Juss.), что объясняется пищевыми, лечебными и декоративными качествами растений. Биохимический анализ ягод и листьев демонстрирует богатство представителей этого семейства фенольными соединениями, обладающими высокой биологической активностью.
Среди наиболее важных и известных ягодных культур семейства вересковые являются клюква болотная (Oxycoccus palustris Pers.) и клюква крупноплодная (O. macrocarpus (Ait.) Pers.). Клюква крупноплодная – это эндемик североамериканского континента, тогда как клюква болотная распространена и в Северной Америке, и в Евразии [6]. Клюква крупноплодная от клюквы болотной отличается размерами (более крупные листья, цветки и ягоды), плоидностью [6], а также рядом биохимических показателей, в т.ч. содержанием фенольных соединений [7, 8]. Закономерен вопрос: будут ли различаться эти виды в культуре in vitro и в чем будут проявляться различия?
Для клюквы крупноплодной имеется ряд исследований фенольного метаболизма в культуре клеток, а для клюквы болотной такие работы единичны [9]. Так, у каллусов клюквы крупноплодной изучалось влияние типа экспланта на накопление антоцианов и других флавоноидов, а также проантоцианидинов [4]. Показано, что максимум накопления антоцианов у каллусов стеблевого происхождения приходился на 12 день культивирования на питательной среде Гамборга с фитогормонами НУК, 2,4-Д и кинетин (Кин) при непрерывном освещении [4]. В другой работе в качестве условий, способствующих накоплению биомассы и синтезу антоцианов у каллусов клюквы крупноплодной, отмечены использование среды WPM с одновременным присутствием фитогормонов α‑нафтилуксусной кислоты (НУК), 2,4-Д, Кин и 6-бензиламинопурина (БАП), повышенным значением pH, а также снижение температуры окружающей среды и освещение красным светом [10]. При этом накопление фенольных соединений и биомассы каллусными культурами клюквы в динамике остаются не охарактеризованными.
Одним из продуктивных биотехнологических подходов для регуляции синтеза вторичных метаболитов является добавление в питательную среду фитогормонов, тип которых должен подбираться для каждого конкретного случая. Для индукции каллусогенеза in vitro необходимо применять одновременно ауксины в сочетании с цитокининами. Ранее нами было показано, что в каллусах клюквы крупноплодной в присутствии ауксина 2,4-Д содержание фенольных веществ ниже, чем в присутствии НУК [11]. В связи с этим в настоящей работе в качестве ауксина мы использовали НУК и варьировали только природой цитокинина. В качестве цитокининов нами были выбраны Кин, БАП и иП; последний широко используется для клонального микроразмножения представителей семейства Вересковые, в т.ч. клюквы крупноплодной [12]. Цель настоящего исследования – сравнить каллусы клюквы болотной и крупноплодной по способности к накоплению биомассы и фенольных соединений в присутствии разных цитокининов в питательной среде.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования явились каллусные культуры клюквы болотной (Oxycoccus palustris Pers.) и крупноплодной (O. macrocarpus (Ait.) Pers., сорт Стивенс). Для получения каллусных культур использовали листья стерильных микрорастений клюквы, размножаемых на питательной среде Андерсона. Инициацию каллусов проводила также на среде Андерсона, дополненной ауксином и цитокинином в концентрациях по 0.5 мг/л. В качестве ауксина использовали НУК, в качестве цитокинина – кинетин (Кин, 6-фурфуриламинопурин), или БАП, или 2-изопентениладенин (иП, 6‑γ,γ-диметилаллиламинопурин). Испытаны сочетания фитогормонов: НУК/Кин, НУК/БАП, НУК/иП. pH среды до автоклавирования – 5. Листья стерильных микрорастений клюквы помещали по 5 штук в сосуды на 100 мл; объем питательной среды – 25 мл. Инициацию каллусов проводили в течение 8 недель на свету (3000 лк, фотопериод – 16/8 ч) при температуре +25°C. После инициациии (т.е. после 0 пассажа) произвели оценку частоты каллусообразования.
Инициированные каллусы пересаживали на свежую питательную среду с тем же гормональным составом и культивировали при таких же температурных условиях и режиме освещения. Длительность культивирования в течение последующих трех пассажей составляла 4 недели; в течение четвертого пассажа – 7 недель, далее – по 5 недель. По окончании исследования общий период культивирования на 12 пассаже составлял 16 месяцев.
После каждого пассажа и еженедельно в течение четвертого пассажа анализировали уровень фенольных соединений. Содержание фенольных соединений в каллусах определяли спектрофотометрически (UV-1700 (Shimadzu, Япония)) и выражали в мг/г сырой массы.
Каллусы фиксировали кипящим 80% этанолом в течение 10 мин. В этанольных экстрактах определяли содержание растворимых фенольных соединений (РФС), флавоноидов и катехинов. Количественный анализ РФС осуществляли по методике, описанной М.Н. Запрометовым [13]. Для этого к 0.5 мл экстракта добавляли 8.55 мл воды, 0.5 мл реактива Фолина-Денис и через 3 мин – 1 мл 7% Na2CO3. Через 1 час определяли оптическую плотность при 725 нм.
Анализ содержания флавоноидов проводили согласно методике, приведенной G. Gunes, R.H. Liu и С.B. Watkins [14], по реакции с AlCl3. Окрашенные растворы спектрофотометрировали при длине волны 510 нм. Для этого к 0.5 мл экстракта добавляли 5 мл воды, 0.3 мл 5% NaNO2, через 5 мин – 0.3 мл 10% AlCl3, через 6 мин – 2 мл 1 М NaOH и водой доводили объем до 10 мл. Спектрофотометрировали при длине волны 510 нм.
Содержание РФС и флавоноидов определяли с использованием градуировочных зависимостей, построенных по раствору рутина.
Анализ содержания катехинов проводили согласно методике, описанной М.Н. Запрометовым [13]. Реакционная смесь состояла из 0.25 мл экстракта, 0.15 мл воды и 2 мл ванилинового реактива (1% ванилин в HClконц). Через 15 мин определяли оптическую плотность при длине волны 510 нм. Содержание катехинов определяли с использованием градуировочной зависимости, построенной по раствору катехина.
В работе использованы реактивы следующих фирм: НУК – “Serva” (Германия); кинетин – “AppliChem” (Германия); БАП и рутин – “Acros Organics” (Бельгия); иП – “Sigma”, (Швейцария); катехин – “Sigma” (США); ванилин – “Roth” (Германия). Остальные реактивы были отечественного производства, имеющие квалификацию х. ч. или ч. д. а.
В ходе четвертого пассажа также определяли динамику роста каллусных тканей по сырой и сухой биомассе. Высушивание проводили в термостате при 60°C до постоянной массы. Индекс роста выражали величиной отношения разности конечной и первоначальной массы к массе первоначального каллуса (mi – m0)/m0. Работы, связанные с определением массы, проведены в трехкратной повторности; на графиках отражены средние арифметические значения и их стандартные отклонения.
В случаях количественного определения фенольных соединений на графиках представлены средние арифметические значения из трех биологических проб (по 2–5 каллусов; каждая проба выполнена в трех аналитических повторностях), и их стандартные отклонения. Статистическую обработку полученных результатов производили с помощью программы Microsoft Excel 2010. Достоверность различий определяли, используя коэффициент Стьюдента (статистически значимыми считали различия при р < 0.05).
РЕЗУЛЬТАТЫ
Инициированные каллусы клюквы болотной и крупноплодной (табл. 1) имели плотную консистенцию и желтый цвет. Каллусы клюквы крупноплодной были больше по размеру, чем каллусы клюквы болотной, и содержали коричневые участки как внутри, так и на поверхности каллусной ткани.
Таблица 1.
Внешний вид первичных каллусов и частота каллусогенеза у клюквы болотной и крупноплодной
| Вид | НУК/Кин | НУК/БАП | НУК/иП |
|---|---|---|---|
| $\left[ {\frac{{^{{}}}}{{_{{}}}}} \right.$Клюква болотная |  84%
84%
|
 40%
40%
|
 76% |
| Клюква крупноплодная |  36% |
 48% |
 88% |
Способность к каллусообразованию листовыми эксплантами клюквы болотной и крупноплодной на средах с разными цитокининами была различной (табл. 1). Для клюквы болотной максимальное образование каллусов происходило в присутствии Кин (84%), тогда как для клюквы крупноплодной, наоборот, оно было минимальным (36%). Высокая частота каллусообразования у клюквы крупноплодной наблюдалась в варианте с иП (88%).
Суммарное содержание РФС в инициированных каллусах варьировало в зависимости от гормонального состава среды: у клюквы болотной – в пределах от 6 до 10 мг/г сырой массы, у клюквы крупноплодной – от 8 до 13 мг/г сырой массы (рис. 1). Для каллусов клюквы болотной при выращивании на питательной среде с иП отмечена наибольшая продукция РФС, а для каллусов клюквы крупноплодной – наоборот, наименьшая.
Рис. 1.
Уровень фенольных соединений в каллусах в течение 0, 1, 2 и 3 пассажей. (а) – каллусы клюквы болотной на среде с НУК/Кин; (б) – каллусы клюквы болотной на среде с НУК/БАП; (в) – каллусы клюквы болотной на среде с НУК/иП; (г) – каллусы клюквы крупноплодной на среде с НУК/Кин; (д) – каллусы клюквы крупноплодной на среде с НУК/БАП; (е) – каллусы клюквы крупноплодной на среде с НУК/иП. 1 – растворимые фенольные соединения; 2 – флавоноиды; 3 – катехины. * – уровень фенольных соединений у каллусов клюквы крупноплодной достоверно (р < 0.05) выше, чем у клюквы болотной в тех же условиях культивирования. БАП – 6-бензиламинопурин; иП – 2-изопентениладенин; Кин – кинетин; НУК – α-нафтилуксусная кислота.
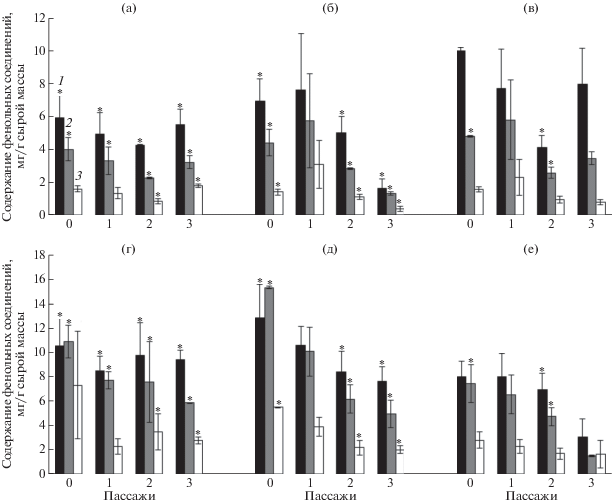
Изменение уровня исследуемых фенольных метаболитов после каждого из трех следующих пассажей зависело как от вида клюквы, так и цитокинина в питательной среде. В частности, в присутствии БАП у каллусов обоих видов клюквы содержание РФС, флавоноидов и катехинов неуклонно снижалось, за исключением первого пассажа для каллусов клюквы болотной. Для каллусов клюквы крупноплодной, культивируемых на среде с иП, значительное снижение РФС и флавоноидов отмечено лишь после третьего пассажа. Наиболее стабильный синтез фенольных соединений для каллусов обоих видов клюквы выявлен в присутствии Кин. Доля флавоноидов в фенольном комплексе каллусов клюквы болотной в среднем составляла 62%, а каллусов клюквы крупноплодной – 82%.
В ходе 4 пассажа анализ содержания исследуемых метаболитов в каллусах проводили каждую неделю в течение 7 недель; кроме того, определяли динамику роста по сырой и сухой биомассе. Результаты такого исследования показали, что через неделю после пассирования уровень фенольных соединений становился до 3 раз меньше, чем в конце предыдущего (третьего) пассажа (рис. 1, 2). Затем биосинтетическая способность культур возрастала в 2–3 раза. При этом время максимального накопления фенольных соединений зависело как от типа цитокинина в питательной среде, так и от вида клюквы. Так, в присутствии Кин или иП наблюдался выраженный максимум накопления, в большинстве случаев приходившийся на 5 неделю культивирования. В случае с БАП ярко выраженный пик в накоплении фенольных соединений отмечен не был.
Рис. 2.
Динамика накопления фенольных соединений в каллусах в течение 7 недель одного пассажа. (а) – динамика накопления растворимых фенольных соединений (РФС) в каллусах клюквы болотной; (б) – динамика накопления растворимых фенольных соединений (РФС) в каллусах клюквы крупноплодной; (в) – динамика накопления флавоноидов в каллусах клюквы болотной; (г) – динамика накопления флавоноидов в каллусах клюквы крупноплодной; (д) – динамика накопления катехинов в каллусах клюквы болотной; (е) – динамика накопления катехинов в каллусах клюквы крупноплодной. Цифрами (1–7) обозначены недели пассажа. БАП – 6-бензиламинопурин; иП – 2-изопентениладенин; Кин – кинетин; НУК – α-нафтилуксусная кислота; РФС – растворимые фенольные соединения.
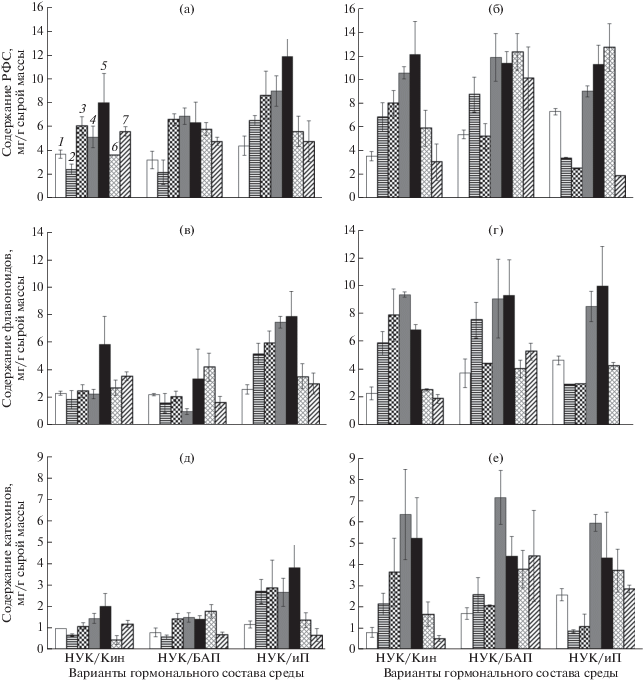
Выявлена различная для каллусов клюквы двух видов реакция на присутствие иП. Содержание всех исследованных групп фенольных соединений – РФС, флавоноидов и катехинов в каллусах клюквы крупноплодной, культивируемых на питательной среде с иП, снижалось на второй и третьей неделе, после чего возрастало (рис. 2б). Подобного снижения для каллусов клюквы болотной не отмечено (рис. 2а).
Содержание фенольных соединений в каллусах клюквы болотной на среде с иП было выше, чем с другими цитокининами, и сопоставимо с таковым в каллусах клюквы крупноплодной. На средах, содержащих в качестве цитокининов Кин и БАП, каллусы клюквы болотной в ходе пассажа накапливали в целом вдвое меньше исследуемых метаболитов, чем каллусы клюквы крупноплодной на этих же средах. Выявленная особенность вторичного синтеза почти всегда распространялась на исследованные группы фенольных соединений: суммарное содержание РФС, содержание флавоноидов и катехинов.
Интересно изменение доли флавоноидов в составе РФС в течение пассажа. У каллусов клюквы крупноплодной она увеличивалась с 65% (первая неделя) до 86% (четвертая неделя), затем снижалась. У каллусов клюквы болотной рассматриваемый показатель имел более сложный характер изменений по неделям: 64% после первой недели, 47% – после второй, 71% – после шестой. В целом, вклад флавоноидов в фенольный комплекс каллусов клюквы болотной был выше на среде с иП, а крупноплодной – с БАП.
В табл. 2 представлен индекс роста каллусов, рассчитанный по их сырой и сухой массе на 5 и 7 неделе культивирования. Наилучший прирост сырой биомассы каллусов отмечен на среде с иП в случае с клюквой болотной и на среде с БАП в случае клюквы крупноплодной. Максимальное увеличение сухой массы каллусов обоих видов происходило на среде с БАП.
Таблица 2.
Индекс роста каллусов клюквы болотной и крупноплодной (по сырой/сухой массе) на 5 и 7 неделях пассажа
| Вид | НУК/Кин | НУК/БАП | НУК/иП | |||
|---|---|---|---|---|---|---|
| 5 неделя | 7 неделя | 5 неделя | 7 неделя | 5 неделя | 7 неделя | |
| Клюква болотная | 1.87/1.22 | 2.04/1.24 | 1.30/1.51 | 2.66/2.41 | 3.52/1.36 | 3.74/1.46 |
| Клюква крупноплодная | 1.16/1.19 | 1.26/0.91 | 1.61/3.60 | 2.54/4.70 | 1.13/1.91 | 1.75/3.22 |
Анализ кривых роста каллусных культур показал, что переход каллусных тканей к стационарной фазе роста приходился на 4 неделю (клюква крупноплодная, среда с Кин) или 5–6 неделю (остальные варианты, кроме среды с БАП) (рис. 3). Каллусы обоих видов клюквы в присутствии БАП даже к 7 неделе культивирования не достигали стационарной фазы. Следует добавить, что к 6–7 неделе культивирования все каллусные культуры приобретали коричневую окраску.
Рис. 3.
Динамика накопления сырой биомассы каллусов в течение 7 недель одного пассажа. (а) – каллусы клюквы болотной; (б) – каллусы клюквы крупноплодной. 1 – среда с НУК/Кин; 2 – среда с НУК/БАП; 3 – среда с НУК/иП. БАП – 6-бензиламинопурин; иП – 2-изопентениладенин; Кин – кинетин; НУК – α-нафтилуксусная кислота.

В связи с полученными данными перенос каллусов на свежую питательную среду в дальнейшем осуществляли каждые 5 недель. Результаты анализа содержания РФС, флавоноидов и катехинов после 6, 8, 10 и 12 пассажей позволили выявить следующие особенности накопления исследуемых метаболитов в каллусных культурах. Способность к синтезу фенольных соединений каллусами клюквы болотной за рассматриваемый период практически не менялась (рис. 4). Исключением являлось повышение уровня исследуемых метаболитов после 8 пассажа в присутствии Кин (в 3 раза) и БАП (в 1.5 раза). Способность к синтезу фенольных соединений каллусами клюквы крупноплодной за период 6–12 пассажей снижалась как минимум в три раза (исключение – 12 пассаж для каллусов на среде с Кин). Особенно заметно снижение на примере каллусов, выращенных на среде с иП (более, чем в 9 раз).
Рис. 4.
Уровень фенольных соединений в каллусах в течение 6, 8, 10 и 12 пассажей. (а) – каллусы клюквы болотной на среде с НУК/Кин; (б) – каллусы клюквы болотной на среде с НУК/БАП; (в) – каллусы клюквы болотной на среде с НУК/иП; (г) – каллусы клюквы крупноплодной на среде с НУК/Кин; (д) – каллусы клюквы крупноплодной на среде с НУК/БАП; (е) – каллусы клюквы крупноплодной на среде с НУК/иП. 1 – растворимые фенольные соединения; 2 – флавоноиды; 3 – катехины. * – уровень фенольных соединений у каллусов клюквы крупноплодной достоверно (р < 0.05) выше, чем у клюквы болотной в тех же условиях культивирования. БАП – 6-бензиламинопурин; иП – 2-изопентениладенин; Кин – кинетин; НУК – α-нафтилуксусная кислота.
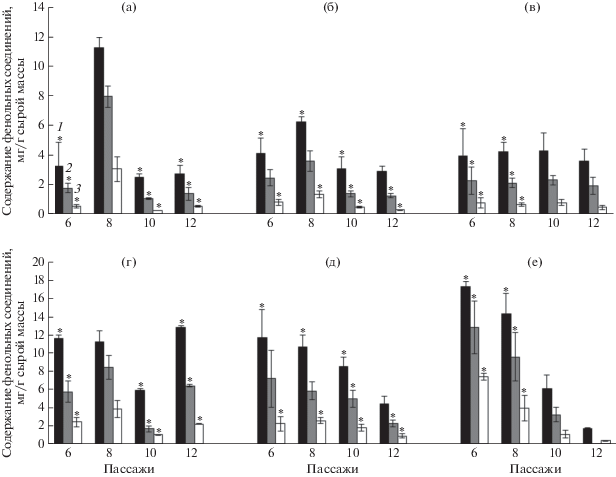
Доля флавоноидов в фенольном комплексе каллусов клюквы болотной и крупноплодной за 6–12 пассажей в среднем составила 53 и 57% соответственно, что ниже, чем в среднем за 0–3 пассажа.
Сравнение уровня фенольных соединений в каллусах клюквы болотной и крупноплодной, полученных после инициации и после культивирования в течение 12 пассажей, указывает на снижение количества всех исследованных метаболитов в 2–8 раз. В меньшей степени это коснулось суммарного содержания РФС, но сказалось на представленности флавоноидов и катехинов в фенольном комплексе каллусных культур клюквы (уменьшение в 1.2–1.4 раза и 1.5 раза соответственно).
ОБСУЖДЕНИЕ
Говоря о влиянии фитогормонов цитокининовой природы на культуры клюквы болотной и клюквы крупноплодной in vitro, прежде всего, отметим их разное влияние на каллусогенез. Высокую частоту каллусогенеза у клюквы болотной обеспечивало присутствие в питательной среде Кин, а у клюквы крупноплодной – иП (табл. 1). При этом отмеченные варианты культивирования, в большей степени способствовавшие инициации каллусной ткани, давали пониженное накопление фенольных веществ (табл. 1, рис. 1).
В ходе пассажа прирост массы каллусов составил до 470%. Большее накопление сырой биомассы каллусов клюквы болотной обеспечивал вариант культивирования с иП, а каллусов клюквы крупноплодной – БАП (табл. 2). Большее накопление сухой биомассы каллусов обоих видов клюквы обеспечивал вариант культивирования с БАП. При этом обращает на себя внимание непропорциональное увеличение индексов роста по сырой и сухой биомассе. Анализ литературных [15, 16] и собственных данных позволяет заключить, что у каллусов клюквы болотной в присутствии Кин и иП происходило увеличение обводненности ткани. Кин в некоторой степени способствовал накоплению воды и в каллусах клюквы крупноплодной (7 неделя пассажа). В отличие от вышеописанных случаев, на средах с иП и БАП для каллусов клюквы крупноплодной отмечены более высокие индексы по сухой биомассе, нежели по сырой. Принимая во внимание увеличение этих показателей на 7 неделе культивирования по сравнению с 5 неделей, можно предположить, что эти цитокинины у каллусов клюквы крупноплодной стимулировали деление клеток и/или накопление органического вещества.
Присутствие Кин в питательной среде для каллусов клюквы крупноплодной уменьшило длительность фаз роста (переход к стационарной фазе роста на 4 неделе) по сравнению с остальными вариантами культивирования. Подобный эффект Кин также был показан в отношении каллусов чая в работе М.Н. Запрометова и др. [17]. Культуры клюквы, полученные на средах с БАП, наоборот, даже за 7 недель эксперимента не достигали стационарной фазы роста, а находились в фазе линейного роста. БАП проявляет более высокую активность в поддержании роста, чем Кин [18], что было отмечено T. Harada и T. Yakuwa [19] на примере другого представителя семейства Вересковые – голубики щитковой. Авторы наблюдали стимулирующий эффект гормонального сочетания НУК (1–10 мг/л) и БАП (0.1–1 мг/л) на рост гетеротрофных каллусов, культивируемых в течение 10 недель [19].
Рассматривая вопрос о характере накопления биомассы и вторичных метаболитов у каллусных культур в течение пассажа, необходимо отметить, что синтез вторичных соединений, в основном, улучшается при замедлении или остановке роста культуры [5]. Очевидно, что каллусы клюквы в целом не являются исключением: максимум накопления фенольных соединений в них приходился при замедлении роста (к моменту выхода ростовой кривой на плато) (рис. 2, 3). В дальнейшем снижение уровня фенольных соединений могло быть следствием истощения питательной среды [4]. Добавим, что имевшее место снижение содержания фенольных соединений на 2–3 неделях культивирования у каллусов клюквы крупноплодной в варианте с иП можно объяснить привыканием каллусной ткани к питательной среде.
У каллусов клюквы болотной в присутствии иП, по сравнению с другими цитокининами, наблюдались как интенсивный прирост биомассы, так и продукция фенольных соединений. У каллусов клюквы крупноплодной чуть более высокие показатели выявлены в случае среды, содержащей БАП. Отмеченное нами различие в уровне фенольных соединений в каллусах клюквы двух видов в присутствии Кин, БАП и иП может быть опосредовано различным влиянием этих фитогормонов на процессы метилирования/деметилирования ДНК. Известно, что при каллусогенезе изменяется характер метилирования ДНК в сторону его увеличения [20], и это может быть причиной снижения продукции ферментов, в т.ч. ферментов вторичного синтеза. Например, метилирование гена фермента стильбенсинтазы приводило к уменьшению продукции такого фенольного соединения, как резвератрол, в каллусах винограда [21]. При этом для БАП описана деметилирующая активность, как минимум в отношении генов рРНК [22].
При выяснении влияния возраста (длительности пассирования) каллусной ткани на продукцию фенольных соединений нами было зафиксировано снижение содержания РФС, флавоноидов и катехинов в течение первых трех пассажей для клюквы обоих видов, а также в течение 6–12 пассажей для клюквы крупноплодной. Наиболее заметное снижение происходило в присутствии в питательной среде БАП, а также иП. Ослабление образования фенольных соединений отмечалось при длительном выращивании в условиях in vitro одного из штаммов каллусов чайного растения [23], боярышника азароль [24]. Вероятно, такое явление объясняется отбором клеток с низкой способностью к синтезу фенольных соединений, но с повышенной жизнеспособностью [25] и измененным (повышенным) уровнем плоидности клеток [23].
В то же время для ряда каллусных культур других растений отмечено увеличение накопления фенольных соединений по мере пассирования: до 5–7 пассажа у фотомиксотрофных каллусов чая [26], а также до 10 пассажа у каллусов нута бараньего [27] и до 27 пассажа у каллусов рододендрона Ледебура [28]. У каллусов рододендрона японского отмечено увеличение содержания РФС, флаванов, проантоцианидинов лишь до 13 пассажа, в дальнейшем наблюдалось снижение, что позволяло каллусам данного вида длительное время сохранять жизнеспособность, в отличие от каллусов рододендрона Ледебура [28]. Подобный характер накопления фенольных соединений выявлен для каллусных культур двух видов тисса: по мере пассирования у тисса ягодного наблюдалось увеличение содержания РФС (а в дальнейшем – гибель самих культур), тогда как у тисса канадского – уменьшение, начиная с 7 пассажа [25].
Причиной колебаний в продукции тех или иных метаболитов в молодых каллусных культурах, скорее всего, является их генетическая и эпигенетическая нестабильность, т.к. в культуре in vitro изменяется экспрессия генов, нарушается нормальный клеточный цикл в результате поранения и/или использования регуляторов роста [1, 20]. Загоскиной Н.В. [29] установлено, что содержание РФС и флаванов в гетеротрофных каллусах чая почти не менялось лишь после 15–20 пассажа. Для фотомиксотрофных каллусов клюквы болотной стабильность вторичного синтеза наблюдалась, начиная с 6–10 пассажа, причем раньше всего она проявилась у культур, выращенных на среде с иП (рис. 4). В этом случае можно предположить, что уровень синтеза фенольных соединений (около 4 мг РФС/г сырой массы) в каллусных клетках способствует их устойчивой пролиферации и является следствием популяционного контроля развития [5]. У каллусов клюквы крупноплодной за рассматриваемый период культивирования (16 мес.) стабилизация синтеза не произошла, не был достигнут тот уровень, который не изменялся хотя бы на протяжении трех циклов культивирования и который был бы востребован клетками в стерильных условиях и одновременно не ограничивал пролиферацию. Возможно, отсутствие стабилизации в этом случае отчасти могло быть связано с изменением длительности пассажей.
При сравнении двух видов клюквы между собой можно указать на то, что в присутствии Кин и БАП каллусы клюквы болотной накапливали, как правило, меньше фенольных соединений, чем каллусы клюквы крупноплодной (рис. 1, 2, 4). Уровень накопления фенольных веществ в каллусах клюквы (в целом) может быть сопоставим с таковым в каллусах рододендрона [28], чая [2, 15], боярышника [3].
По сравнению с листьями растений открытого грунта биосинтетическая способность к образованию фенольных соединений имеющихся каллусов клюквы болотной и крупноплодной существенно снижена (особенно флавоноидов – до двух порядков), но может быть сопоставима с ягодами [4, 7, 8]. Снижение способности к синтезу фенольных соединений по сравнению с интактными растениями было описано и для каллусов чая [17, 30], боярышника [3], рододендрона [28]. Наоборот, содержание фенольных соединений в каллусных культурах тисса (особенно во время первых циклов культивирования) значительно выше, чем в тканях интактных растений [25].
Доля флавоноидов в фенольном комплексе листьев клюквы крупноплодной выше, чем клюквы болотной [7, 8], и полученные каллусы в течение первых пассажей сохраняли это межвидовое различие, однако в условиях длительного культивирования in vitro оно было нивелировано в результате упрощения вторичного синтеза.
По всей видимости, в отношении накопления фенольных веществ в каллусах существует лимит; избыточное их содержание коррелирует с приобретением культуры коричневой окраски и некротическими явлениями, что говорит о повышении активности оксидаз [27]. Полученные нами результаты по содержанию фенольных соединений в каллусных культурах клюквы вне зависимости от фитогормонального (цитокининового) состава среды и возраста каллусов не превышали определенных значений. В связи с этим представляется вероятным, что концентрация РФС более 11 мг/г сырой массы для каллусов клюквы болотной и более 17 мг/г сырой массы для каллусов клюквы крупноплодной является чрезвычайно высокой и может вызвать остановку роста и/или гибель культур. В целом, в каллусах клюквы болотной диапазон содержания РФС составил 2–11 мг/г сырой массы, флавоноидов – 1–8 мг/г сырой массы, катехинов – от следовых количеств до 4 мг/г сырой массы; в каллусах клюквы крупноплодной – соответственно, 2–17 мг/г сырой массы, от следовых количеств до 15 мг/г сырой массы, от следовых количеств до 7 мг/г сырой массы.
В клеточной культуре образование и накопление вторичных соединений со сложной структурой менее вероятно в силу большого числа специфических этапов их синтеза после “ответвления” от первичного метаболизма [5]. Эту особенность вторичного метаболизма культур in vitro можно проследить на примере флавоноидов, синтез которых совмещает два пути образования фенольных соединений в растительной клетке: ацетатный и шикиматный. По мере пассирования каллусов клюквы нами выявлено снижение представленности флавоноидов (в т.ч. катехинов) в фенольном комплексе, что согласуется с данными, полученными в отношении доли флаванов в каллусах тисса [25] и чая [26]. Таким образом, в каллусных культурах клюквы произошло упрощение вторичного синтеза. Снижение доли флавоноидов, возможно, является следствием слабого развития фотосинтетического аппарата у каллусов из-за использования готового органического углерода питательной среды [30]. Согласно данным литературы, генетическая стабильность каллусных культур может быть достигнута даже через несколько лет после инициации, и только тогда из наиболее перспективных линий рекомендуется получать уже суспензионные культуры [1], поэтому продолжение работ по изучению содержания фенольных соединений в каллусах клюквы остается актуальным и имеет большое фундаментальное и прикладное значение.
В целом, каллусы клюквы болотной и крупноплодной по-разному отвечали накоплением биомассы и фенольных соединений на природу цитокинина. Проведенное исследование дает основание для контроля и направленного биосинтеза фенольных соединений в культуре тканей и клеток клюквы при варьировании гормонального состава среды. С целью получения увеличенного количества фенольных соединений в каллусах клюквы болотной на ранних этапах культивирования (0–1 пассажи) лучше использовать иП, а крупноплодной – БАП. Однако длительное пассирование каллусных культур на среды с этими цитокининами ведет к снижению содержания фенольных соединений. Более стабильное накопление фенольных соединений у каллусов двух видов клюквы обеспечивает наличие Кин в питательной среде.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 16-34-00529 мол_а.
Список литературы
Bourgaud F., Gavot A., Milesi F., Gontier E. Production of plant secondary metabolites: a historical perspective // Plant Sci. 2001. V. 161. P. 839–851.
Загоскина Н.В., Гончарук Е.А., Алявина А.К. Изменения в образовании фенольных соединений при действии кадмия на каллусные культуры, инициированные из различных органов чайного растения // Физиология растений. 2007. Т. 54. С. 267–274.
Chaâbani G., Tabart J., Kevers C., Dommes J., Khan M.I., Zaoui S., Chebchoub L., Lachaâl M., Karray-Bouraoui N. Effect of 2,4-dichlorophenoxyacetic acid combined to 6-Benzylaminopurine on callus induction, total phenolic and ascorbic acid production, and antioxidant activities in leaf cultures of Crataegus azarolus L. var. aronia // Acta Physiol. Plant. 2015. V. 37. doi 10.1007/s11738-014-1769-4
Madhavi D.L., Smith M.A.L., Berber-Jiménez M.D. Expression of anthocyanins in callus cultures of cranberry (Vaccinium macrocarpon Ait.) // J. Food Sci. 1995. V. 60. P. 351–355.
Носов А.М. Функции вторичных метаболитов растений in vivo и in vitro // Физиология растений. 1994. Т. 41. С. 873–878.
Помология. В 5 т. Т. V. Земляника. Малина. Орехоплодные и редкие культуры / Под ред. Седова Е.Н., Грюнер Л.А. Орел: изд-во ВНИИСПК. 2014. 592 с.
Березина Е.В., Брилкина А.А., Веселов А.П. Содержание фенольных соединений в листьях и плодах Vaccinium vitis-idaea и Oxycoccus palustris (Ericaceae) в разные периоды вегетации // Растит. ресурсы. 2015. Т. 51. С. 88–100.
Berezina E.V., Brilkina A.A., Veselov A.P. Content of phenolic compounds, ascorbic acid, and photosynthetic pigments in Vaccinium macrocarpon Ait. dependent on seasonal plant development stages and age (the example of introduction in Russia) // Sci. Hortic. 2017. V. 218. P. 139–146.
Березина Е.В., Агеева М.Н., Брилкина А.А., Веселов А.П. Содержание полифенолов в каллусных культурах клюквы болотной при модификации питательной среды цитокининами и препаратами микромицетов // Вестник защиты растений. 2016. № 3. С. 26–27.
Zhou Y., Singh B.R. Characterization of environmental stress-regulated anthocyanin production and growth of cranberry callus // J. Appl. Hort. 2007. V. 9. P. 17–21.
Березина Е.В., Брилкина А.А. Содержание фенольных соединений у Oxycoccus macrocarpus (Ait.) Pers. (сорт “Ранний черный”) в условиях in vivo и in vitro // Известия УНЦ РАН. 2013. №3. С. 91–94.
Debnath S.C., McRae K.B. An efficient in vitro shoot propagation of cranberry (Vaccinium macrocarpon Ait.) by axillary bud proliferation // Plant Cell Tiss. Organ Cult. 2008. V. 93. P. 231–240.
Запрометов М.Н. Фенольные соединения и методы их исследования // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 185–197.
Gunes G., Liu R.H., Watkins C.B. Controlled-atmosphere effects on postharvest quality and antioxidant activity of cranberry fruits // J. Agric. Food Chem. 2002. V. 50. P. 5932–5938.
Загоскина Н.В., Усик Т.У., Запрометов М.Н. Влияние длительности освещения на фенольный метаболизм фотомиксотрофных каллусных культур чайного растения // Физиология растений. 1990. Т. 37. С. 1089–1094.
Филиппова В.Н., Володина С.О., Смоленская И.Н., Зоринянц С.Э., Володин В.В. Экдистероиды в культурах клеток Serratula coronata и Ajuga reptans // Химия растительного сырья. 2002. №1. С. 57–62.
Запрометов М.Н., Стрекова В.Ю., Субботина Г.А., Загоскина Н.В. Действие кинетина на дифференциацию и образование фенольных соединений в каллусной культуре чайного растения // Физиология растений. 1986. Т. 33. С. 356–364.
Tan S.H., Musa R., Ariff A., Maziah M. Effect of plant growth regulators on callus, cell suspension and cell line selection for flavonoid production from pegaga (Centella asiatica L. urban) // Am. J. Biochem. Biotech. 2010. V. 6. P. 284–299.
Harada T., Yakuwa T. Basic studies on the vegetative propagation of horticultural plants. IV. Callus formation in the in vitro culture of current shoot segments of highbush blueberry // J. Fac. Agr. Hokkaido Univ. 1984. V. 61. P. 419–425.
Ghosh A., Igamberdiev A.U., Debnath S.C. Detection of DNA methylation pattern in thidiazuron-induced blueberry callus using methylation-sensitive amplification polymorphism // Biol. Plantarum. 2017. V. 61. 3. P. 511–519.
Kiselev K.V., Tyunin A.P., Zhuravlev Y.N. Involvement of DNA methylation in the regulation of STS10 gene expression in Vitis amurensis // Planta. 2013. V. 237. P. 933–941.
Сабиржанов Б.Е., Бикбулатова С.М., Фатхутдинова Р.А., Чемерис А.В., Шакирова Ф.М., Вахитов В.А. Влияние 6-бензиламинопурина на метилирование цитозиновых остатков промоторных областей межгенного спейсера рДНК Triticum aestivum и Triticum urartu // Физиология растений. 2007. Т. 54. С. 235−242.
Загоскина Н.В., Федосеева В.Г., Фролова Л.В., Азаренкова Н.Д., Запрометов М.Н. Культура ткани чайного растения: дифференциация, уровень плоидности, образование фенольных соединений // Физиология растений. 1994. Т. 41. С. 762–767.
Bahri-Sahloul R., Fredj R.B., Boughalleb N., Shriaa J., Saguem S., Hilbert J.-L., Trotin F., Ammar S., Bouzid S., Harzallah-Skhiri F. Phenolic composition and antioxidant and antimicrobial activities of extracts obtained from Crataegus azarolus L. var. aronia (Willd.) Batt. ovaries calli // J. Bot. 2014. V. 2014. doi 10.1155/ 2014/623651
Dubravina G.A., Zaytseva S.M., Zagoskina N.V. Changes in formation and localization of phenolic compounds in the tissues of European and Canadian yew during differentiation in vitro // Russ. J. Plant Physiol. 2005. V. 52. P. 672−678.
Запрометов М.Н., Загоскина Н.В. Еще об одном доказательстве участия хлоропластов в биосинтезе фенольных соединений // Физиология растений. 1987. Т. 34. С. 165–172.
Naz S., Ali A., Iqbal J. Phenolic content in vitro cultures of chick pea (Cicer arietinum L.) during callogenesis and organogenesis // Pak. J. Bot. 2008. V. 40. P. 2525–2539.
Костина В.М. Особенности фенольного метаболизма растений рода Rhododendron L. in vivo и in vitro: Автореф. дисс. канд. биол. наук. М., 2009. 22 с.
Загоскина Н.В. Особенности метаболизма фенольных соединений гетеротрофных и фотомиксотрофных каллусных культур чайного растения (C-amellia sinensis L.): Автореф. дис. ... докт. биол. наук. М., 1997. 49 с.
Стрекова В.Ю., Загоскина Н.В., Субботина Г.А., Запрометов М.Н. Влияние длительного освещения на синтез фенольных соединений и формирование хлоропластов в каллусных тканях чайного растения // Физиология растений. 1989. Т. 36. С. 83–87.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


