Физиология растений, 2019, T. 66, № 4, стр. 277-285
Стресс-протекторные реакции проростков пшеницы и ржи при индуцировании устойчивости к низким температурам донором сероводорода
Ю. Е. Колупаев a, Е. И. Горелова a, Т. О. Ястреб a, Н. И. Рябчун b, В. В. Кириченко a, b
a Харьковский национальный аграрный университет им. В.В. Докучаева
Харьков, Украина
b Институт растениеводства им. В.Я. Юрьева
Национальной академии аграрных наук Украины
Харьков, Украина
Поступила в редакцию 01.08.2018
После доработки 31.08.2018
Принята к публикации 06.09.2018
Аннотация
Исследовали влияние донора сероводорода гидросульфида натрия (NaHS) на устойчивость проростков озимых пшеницы (Triticum aestivum L.) и ржи (Secale cereale L.) к действию отрицательных температур. Обработка незакаленных проростков NaHS в концентрациях 0.1 и 0.5 мМ вызывала повышение их выживания после промораживания при температуре –5°С. Воздействие NaHS в таких же концентрациях увеличивало и выживание закаленных при 2–4°С проростков пшеницы и ржи после их промораживания при –9°С. Под влиянием донора сероводорода в проростках обоих видов при обычной температуре (20–22°С) и в условиях холодового закаливания отмечалось повышение содержания сахаров и пролина. Содержание антоцианов при обработке гидросульфидом натрия увеличивалось только у проростков пшеницы. Донор сероводорода также индуцировал повышение активности каталазы и гваяколпероксидазы в проростках обоих видов при обычной и закаливающей температурах, активность супероксиддисмутазы при этом существенно не изменялась. Под влиянием NaHS у обоих видов уменьшалось накопление малонового диальдегида, вызываемое криострессом. Обсуждаются видовые особенности вклада различных компонентов стресс-протекторных систем в индуцированное сероводородом и закаливанием развитие устойчивости к отрицательным температурам.
ВВЕДЕНИЕ
В настоящее время сероводород (H2S) считается одной из важных газообразных сигнальных молекул в клетках животных и растений [1]. Изучение физиологических эффектов этого газотрансмиттера представляет особый интерес как для познания фундаментальных механизмов формирования адаптивных реакций растений, так и для разработки практических приемов, называемых “праймингом” (priming). Под этим термином понимают индуцирование устойчивости действием сигнальных молекул или их доноров, во многом похожее на естественные процессы закаливания растений и позволяющие им адаптироваться к экстремальным температурам и другим неблагоприятным факторам [2]. Использование сероводорода в качестве праймирующего агента может быть перспективным в связи с наличием его стабильных и относительно недорогих доноров [3].
Несмотря на то, что за последнее десятилетие получен довольно большой объем сведений о стресс-протекторном действии доноров сероводорода на растения, остаются малоисследованными его механизмы, видовые особенности и даже феноменология эффектов при различных стрессовых воздействиях [1, 3]. Так, в ряде работ показано положительное влияние экзогенного сероводорода на устойчивость растений к гипертермии. Установлено уменьшение под влиянием гидросульфида натрия окислительных повреждений клеток табака [4] и растений клубники [5], повышение выживания проростков кукурузы [6] и колеоптилей пшеницы [7] после повреждающего нагрева. Индуцирование сероводородом теплоустойчивости злаковых растений сопровождалось повышением в них активности антиоксидантных ферментов (супероксиддисмутазы – СОД, каталазы – КАТ, гваяколпероксидазы – ГПО), а также пула восстановленных аскорбата и глутатиона [6, 7].
В то же время данных о роли сероводорода в устойчивости растений к низким температурам значительно меньше. Показано транзиторное повышение эндогенного содержания сероводорода и усиление экспрессии генов ключевых ферментов его синтеза – L-/D-цистеиндесульфгидраз – при действии температуры 4°С у растений винограда [8]. Такой же эффект выявлен и у растений арабидопсиса; с использованием мутантов, дефектных по генам цистеиндесульфгидраз, показана роль сероводорода в активации холодочувствительных генов COR15 и CBF3 [9]. У растений огурца показано повышение под влиянием донора сероводорода активности и усиление экспрессии генов нескольких молекулярных форм H+-АТФазы плазматической мембраны корней при действии пониженной температуры (10°С) [10]. Среди злаков влияние сероводорода на устойчивость к гипотермии изучено лишь на растениях свинороя пальчатого (Cynodon dactylon L.) [11]. Показано повышение активности антиоксидантных ферментов у этих растений при обработке 500 мкМ NaHS перед воздействием закаливающей температуры 4°С, а также их выживания при последующем промораживании при –10°С.
Известно, что адаптация к гипотермии представляет собой сложный процесс, включающий в себя изменения жирнокислотного (ЖК) состава мембран в пользу остатков ненасыщенных ЖК, накопление криопротекторов, синтез специфических защитных белков, активацию антиоксидантной системы и альтернативного дыхания [12–14]. При этом вклад различных протекторных систем в формирование холодо- и морозоустойчивости растений может различаться в зависимости от видовых особенностей растений. Так, даже среди различных видов культурных злаков выявлены заметные отличия по вкладу отдельных антиоксидантных ферментов и полифункциональных низкомолекулярных протекторов в поддержание гомеостаза при действии холода. Например, для растений ржи характерны значительное накопление пролина и антоцианов, повышенная конститутивная активность пероксидаз, в то время как у растений пшеницы и ячменя происходит более заметное индуцирование холодом СОД и КАТ [15].
В целом, действие сероводорода на устойчивость растений к гипотермии и функционирование их конкретных протекторных систем в условиях действия низких температур до сих пор изучено очень слабо, а работы, в которых бы сравнивалось влияние доноров H2S на растения разных таксономических групп, вообще отсутствуют. В связи с этим представлялось целесообразным изучить влияние донора сероводорода гидросульфида натрия на устойчивость к гипотермии и процесс холодового закаливания проростков пшеницы и ржи, которые, как было показано ранее [16], отличаются между собой специфическими особенностями функционирования антиоксидантной и осмопротекторной систем.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследований использовали этиолированные проростки озимых пшеницы (Triticum aestivum L.) сорта Досконала и ржи (Secale cereale L.) сорта Память Худоерко. Семена в течение 40 мин обеззараживали в 6% растворе пероксида водорода, тщательно многократно промывали дистиллированной водой и затем проращивали в темноте при температуре 20–22°С на фильтровальной бумаге, смоченной очищенной водопроводной водой.
В серии экспериментов по исследованию влияния донора сероводорода на устойчивость проростков к криострессу гидросульфид натрия (NaHS) в концентрациях диапазона 0.025–1 мМ добавляли в среду в начале проращивания семян и на третьи сутки. Через 4 суток этиолированные проростки использовали для биохимических анализов и подвергали промораживанию в камере Danfoss (Нидерланды) в отсутствие света при –5°С в течение 4 ч, снижая температуру со скоростью 1°C/ч. Перед началом промораживания излишки воды на фильтрах под проростками удаляли фильтровальной бумагой. Для оттаивания проростков температуру в камере повышали до 2°С со скоростью 1°С/ч. После этого проростки отращивали в течение 3 суток при 20–22°С и освещенности 6 клк и оценивали их выживание.
В экспериментах по изучению влияния донора сероводорода на развитие морозоустойчивости пшеницы и ржи при закаливании 3-дневные этиолированные проростки обрабатывали NaHS и помещали на 7 суток в холодильную камеру (без освещения) с температурой 2–4°С. Через 3 суток закаливания проростки соответствующих вариантов повторно обрабатывали растворами гидросульфида натрия, добавляя их соответствующие количества на фильтры под проростками. Контрольные проростки в процессе закаливания инкубировали на очищенной водопроводной воде. Оптимальный режим закаливания был установлен ранее [15, 16]. Для сравнения использовали 4-дневные этиолированные проростки, не подвергавшиеся закаливанию (см. выше). Поскольку при низкой температуре развитие проростков замедлялось, 10-дневные закаленные растения были такими же, как 4-дневные контрольные, выращенные при 20–22°С.
Закаленные образцы подвергали промораживанию в отсутствие света при температурах –5° или –9°С в течение 4 ч, снижая температуру со скоростью 1°С/ч. Затем образцы оттаивали и отращивали на свету для оценки выживания, как описано выше.
Суммарное содержание сахаров в проростках анализировали методом Морриса-Роэ с использованием антронового реактива с модификациями, описанными нами ранее [15]. Их количество выражали в мг/г сухой массы. Содержание пролина определяли с использованием нингидринового реактива и выражали в мкмоль/г сухой массы [17]. Для определения содержания антоцианов навески побегов гомогенизировали в 1% растворе HCl в метаноле. После центрифугирования гомогената на центрифуге MPW 350R (“MedInstruments”, Польша) при 8000 g в течение 15 мин определяли оптическую плотность супернатанта при длине волны 530 нм на спектрофотометре СФ 46 (“ЛОМО”, Россия) [18]. Содержание антоцианов выражали в условных единицах как величины A530/г сухой массы.
Активность антиоксидантных ферментов – цитозольной СОД (КФ 1.15.1.1), КАТ (КФ 1.11.1.6) и ГПО (КФ 1.11.1.7) – определяли по методикам, описанным ранее [15]. Навески побегов гомогенизировали на холоде в 0.15 М K,Na-фосфатном буфере (pH 7.6) с добавлением ЭДТА (0.1 мМ) и дитиотрейтола (1 мМ). Для анализа использовали супернатант после центрифугирования гомогената при 8000 g в течение 15 мин при температуре не выше 4°С. Активность СОД определяли при pH реакционной смеси 7.6 с использованием метода, основанного на способности фермента конкурировать с нитросиним тетразолием за супероксидные анионы, которые образуются вследствие аэробного взаимодействия НАД⋅H и феназинметосульфата. Активность КАТ определяли по количеству пероксида водорода, разложившегося за единицу времени. Активность ГПО анализировали, используя в качестве донора водорода гваякол, в качестве субстрата – пероксид водорода. Активность СОД и ГПО выражали в усл. ед./(мг белка мин), активность КАТ – в мкмоль H2O2/(мг белка мин). Содержание белка в пробах определяли по Bradford [19], используя в качестве стандарта бычий сывороточный альбумин.
Интенсивность пероксидного окисления липидов (ПОЛ) в тканях проростков определяли по количеству продуктов, реагирующих с 2-тиобарбитуровой кислотой (в основном малоновый диальдегид – МДА), как описано ранее [15]. Содержание МДА выражали в нмоль/г сухой массы.
Повторность независимых опытов 3–4-кратная при 3–4-кратной в каждом из них. Приведены средние величины и их стандартные ошибки. Достоверность различий между вариантами определяли по t-критерию Стьюдента. Кроме оговоренных случаев, обсуждаются различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ
Морозоустойчивость проростков
Морозоустойчивость незакаленных проростков пшеницы была очень низкой: после 4-часового промораживания при –5°С их выживание составило 9%, при этом обработка гидросульфидом натрия в концентрациях 0.1 и 0.5 мМ повышала его до 21–22%, концентрации 0.025 и 1 мМ оказались менее эффективными (табл. 1).
Таблица 1.
Влияние обработки донором H2S на выживаемость (%) незакаленных и закаленных проростков пшеницы и ржи после 4-часового промораживания при температурах –5 и –9°С
| Вариант | Промораживание незакаленных проростков при –5°С | Промораживание закаленных проростков при –5°С | Промораживание закаленных проростков при –9°С |
|---|---|---|---|
| Triticum aestivum | |||
| Контроль | 9.0 ± 2.5b | 68.8 ± 2.6b | 30.6 ± 1.8b |
| NaHS (0.025 мМ) | 12.2 ± 2.2ab | 80.5 ± 2.3ab | 33.3 ± 2.7b |
| NaHS (0.1 мМ) | 21.7 ± 1.9a | 84.2 ± 2.1a | 46.6 ± 2.4a |
| NaHS (0.5мМ) | 20.8 ± 2.0a | 85.0 ± 2.5a | 44.8 ± 2.6a |
| NaHS (1 мМ) | 16.8 ± 2.8ab | 79.7 ± 2.7ab | 38.6 ± 2.4ab |
| Secale cereale | |||
| Контроль | 40.5 ± 2.0b | 86.6 ± 1.8a | 58.8 ± 3.0b |
| NaHS (0.025 мМ) | 44.2 ± 2.4ab | 88.9 ± 2.4a | 62.4 ± 2.6ab |
| NaHS (0.1 мМ) | 54.6 ± 2.2a | 96.6 ± 2.4a | 75.5 ± 2.5a |
| NaHS (0.5мМ) | 58.4 ± 2.6a | 94.0 ± 2.0a | 77.1 ± 2.7a |
| NaHS (1 мМ) | 46.4 ± 3.2ab | 92.8 ± 2.2a | 72.2 ± 2.4ab |
Проростки ржи обладали определенным уровнем конститутивной морозоустойчивости и их выживание после промораживания при –5°С без предварительного закаливания составляло не менее 40%. Предварительная обработка донором сероводорода достоверно увеличивала процент выживания проростков ржи (табл. 1). Наиболее эффективными, как и в случае с проростками пшеницы, были концентрации 0.1 и 0.5 мМ.
Закаливание существенно повышало морозоустойчивость проростков пшеницы, их выживание в разных вариантах опытов было около 70–85% после промораживания при –5°С и 30–45% после воздействия температуры –9°С (табл. 1). В обоих случаях предварительная обработка донором сероводорода способствовала увеличению относительного количества выживших проростков.
Морозоустойчивость проростков ржи под влиянием закаливания также существенно повышалась. После промораживания при –5°С во всех вариантах опыта около 90% проростков оставались живыми. В связи с высоким уровнем выживания достоверного влияния обработки NaHS зафиксировать не удалось (табл. 1). После промораживания при –9°С отмечались заметные различия по величине выживания контрольных и обработанных донором сероводорода проростков ржи. Наиболее эффективными были концентрации NaHS 0.1 и 0.5 мМ. В связи с этим, в последующих экспериментах при изучении влияния донора сероводорода на биохимические показатели проростков пшеницы и ржи использовали именно такие его концентрации.
Содержание низкомолекулярных протекторов
Обработка незакаленных проростков пшеницы донором сероводорода в концентрациях 0.1 и 0.5 мМ способствовала повышению в них содержания сахаров (рис. 1а). Закаливание вызывало почти двукратное увеличение суммарного количества растворимых углеводов в побегах. При этом сочетание закаливания проростков с обработкой NaHS способствовало дополнительному их накоплению, особенно эффективным было действие гидросульфида натрия в концентрации 0.5 мМ.
Рис. 1.
Содержание сахаров (а), пролина (б) и антоцианов (в) в проростках пшеницы и ржи при действии донора сероводорода и холодового закаливания (7 суток при 2–4°С). 1 – контроль; 2 – NaHS (0.1 мМ); 3 – NaHS (0.5 мМ); 4 – закаливание; 5 – закаливание + NaHS (0.1 мМ); 6 – закаливание + + NaHS (0.5 мМ). Одинаковыми латинскими буквами для каждого вида по отдельности отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
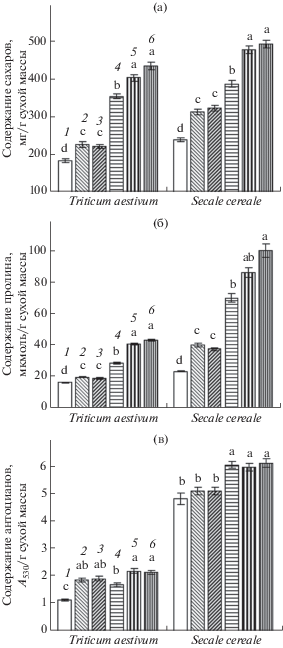
Побеги проростков ржи отличались более высоким содержанием сахаров (рис. 1а). Обработка проростков донором сероводорода при обычной температуре способствовала повышению их содержания. При закаливании их количество также существенно увеличивалось, а обработка 0.1 и 0.5 мМ NaHS вызывала дополнительное накопление сахаров в побегах проростков ржи.
Под влиянием обработки проростков пшеницы гидросульфидом натрия при обычной температуре повышалось содержание пролина (рис. 1б). Еще более существенно его количество в побегах увеличивалось после закаливания при 2–4°C. Сочетание закаливания с обработкой донором сероводорода вызывало повышение содержания пролина до 40–43 мкмоль/г сухой массы, что более чем в 2.5 раза превышало значения контроля.
Базовое содержание пролина в проростках ржи было более высоким, чем в проростках пшеницы (рис. 1б). Обработка NaHS в обычных условиях индуцировала существенное увеличение его количества. Закаливание вызывало трехкратное повышение содержания пролина, а в вариантах с сочетанием действия низких положительных температур и гидросульфида натрия оно составляло 86–100 мкмоль/г сухого вещества и превышало значения контроля приблизительно в 4 раза.
Под влиянием донора сероводорода в проростках пшеницы увеличивалось содержание антоцианов (рис. 1в). Закаливание также способствовало их накоплению в побегах. При сочетании воздействия закаливающих температур и NaHS отмечалось наиболее высокое содержание антоцианов, которое двукратно превышало значения контроля.
Проростки ржи отличались значительно большим содержанием антоцианов в побегах по сравнению с проростками пшеницы (рис. 1в). Однако их обработка гидросульфидом натрия не вызывала достоверного изменения количества антоцианов. После закаливания отмечалось повышение содержания этих пигментов, при этом величины в вариантах с сочетанием действия низких температур с обработкой донором сероводорода не отличались от таковых с влиянием только закаливания. Таким образом, донор H2S не оказывал существенного влияния на содержание антоцианов в проростках ржи ни в обычных температурных условиях, ни при закаливании.
Активность антиоксидантных ферментов
Базовая активность СОД у проростков пшеницы была выше, чем у ржи (рис. 2а). При обработке донором сероводорода активность СОД в проростках пшеницы в обычных температурных условиях существенно не изменялась. Закаливание вызывало небольшое, но достоверное при P ≤ 0.05 повышение активности фермента. При этом обработка NaHS, как и в обычных условиях, не вызывала заметных изменений активности СОД.
Рис. 2.
Активность СОД (а), КАТ (б) и ГПО (в) в проростках пшеницы и ржи при действии донора сероводорода и холодового закаливания (7 сут при 2–4°С). 1 – контроль; 2 – NaHS (0.1 мМ); 3 – NaHS (0.5 мМ); 4 – закаливание; 5 – закаливание + NaHS (0.1 мМ); 6 – закаливание + NaHS (0.5 мМ). Одинаковыми латинскими буквами для каждого вида по отдельности отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
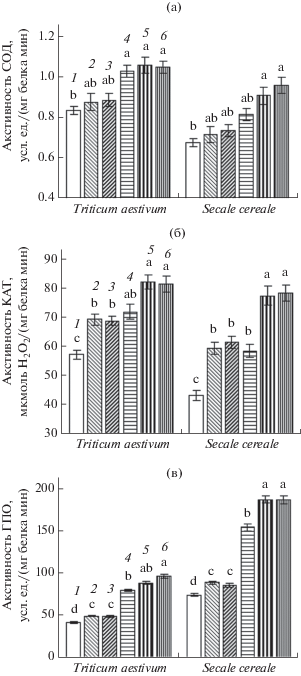
У проростков ржи под влиянием гидросульфида натрия в обеих концентрациях активность СОД также изменялась незначительно (рис. 2а). Закаливание вызывало лишь тенденцию к увеличению активности фермента. Однако при сочетании действия закаливающих низких температур и донора сероводорода активность СОД была достоверно выше, чем в контроле.
Конститутивная активность каталазы у проростков пшеницы была несколько выше, чем у проростков ржи (рис. 2б). Под влиянием обработки гидросульфидом натрия и низкотемпературного закаливания в побегах проростков пшеницы повышалась активность КАТ. Комбинированное действие закаливания и донора сероводорода вызывало тенденцию к дополнительному увеличению активности фермента, однако ее значения в этих вариантах достоверно не отличались от величин варианта только с закаливанием.
У проростков ржи также происходило повышение активности КАТ под влиянием донора сероводорода и закаливания (рис. 2б). При сочетании низкотемпературного воздействия с обработкой 0.1 или 0.5 мМ NaHS отмечалось достоверное дополнительное повышение активности фермента.
Обработка проростков пшеницы гидросульфидом натрия в обеих исследуемых концентрациях вызывала небольшое, но достоверное при P ≤ 0.05 повышение активности ГПО в побегах (рис. 2в). Низкотемпературное закаливание оказывало более существенное влияние на активность фермента. При комбинации закаливания и обработки проростков NaHS (особенно в концентрации 0.5 мМ) отмечалось дополнительное увеличение активности ГПО.
Конститутивные величины активности ГПО у проростков ржи значительно превышали таковые у проростов пшеницы (рис. 2в). Под влиянием донора сероводорода происходило повышение активности фермента. Закаливание вызывало двукратное увеличение активности ГПО в проростках ржи, а его сочетание с обработкой NaHS в обеих концентрациях приводило к еще большему повышению ферментативной активности.
Содержание МДА
В обычных условиях обработка проростков пшеницы и ржи донором сероводорода не вызывала существенных изменений содержания продукта ПОЛ МДА в побегах (табл. 2). В то же время при действии NaHS на фоне холодового закаливания проростков эти величины были ниже, чем в соответствующем контроле. Влияние донора сероводорода на содержание МДА при холодовом закаливании в проростках пшеницы было более существенным, чем на таковое в проростках ржи.
Таблица 2.
Влияние обработки донором H2S на содержание МДА (нмоль/г сухой массы) в проростках пшеницы и ржи
| Вариант | Без закаливания | После закаливания (7 суток при 2–4°С) | После промораживания закаленных проростков (4 ч при –5°С) |
|---|---|---|---|
| Triticum aestivum | |||
| Контроль | 70.6 ± 2.2a | 58.5 ± 2.0a | 142.2 ± 3.2a |
| NaHS (0.1 мМ) | 71.1 ± 1.9a | 42.4 ± 2.2b | 123.0 ± 2.8b |
| NaHS (0.5 мМ) | 74.5 ± 2.6a | 43.9 ± 1.9b | 116.4 ± 4.2b |
| Secale cereale | |||
| Контроль | 147.8 ± 2.6a | 129.5 ± 3.6a | 189.8 ± 7.6a |
| NaHS (0.1 мМ) | 145.7 ± 3.3a | 109.0 ± 2.8b | 116.0 ± 4.2c |
| NaHS (0.5 мМ) | 150.0 ± 2.5a | 113.3 ± 3.3ab | 146.9 ± 5.6b |
Через 1 сутки после промораживания закаленных проростков пшеницы и ржи при температуре –5°С визуальные их повреждения не проявлялись, что позволило определить в них содержание МДА. Этот показатель, характеризующий окислительные повреждения, увеличивался у обоих видов, но более существенно у пшеницы (табл. 2). Обработка донором сероводорода снижала вызываемое криострессом накопление МДА в побегах закаленных проростков пшеницы и ржи.
ОБСУЖДЕНИЕ
Обработка проростков пшеницы и ржи донором сероводорода гидросульфидом натрия сама по себе вызывала повышение их устойчивости к низким температурам, а в условиях холодового закаливания способствовала дополнительному приросту морозоустойчивости (табл. 1). Криорезистентность двух злаков наиболее существенно повышалась при действии NaHS в концентрациях 0.1 и 0.5 мМ. При этом, однако, в отсутствие закаливания влияние донора сероводорода на устойчивость проростков пшеницы было более существенным по сравнению с таковым на резистентность проростков ржи.
Под влиянием обработки донором сероводорода не только повышалось выживание проростков пшеницы и ржи после действия отрицательных температур, но и снижалась степень проявления окислительных повреждений в первые сутки после промораживания, определяемая по содержанию продукта ПОЛ МДА (табл. 2). Такие результаты в целом согласуются с данными, полученными на растениях свинороя [11].
Уменьшение окислительных повреждений проростков пшеницы и ржи при криострессе в результате их предварительной обработки NaHS указывает на активацию сероводородом антиоксидантной системы. И действительно, в проростках обоих видов происходило повышение активности КАТ и ГПО как при действии только донора сероводорода, так и при его сочетании с закаливанием (рис. 2). При этом проявлялись некоторые видовые особенности. У проростков ржи базовый и индуцированный холодом уровень активности ГПО был значительно выше, чем у пшеницы, более выраженной у закаленных проростков ржи была и реакция этого фермента на обработку донором сероводорода (рис. 2в).
В отличие от ГПО и КАТ, активность СОД под влиянием обработки донором сероводорода существенно не изменялась у обоих видов злаков как при обычной температуре, так и на фоне холодового закаливания (рис. 2а). Следует отметить, что активность СОД повышалась при обработке донором сероводорода зеленых растений пшеницы в нормальных условиях и на фоне засухи [20]. У растений винограда показано повышение активности СОД под влиянием обработки NaHS в условиях действия пониженной температуры [8]. Можно предположить, что влияние сероводорода на протекторные системы зеленых и этиолированных объектов несколько отличается. В случае с этиолированными проростками злаков экзогенный сероводород, очевидно, оказывает влияние на другие компоненты антиоксидантной системы, обезвреживающие радикальные АФК, в частности, на содержание низкомолекулярных антиоксидантов (см. ниже).
Следует отметить, что влияние доноров сероводорода на активность и экспрессию генов антиоксидантных ферментов в настоящее время зарегистрировано на многих объектах и при различных типах стрессов. Так, повышение устойчивости растений свинороя к действию холода, вызываемое донором сероводорода, сопровождалось увеличением активности КАТ, пероксидазы и глутатионредуктазы [11]. У растений люцерны под влиянием обработки донором сероводорода, индуцирующей развитие солеустойчивости, не только повышалась активность, но и усиливалась экспрессия генов Cu/Zn-СОД, КАТ, различных форм пероксидазы [21].
В условиях наших экспериментов особенно заметным было влияние донора сероводорода на содержание полифункциональных низкомолекулярных соединений, выполняющих и роль антиоксидантов. Так, при обработке NaHS в проростках пшеницы и особенно ржи существенно повышалось содержание сахаров, как в обычных условиях, так и на фоне холодового закаливания (рис. 1а). Сахара, как известно, относятся к ключевым криопротекторам, при этом они могут проявлять и антиоксидантное действие. Более того, предполагается, что сахара как антирадикальные агенты могут функционально заменять СОД [22]. Примечательно, что в наших опытах донор сероводорода, повышая содержание сахаров (рис. 1а), не оказывал положительного влияния на активность СОД (рис. 2а).
Другим важным полифункциональным защитным соединением является пролин. Сообщается о связи между накоплением пролина и морозоустойчивостью растений разных видов [15, 23]. В наших экспериментах обработка донором сероводорода проростков обоих злаков вызывала повышение в них содержания пролина как при обычной температуре, так и при закаливающей. При этом влияние обработки NaHS на содержание пролина у ржи было более существенным (рис. 1б). Вероятно, действие донора сероводорода на содержание пролина зависит от видовых особенностей растений. В некоторых работах даже показано снижение содержания пролина при обработке растений донором H2S. В частности, такие эффекты зарегистрированы у растений огурца в условиях солевого стресса [24] и у проростков шпината при засухе [25]. С другой стороны, у растений пшеницы, обработанных NaHS, содержание пролина в условиях почвенной засухи повышалось более существенно по сравнению с необработанными [20]. По-видимому, неоднозначность влияния сероводорода на содержание пролина может быть обусловлена сложным функциональным взаимодействием этого низкомолекулярного протектора с другими компонентами антиоксидантной системы, вклад которых в защитные процессы также может быть различным в зависимости от вида и физиологического состояния растений. Например, известно, что между активностью СОД и накоплением пролина, как и накоплением сахаров, у растений может проявляться реципрокная зависимость [26].
Еще одним важным протекторным компонентом, содержание которого повышалось в условиях наших экспериментов под влиянием донора сероводорода, являются антоцианы. Их количество при обработке NaHS в обычных и закаливающих условиях заметно повышалось у проростков пшеницы, обладающих низким базовым содержанием этих соединений (рис. 1в). В то же время у проростков ржи, содержавших в несколько раз больше антоцианов, индуцирования их накопления донором сероводорода не наблюдали. Ранее нами было показано значительное повышение содержания антоцианов в зеленых листьях пшеницы под влиянием обработки NaHS перед засухой [20]. В целом же действие сероводорода на накопление флавоноидных соединений пока изучено очень слабо. Помимо результатов, полученных на растениях пшеницы, имеются данные о повышении под влиянием обработки NaHS содержания антоцианов в листьях ячменя при действии УФ-В [27]. Также недавно было показано повышение под действием NaHS общего содержания флавоноидов и количества антоцианов при низкотемпературном хранении плодов боярышника [28].
Следует отметить, что по антиоксидантной активности антоцианы превосходят такие известные антиоксиданты, как аскорбат и α-токоферол [29]. Несмотря на сомнения по поводу значительного вклада антоцианов в антиоксидантную защиту in vivo, связанные с преимущественно вакуолярной локализацией этих пигментов [29], есть данные, указывающие на их значительную роль в холодовой адаптации. Так, показано, что у мутантных растений арабидопсиса, не содержащих антоцианов, при действии низких температур окислительные повреждения были значительно сильнее, чем у обычных растений [18]. При холодовой адаптации выявлено большее накопление флавоноидных соединений у морозоустойчивого сорта пшеницы по сравнению с неморозоустойчивым [30].
Вполне естественно, что сероводород с участием других сигнальных посредников может оказывать влияние не только на накопление низкомолекулярных протекторов и состояние антиоксидантной системы, но и на многие другие физиологические процессы, от которых зависит свойство морозоустойчивости. Так, H2S вместе с АФК и оксидом азота вовлекается в сложные процессы тиольных модификаций многих белков, в том числе регуляторных [3]. Имеются сведения о повышении под влиянием донора сероводорода активности и экспрессии генов H+-АТФазы плазматической мембраны у растений огурца при гипотермии [10], что препятствует подкислению цитоплазмы, вызываемому действием стресс-фактора.
В нашей работе впервые сопоставлено влияние донора сероводорода NaHS на базовую и индуцированную закаливанием устойчивость проростков пшеницы и ржи к криострессу. Показано, что положительное влияние экзогенного сероводорода на морозоустойчивость сопровождается активацией под его влиянием отдельных компонентов антиоксидантной системы и накоплением полифункциональных протекторов. Особенно заметным было влияние донора сероводорода на накопление сахаров и пролина у проростков обоих видов злаков и антоцианов у пшеницы. В целом положительное влияние донора сероводорода было более существенным на проростки пшеницы, обладающие меньшей устойчивостью по сравнению с проростками ржи. Можно предположить, что сероводород, как сигнальная молекула, активирует экспрессию большего числа генов, причастных к свойству морозоустойчивости, у растений, у которых слабее функционируют системы, обусловливающие их резистентность. Естественно, это предположение выходит далеко за рамки полученных экспериментальных данных и требует специальных исследований влияния сероводорода не только на антиоксидантную и осмопротекторную, но и другие защитные системы, составляющие свойство криоустойчивости. В этом контексте также представляет интерес исследование возможных видовых особенностей синтеза эндогенного сероводорода при адаптации злаков к гипотермии и других стрессорам.
Список литературы
Hancock J.T., Whiteman M. Hydrogen sulfide and cell signaling: Team player or referee? // Plant Physiol. Biochem. 2014. V. 78. P. 37–42.
Savvides A., Ali S., Tester M., Fotopoulos V. Chemical priming of plants against multiple abiotic stresses: mission possible? // Trends Plant Sci. 2016. V. 21. P. 329–340.
Lisjak M., Teklic T., Wilson I.D., Whiteman M., Hancock J.T. Hydrogen sulfide: environmental factor or signalling molecule? // Plant Cell Environ. 2013. V. 36. P. 1607–1616.
Li Z.G., Gong M., Xie H., Yang L., Li J. Hydrogen sulfide donor sodium hydrosulfide-induced heat tolerance in tobacco (Nicotiana tabacum L.) suspension cultured cells and involvement of Ca2+ and calmodulin // Plant Sci. 2012. V. 185–186. P. 185–189.
Christou A., Filippou P., Manganaris G., Fotopoulos V. Sodium hydrosulfide induces systemic thermotolerance to strawberry plants through transcriptional regulation of heat shock proteins and aquaporin // BMC Plant Biol. 2014. V. 14:42. doi:https://doi.org/10.1186/1471-2229-14-42
Li Z.G., Yang S.Z., Long W.B., Yang G.X., Shen Z.Z. Hydrogen sulfide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize (Zea mays L.) seedlings // Plant Cell Environ. 2013. V. 36. P. 1564–1572.
Колупаев Ю.Е., Фирсова Е.Н., Ястреб Т.О., Луговая А.А. Участие ионов кальция и активных форм кислорода в индуцировании антиоксидантных ферментов и теплоустойчивости растительных клеток донором сероводорода // Прикл. биохимия и микробиол. 2017. Т. 53. С. 502–509.
Fu P.N., Wang W.J., Hou L.X., Liu X. Hydrogen sulfide is involved in the chilling stress response in Vitis vinifera L. // Acta Soc. Bot. Pol. 2013. V. 82. P. 295–302.
Du X., Jin Z., Liu D., Yang G., Pei Y. Hydrogen sulfide alleviates the cold stress through MPK4 in Arabidopsis thaliana // Plant Physiol. Biochem. 2017. V. 120. P. 112–119.
Janicka M., Reda M., Czyżewska K., Kabała K. Involvement of signalling molecules NO, H2O2 and H2S in modification of plasma membrane proton pump in cucumber roots subjected to salt or low temperature stress // Funct. Plant Biol. 2018. V. 45. P. 428–439.
Shi H., Ye T., Chan Z. Exogenous application of hydrogen sulfide donor sodium hydrosulfide enhanced multiple abiotic stress tolerance in bermudagrass (Cynodon dactylon (L.). Pers.) // Plant Physiol. Biochem. 2013. V. 71. P. 226–234.
Mizuno N., Sugie A., Kobayashi F., Takumi S. Mitochondrial alternative pathway is associated with development of freezing tolerance in common wheat // Plant Physiol. 2008. V. 165. P. 462–467.
Yoshida M., Kawakami A. Molecular analysis of fructan metabolism associated with freezing tolerance and snow mold resistance of winter wheat // Plant and Microbe Adaptations to Cold in a Changing World / Eds. Imai R. et al. New York: Springer Science+Business Media, 2013. P. 231–243.
Нарайкина Н.В., Синькевич М.С., Дёмин И.Н., Селиванов А.А., Мошков И.Е., Трунова Т.И.Изменения активности изоформ супероксиддисмутазы у растений картофеля дикого типа и трансформированных геном Δ12-ацил-липидной десатуразы при низкотемпературной адаптации // Физиология растений. 2014. Т. 61. С. 359–366.
Колупаев Ю.Е., Рябчун Н.И., Вайнер А.А., Ястреб Т.О., Обозный А.И. Активность антиоксидантных ферментов и содержание осмолитов в проростках озимых злаков при закаливании и криострессе // Физиология растений. 2015. Т. 62. С. 533–541.
Колупаев Ю.Е., Ястреб Т.О., Обозный А.И., Рябчун Н.И., Кириченко В.В. Конститутивная и индуцированная холодом устойчивость проростков ржи и пшеницы к агентам окислительного стресса // Физиология растений. 2016. Т. 63. С. 346–358.
Bates L.S., Walden R.P., Tear G.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205–210.
Havaux M., Kloppstech K. The protective functions of carotenoid and flavonoids pigments against excess visible radiation at chilling temperature investigated in Arabidopsis npq and tt mutants // Planta. 2001. V. 213. P. 953–966.
Bradford M.M.A. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248–254.
Колупаев Ю.Е., Фирсова Е.Н., Ястреб Т.О., Рябчун Н.И., Кириченко В.В. Влияние донора сероводорода на состояние антиоксидантной системы и устойчивость растений пшеницы к почвенной засухе // Физиология растений. 2019. Т. 66. P. 26–34.
Lai D.W., Mao Y., Zhou H., Li F., Wu M., Zhang J., He Z., Cui W., Xie Y. Endogenous hydrogen sulfide enhances salt tolerance by coupling the reestablishment of redox homeostasis and preventing salt-induced K+ loss in seedlings of Medicago sativa // Plant Sci. 2014. V. 225. P. 117–129.
Синькевич М.С., Дерябин А.Н., Трунова Т.И. Особенности окислительного стресса у растений картофеля с измененным углеводным метаболизмом // Физиология растений. 2009. Т. 56. С. 186–192.
Burbulis N., Jonytiene V., Kupriene R., Blinstrubiene A. Changes in proline and soluble sugars content during cold acclimation of winter rapeseed shoots in vitro // J. Food Agricult. Environ. 2011. V. 9. P. 371–374.
Yu L., Zhang C., Shang H., Wang X., Wei M., Yang F., Shi Q. Exogenous hydrogen sulfide enhanced antioxidant capacity, amylase activities and salt tolerance of cucumber hypocotyls and radicles // J. Integr. Agricult. 2013. V. 12. P. 445–456.
Chen J., Shang Y.T., Wang W.H. Chen X.Y., He E.M., Zheng H.L., Shangguan Z. Hydrogen sulfide-mediated polyamines and sugar changes are involved in hydrogen sulfide-induced drought tolerance in Spinacia oleracea seedlings // Front. Plant Sci. 2016. V. 7. P. 1173. https://doi.org/10.3389/fpls.2016.01173
Шевякова Н.И., Бакулина Е.А., Кузнецов Вл.В. Антиоксидантная роль пролина у галофита хрустальной травки при действии засоления и параквата, инициирующих окислительный стресс // Физиология растений. 2009. Т. 56. С. 736–742.
Li Q., Wang Z., Zhao Y., Zhang X., Zhang S., Bo L., Wang Y., Ding Y., An L. Putrescine protects hulless barley from damage due to UV-B stress via H2S- and H2O2-mediated signaling pathways // Plant Cell Rep. 2016. V. 35. P. 1155–1168.
Aghdama M.S., Mahmoudi R., Razavi F., Rabiei V., Soleimani A. Hydrogen sulfide treatment confers chilling tolerance in hawthorn fruit during cold storage by triggering endogenous H2S accumulation, enhancing antioxidant enzymes activity and promoting phenols accumulation // Sci. Horticult. 2018. V. 238. P. 264–271.
KhlestkinaE.K. The adaptive role of flavonoids: emphasis on cereals // Cereal Res. Commun. 2013. V. 41. P. 185–198.
Олениченко Н.А., Загоскина Н.В., Астахова Н.В., Трунова Т.И., Кузнецов Ю.В. Первичный и вторичный метаболизм озимой пшеницы при холодовом закаливании и действии антиоксидантов // Прикл. биохимия и микробиология. 2008. Т. 44. С. 589–594.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


