Физиология растений, 2019, T. 66, № 4, стр. 286-294
Состав и содержание липидов и их жирных кислот в хвое Pinus sylvestris L. и Picea obovata Ledeb. при закаливании к низкой температуре в условиях криолитозоны Якутии
В. В. Нохсоров a, Л. В. Дударева b, К. А. Петров c
a Федеральное государственное автономное образовательное учреждение высшего образования
Северо-Восточный федеральный университет им. М. К. Аммосова
Якутск, Россия
b Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
c Федеральное государственное бюджетное учреждение науки Институт биологических проблем криолитозоны Сибирского отделения Российской академии наук
Якутск, Россия
Поступила в редакцию 30.03.2018
После доработки 03.10.2018
Принята к публикации 23.10.2018
Аннотация
Методом тонкослойной и газожидкостной хроматографии масс-спектрометрии комплексно изучены состав и особенности изменения содержания липидов и жирных кислот (ЖК) в хвое летне- и осенневегетирующих древесных растений, произрастающих в условиях криолитозоны Якутии. Проведен сравнительный анализ содержания суммарных липидов (СЛ), фосфолипидов (ФЛ) и ЖК-состава суммарных липидов хвои Pinus sylvestris L. и Picea obovata Ledeb. в летне-осенний период. Содержание СЛ в хвое P. sylvestris и P. obovata заметно возрастало (в 1.3 раза по сравнению с летним сезоном) при адаптации к низкой осенней температуре криолитозоны Якутии. Установлено, что в этот период содержание фосфатидилхолина (ФХ) в хвое у P. sylvestris и P. obovata также увеличивалось (от 13.8 до 31 мг/г сухой массы). В составе ЖК липидов хвои обоих видов показано высокое содержание видоспецифичных для хвойных ненасыщенных полиметилен разделенных ЖК. Выявлено, что увеличение содержания СЛ, ФЛ, суммарных ЖК и Δ5-кислот при снижении температуры существенно превышает таковое у растений этих видов, произрастающих в других регионах Сибири. Этот факт связан, вероятно, с особенностями адаптации растений к низким температурам мерзлотных экосистем Якутии.
ВВЕДЕНИЕ
Климат Якутии, полностью расположенной в пределах распространения многолетней мерзлоты, характеризуется максимальными сезонными амплитудами температур, не встречающимися ни в одном другом месте мира. Растения находятся в этом регионе в исключительно своеобразных, практически уникальных условиях, обусловленных сочетанием многолетней мерзлоты с высокой солнечной радиацией и с недостатком влаги в почве и воздухе, особенно в первой половине вегетационного периода, длинного жаркого дня с резкими снижениями ночных температур во время поздневесенних и раннеосенних заморозков относительно теплого, но короткого лета. Для перезимовки многолетних растений здесь характерны нигде не повторяющиеся в северном полушарии крайне- и экстремально низкие температуры зимой (до –55°…–60°С при средней температуре ниже –42.5°С). Существование древесных форм растений в таких условиях и их способность переносить зимой жесткий низкотемпературный стресс уникально. Последний выступает как главный фактор отбора при адаптации местных видов. Для древесных растений Якутии выживание при экстремально низких температурах обеспечивается, в том числе, поддержанием оптимальной физиологической активности клеточных мембран тканей хвои, что зависит от особенностей их липидного и ЖК-состава. Количественный состав и структура насыщенных и ненасыщенных ЖК в мембранных липидах позволяет получать информацию о наличии и активности мембранных десатураз, катализирующих введение двойной связи в углеводородную цепь ЖК [1, 2]. У многих видов высших растений в биосинтезе ненасыщенных ЖК введение первой двойной связи осуществляется растворимой стеароил-ацил переносящим белком десатуразой (SAD) [3, 4], введение второй и третьей двойной связи в ненасыщенных ЖК с 18 углеродными атомами в хлоропластных мембранах осуществляется с участием ацил-липидных ω6 (Fad5 и Fad6) и ω3 (Fad7 и Fad8) мембранных десатураз [4–6].
Несмотря на изученность биохимических процессов, обеспечивающих адаптивные изменения состава и содержания липидного комплекса мембран отдельных видов культурных растений (арабидопсиса, кукурузы, табака и др.) при действии низких температур, для древесных растений, особенно для условий экстремального холода, эти процессы остаются пока мало изученными. Зависимые от температуры окружающей среды изменения ЖК-состава в клеточных липидах растений являются обычным явлением. Они постоянно происходят в различных условиях обитания растений, в том числе в условиях многолетней мерзлоты. В связи с этим, особый интерес представляет изучение летне-осенних изменений качественного и количественного состава СЛ, мембранных ФЛ и ЖК СЛ в хвое основных лесообразующих пород региона сосны обыкновенной (Pinus sylvestris L.) и ели сибирской (Picea obovata Ledeb.).
Цель работы – сравнительный анализ содержания и состава СЛ, ФЛ, а также ЖК-состава СЛ в хвое Pinus sylvestris и Picea obovata в условиях криолитозоны Якутии.
МАТЕРИАЛЫ И МЕТОДЫ
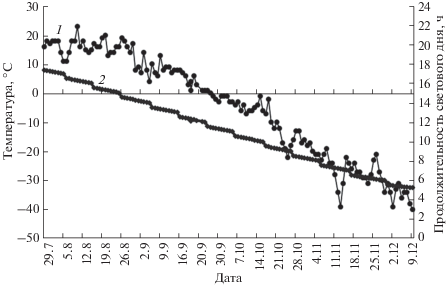
Растительный материал и условия произрастания. В качестве объектов исследования была использована хвоя второго года Pinus sylvestris и Picea obovata, произрастающих в Центральной Якутии. Хвою отбирали со средней хорошо освещаемой части кроны. Сбор полевых материалов осуществляли на постоянных пробных площадях с трех деревьев каждого вида. Древесные виды произрастают в лесопарковой зоне на территории Ботанического сада Института биологических проблем криолитозоны СО РАН, расположенного на второй надпойменной террасе долины р. Лены в 7 км к западу от г. Якутска (62°15′ с.ш., 129°37′ в.д.). Возраст деревьев P. sylvestris и P. obovata 60–65 лет, высота около 12–13 м. Температуру воздуха на участках произрастания древесных видов регистрировали с помощью термографов DS 1922 LiBitton (“DallasSemiconductor”, США). Интервал между измерениями составил 1 ч. Точность измерения ± 0.5°С (рис. 1). Средняя температура воздуха за вегетационный период (май–сентябрь) была немногим более 14°C, сумма осадков – 163 мм. Минимальная температура воздуха в зимний период не опускалась ниже –48°C. Высота снежного покрова в декабре–январе составляла 44–48 см. Погодные условия в годы проведения эксперимента были типичными для Центральной Якутии. Начало заморозков отмечали в середине третьей декады сентября, устойчивый переход ночной температуры через 0°С – в начале октября.
Рис. 1.
Сезонные изменения температуры воздуха (1) и продолжительности светового дня (2) в Центральной Якутии (62°15′ с.ш. и 129°37′ в.д.) в 2014 г. Представлены усредненные данные за сутки (для температуры).
Экстракция и анализ суммарных липидов. Для экстракции липидов навеску растительного материала (0.5 г) фиксировали в жидком азоте, добавляли 0.001% раствор ионола и растирали до получения гомогенной массы. Затем добавляли 10 мл смеси хлороформ : метанол (1 : 2 по объему), тщательно перемешивали и оставляли на 30 мин до полной диффузии липидов в растворитель. Раствор переносили количественно в делительную воронку через фильтр, трижды промывая ступку и фильтр той же смесью растворителей. Для отделения нелипидных компонентов добавляли воду.
Для анализа суммарных липидов отделяли нижнюю хлороформную фракцию. Хлороформ (ОСЧ, стабилизированный 0.005% амилена) из липидного экстракта удаляли под вакуумом с помощью роторного испарителя RVO-64 (Чехия). Для контроля экстрагируемости липидов (%) использовали нонадекановую кислоту (С19:0), добавляя ее известное количество на этапе гомогенизации. Метиловые эфиры ЖК (МЭЖК) получали по методу Кристи [7]. Дополнительную очистку МЭЖК проводили методом тонкослойной хроматографии (ТСХ) в камере с бензолом на стеклянных пластинках с силикагелем КСК (Россия) в качестве подвижной фазы. Для визуализации зоны МЭЖК (Rf = 0.71–0.73) пластинки опрыскивали 10% H2SO4 в MeOH и нагревали в сушильном шкафу при 100°С. Зону МЭЖК удаляли с пластинки шпателем и элюировали с силикагеля (н)-гексаном. Анализ МЭЖК проводили методом ГЖХ с использованием хромато-масс-спектрометра 5973/6890N MSD/DS (“Agilent Technologies”, США). Детектор – квадрупольный масс-спектрометр, способ ионизации – электронный удар, энергия ионизации 70 эВ; анализ проводили в режиме регистрации полного ионного тока.
Для разделения смеси МЭЖК использовали капиллярную колонку HP-INNOWAX (30 м × × 250 мкм × 0.50 мкм) со стационарной фазой (ПЭГ). Газ-носитель – гелий, скорость потока газа – 1 мл/мин. Температура испарителя – 250°С, источника ионов – 230°C, детектора – 150°С; температура линии, соединяющей хроматограф с масс-спектрометром, 280°С. Диапазон сканирования – 41–450 а.e.м. Объем вводимой пробы – 1 мкл, делитель потока – 5 : 1. Разделение смеси МЭЖК выполняли в изотермическом режиме при 200°С. Для идентификации ЖК использовали библиотеку масс-спектров NIST 08, а также архив масс-спектров МЭЖК Christie [8]. Относительное содержание ЖК определяли методом внутренней нормализации – в весовых процентах (вес. %) от их общего содержания в исследуемом образце с учетом коэффициента отклика ЖК.
Для характеристики степени ненасыщенности липидов использовали коэффициент ненасыщенности (k) и индекс двойной связи (ИДС) [9]:
(1)
$k = {{\sum {{{P}_{{{\text{н е н а с ы щ е н н ы х }}}}}} } \mathord{\left/ {\vphantom {{\sum {{{P}_{{{\text{н е н а с ы щ е н н ы х }}}}}} } {\sum {{{P}_{{{\text{н а с ы щ е н н ы х }}}}}} }}} \right. \kern-0em} {\sum {{{P}_{{{\text{н а с ы щ е н н ы х }}}}}} }},$(2)
${\text{И Д С }} = \sum {{{{{P}_{j}}{{n}_{j}}} \mathord{\left/ {\vphantom {{{{P}_{j}}{{n}_{j}}} {100}}} \right. \kern-0em} {100}}} ,$Активность ацил-липидных мембранных ω9-, ω6- и ω3-десатураз, отвечающих за введение двойных связей в углеводородные цепи олеиновой (С18:1(n-9)), линолевой (С18:2(n-6)) и α-линоленовой (С18:3(n-3)) ЖК, рассчитывали как стеароил- (SDR), олеил- (ODR) и линолеил- (LDR) десатуразные отношения [10] по формулам:
(3)
${\text{SDR}} = {{\left( {\% {\text{С }}18{\kern 1pt} :{\kern 1pt} 1} \right)} \mathord{\left/ {\vphantom {{\left( {\% {\text{С }}18{\kern 1pt} :{\kern 1pt} 1} \right)} {\left( {\% {\text{С }}18{\kern 1pt} :{\kern 1pt} 0 + \% {\text{С }}18{\kern 1pt} :{\kern 1pt} 1} \right)}}} \right. \kern-0em} {\left( {\% {\text{С }}18{\kern 1pt} :{\kern 1pt} 0 + \% {\text{С }}18{\kern 1pt} :{\kern 1pt} 1} \right)}},$(5)
${\text{LDR}} = {{\left( {\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3} \right)} \mathord{\left/ {\vphantom {{\left( {\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3} \right)} {\left( {\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + \% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3} \right)}}} \right. \kern-0em} {\left( {\% {\text{C}}18{\kern 1pt} :{\kern 1pt} 2 + \% {\text{C}}18{\kern 1pt} :{\kern 1pt} 3} \right)}},$Количественное определение ФЛ и их разделение на индивидуальные липиды проводили методом двумерной ТСХ с использованием систем растворителей. Первое направление: хлороформ : метанол : бензол : 28% аммиак (водный) в соотношении 65 : 30 : 10 : 6; второе направление: хлороформ : метанол : уксусная кислота : : ацетон : бензол : вода, в соотношении 70 : 30 : : 4 : 5 : 10 : 1. Для обнаружения и идентификации ФЛ в растительном материале использовали специфические реагенты: для фосфорсодержащих компонентов – молибденовый синий [11], для холин-содержащих липидов – реактив Драгендорфа, приготовленный по методу, описанному Вагнером с соавт. [12], для аминосодержащих липидов – 0.2% раствор нингидрина в ацетоне [13]. Количественное определение содержания фосфолипидов проводили по методу Васьковского [11].
Статистическая обработка. В таблицах представлены средние данные из 3–6 биологических повторностей и их стандартные отклонения. Статистическую обработку экспериментальных данных осуществляли с использованием пакета статистического анализа в среде Microsoft Office Excel 2010. Статистическую значимость различий сравниваемых средних значений оценивали с помощью t-критерия (P < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице 1 представлены результаты летне- и осенне-зимних изменений абсолютного содержания СЛ в хвое P. sylvestris и P. obovata в условиях Центральной Якутии. С летнего по зимний периоды содержание СЛ в хвое P. sylvestris было выше, чем в хвое P. obovata (в среднем в 1.5 раза), причем наибольшая разница между видами наблюдалась в августовских пробах во время прекращения роста массы почек (в 1.6 раза). Более высокое содержание липидов у P. sylvestris является видоспецифичным. В процессе вегетации в хвое P. sylvestris отмечалось накопление СЛ от 211.7 ± 9.5 (июль) до 314.5 ± 18.6 (декабрь) мг/г сухой массы, т.е. в 1.5 раза. Относительное накопление СЛ в хвое P. obovata в этот же период было несколько меньше (в 1.4 раза), изменяясь от 145.8 ± 8.4 (июль) до 204.9 ± 12.3 (декабрь) мг/г сухой массы. В сентябре, когда хвойные древесные растения находились в первой фазе закаливания при пониженных и низких положительных температурах воздуха (2°С), при сокращении долготы светового дня (рис. 1), а также при наступлении физиологического покоя, уровень содержания СЛ увеличился в среднем в 1.3 раза в фотосинтезирующих органах сосны и ели по сравнению с летним сезоном.
Таблица 1.
Сезонные изменения содержания суммарных липидов (СЛ) в хвое Pinus sylvestris и Picea obovata (мг/г сухой массы)
| Даты взятия проб |
Этапы развития; фаза закаливания |
Содержание СЛ | |
|---|---|---|---|
| Pinus sylvestris | Picea obovata | ||
| 29.07 | Распускание почек; начало внепочечного роста | 211.7 ± 9.5 | 145.8 ± 8.4 |
| 05.08 | Рост массы почек; вхождение в органический покой | 225.6 ± 8.7 | 139.2 ± 8.9 |
| 20.09 | I фаза закаливания | 273.1 ± 10.7 | 189.1 ± 11.2 |
| 09.12 | Вынужденный покой | 314.5 ± 18.6 | 204.9 ± 12 |
В целом, как свидетельствуют результаты исследований сезонных изменений абсолютного содержания СЛ в хвое сосны обыкновенной и ели сибирской (табл. 1), произрастающих в Центральной Якутии, содержание суммарных липидов в этих тканях имело закономерную тенденцию к возрастанию от летнего к осеннему периоду, поскольку накопление липидов является одним из показателей адаптации к низкотемпературному стрессу. Полученные нами результаты согласуются с имеющимися данными о том, что в осенний период количество суммарных липидов у Larix gmelinii Rupr., L. sibirica Ledeb. и Picea obovata в Красноярском крае и в Восточной Сибири возрастало примерно на 20% от их содержания в летний период [14, 15]. Однако следует отметить, что в условиях криолитозоны показано более существенное увеличение количества суммарных липидов в хвое ели (30%).
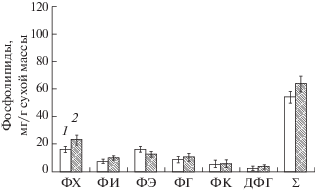
Результаты исследования качественного состава ФЛ хвои исследуемых видов показали, что основной группой ФЛ растений в течение исследуемого периода являлся ФХ (рис. 2, 3), причем его содержание в хвое P. sylvestris было выше, чем у P. obovata, что, по-видимому, является видовой особенностью. Осенью, когда ростовые процессы завершаются, а интенсивность метаболизма снижается, количество ФХ увеличивалось в хвое P. sylvestris в 2.2 раза, а у P. obovata – в 1.4 раза по сравнению с летними показателями. Увеличение содержания ФХ при формировании криорезистентности растительных клеток, вероятно, представляет собой один из механизмов, позволяющих избежать перехода липидного бислоя отдельных участков мембран в инвертированную гексагональную фазу. Крупная полярная головка сильно гидратированного ФХ, по-видимому, обеспечивает более низкую температуру его фазового перехода при дегидратации, вызванной внеклеточным льдообразованием. Содержание фосфатидилинозита (ФИ) в хвое P. obovata увеличивалось по мере снижения температуры и освещенности на 2.9 мг/г сухой массы по сравнению с летним периодом. В хвое P. sylvestris содержание ФИ варьировало в летне-осенний период от 9.6 до 11.2 мг/г сухой массы. Содержание уровня фосфатидилглицерина (ФГ) у P. sylvestris было высоким на протяжении летнего периода, что, по-видимому, обусловлено максимальной концентрацией хлорофиллов в хвое в это время [16]. Показатели содержания фосфатидилэтаноламина (ФЭ) в летний и осенний периоды у P. sylvestris достоверно не различались и составляли около 10.6–11.5 мг/г сухой массы. Содержание ФЭ в хвое P. obovata с наступлением осеннего периода снизилось в 1.2 раза по сравнению с летними показателями. У P. sylvestris осенью наблюдалось повышенное содержание фосфатидной кислоты (ФК). У P. obovata при снижении температуры окружающей среды количество ФК не изменялось и составляло около 5.3 мг/г сухой массы (около 8–9% от суммы ФЛ). Содержание дифосфатидилглицерина (ДФГ) у P. sylvestris было выше, чем у P. obovata, и составило в летне-осенний период около 7–8 мг/г сухой массы. У P. obovata в период осеннего холодового закаливания содержание ДФГ заметно повышалось (в 1.7 раза) по сравнению с летним уровнем. В целом, осеннее повышение суммы ФЛ было особенно заметно в хвое P. sylvestris. Если летом содержание суммы ФЛ было 75.6 мг/г, то уже к осени оно достигало 106.7 мг/г сухой массы, а изменения содержания ФЛ у P. obovata были выражены слабее.
Рис. 2.
Летне-осенние изменения содержания индивидуальных фосфолипидов в хвое Pinus sylvestris. 1 – лето; 2 – осень. ФХ – фосфатидилхолин; ФИ – фосфатидилинозит; ФЭ – фосфатидилэтаноламин; ФГ – фосфатидилглицерин; ФК – фосфатидная кислота; ДФГ – дифосфатидилглицерин; Σ – сумма фосфолипидов.
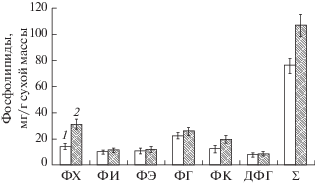
Рис. 3.
Летне-осенние изменения содержания индивидуальных фосфолипидов в хвое Picea obovata. 1 – лето; 2 – осень. ФХ – фосфатидилхолин; ФИ – фосфатидилинозит; ФЭ – фосфатидилэтаноламин; ФГ – фосфатидилглицерин; ФК – фосфатидная кислота; ДФГ – дифосфатидилглицерин; Σ – сумма фосфолипидов.
Поскольку достоверные данные при изучении динамики ЖК-состава при криозакаливании можно получить путем определения абсолютного содержания жирных кислот в расчете на сухой вес, а не только их концентраций в процентах [17, 18], в нашем исследовании были определены оба показателя. Всего в изученных липидах P. sylvestris, произрастающей в Центральной Якутии, было выявлено 25 ЖК, P. obovata – 26 ЖК (табл. 2, 3). Показано, что в составе насыщенных ЖК в хвое P. sylvestris и P. obovata преобладала пальмитиновая (С16:0) кислота, относительное содержание которой варьировало в летне-осенние периоды от 16.32 до 20.02%. Главными ненасыщенными кислотами были С18:2 (линолевая) и С18:3 (линоленовая) кислоты, а также ЖК Δ-5 серии, характерные для хвойных и некоторых других древних таксонов. Уровень содержания олеиновой кислоты (С18:1) у P. obovata осенью повышался в 2 раза по сравнению с летним показателем. Олеиновая кислота является субстратом для синтеза линолевой, α-линоленовой и для ∆5-ненасыщенных полиметиленовых ЖК в мембранах хвои у хвойных растений [19]. Одновременно с увеличением абсолютного содержания олеиновой кислоты (С18:1) в осенний период отмечалось повышение уровня арахиновой (С20:0) и бегеновой (С22:0) кислот от 0.9 до 4.5%. Следует отметить, что С20:0 и С22:0 присутствуют в фотосинтезирующих тканях практически всех голосеменных растений, в отличие от покрытосеменных. Сезонная динамика абсолютного содержания ЖК суммарных липидов хвои показывает выраженную тенденцию увеличения их абсолютного содержания от летнего периода к осеннему. Так, в сентябре в хвое P. obovata, по сравнению с июлем, сумма ЖК была выше на 43 мг/г, а в хвое P. sylvestris – в 1.3 раза. При этом максимальное количество ненасыщенных ЖК также отмечалось в осенний период. В этот период на биосинтез ненасыщенных ЖК хвои наряду с низкими температурами оказывает влияние низкая освещенность. Данные факторы ингибируют фотосинтез в хлоропластных мембранах хвои P. sylvestris и P. obovata и, по-видимому, в процессе адаптации растений к этим условиям приводят к увеличению абсолютного содержания α-линоленовой кислоты (С18:3 n-3) в хлоропластах [20]. Имеются данные, что липидам более зимостойких растений, в том числе древесных видов, свойственно более высокое содержание полиненасыщенных жирных кислот (ПНЖК) – линолевой и α-линоленовой. Такие результаты получены при изучении хвойных деревьев, в том числе P. sylvestris, в Центральной Сибири [21]. Абсолютное содержание суммы основных насыщенных ЖК у P. sylvestris значительно варьировало по сезонам от 60.4 до 78.9 мг/г сухой массы. У P. obovata эти изменения были не столь сильно выражены. В отличие от летних показателей, в тканях растений осенью кислоты С14:0 (миристиновая) и С16:1(n-7) (изомер пальмитолеиновой) не были обнаружены.
Таблица 2.
Летне-осенние изменения ЖК-состава суммарных липидов в хвое Pinus sylvestris в Центральной Якутии
| Жирные кислоты | Летний период (29.07) | Осенний период (20.09) | ||
|---|---|---|---|---|
| мг/г сухой массы |
% от суммы ЖК | мг/г сухой массы |
% от суммы ЖК | |
| C14:0 | 5.3 ± 0.9 | 2.5 ± 0.5 | – | – |
| C15:0 | 0.5 ± 0.1 | 0.2 ± 0.0 | 0.7 ± 0.1 | 0.3 ± 0.0 |
| C16:0 | 41.9 ± 4.9 | 19.8 ± 1.7 | 54.7 ± 3.6 | 20.0 ± 0.2 |
| C16:1(n-9) | 0.6 ± 0.1 | 0.3 ± 0.1 | 1.0 ± 0.5 | 0.4 ± 0.1 |
| C16:1(n-7) | 0.5 ± 0.0 | 0.3 ± 0.0 | – | – |
| C16:1(n-5) | 2.7 ± 0.4 | 1.3 ± 0.1 | 1.1 ± 0.1 | 0.4 ± 0.0 |
| C17:0-a | 2.5 ± 0.2 | 1.2 ± 0.1 | 5.2 ± 0.3 | 1.9 ± 0.0 |
| C17:0 | 1.1 ± 0.1 | 0.5 ± 0.0 | 1.2 ± 0.1 | 0.4 ± 0.0 |
| C16:3(n-3) | 1.0 ± 0.2 | 0.5 ± 0.1 | 2.5 ± 0.8 | 0.9 ± 0.2 |
| C18:0 | 6.0 ± 0.7 | 2.8 ± 0.2 | 5.8 ± 0.1 | 2.1 ± 0.1 |
| C18:1(n-9) | 14.8 ± 1.1 | 7.0 ± 0.6 | 17.0 ± 0.7 | 6.2 ± 0.1 |
| C18:1(n-7) | 1.8 ± 0.2 | 0.8 ± 0.1 | 2.9 ± 0.2 | 1.1 ± 0.1 |
| C18:2(Δ5,9) | 0.9 ± 0.2 | 0.4 ± 0.1 | 1.1 ± 0.0 | 0.4 ± 0.0 |
| C18:2(n-6) | 47.6 ± 1.9 | 22.5 ± 0.7 | 61.6 ± 3.1 | 22.6 ± 0.1 |
| C18:3(Δ5,9,12) | 9.7 ± 1.9 | 4.6 ± 1.0 | 24.3 ± 1.2 | 8.9 ± 0.9 |
| C18:3(n-3) | 55.1 ± 4.2 | 26.0 ± 1.1 | 47.5 ± 2.2 | 17.4 ± 0.8 |
| C18:4(Δ5,9,12,15) | 2.9 ± 0.4 | 1.3 ± 0.2 | 6.8 ± 0.4 | 2.5 ± 0.3 |
| C20:0 | 1.4 ± 0.2 | 0.7 ± 0.1 | 4.5 ± 0.3 | 1.6 ± 0.2 |
| C20:1(n-11) | 0.3 ± 0.0 | 0.2 ± 0.0 | 0.9 ± 0.1 | 0.3 ± 0.0 |
| C20:2(n-9) | 0.9 ± 0.1 | 0.4 ± 0.0 | 4.1 ± 0.2 | 1.5 ± 0.2 |
| C20:3(Δ5,11,14) | 9.8 ± 0.6 | 4.6 ± 0.3 | 16.3 ± 0.8 | 6.0 ± 0.8 |
| C20:3(Δ7,11,14) | 0.9 ± 0.0 | 0.4 ± 0.0 | 3.1 ± 0.0 | 1.1 ± 0.4 |
| C20:3(Δ11,14,17) | 0.4 ± 0.1 | 0.2 ± 0.0 | 1.6 ± 0.0 | 0.6 ± 0.1 |
| C20:4(Δ5,11,14,17) | 1.4 ± 0.1 | 0.6 ± 0.0 | 2.4 ± 0.0 | 0.9 ± 0.1 |
| C22:0 | 1.7 ± 0.1 | 0.8 ± 0.0 | 6.8 ± 0.7 | 2.5 ± 0.3 |
| ΣΔ5-UPIFA | 24.6 ± 1.2 | 11.6 ± 0.7 | 50.9 ± 2.1 | 18.6 ± 0.9 |
| Σ | 211.7 ± 9.5 | 100.0 | 273.1 ± 10.7 | 100.0 |
| Σнасыщенных | 60.4 ± 5.5 | 28.5 ± 1.7 | 78.9 ± 5.1 | 28.9 ± 1.1 |
| Σненасыщенных | 151.3 ± 5.8 | 71.5 ± 1.7 | 194.3 ± 10.0 | 71.1 ± 0.9 |
| k | 2.51 ± 0.21 | 2.46 ± 0.02 | ||
| ИДС | 1.73 | 1.75 | ||
| SDR | 0.71 ± 0.04 | 0.74 ± 0.01 | ||
| ODR | 1.47 ± 0.01 | 0.87 ± 0.02 | ||
| LDR | 0.54 ± 0.02 | 0.44 ± 0.02 | ||
Таблица 3.
Летне-осенние изменения ЖК-состава суммарных липидов в хвое Pícea obovata в Центральной Якутии
| Жирные кислоты | Летний период (29.07) | Осенний период (20.09) | ||
|---|---|---|---|---|
| мг/г сухой массы |
% от суммы ЖК | мг/г сухой массы |
% от суммы ЖК | |
| C12:0 | 1.5 ± 0.2 | 1.0 ± 0.1 | 2.7 ± 0.6 | 1.4 ± 0.4 |
| C14:0 | 4.4 ± 0.9 | 3.0 ± 1.1 | 4.8 ± 0.3 | 2.5 ± 0.1 |
| C15:0 | 0.3 ± 0.0 | 0.2 ± 0.0 | 0.4 ± 0.1 | 0.2 ± 0.0 |
| C16:0 | 23.8 ± 2.9 | 16.3 ± 1.5 | 33.0 ± 3.7 | 17.4 ± 0.5 |
| C16:1(n-9) | 0.4 ± 0.0 | 0.3 ± 0.0 | 0.7 ± 0.1 | 0.4 ± 0.0 |
| C16:1(n-7) | 0.3 ± 0.0 | 0.2 ± 0.0 | – | – |
| C16:1(n-5) | 1.2 ± 0.1 | 0.8 ± 0.1 | 1.5 ± 0.3 | 0.8 ± 0.1 |
| C17:0-a | 4.9 ± 0.1 | 3.4 ± 0.3 | 6.2 ± 0.4 | 3.3 ± 0.0 |
| C17:0 | 1.4 ± 0.2 | 1.0 ± 0.3 | 1.4 ± 0.1 | 0.7 ± 0.1 |
| C16:3(n-3) | 0.7 ± 0.1 | 0.5 ± 0.1 | 0.9 ± 0.1 | 0.5 ± 0.0 |
| C18:0 | 3.1 ± 0.0 | 2.1 ± 0.2 | 7.4 ± 1.1 | 3.9 ± 0.2 |
| C18:1(n-9) | 12.1 ± 2.7 | 8.3 ± 2.0 | 19.1 ± 1.7 | 10.1 ± 1.9 |
| C18:1(n-7) | 1.3 ± 0.1 | 0.9 ± 0.0 | 1.4 ± 0.2 | 0.7 ± 0.1 |
| C18:2(Δ5,9) | 2.7 ± 0.6 | 1.9 ± 0.8 | 2.4 ± 0.6 | 1.3 ± 0.4 |
| C18:2(n-6) | 23.3 ± 2.7 | 16.0 ± 1.4 | 31.4 ± 2.9 | 16.6 ± 1.3 |
| C18:3(Δ5,9,12) | 7.1 ± 1.4 | 4.9 ± 1.0 | 10.2 ± 1.9 | 5.4 ± 1.1 |
| C18:3(n-3) | 40.3 ± 1.3 | 27.6 ± 3.5 | 44.6 ± 4.1 | 23.6 ± 2.1 |
| C18:4(Δ5,9,12,15) | 5.0 ± 0.3 | 3.4 ± 0.6 | 5.0 ± 0.8 | 2.6 ± 0.5 |
| C20:0 | 1.0 ± 0.6 | 0.7 ± 0.5 | 2.0 ± 0.3 | 1.1 ± 0.6 |
| C20:1(n-11) | 0.3 ± 0.1 | 0.2 ± 0.0 | 0.4 ± 0.0 | 0.2 ± 0.0 |
| C20:2(n-9) | 0.9 ± 0.0 | 0.6 ± 0.1 | 1.1 ± 0.1 | 0.6 ± 0.1 |
| C20:3(Δ5,11,14) | 5.7 ± 0.4 | 3.9 ± 0.3 | 7.1 ± 0.4 | 3.7 ± 0.7 |
| C20:3(Δ7,11,14) | 0.8 ± 0.2 | 0.5 ± 0.1 | 0.7 ± 0.1 | 0.4 ± 0.0 |
| C20:3(Δ11,14,17) | 0.3 ± 0.0 | 0.2 ± 0.0 | 0.4 ± 0.0 | 0.2 ± 0.0 |
| C20:4(Δ5,11,14,17) | 1.7 ± 0.2 | 1.1 ± 0.3 | 1.7 ± 0.1 | 0.9 ± 0.1 |
| C22:0 | 1.3 ± 0.8 | 0.9 ± 0.3 | 2.5 ± 0.8 | 1.3 ± 0.2 |
| ΣΔ5-UPIFA | 22.2 ± 1.8 | 15.3 ± 1.2 | 26.3 ± 1.9 | 13.9 ± 1.4 |
| Σ | 145.8 ± 8.4 | 100.0 | 189.1 ± 11.2 | 100.0 |
| Σнасыщенных | 41.8 ± 3.4 | 28.6 ± 1.6 | 60.5 ± 5.5 | 32.0 ± 1.8 |
| Σненасыщенных | 104.0 ± 5.0 | 71.4 ± 1.9 | 128.6 ± 10.3 | 68.0 ± 2.1 |
| k | 2.49 | 2.13 | ||
| ИДС | 1.79 | 1.65 | ||
| SDR | 0.79 | 0.72 | ||
| ODR | 0.84 | 0.80 | ||
| LDR | 0.63 | 0.59 | ||
Одним из важных признаков, характеризующих липиды хвои, является также присутствие в них “реликтовых” Δ5 метилен-разделенных ЖК (Δ5-UPIFA). С наступлением низких температур абсолютное содержание Δ5-UPIFA в хвое P. sylvestris повышалось в 2.06 раза и составляло в осенний период 50.9 мг/г сухой массы, а для P. obovata этот показатель составлял 26.3 мг/г. Рассчитанные значения десатуразных SDR, ODR, LDR соотношений, характеризующих активность ацил-липидных ω9-, ω6- и ω3-десатураз, показали, что для P. sylvestris и P. obovata уровень ODR составил от 0.87 до 1.47, тогда как для SDR и LDR он варьировал от 0.44 до 0.74, что показывает большую активность олеатной десатуразы, которая может быть обусловлена более высоким уровнем экспрессии гена fad2, кодирующего хлоропластную ω6-десатуразу у вечнозеленых хвойных [22].
В составе липидов хвои древесных растений отмечалось большое разнообразие ненасыщенных ЖК с длиной углеродной цепи С ≥ 20, что обусловлено элонгацией молекул олеиновой и линолевой кислот с образованием С20:1 (эйкозеновой) и С20:2 (эйкозадиеновая) и других ЖК. В жирнокислотном спектре P. sylvestris и P. obovata обнаружены следующие ∆5-кислоты: С18:3(Δ5,9) – таксолеиновая, С18:3(Δ5,9,12) – пиноленовая, С18:4(Δ5,9,12,15) – конифероновая, С20:3(Δ5,11,14) – скиадоновая и С20:4(Δ5,11,14,17) – юнипероновая. Динамика содержания ∆5-кислот повторяет общий характер изменения суммарного содержания ненасыщенных ЖК. Судя по литературным данным [15, 22], у P. sylvestris и P. obovata в Восточной Сибири было выявлено заметно более низкое содержание Δ5-ЖК, чем у растений, произрастающих в криолитозоне Якутии. У P. sylvestris эта разница составила 27.5 мг/г, а у P. obovata – 12 мг/г в пересчете на сухую массу. Высокое содержание этих кислот в липидах хлоропластных мембран хвои P. sylvestris и P. obovata обычно связывают с адаптацией растений к низким температурам [23–25]. В осенний период уровень освещенности, наряду с низкими температурами, является стрессовым фактором для хвои вечнозеленых деревьев, произрастающих в Центральной Якутии, что приводит к повышению содержания практически всех ненасыщенных ЖК в их СЛ. Такое повышение в осенний период, судя по литературным данным, обусловлено как наступлением первых этапов глубокого физиологического покоя (первая фаза закаливания), так и реорганизацией хлоропластных мембран хвои сосны обыкновенной и ели сибирской, вызываемой снижением освещенности и температуры, в частности, за счет увеличения площади поверхности гран, количества тилакоидов в одной гране и общего числа тилакоидов в хлоропласте [22]. Физиологическая роль некоторых ненасыщенных ЖК как в хлоропластных, так и микросомальных мембранах деревьев хвойных пород во многом не ясна. Важная роль в этих процессах отводится цитохрому b5, который является в клетках животных и растений одним из ключевых ферментов синтеза ПНЖК [26]. Как отмечалось ранее, предполагается, что Δ5-UPIFA могут играть важную роль в адаптации растений к низким температурам, о чем может свидетельствовать замещение α-линоленовой кислоты пиноленовой в ЖК липидов семян деревьев хвойных пород. Так, предполагается, что пиноленовая кислота может быть эквивалентна γ-линоленовой как промежуточное звено, сохранившееся в ходе эволюции при биосинтезе арахидоновой и эйкозапентаеновой кислот с последующим изменением из Δ6,9,12-С18 (в птереофитах) в Δ5,9,12-С18 (в хвойных). Арахидоновая и эйкозапентаеновая кислоты в значительных количествах обнаруживаются в микроорганизмах, мхах, лишайниках, грибах, а также в животных организмах [27], но практически не обнаруживаются аналитическими методами в липидах хвойных – семенах, хвое [26, 28]. Эволюционный порядок метаболических путей этих кислот явно прослеживается от низших к высшим растениям [29]. В низших растениях биосинтез ПНЖК идет по ω6-пути с образованием линоленовой – γ-линоленовой – арахидоновой – эйкозапентаеновой кислот, тогда как в высших биосинтез ПНЖК идет по ω3-пути с образованием линолевой – α-линоленовой кислот и может заканчиваться получением эйкозапентаеновой кислоты, минуя арахидоновую [30].
Таким образом, выявленные закономерности, присущие хвое вечнозеленых растений Якутии – высокое абсолютное содержание суммарных липидов, фосфолипидов и ЖК, особенно их ненасыщенных форм, влияющих на стабилизацию клеточных мембран, а также многообразие и высокое содержание уникальных Δ5-метилен-разделенных ЖК, которые могут играть существенную роль в формировании устойчивости этих видов деревьев к низкотемпературному стрессу (до –60°С) в условиях многолетней мерзлоты.
Список литературы
Ohlorogg J., Browse J. Lipid Biosynthesis // Plant Cell. 1995. V. 7. P. 957–970.
Wang Z., Benning C. Chloroplast lipids synthesis and lipid trafficking through ER-plastid membrane contact sites // Biochem. Soc. Trans. 2012. V. 40. P. 457–463.
Schultz D.J., Suh M.C., Ohlrogge J. Stearoyl-acyl carrier protein and unusual acyl-acyl carrier protein desaturase activities are differentially influenced by ferrodoxin // Plant Physiol. 2000. V. 124. P. 681–692.
Kang J., Snapp A.R., Lu C. Identification of three genes encoding microsomal oleatedesaturases (FAD2) from the oilseed crop Camelina sativa // Plant Physiology and Biochemistry. 2011. V. 49. P. 223–229.
Theocharis A., Clement C., Barka E.A. Physiological and molecular changes in plants grow at low temperatures // Planta. 2012. V. 235. P. 1091–1105.
Лось Д.А. Десатуразы жирных кислот. М.: Научный мир, 2014. 486 с.
Christie W.W. Preparation of ester derivatives of fatty acids for chromatographic analysis // Advances in Lipid Methodology – Two / Ed. Christie W.W. Dundee: Oily Press, 1993. P. 69–111.
Christie W.W. The AOCS lipid library: methyl esters of fatty acids // Archive of Mass Spectra. 2010. http://lipidlibrary.aocs.org/ms/arch_me/index.htm
Lyons J.M., Wheaton T.A., Pratt H.R. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants // Plant Physiol. 1964. V. 39. P. 262–268.
Jaworski J.G., Stumpf P.K. Fat metabolism in higher plants. Properties of a soluble stearyl-acyl carrier protein desaturase from maturing Carthamus tinctorius // Arch. Biochem. Biophys. 1974. V. 162. P. 158–165.
Vaskovsky V.E., Kostetsky J.M., Vasendin E.Y. Universal reagent for determination of phosphorea in lipids // J. Chromatography. 1975. V. 114. P. 129–141.
Wagner H., Horhammer L., Wolf P. Dunnschicht Chromatographic von Phosphatiden and glycolipiden // Biochem. Z. 1961. V. 334. P. 175–184.
Кейтс М. Техника липидологии. Москва: Мир, 1975. 322 с.
Алаудинова Е.В., Миронов П.В. Сезонно-климатические аспекты метаболизма лесообразующих хвойных видов Красноярского края // Вестник МАНЭБ. 2009. Т. 14. С. 197–202.
Семенова Н.В., Макаренко С.П., Шмаков В.Н., Константинов Ю.М., Дударева Л.В. Жирнокислотный состав суммарных липидов хвои и каллусов некоторых хвойных: Pinus sylvestris L., Picea pungens Engelm., Pinus koraiensis Siebold & Zucc. и Larix sibirica Ledeb. // Биологические мембраны. 2017. Т. 34. С. 298–306.
Софронова В.Е., Дымова О.В., Головко Т.К., Чепалов В.А., Петров К.А. Адаптивные изменения пигментного комплекса хвои Pinus sylvestris при закаливании к низкой температуре // Физиология растений. 2016. Т. 63. С. 461–471.
Верещагин А.Г. Липиды в жизни растений. Москва: Наука, 2007. 78 с.
Селиванов А.А., Попов В.Н., Антипина О.В., Пчёлкин В.П., Цыдендамбаев В.Д., Мошков И.Е. Изменение содержания транскриптов генов десатураз жирных кислот растений арабидопсиса при адаптации к гипотермии // Физиология растений. 2017. Т. 64. С. 228–234.
Wolff R.L., Christie W.W., Pédrono F., Marpeau A.M., Tsevegsüren N., Aitzetmüller K., Gunstone F.D. Delta5-olefinic acids in the seed lipids from four Ephedra species and their distribution between the alpha and beta positions of triacylglycerols. Characteristics common to coniferophytes and cycadophytes // Lipids. 1999. V. 58. P. 101−115.
Oquist G. Seasons induced changes in acyl lipids and fatty acids of chloroplast thylakoids of Pinus sylvestris: a correlation between the level of unsaturation of monogalactosyldiglyceride and the rate of electron transport // Plant Physiol. 1982. V. 69. P. 869−875.
Алаудинова Е.В., Миронов П.В. Липиды меристем лесообразующих хвойных пород Центральной Сибири в условиях низкотемпературной адаптации // Химия растит. сырья. 2009. С. 65–76.
Макаренко С.П., Коненкина Т.А., Суворова Г.Г. Сезонные изменения жирнокислотного состава липидов хвои Pinus sylvestris // Физиология растений. 2014. Т. 61. С. 129–134.
Roman A., Andreu V., Hernandez M.L. Contribution of the different omega-3 fatty acid desaturase genes to the cold response in soybean // J. Exp. Bot. 2012. V. 63. P. 4973–4982.
Provart N.J., Gil P., Chen W. Gene expression phenotypes of Arabidopsis associated with sensitivity to low temperatures // Plant Physiol. 2003. V. 132. P. 893–906.
Kargiotidou A., Deli D., Galanopoulou D. Temperature and light regulate delta-12 fatty acid desaturases (FAD2) at a transcriptional level in cotton (Gossypium hirsutum) // J. Exp. Bot. 2008. V. 59. P. 2043–2056.
Wolff R.L., Lavialle O., Pedrono F., Pasquier E., Destaillats F., Marpeau A., Angers P., Aitzetmuller K. Abietoid seed fatty acid compositions – a review of the genera Abies, Cedrus, Hesperopeuce, Keteleeria, Pseudolarix, Tsuga and preliminary inferences on the taxonomy of Pinaceae // Lipids. 2002. V. 37. P. 17–26.
Dobson G., Christie W.W. Mass spectrometry of fatty acid derivatives // Eur. J. Lipid Sci. Technol. 2002. V. 104. P. 36–43.
Mongrad S., Badoc A., Patouille B., Lacomblez C., Chavent M., Cassagne C., Bessoule J.J. Taxonomy of Gymnospermae: multivariate analyses of leaf fatty acid composition // Phytochemistry. 2001. V. 58. P. 101–115.
Williams M., Sanchez J., Hann A.C., Harwood J.L. Lipid biosynthesis in olive cultures lipid biosynthesis // J. Exp. Bot. 1993. V. 44. P. 1717–1723.
Wolff R.L., Christie W.W. Structure, practical sources (gymnosperm seeds), gas-chromatographic data (equivalent chain lengths), and mass spectrometric characteristics of all-cis Δ5-olefinic acids // Eur. J. Lipid Sci. T-echnol. 2002. V. 104. P. 234–244.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


