Физиология растений, 2019, T. 66, № 4, стр. 295-303
Анализ нового штамма водоросли Pseudomuriella engadinensis (Sphaeropleales, Chlorophyta) для возможного использования в биотехнологии
Е. И. Мальцев a, b, И. А. Мальцева b, М. С. Куликовский a, С. Ю. Мальцева a, Р. А. Сидоров a
a Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Мелитопольский государственный педагогический университет им. Б. Хмельницкого
Мелитополь, Украина
Поступила в редакцию 03.09.2018
После доработки 31.10.2018
Принята к публикации 19.11.2018
Аннотация
Изучение видового разнообразия зеленых коккоидных водорослей с использованием световой микроскопии часто затруднено их сложной морфологией. Одними из наиболее таксономически сложных являются водоросли, имеющие морфологическое и экологическое сходство с родами Bracteacoccus Tereg., Dictyococcus Gerneck и Pseudomuriella Hanagata. Зачастую только сравнение нуклеотидных последовательностей позволяет осуществить достоверную идентификацию и выяснить филогенетическую принадлежность исследуемых объектов. Pseudomuriella относится к группе генетически разнообразных родов, но обладающих однородной Bracteacoccus-подобной морфологией. Совместное использование двух генетических маркеров (ядерного гена 18S рДНК и хлоропластного rbcL) наряду с методами световой микроскопии и сопоставлением профилей жирных кислот позволило нам идентифицировать штамм зеленых водорослей, выделенный из почвы искусственного сосново-белоакациевого насаждения на территории степной зоны Украины, как Pseudomuriella engadinensis (Kol et Chodat) Fučiková, Rada et Lewis – первую находку данного вида во флоре водорослей Украины. Анализ жирнокислотного состава клеток исследованного штамма показал, что содержание суммарных липидов в стационарной фазе роста было на уровне 87.9 ± 2.1 мг/г сухой массы клеток, а главными жирными кислотами были пальмитиновая, гексадекадиеновая, ругановая, олеиновая, линолевая и α-линоленовая – на их долю приходилось 82.4% от суммы всех жирных кислот.
ВВЕДЕНИЕ
Chlorophyta являются одной из наиболее многочисленных групп водорослей, изучение которых происходит в различных направлениях. Многие из них привлекают внимание своей потенциальной биотехнологической ценностью при производстве биотоплива и способностью накапливать высокоценные биологические продукты (например, α-токоферол или омега-3-полиненасыщенные жирные кислоты) [1, 2].
Одной из наиболее многочисленных групп Chlorophyta являются одноклеточные коккоидные водоросли. Таксономическое разнообразие и филогенетические отношения внутри этой группы остаются недостаточно изученными. Часто обнаруживаются новые линии, для которых выделение уникальной морфологии затруднительно [3]. Одной из основных причин такой ситуации является небольшой размер клеток у большинства представителей и, как следствие, – плохо отличимые в световой микроскоп морфологические признаки. В этом случае, наряду с изучением особенностей ультраструктуры клеток, имеет значение использование молекулярно-генетических методов. Молекулярно-филогенетические исследования коккоидных зеленых водорослей подтверждают наличие скрытого разнообразия внутри группы. Например, в результате ревизии Chlorophyceae и Trebouxiophyceae уточняются объемы таксонов, производится их разделение и описание новых [3, 4]. Большое число разных линий отмечено и внутри Sphaeropleales – одного из порядков хлорофициевых водорослей, характеризующегося DO ориентацией базальных тел жгутиков. Большинство из них включают несколько родов (например, Hydrodyctiaceae, Neochloridaceae, Scenedesmaceae и др.), однако имеются и такие, которые состоят из одного рода или вида (Bracteacoccaceae, Bracteamorphaceae, Chromochloridaceae, Pseudomuriellaceae). Исследования филогении этой группы водорослей часто сопровождаются созданием новых комбинаций или предложением новых родов и видов.
Достаточно сложным оказался поиск критериев для разграничения видов Dictyococcus Gerneck и Bracteacoccus Tereg. Оба рода характеризуются коккоидными представителями с несколькими париетальными хлоропластами без пиреноидов, наличием нескольких ядер у взрослых клеток и образованием голых зооспор. Кроме этого, к группе Dictyococcus-Bracteacoccus морфологически близкой оказалась Muriella aurantiaca Vischer, которая на основании филогенетического анализа 18S рДНК была перенесена из Trebouxiophyceae в новый род Pseudomuriella Hanagata, принадлежащий к Chlorophyceae [5].
Проблема во многом разрешилась благодаря ревизиям Fučiková с соавторами [4, 6, 7], которые не подтвердили близкое родство между Dictyococcus и Bracteacoccus. Филогенетическая реконструкция показала, что Dictyococcus занимает независимую от Bracteacoccus позицию внутри Sphaeropleales. Авторы указали, учитывая результаты молекулярно-филогенетических исследований, что единственным отличием Dictyococcus от Bracteacoccus и Pseudomuriella является положение и форма его хлоропластов, которые соприкасаются между собой и имеют заостренные края, часто загибающиеся внутрь клетки. Выделить однозначные морфологические критерии, которые достоверно разделили бы роды Bracteacoccus и Pseudomuriella не удалось. В тоже время филогенетически они формируют обособленные клады и, по-видимому, относятся к криптическим таксонам. Для Bracteacoccus характерно образование голых зооспор со слегка неравными по длине жгутиками, в то время как для Pseudomuriella образование зооспор было отмечено только один раз и без подробного изучения их жгутиков [8]. Поэтому на данный момент длина жгутиков не может использоваться как надежный критерий при разграничении этих родов. Среди возможных отличий указывается разница в строении и свойствах клеточной стенки, которая проявляется в неодинаковой чувствительности при окрашивании 4',6-диамидино-2-фенилиндолом (DAPI) или Syto11 [3]. Caisova и Melkonian [9], рассматривая особенности образования вторичной структуры ITS2 в Sphaeropleales, обратили внимание на отличия в топологии спирали I. Для большинства филогенетических линий порядка характерно формирование дихотомически раздвоенной спирали I (в том числе и для Bracteacoccus). Представители семейства Sphaeropleaceae образуют нераздвоенную спираль I. И только у родов Desmodesmus (Chodat) An, Friedl et Hegewald и Pseudomuriella спираль I в ITS2 способна принимать как нераздвоенный, так и раздвоенный вид. Данная черта, с одной стороны, подтверждает самостоятельность Pseudomuriella от Bracteacoccus, а с другой – может выступать одной из отличительных особенностей между данными криптическими таксонами.
На данный момент род Pseudomuriella включает 4 вида, обитающих в почве: P. aurantiaca (Vischer) Hanagata (ранее известная как Muriella aurantiaca), P. engadinensis (Kol et Chodat) Fučiková, Rada et Lewis (ранее известная как Chlorellopsis engadinensis Kol et Chodat, включая синонимы B. engadinensis (Kol et Chodat) Starr, B. terrestris (Kol et Chodat) Starr, Chlorellopsis terrestris Kol et Chodat), P. schumacherensis Metting ex Fučiková, Rada et Lewis (= D. schumacherensis Metting nom. inval.) и P. cubensis Fučiková, Rada, Lukešová et Lewis. При этом, несмотря на наличие разнообразных почвенных условий и длинную историю изучения водорослей, до последнего времени во флоре Украины представители рода встречены лишь один раз как Pseudomuriella sp. в почвенном образце Kh-4 со склона северной экспозиции каньона р. Рось (возле с. Хохитва) [10]. При этом авторы отметили, что найденный представитель по морфологическим признакам был наиболее близким к D. schumacherensis.
Исследуя водоросли лесной подстилки и почвы в древесных насаждениях парка-памятника садово-паркового искусства государственного значения “Мелитопольский центральный парк культуры и отдыха им. М. Горького”, нами был выделен штамм Bracteacoccus-подобной водоросли. Данная статья посвящена описанию нового штамма, определению его таксономического положения и видовой принадлежности методами световой микроскопии и молекулярной филогении, анализу его жирнокислотного состава с целью выяснения биотехнологического потенциала.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследований послужил штамм зеленых водорослей, выделенный микропипетированием из почвенной культуры со стеклами обрастания. Монокультуру водорослей выращивали в жидкой среде Болда (BBM) [11] на осветительной установке с режимом 12 : 12. Микроскопическое исследование культуры началось в возрасте 7 дней и продолжалось до 12 месяцев.
При микроскопировании применяли прижизненную окраску препаратов раствором Люголя – на крахмал, 0.1% раствором метиленового синего и 1% раствором туши проверяли наличие слизи. Микроскопические исследования и фотографирование проводили с помощью светового микроскопа Olympus IX-71 (Япония).
ДНК исследуемого штамма CAMU MZ–Ch33 экстрагировали с помощью набора InstaGeneTM Matrix в соответствии с протоколом производителя. Амплификацию баркодингового участка V4 ядерного гена 18S рДНК длиной 382 п.н. проводили с помощью пары праймеров D512 и D978 [12]. Условия амплификации: начальная денатурация – 5 мин при 95°С, последующие 35 циклов: денатурация при 94°С – 30 с, отжиг праймеров – 40 с при 52°С, элонгация – 50 с при 72°С; окончательное удлинение – 5 мин при 72°С. Амплификацию фрагмента хлоропластного гена rbcL длиной 1041 п.н. проводили с помощью пары праймеров rbcL-F9 и rbcL-R8 [13]. Условия амплификации: начальная денатурация – 5 мин при 95°С, последующие 45 циклов: денатурация при 94°С – 30 с, отжиг праймеров – 40 с при 60°С, элонгация – 1 мин 20 с при 72°С; окончательное удлинение – 5 мин при 72°С.
Полученные ПЦР-продукты визуализировали методом горизонтального электрофореза в агарозном геле (1%) и окрашивали SYBR® Safe (Life Technologies, США). Очистку ПЦР-продуктов проводили смесью FastAP, 10× FastAP Buffer, Exonuclease I (Thermo Fisher Scientific, США) и воды. Расшифровку последовательностей V4 18S рДНК и rbcL осуществляли при помощи прямых и обратных праймеров, указанных для ПЦР, системы Big Dye (Applied Biosystems, США) с использованием секвенатора Genetic Analyzer 3500 (Applied Biosystems, США).
Редактирование и сборку полученных консенсусных последовательностей проводили путем сопоставления прямых и обратных хроматограмм при помощи программ Ridom TraceEdit (ver. 1.1.0) и Mega6. Для построения филогенетического дерева в анализ из GenBank были добавлены ДНК-последовательности 45 представителей Sphaeropleales и 2 из клады Radicarteria, взятых в качестве внешней группы. Нуклеотидные последовательности генов 18S рДНК и rbcL выравнивали по отдельности с помощью программы Mafft v7, используя модель E-INS-i [14]. Далее проводили окончательное выравнивание – визуально определяли и удаляли неспаренные участки в начале и в конце полученных матриц, при этом для белок-кодирующих последовательностей гена rbcL убеждались, что начало выравненной матрицы соответствует первой позиции кодона (триплета). После удаления неспаренных участков выровненные последовательности гена 18S рДНК объединяли с последовательностями гена rbcL в одну матрицу длиной 1428 п.н. в программе Mega6. Реконструкцию филогенетических связей осуществляли методами максимального правдоподобия (ML) и Байеса (BI) с применением модели GTR + G + I. Для выбора модели нуклеотидных замен использовали программу Mega6. Деревья ML строили в онлайн программе RA×ML [15] с проверкой их устойчивости 1000 бутстреп-репликами. BI анализ проводили с помощью программы MrBayes-3.2.5 [16] со следующими параметрами: случайное начальное дерево, количество запусков – 2, число параллельных цепочек – 4, количество поколений – 1 × 106, запись параметров каждого сотого поколения и параметр отжига – 25%. Просмотр и редактирование дерева осуществляли в программах FigTree (ver. 1.4.2) и Adobe Photoshop CC (19.0).
Для определения состава жирных кислот клетки водорослей отмывали от среды дистиллированной водой, осаждали центрифугированием (4000 об./мин, 10 мин) и удаляли надосадочную жидкость, операцию повторяли три раза. После отмывания биомассу водорослей фиксировали 10 мл горячего изо-пропанола, содержащего 20 мг/л ионола, и выдерживали 20 мин при 70°С. Зафиксированные таким образом пробы до анализа хранили при –20°С. Для определения ЖК суммарных липидов и их содержания в пересчете на этерифицированные ЖК, предварительно зафиксированные пробы с определенной сухой массой клеток количественно переносили в 50-мл круглодонную колбу, добавляли 100 мкг маргариновой кислоты (Кат. № H3500, Sigma-Aldrich, США), используемой в качестве внутреннего стандарта и упаривали изо-пропанол досуха на ротационном вакуумном испарителе (РВИ). К сухому остатку приливали 10 мл 1 М раствора КОН в 80% водном этаноле, закрывали колбу обратным холодильником и выдерживали 60 мин при температуре кипения смеси (~80°С). По истечении времени растворители упаривали in vacuo до объема ~3 мл и количественно переносили дистиллированной водой в 50-мл центрифужную пробирку до общего объема 25 мл, после чего порциями по 10 мл н-гексана (ХЧ, Химмед, Россия) трижды экстрагировали неомыляемые компоненты. Для ускорения разделения фаз, пробирку центрифугировали 5 минут при комнатной температуре и 2000 об./мин. После этого водную фазу закисляли до слабокислой реакции (по индикаторной бумаге) несколькими каплями 20% серной кислоты (ХЧ, Химмед, Россия) и 20 мл н-гексана экстрагировали свободные жирные кислоты (СЖК). Гексановый раствор СЖК переносили в сухую круглодонную колбу объемом 50 мл, с помощью ротационного вакуумного испарителя (IKA RV-10, Германия) упаривали растворитель досуха, после чего к сухому остатку добавляли 10 мл абсолютного метанола (Кат. № 34860, Sigma-Aldrich, США) и 1 мл ацетилхлорида (Кат. № 114189, Sigma-Aldrich, США). Колбу, закрытую обратным холодильником, выдерживали один час при 70°С, после чего упаривали растворители досуха, к сухому остатку добавляли несколько капель дистиллированной воды и н-гексаном экстрагировали метиловые эфиры жирных кислот (МЭЖК).
Полученные метиловые эфиры ЖК анализировали при помощи газо-жидкостного хроматографа Agilent 7890A (Agilent Technologies, США) с масс-спектрометрическим детектором Agilent 5975С. Использовали капиллярную колонку DB-23 длиной 60 м и диаметром 0.25 мм (B&W, США). Остальные условия анализа: газ носитель – гелий, скорость потока 1 мл/мин, объем вводимого образца 1 мкл, делитель потока 1 : 5, температура испарения 260°C. Программа градиента температуры: от 130 до 170°C с шагом в 6.5°C/мин; от 170 до 215°C с шагом в 2.5°C/мин, 215°C в течение 25 мин, от 215 до 240°C с шагом 40°C/мин; и окончательная стадия продолжительностью 50 мин при 240°C. Рабочая температура масс-спектрометрического детектора была 240°C, энергия ионизации 70 эВ [17].
РЕЗУЛЬТАТЫ
Классификация, морфология и депонирование Pseudomuriella engadinensis
Pseudomuriella engadinensis CAMU MZ–Ch33 (рис. 1) относится к отделу Chlorophyta, классу Chlorophyceae, порядку Sphaeropleales, кладе DO, семейству Pseudomuriellaceae, роду Pseudomuriella.
Рис. 1.
Pseudomuriella engadinensis, штамм CAMU MZ–Ch33: (а) – молодые вегетативные клетки, возраст 2 недели; (б) – зрелая вегетативная клетка с несколькими ядрами (ядра указаны стрелками), возраст 3 мес.; (в) – зрелая вегетативная клетка с накопленными включениями желто-оранжевого цвета, возраст 6 мес.; (г) – многочисленные хлоропласты, вид с поверхности зрелой клетки; (д) – клетка с утолщенной оболочкой; (е) – автоспорангий. Шкала – 10 μm.
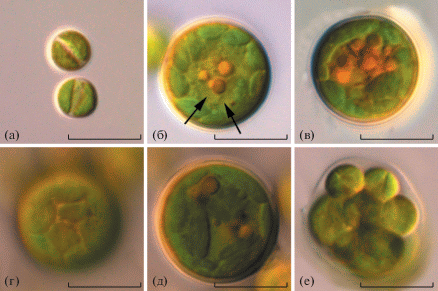
Молодые клетки шаровидные с одним пристенным широким поясковидным хлоропластом, 5–6 мкм в диаметре. Зрелые клетки шаровидные или немного сжатые, 14–18 мкм в диаметре. Хлоропласты пристенные и многочисленные, дисковидной или линзовидной формы, без пиреноидов. Иногда хлоропласты могут располагаться достаточно плотно. У молодых клеток оболочка тонкая и гладкая, с возрастом может утолщаться до 1–1.4 мкм. Зрелые клетки многоядерные. С возрастом культуры клетки накапливают включения желто-оранжевого цвета. Размножение происходит путем образования автоспор по 2–4 (8) шт. Зооспоры или половое размножение не наблюдалось.
Исследуемый штамм поддерживается в Коллекции водорослей Мелитопольского государственного педагогического университета им. Б. Хмельницкого CAMU (WDCM1158) под номером CAMU MZ–Ch33 и в Коллекции культур водорослей лаборатории молекулярной систематики водных растений Института физиологии растений им. К.А. Тимирязева под номером MZ–Ch33.
Нуклеотидные последовательности в GenBank: участок V4 18S рДНК (номер доступа MH660907), фрагмент хлоропластного гена rbcL (номер доступа MH672690).
Экология и местообитание Pseudomuriella engadinensis
Штамм CAMU MZ–Ch33 выделен из образца верхнего пятисантиметрового слоя почвы, отобранного в смешанном насаждении сосны крымской (Pinus pallasiana D. Don) и белой акации (Robinia pseudoacacia L.) “Мелитопольского центрального парка культуры и отдыха им. М. Горького” (С 46°50′17.04′′ В 35°21′46.15′′), г. Мелитополь, Запорожская обл., Украина, 10.11.2012. Почва темно-каштановая, pH(водн.) почвы 5.06; влажность – 5.1%; зольность – 62.31%.
Молекулярно-филогенетический анализ Pseudomuriella engadinensis
Для определения филогенетического положения исследуемого штамма CAMU MZ–Ch33 нами получены нуклеотидные последовательности участка V4 ядерного гена 18S рДНК длиной 382 п.н. и фрагмент хлоропластного гена rbcL длиной 1041 п.н. Использование участка V4 аргументировано его большой вариабельностью по сравнению с другими регионами 18S рДНК; rbcL, среди используемых в работе с зелеными водорослями митохондриальных и пластидных генов, сочетает простоту амплификации и содержит больше вариаций, чем обеспечивает лучшее разрешение на более низких таксономических уровнях по сравнению с 18S рДНК [6]. Реконструкция филогенетических связей методами максимального правдоподобия (ML, где LB – значение бутстрепа) и Байеса (BI, где PP – апостериорная вероятность) показала, как и в предыдущих исследованиях, касающихся вопросов филогении штаммов Pseudomuriella [3, 6], что все включенные в анализ последовательности Pseudomuriella образовали единую кладу Pseudomuriellaceae с максимальной статистической поддержкой (LB 100, PP 100), в состав которой вошел штамм CAMU MZ–Ch33 (рис. 2). При этом данная клада была идентичной как в дереве, построенном на основе объединенных последовательностей генов 18Sи rbcL, так и в индивидуальных деревьях для гена rbcL (Supplementary Fig. S1 ) и 18S (Supplementary Fig. S2 ). Клада Pseudomuriellaceae разделяется на две хорошо поддерживаемые субклады, одна из которых содержит виды P. aurantiaca, P. engadinensis и P. cubensis (LB 99, PP 100), а другая – только P. schumacherensis (LB 100, PP 100) (рис. 2). Исследуемый нами штамм CAMU MZ–Ch33 показал наибольшее родство со штаммами P. engadinensis и образовал с ними субкладу PE, включающую и изотип вида – штамм UTEX 57 (рис. 2).
Рис. 2.
Филогенетическое дерево Sphaeropleales, сконструированное на основе совместного анализа нуклеотидных последовательностей участка V4 18S рДНК и фрагмента гена rbcL для 45 представителей порядка. В качестве внешней группы выбрана клада Radicarteria. Общая длина выравнивания 1428 п.н. Исследуемый штамм выделен жирным шрифтом. Для всех представителей указан номер штамма и номера доступа к последовательностям в GenBank. Справа от вертикальных линий указаны названия филогенетических линий и клад. Над горизонтальными линиями показаны значения бутстрепа для ML-анализа (< 50 не указаны), под горизонтальными линиями – значения Байесовских апостериорных вероятностей (< 80 не указаны); значения равные 100 обозначены *. Модель нуклеотидных замен GTR + G + I.
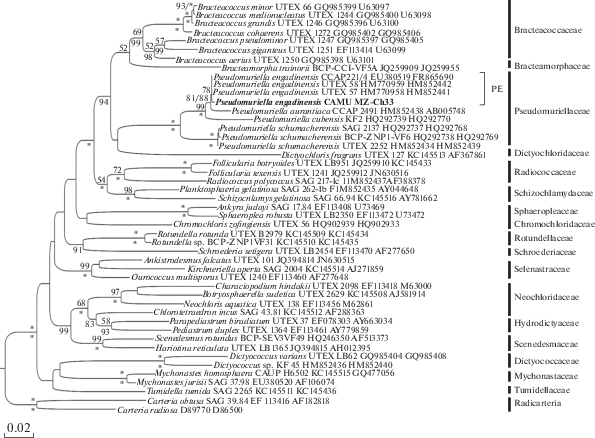
Выборка для построения филогенетического дерева состояла из представителей 17 семейств Sphaeropleales, за исключением Microsporaceae [18]. Также в анализ мы включили представителей семейства Dictyococcaceae, предложенного Fučiková с соавторами [7] как часть Sphaeropleales. Вся исследуемая выборка разбилась на клады, соответствующие современному пониманию филогении Sphaeropleales [7, 18]. Единственным исключением является положение Chlorotetraedron incus (Teiling) Komárek et Kovácik, для которой показано вхождение в кладу Neochloridaceae [7]. В нашем филогенетическом дереве штамм Chlorotetraedron incus SAG 43.81 с невысокой поддержкой (PP 83) присоединился к соседней кладе Hydrodictyaceae (рис. 2). Следует отметить, что в оригинальном исследовании, основанном на 7 генах, место присоединения Chlorotetraedron incus к кладе Neochloridaceae также имеет низкую статистическую поддержку (LB 54, PP 67) [7]. Построенные индивидуальные rbcL и 18S деревья для Sphaeropleales имели подобную топологию с объединенным rbcL-18S деревом (Supplementary Figs S1, S2 , рис. 2). К специфическим чертам индивидуальных деревьев можно отнести изменение положения отдельных клад внутри деревьев: Tumidellaceae и Bracteamorphaceae в rbcL-дереве (Supplementary Fig. S1 ), Schizochlamydaceae и Radiococcaceae в 18S-дереве (Supplementary Fig. S2 ). При этом качественный состав полученных клад остается идентичным в объединенном и индивидуальных деревьях.
Несмотря на то, что нет четких морфологических различий между видами P. aurantiaca и P. engadinensis, и данная пара, вероятно, располагается на границе внутривидовой и межвидовой изменчивости [6], мы относим штамм CAMU MZ–Ch33 к P. engadinensis. С точки зрения морфологии, диагноз нашего штамма соответствует приведенным раннее описаниям Chlorellopsis engadinensis и B. engadinensis [19, 20]. Основным же аргументом в пользу такого таксономического статуса является количество нуклеотидных замен в исследуемых генах. Так, в участке V4 18S рДНК штамм CAMU MZ–Ch33 отличается от P. aurantiaca CCAP 2491 девятью нуклеотидными заменами и пятью вставками/делециями, при этом от всех известных штаммов P. engadinensis (в том числе изотипа UTEX 57) – только одной трансверсией T → A. Фрагмент гена rbcL нашего штамма полностью идентичен аналогичным участкам у всех штаммов P. engadinensis, тогда как от P. aurantiaca CCAP 2491 отличается шестью заменами.
Состав жирных кислот
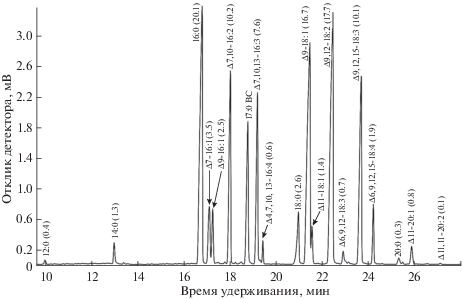
Анализ жирнокислотного состава штамма P. engadinensis CAMU MZ–Ch33 во время стационарной фазы роста показал, что в составе суммарных липидов клеток главными ЖК были пальмитиновая (16:0), гексадекадиеновая (Δ7,10-16:2), ругановая (Δ7,10,13-16:3), олеиновая (Δ9-18:1), линолевая (Δ9,12-18:2) и α-линоленовая (Δ9,12,15-18:3) – на их долю приходилось 82.4% от суммы ЖК (рис. 3). В минорных количествах содержались лауриновая (12:0), миристиновая (14:0), изомеры гексадеценовой кислоты Δ7- и Δ9-16:1), гексадекатетраеновая (Δ4,7,10,13-16:4), цис-вакценовая (11-18:1), γ-линоленовая (Δ6,9,12-18:3) и стеаридоновая (Δ6,9,12,15-18:4), они составляли 14.9%. Оставшиеся 2.7% составляли насыщенные и ненасыщенные ЖК с очень длинной цепью (поскольку на рис. 3 они не представлены, в скобках после обозначения каждой ЖК в соответствии с принятой номенклатурой приведено ее содержание в процентах от суммы ЖК): арахиновая (20:0, 0.3%), гондоиновая (Δ11-20:1, 0.8%), эйкозадиеновая (Δ11,14-20:2, 0.1%), бегеновая (22:0, 0.7%), лигноцериновая (24:0, 0.3%), церотиновая (26:0, 0.3%) и монтановая (28:0, 0.1%). Содержание суммарных липидов в пересчете на этерифицированные жирные кислоты составило 87.9 ± 2.1 мг/г сухой массы клеток, индекс ненасыщенности ЖК 1.460 ± 0.068 отн. ед; ω-3-ЖК составляли 20.2%, ω-6 – 28.6% от суммы ЖК.
Рис. 3.
Фрагмент ГЖХ-МС хроматограммы метиловых эфиров жирных кислот из суммарных липидов клеток штамма Pseudomuriella engadinensis CAMU MZ–Ch33 (суммарный ионный ток). Содержание i-ЖК в масс. % от суммы жирных кислот указано в скобках над ее пиком на хроматограмме (приведено среднее значение по трем повторностям, стандартное отклонение не превышало 5%).
ОБСУЖДЕНИЕ
Исследования показали, что водоросли с Bracteacoccus-подобной морфологией (имеющие шаровидные многоядерные вегетативные клетки с несколькими пристенными хлоропластами без пиреноидов) полифилетичны и образуют внутри Sphaeropleales несколько филогенетических клад независимых от линий Bracteacoccaceae и Radiococcaceae – это, например, Chromochloridaceae, Pseudomuriellaceae и Rotundellaceae [3, 4, 6, 7]. Bracteacoccus-подобные морфологические характеристики встречаются не только в Sphaeropleales. По строению и размерам вегетативных клеток с родом Bracteacoccus легко спутать виды Muriella J.B. Petersen, которые на данный момент относятся к Trebouxiophyceae. Возможно, именно отсутствие четких морфологических отличий между представителями родов Pseudomuriella и Bracteacoccus послужило причиной сформировавшегося мнения о широком распространении видов рода Bracteacoccus, имеющего большее видовое разнообразие и хорошо известного среди исследователей. Использование наряду со световой микроскопией биохимических, экологических или молекулярно-генетических методов часто помогает выявить скрытое разнообразие водорослей на определенных территориях и пересмотреть представления о космополитизме отдельных представителей [21].
Водоросли c Bracteacoccus-подобной морфологией в почвах Украины представлены преимущественно видами рода Bracteacoccus. Среди представителей рода повсеместно встречается B. minor (Schmidle ex Chodat) Petrová [22–27]. Широко распространены B. giganteus H.W. Bischoff et Bold и B. grandis H.W. Bischoff et Bold. Они отмечены в почве различных природных экосистем, урбоэкосистем и субстратах техногенных экотопов [10, 22, 28]. Виды B. aerius H.W. Bischoff et Bold, B. aggregatus Tereg, B. cohaerens H.W. Bischoff et Bold, B. medionucleatus Bischoff et Bold, B. pseudominor H.W. Bischoff et Bold – отмечены значительно реже.
Род Dictyococcus на данной территории представлен только D. varians Gerneck. Он отмечен в почве грабового леса и остепненного луга Каневского заповедника [22], в дубовой подстилке Алтагирского леса [25].
Из видов Muriella обнаружены M. magna Fritsch et John в почвенных образцах из г. Луганск [22], M. terrestris Petersen в засоленных почвах Азово-Сивашского Национального природного парка [29], в почве дубового и соснового насаждений Великоанадольского лесничества [23], в трещинах гранита каньона р. Южный Буг [10], в дубовой подстилке Самарского леса [25]. Для M. terrestris, рассматриваемого в качестве синонима M. urantiaca Vischeragata, приводится еще одно местообитание – почва березового леса Полесского заповедника [22].
При этом следует учитывать, что установление видовой принадлежности водорослей во всех выше перечисленных случаях сделано исключительно с помощью световой микроскопии. Принимая во внимание сложную морфологию группы, применение молекулярно-генетических методов в дальнейшем позволит уточнить распространение и разнообразие водорослей с Bracteacoccus-подобной морфологией на территории Украины.
Один из синонимов P. engadinensis изначально был описан в составе рода Chlorellopsis как Chlorellopsis engadinensis. Однако на сегодняшний момент типовой вид Chlorellopsis pyrenoidosa перенесен в род Pseudochlorella J.W.G. Lund как Pseudochlorella pyrenoidosa (Zeitler) J.W.G. Lund и входит в состав Trebouxiophyceae [18]. Во флоре водорослей Украины Pseudochlorellopsis pyrenoidosa найдена в почве соснового леса Карпатского биосферного заповедника [22] и почве о. Змеиный [28]. Таким образом, ближайшей к нашей находке остается обнаруженная Pseudomuriella sp. в почве каньона р. Рось [10].
Все известные штаммы P. aurantiaca и P. engadinensis были выделены из почвенных местообитаний на территории Центральной Европы (Чехия и Швейцария), кроме штамма P. engadinensis ATA1-4KH47C из почвенной корки в пустыне Атакама (Чили). Изначально Chlorellopsis engadinensis и Chlorellopsis terrestris (на данный момент оба включены в P. engadinensis) были описаны из почвы в Швейцарских Альпах [19]. Позже оба вида были перенесены в род Bracteacoccus [20]. В связи с этим наша находка P. engadinensis в почве соснового насаждения на юге Украины значительно расширяет понимание биогеографии вида и рода в целом.
Новые исследования по поиску биотехнологически перспективных штаммов водорослей показали, что ряд представителей Sphaeropleales характеризуются способностью накапливать значительное количество α-токоферола (витамина Е) в стационарной фазе роста [2]. Авторы протестировали 130 штаммов водорослей и показали, что максимальный показатель содержания α-токоферола принадлежит штамму SAG 34-1a Haematococcus pluvialis Flotow (Chlamydomonadales) – до 880.38 мг/г сухой массы. Среди Sphaeropleales наибольшее содержание α-токоферола отмечено у Coelastrella rubescens (Vinatzer) Kaufnerová et Eliás (до 509.11 мг/г) и Coenochloris oleifera (Broady) Kostikov, Darienko, Lukesová et Hoffmann (до 740.47 мг/г). Для штамма SAG 211-4 P. engadinensis обнаружено накопление витамина Е на уровне 240.11 мг/г, при этом азотное голодание способствовало увеличению этого показателя до 443.88 мг/г. В своей работе авторы подчеркивают, что содержание α-токоферола может значительно варьировать среди разных изолятов одного и того же вида.
Накопление в научной литературе результатов успешного использования липидных профилей в качестве биомаркеров [30] позволяет рассматривать анализ состава ЖК как один из методов определения видовой принадлежности водорослей наряду со световой микроскопией и молекулярной филогенией. В данном контексте спектр ЖК штамма P. engadinensis CAMU MZ–Ch33 наиболее близок к аналогичным спектрам штаммов P. engadinensis SAG 221-3 и SAG 221-4 по сравнению со штаммом P. aurantiaca SAG 249-1 [30]. Особенно выделяются отличия в содержании таких жирных кислот как ругановая (7.6–12.4% у штаммов P. engadinensis и 2.1% у P. aurantiaca SAG 249-1), олеиновая (16.1–20.7% у штаммов P. engadinensis и 39.0% у P. aurantiaca) и α-линоленовая (10.1–12.3% у штаммов P. engadinensis и 6.4% у P. aurantiaca).
Не смотря на общее сходство спектров ЖК, присутствует несколько специфических черт, отличающих штамм P. engadinensis CAMU MZ–Ch33 от штаммов P. engadinensis SAG 221-3 и SAG 221-4. Наш штамм характеризуется почти в два раза большим содержанием пальмитиновой (16:0) ЖК – 20.1% по сравнению с 11.3% (SAG 221-3) и 10.1% (SAG 221-4). Также отмечено увеличенное количество линолевой (Δ9,12-18:2) ЖК – 17.7% у CAMU MZ–Ch33 при 11.6 и 12.0% у SAG 221-3 и SAG 221-4 соответственно [30]. Такие отличия могут быть связаны с использованием разных питательных сред для культивирования (BBM для CAMU MZ–Ch33 и ESP Ag для SAG 221-3 и SAG 221-4) или являться специфическими чертами изолятов. В целом, несмотря на невысокое содержание суммарных липидов в сухой биомассе P. engadinensis CAMU MZ–Ch33 (8.79 ± 2.1%), ценным является достаточно высокое содержание линолевой ЖК, которая является незаменимой для животных и может быть превращена в их организмах в длинноцепочечные полиненасыщенные ЖК [1]. Немаловажным является наличие на уровне 20.2% одной из наиболее ценных групп веществ в рационе животных – омега-3-полиненасыщенных ЖК. В связи с этим выделенный нами новый штамм P. engadinensis CAMU MZ–Ch33 может быть рассмотрен как один из компонентов при создании подкормок в животноводстве или аквакультуре.
ЗАКЛЮЧЕНИЕ
Изучение водорослей в почве искусственных лесных насаждений г. Мелитополь позволило выделить в культуру штамм новой для флоры Украины зеленой водоросли Pseudomuriella engadinensis (Sphaeropleales, Chlorophyta), относящейся к группе загадочных видов среди родов Bracteacoccus и Pseudomuriella. Таксономическое положение данного штамма подтверждено с помощью молекулярно-филогенетического анализа на основе ядерного гена 18S рДНК и хлоропластного r-bcL. Анализ жирнокислотного состава клеток исследованного штамма CAMU MZ–Ch33 показал увеличенное содержание пальмитиновой и линолевой ЖК по сравнению с другими штаммами P. engadinensis. Обнаружение криптических таксонов в почвенной альгофлоре Украины указывает на наличие скрытого разнообразия водорослей и актуализирует проведение дальнейших исследований с привлечением молекулярно-филогенетических методов. Полученные результаты являются продолжением морфологического и молекулярно-филогенетического изучения криптических и псевдокриптических родов зеленых водорослей, а также дальнейшим развитием выборки биотехнологически перспективных штаммов водорослей.
Исследование выполнено за счет гранта Российского научного фонда (проект № 18-74-00095).
Список литературы
Maltsev Y.I., Konovalenko T.V., Barantsova I.A., Maltseva I.A., Maltseva K.I. Prospects of using algae in biofuel production // Regul. Mech. Biosyst. 2017. V. 8. P. 455–460. https://doi.org/10.15421/021770
Mudimu O., Koopmann I.K., Rybalka N., Friedl T., Schulz R., Bilger W. Screening of microalgae and cyanobacteria strains for α-tocopherol content at different growth phases and the influence of nitrate reduction on α-tocopherol production // J. Appl. Phycol. 2017. https://doi.org/10.1007/s10811-017-1188-1
Fučiková K., Rada J.C., Lewis L.A. The tangled taxonomic history of Dictyococcus, Bracteacoccus and Pseudomuriella (Chlorophyceae, Chlorophyta) and their distinction based on a phylogenetic perspective // Phycologia. 2011. V. 50. P. 422–429. https://doi.org/10.2216/10-69.1
Fučiková K., Lewis L.A. Intersection of Chlorella, Muriella and Bracteacoccus: Resurrecting the genus Chromochloris Kol et Chodat (Chlorophyceae, Chlorophyta) // Fottea. 2012. V. 12. P. 83–93.
Hanagata N. Phylogeny of the subfamily Scotiellocystoideae (Chlorophyceae, Chlorophyta) and related taxa inferred from 18S ribosomal RNA gene sequence data // J. Phycol. 1998. V. 34. P. 1049–1054.
Fučiková K., Rada J.C., Lukešová A., Lewis L.A. Cryptic diversity within the genus Pseudomuriella Hanagata (Chlorophyta, Chlorophyceae, Sphaeropleales) assessed using four Barcode markers // Nova Hedw. 2011. V. 93. P. 29–46. https://doi.org/10.1127/0029-5035/2011/0093-0029
Fučiková K., Lewis P.O., Lewis L.A. Putting incertae sedis taxa in their place: a proposal for ten new families and three new genera in Sphaeropleales (Chlorophyceae, Chlorophyta) // J. Phycol. 2014. V. 50. P. 14–25. https://doi.org/10.1111/jpy.12118
Kalina T., Punčochářová M. Taxonomy of the subfamily Scotiellocystoideae Fott 1976 (Chlorellaceae, Chlorophyceae) // Arch. Hydrobiol. 1987. V. 73. P. 473–521.
Caisova L., Melkonian M. Evolution of helix formation in the ribosomal internal transcribed spacer 2 (ITS2) and its significance for RNA secondary structures // J. Mol. Evol. 2014. https://doi.org/10.1007/s00239-014-9625-0
Михайлюк Т.І., Кондратюк С.Я., Нипорко С.О., Дарієнко Т.М., Демченко Е.М., Войцехович А.О. Лишайники, Мохоподібні та наземні водорості гранітних каньйонів України. Київ: Альтерпрес, 2011. 398 с.
Bischoff H.W., Bold H.C. Phycological studies IV. Some soil algae from Enchanted Rock and related algal species. University of Texas Publication 6318, 1963. 95 p.
Zimmermann J., Jahn R., Gemeinholzer B. Barcoding diatoms: evaluation of the V4 subregion on the 18S rRNA gene, including new primers and protocols // Org. Divers. Evol. 2011. V. 11. P. 173–192.
Nakada T., Shinkawa H., Ito T., Tomita M. Recharacterization of Chlamydomonas reinhardtii and its relatives with new isolates from Japan // J. Plant Res. 2010. V. 123. P. 67–78.
Katoh K., Toh H. Parallelization of the MAFFT multiple sequence alignment program // Bioinformatics. 2010. V. P. 1899–1900.
Stamatakis A., Hoover P., Rougemont J. A rapid bootstrap algorithm for the RAxML web-servers // Syst. Biol. 2008. V. 75. P. 758–771.
Ronquist F., Huelsenbeck J.P. MrBayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. P. 1572–1574.
Стариков А.Ю., Усербаева А.А., Миронов К.С., Сидоров Р.А., Заядан Б.К., Бедбенов В.С., Синетова М.А., Лось Д.А. Субстратная специфичность ацил-липидной ∆9-десатуразы жирных кислот из цианобактерии Cyanobacterium sp. IPPAS B-1200 с необычным жирнокислотным составом // Физиология растений. 2018. Т. 65. С. 270–278.
Neustupa J.I. Chlorophyta, Streptophyta p.p. (except Ulvophyceae, Charophyceae; incl. Trentepohliales). In: Syllabus of Plant Families. A. Engler’s Syllabus der Pflanzenfamilien Part 2/1: Photoautotrophic eukaryotic Algae Glaucocystophyta, Cryptophyta, Dinophyta/Dinozoa, Haptophyta, Heterokontophyta/Ochrophyta, Chlorarachniophyta/Cercozoa, Euglenophyta/ Euglenozoa, Chlorophyta, Streptophyta p.p. Wolfgang F. (Ed.). GmbH: Borntraeger Science Pub., 2015. P. 190–247.
Kol E., Chodat F. Quelques algues nouvelles des sols et de la neige du Parc National Suisse, Engadine // Bulletin de la Socie’te’botanique de Gene`ve. 1934. V. 25. P. 250–263.
Starr R.C. A comparative study of Chlorococcum Meneghini and other spherical, zoospore producing genera of the Chlorococcales. Bloomington: Indiana University Press, 1955. 111 p.
Maltsev Y., Kulikovskiy M. Molecular and morphological investigation of cosmopolitan diatom Hantzschia amphioxys with remarks on biogeography // Phycologia. 2017. V. 56. No. 4. P. 125.
Костіков І.Ю., Романенко П.О., Демченко Е.М., Дарієнко Т.М., Михайлюк Т.І., Рибчинський О.В., Солоненко А.М. Водорості ґрунтів України (історія та методи дослідження, система конспектфлори). Київ: Фітосоціоцентр, 2001. 300 с.
Мальцева І.А. Ґрунтові водорості лісів степової зони України. Мелітополь: Люкс, 2009. 312 с.
Scherbina V.V., Maltseva I.A., Solonenko A.N. Peculiarities of postpyrogene development of algae in steppe biocenoses at Askania Nova Biospheric National Park // Contemp. Probl. Ecol. 2014. V. 7. P. 187–191. https://doi.org/10.1134/S1995425514020140
Maltsev Y.I., Pakhomov A.Y., Maltseva I.A. Specific features of algal communities in forest litter of forest biogeocenoses of the Steppe zone // Contemp. Probl. Ecol. 2017. V. 10. P. 71–76. https://doi.org/10.1134/S1995425517010085
Maltsev Y.I., Didovich S.V., Maltseva I.A. Seasonal changes in the communities of microorganisms and algae in the litters of tree plantations in the Steppe zone // Eurasian Soil Science. 2017. V. 50. P. 935–942. https://doi.org/10.1134/S1064229317060059
Maltsev Y.I., Maltseva I.A., Solonenko A.N., Bren A.G. Use of soil biota in the assessment of the ecological potential of urban soils // Biosyst. Divers. 2017. V. 25. P. 257–262. https://doi.org/10.15421/011739
Tsarenko P.M., Wasser S., Nevo E. Algae of Ukraine: diversity, nomenclature, taxonomy, ecology and geography. Vol. 3. Chlorophyta. Ruggell: A. R. G. Gantner Verlag, 2011. 515 p.
Vinogradova O.N., Darienko T.M. Algae of Azovo-Syvashsky national nature park (Ukraine) // Int. J. Algae. 2008. V. 10. P. 163–178. https://doi.org/10.1615/InterJAlgae.v10.i2.50
Lang I., Hodac L., Friedl T., Feussner I. Fatty acid profiles and their distribution patterns in microalgae: a comprehensive analysis of more than 2000 strains from the SAG culture collection // BMC Pl. Biol. 2011. V. 11. https://doi.org/10.1186/1471-2229-11-124
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


