Физиология растений, 2019, T. 66, № 5, стр. 367-374
Влияние неравномерного распределения макроэлементов на содержание гормонов и удлинение корней у растений пшеницы
А. В. Коробова a, И. И. Иванов a, *, Г. Р. Ахиярова a, С. Ю. Веселов b, Д. С. Веселов a, Г. Р. Кудоярова a
a Федеральное государственное бюджетное учреждение науки Уфимский институт биологии,
Уфимский федеральный исследовательский центр Российской академии наук
Уфа, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Башкирский государственный университет
Уфа, Россия
* E-mail: i_ivanov@anrb.ru
Поступила в редакцию 26.12.2017
После доработки 30.10.2018
Принята к публикации 16.11.2018
Аннотация
Повышение уровня минерального питания снижает относительную скорость роста корней, что отрицательно сказывается на засухоустойчивости растений. Этого не наблюдается при локальном внесении удобрений, при котором происходит активация удлинения корней, непосредственно не контактирующих с локально внесенными удобрениями. Данная работа направлена на выявление особенностей связи между содержанием гормонов и ростом растений Triticum durum Desf. под влиянием изменения уровня и распределения элементов минерального питания в среде. С этой целью была использована модель с разделенной корневой системой, имитирующая локальное внесение удобрений, когда часть корней контактирует с высокой (ВК), а другая часть – с низкой концентрацией макроэлементов (НК). С помощью иммуногистохимической локализации впервые показано, что торможение удлинения ВК-корней происходило на фоне повышенной концентрации цитокининов в клетках кончиков корней, чем можно объяснить торможение удлинения корней под влиянием повышенной концентрации элементов минерального питания. Не обнаружено различий по содержанию АБК в побегах между растениями, росшими на фоне неравномерного (гетерогенное, Гет-растения) и равномерного (гомогенное, Гом-растения) распределения макроэлементов, что указывает на отсутствие стрессового воздействия локального повышения концентрации осмотиков в области ВК-корней на растение в целом.
ВВЕДЕНИЕ
Известно, что дефицит минерального питания приводит к относительной активации роста корней, что способствует оптимизации поглощения элементов минерального питания и воды [1, 2]. Вместе с тем справедливо утверждение об ингибирующем влиянии удобрений на рост корней. Поскольку увеличение доступности питательных веществ вызывает относительное подавление развития корневой системы (по сравнению с ростом надземной части растений) [3], это может быть ограничивающим фактором при их адаптации к засухе. Гетерогенное распределение питательных веществ в почве уменьшает чувствительность растений к засухе за счет более высокой скорости удлинения корней вне зоны локального внесения удобрений и их проникновения в глубину почвы [4]. Этот ростовой ответ корней приводит к увеличению способности растений извлекать воду, когда в отсутствие осадков верхние слои почвы пересыхают [5]. Показано, что разделение корневой системы одного и того же растения по отсекам с разной концентрацией питательных веществ (split-root culture) имитирует функциональную дифференциацию корневой системы, наблюдаемую при локальном размещении удобрений (часть корней, снабженная более высокой концентрацией питательных веществ, короче и сильнее ветвится) [6]. Повышенное ветвление корней в зонах с высокой концентрацией элементов минерального питания объясняется более высоким содержанием ИУК [6]. Однако в упомянутых экспериментах не изучались механизмы действия локального распределения питательных веществ на рост корня в длину. В настоящей работе основное внимание было уделено цитокининам. Роль этих гормонов в реакции на уровень минерального питания хорошо известна [7]. Однако большинство исследователей изучали роль цитокининов в передаче в побег сигналов о доступности элементов минерального питания. Соответственно содержание цитокининов чаще определяли в листьях и ксилемном соке, но не в корнях, а роль этих гормонов в регуляции роста корней изучена слабо. Кроме того, в немногочисленных работах [7], в которых определяли содержание цитокининов в корнях при изменении уровня минерального питания, не оценивался их уровень в кончиках корней.
Цель настоящего исследования – выявление особенностей связи между содержанием гормонов и ростом корней растений Triticum durum Desf. под влиянием изменения уровня и распределения элементов минерального питания в среде. Исследовали как изменения общего содержания цитокининов, так и их уровень в кончиках корней (в последнем случае использовали иммуногистохимический метод). Содержание цитокининов в кончиках корней при изменении уровня минерального питания оценивалось впервые. Такой подход важен, поскольку рост корней происходит именно в их кончиках, а оценки суммарного содержания цитокининов в корнях может быть недостаточно для выявления их роли в регуляции роста корней. Содержание ИУК и АБК в корнях также измеряли для проверки возможного влияния этих гормонов на длину корня при изменении концентрации и распределения основных элементов питания в среде.
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений. Семена пшеницы сорта Безенчукская 139 (Triticum durum) проращивали на водопроводной воде в течение 4 суток. Для закладки опыта использовали блоки из двух сосудов с питательной средой Хогланда-Арнона I (Х-А) различной концентрации с добавлением одного и того же количества микроэлементов. Для имитации гетерогенного питания (Гет-растения) проростки с пятью развитыми зародышевыми корнями размещали на границе сосудов так, чтобы два зародышевых корня находились в питательном растворе, где концентрация макроэлементов была в 3 раза выше, чем в стандартном растворе Х-А (ВК, 300% Х-А: 15 мM KNO3, 15 мM Ca(NO3)2, 3 мM KH2PO4, 3 мM MgSO4, 15 мM CaSO4), а три других корня – в растворе низкой концентрации ЭМП (НК, 1% Х-А: 0.05 мM KNO3, 0.05 мM Ca(N03)2, 0.01 мM KH2PO4, 0.01 мM MgSO4, 0.05 мM CaSO4). На гомогенной среде (Гом-растения) оба сосуда содержали питательную смесь усредненной концентрации (150% Х-А: 7.5 мM KNO3, 7.5 мM Ca(N03)2, 1.5 мM KH2PO4, 1.5 мM MgSO4, 7.5 мM CaSO4). Осмотический потенциал 300% Х-А составлял –0.186 МПа, 150% Х-А: –0.102 МПа, 1% Х-А: –0.022 МПа. Объем сосуда 1.2 л. Проростки закрепляли на стыке сосудов с помощью силиконовых трубочек с прорезями, как показано на схеме (рис. 1). Растения выращивали при освещенности 400 мкмоль/(м2 с) ФАР с 14-часовым фотопериодом. Температуру воздуха днем и ночью поддерживали на уровне 26/20°C.
Рис. 1.
Схема опыта. Х-А – питательная среда Хогланда-Арнона I, Гом – растения (и корни) на гомогенном питании (150% Х-А), Гет – растения на гетерогенном питании, НК – корни на питательном растворе низкой концентрации (1% Х-А), ВК – корни на питательном растворе высокой концентрации (300% Х-А).

Для оценки возможного осмотического эффекта повышенной концентрации питательного раствора на рост корней сравнивали длину корней у растений, которые в течение 4 дней росли на 300% Х-А и 10% среде Х-А с добавлением ПЭГ-6000 до концентрации 8%, что по осмотическому потенциалу соответствует 300% Х-А (–0.19 МПа).
Также была проведена оценка влияния на длину корней добавления в питательный раствор проростков пшеницы экзогенного зеатина в концентрации 4 × 10–7 М с параллельным измерением содержания цитокининов в корнях растений.
Осмотический потенциал питательного раствора и корней измеряли с помощью осмометра (Osmomat 030, “Gonotec”, Германия) [8].
Среднюю длину зародышевых корней измеряли через 3, 4, 5 и 6 дней, количество боковых корней – через 4 и 6 дней после разделения корневой системы; отбор проб на содержание гормонов – через 4 дня после разделения корневой системы. Для выявления примордиев боковых корней использовали окраску ацетокармином [6].
Оценка содержания фитогормонов. Содержание гормонов определяли на четвертые сутки после перенесения растений в сосуды с разделенной корневой системой. Фитогормоны экстрагировали из побегов и корней растений с помощью 80% этилового спирта. Очистку и концентрирование ИУК и АБК из аликвоты водного остатка после упаривания спиртового экстракта проводили с помощью эфирной экстракции по модифицированной схеме [9]. Из подкисленной до рН 2–3 аликвоты водного остатка ИУК и АБК дважды экстрагировали диэтиловым эфиром в соотношении 1 : 3, затем возвращали их в водную фазу (1% раствор гидрокарбоната натрия, соотношение водной и органической фазы – 1 : 2), снова подкисляли до рН 2–3 и после 2-кратной реэкстракции диэтиловым эфиром метилировали диазометаном. Образцы высушивали и перед проведением иммуноанализа растворяли в небольшом количестве 80% этанола.
Цитокинины из аликвоты водного остатка концентрировали на картридже С18 (“Waters”, США), спиртовый элюат упаривали и наносили на тонкослойную пластину для хроматографического разделения [10, 11]. Зеатин, его рибозид и нуклеотид, положение которых определяли по поглощению ультрафиолета метчиками, элюировали фосфатным буфером (pH 7.2–7.4). Количественное определение ИУК, АБК и цитокининов проводили с помощью иммуноферментного анализа с использованием специфических антител к гормонам. Антитела к зеатинрибозиду обладают перекрестной реактивностью к зеатину, а также к его нуклеотиду и по этой причине были использованы для определения и этих разновидностей цитокининов [10]. Для подтверждения надежности результатов иммуноанализа ранее проводили сравнение данных иммуноанализа с результатами физико-химических методов хромато-масс-спектрометрии [10, 11].
Для исследования брали ткани апекса основного корня длиной 5 мм от его кончика. Содержащиеся в клетках свободные основания цитокининов фиксировали смесью 4% параформальдегида и 0.1% глутарового альдегида (на фосфатном буфере рН 7.2–7.4) в течение ночи (первые 30 мин под вакуумом), отмывали от фиксатора в фосфатном буфере (рН 7.3), обезвоживали в серии возрастающей концентрации этанола и заключали в метакрилатную смолу JB-4 (“Electron Microscopy Sciences”, США). Поверхность срезов обрабатывали антителами к рибозиду зеатина, которые имели сродство и к зеатину (фиксация смесью альдегидов обеспечивала конъюгацию свободных оснований цитокининов [12]). Связавшиеся с клеточными структурами антитела выявляли с помощью вторичных антител, меченных коллоидным золотом (“Aurion”, США), и препарата “серебряного усилителя” (silver enhancer) (“Aurion”, США). За развитием окраски наблюдали в световой микроскоп (“Carl Zeiss Jena”, Германия). Специфичность связывания антител подтверждена в данных экспериментах с помощью сравнения окрашивания срезов при использовании специфической и неиммунной сыворотки, а также ранее – в экспериментах, где было зарегистрировано повышение интенсивности окрашивания при поглощении экзогенных гормонов [11, 13] и индукции экспрессии ipt-гена, контролирующего синтез цитокининов [14] (положительный контроль). О специфичности метода также свидетельствуют эксперименты, в которых ингибирование окрашивания наблюдали в результате предварительной инкубации специфических антител с раствором синтетического фитогормона [10].
Опыты повторяли многократно (с определением гормонов – 3 раза). Статистические показатели рассчитывали стандартными методами с использованием программы MS Excel. Количество повторностей при определении разных показателей было неодинаковым, поэтому их число указано в подрисуночных подписях или в тексте. На рисунках и в таблицах приведены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Сравнение массы побегов растений, которые росли на фоне равномерного (Гом-растения) и гетерогенного (Гет-растения) распределения макроэлементов, не выявило существенных различий (рис. 2а). На шестой день после разделения корней их масса была достоверно больше у Гет-растений, чем у Гом-растений (рис. 2б). ВК-корни, находившиеся в 300% питательном растворе, росли медленнее, чем НК-корни, что было заметно, начиная с четвертого дня после разделения корневых прядей (рис. 3а). На шестой день в отсеке с низкой концентрацией ионов корни были значительно длиннее, чем при равномерном распределении макроэлементов (Гом-растения) (рис. 3б). Средняя длина корней Гом-растений не отличалась от длины ВК-корней (рис. 3б). Средняя длина корней у растений пшеницы, которые росли на фоне 300% Х-А, была на треть меньше по сравнению с корнями растений, росших на фоне раствора ПЭГ-6000, имеющего такой же осмотический потенциал, что и 300 Х-А (–0.19 МПа) (табл. 1). При этом содержание цитокининов на фоне ПЭГ было меньше, чем на растворе с высокой концентрацией макроэлементов.
Рис. 2.
Сырая масса побега (а) и зародышевого корня (б) растений пшеницы при гомогенном (1) и гетерогенном (2) распределении макроэлементов (n = 30). * – значения различаются при Р ≤ 0.05.
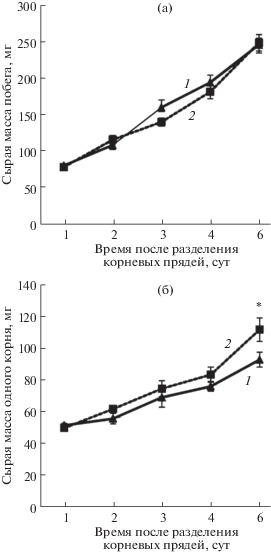
Рис. 3.
Средний суточный прирост корней (а) и длина зародышевых корней (б) растений пшеницы при гомогенном (1) и гетерогенном (2 – низкая концентрация, 3 – высокая концентрация питательного раствора) распределении макроэлементов (n = 30). * – значения различаются при Р ≤ 0.05; для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.05.
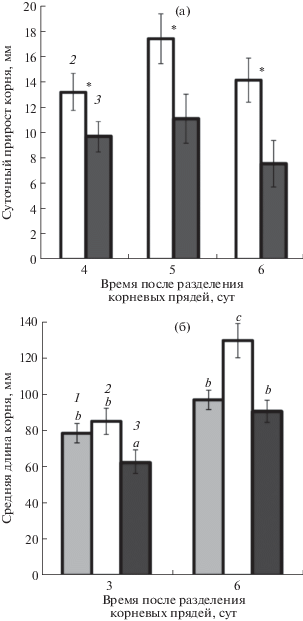
Таблица 1.
Длина корней (n = 40) и содержание цитокининов (n = 9) в корнях 8-дневных растений, росших 4 дня на среде с высокой концентрацией макроэлементов и растворе ПЭГ с тем же осмотическим потенциалом (–0.19 МПа)
| Варианты среды | Средняя длина корней, мм | Содержание цитокининов, нг/г сырой массы |
|---|---|---|
| 300% Х-А | 52 ± 3 | 4.9 ± 0.5 |
| 8% ПЭГ в 10% Х-А | 83 ± 5 | 2.3 ± 0.3 |
В экспериментах с разделенной корневой системой осмотический потенциал корней был как минимум в 3.7 раза (в случае ВК-корней) ниже, чем потенциал питательного раствора, что должно было обеспечить приток воды из питательного раствора (табл. 2). На четвертый день после разделения корней осмотический потенциал корней на фоне 300% Х-А был на 0.15 МПа ниже по сравнению с корнями на 1% Х-А. Таким образом, понижение осмотического потенциала 300% Х-А было скомпенсировано понижением осмотического потенциала ВК-корней по сравнению с НК-корнями.
Таблица 2.
Осмотический потенциал питательного раствора и контактирующих с ним корней 8-дневных растений пшеницы, которые 4 дня росли при разделении корневой системы (n = 3)
| Концентрация питательного раствора | Осмотический потенциал, МПа | |
|---|---|---|
| питательный раствор | корни | |
| 150% Х-А (Гом) | –0.081 | –0.520 ± 0.019b |
| 1% Х-А (НК) | –0.002 | –0.442 ± 0.011a |
| 300% Х-А (ВК) | –0.156 | –0.584 ± 0.009c |
На четвертый день, когда проводили отбор на анализ фитогормонов, различий по количеству боковых корней на зародышевый корень еще не было зарегистрировано, и сумма примордиев и боковых корней на зародышевых корнях растений разных вариантов была около 8. Количественное определение цитокининов в корнях показало более высокое содержание зеатина, его рибозида и нуклеотида в ВК-корнях по сравнению с НК-корнями (рис. 4а). По суммарному содержанию цитокининов в корнях растения, росшие на фоне равномерного распределения того же количества макроэлементов, занимали промежуточное положение между НК- и ВК-корнями. При подсчете содержания цитокининов на один боковой корень/примордий мы получили ту же тенденцию, что и при расчете на г массы корней: 0.13; 0.06 и 0.32 нг для Гом-растений (промежуточная величина), НК- (минимальное значение) и ВК-корней (максимальное значение) Гет-растений, соответственно. В побегах содержание цитокининов существенно не различалось у Гет-растений и Гом-растений как при расчете на г сырой массы (рис. 4б), так и на побег в целом (0.35 ± 0.04 и 0.33 ± 0.04 нг у Гет- и Гом-растений, соответственно). Суммарное содержание цитокининов в растениях в целом получили почти в 3 раза выше в Гет-растениях по сравнению с Гом-растениями (3.41 ± 0.48 и 1.36 ± 0.22 нг на растение, соответственно).
Рис. 4.
Содержание цитокининов (З – зеатин, ЗР – зеатинрибозид, ЗН – зеатиннуклеотид) в корнях (а) и побегах (б) растений пшеницы при гомогенном (1, 4) и гетерогенном (2 – корни на низкой, 3 – на высокой концентрации питательного раствора, 5 – побеги) распределении макроэлементов (n = 6). В рамках представлены значения содержания цитокининов (нг на 1 зародышевый корень). Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.05.

Оценка влияния экспозиции растений пшеницы на растворе экзогенного зеатина показала повышение содержания цитокининов (суммы зеатина, его рибозида и нуклеотида) в корнях примерно в 2 раза (от 3.8 ± 0.4 до 7.1 ± 0.6 нг/г сырой массы), что сопровождалось снижением длины корней на 17%.
Концентрация как ауксинов, так и АБК была выше в ВК-корнях по сравнению с НК-корнями, в то время как на фоне гомогенного распределения ионов содержание этих гормонов было на уровне НК корней (рис. 5). В побегах не было выявлено существенных различий по содержанию АБК между Гет-растениями и Гом-растениями, в то время как содержание ауксинов было ниже у Гет-растений по сравнению с Гом-растениями (рис. 6).
Рис. 5.
Содержание ИУК (а) и АБК (б) в корнях растений пшеницы при гомогенном (1) и гетерогенном (2 – низкая концентрация, 3 – высокая концентрация питательного раствора) распределении макроэлементов (n = 6). Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.01 по ИУК и при Р ≤ 0.05 по АБК.
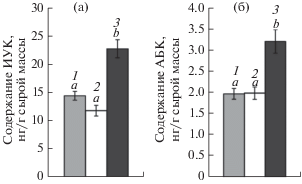
Рис. 6.
Содержание ИУК (а) и АБК (б) в побегах растений пшеницы при гомогенном (1) и гетерогенном (2) распределении макроэлементов (n = 6). * – различия достоверны при Р ≤ 0.01.

Иммунолокализация цитокининов в кончиках корней, фиксированных через 5 дней после начала эксперимента, когда наблюдался быстрый прирост НК корней (рис. 3а), показала более интенсивное окрашивание на зеатин клеток в зоне деления корней, контактирующих с повышенной концентрацией макроэлементов, по сравнению с НК-корнями (рис. 7).
Рис. 7.
Иммунолокализация цитокининов в кончиках корней, фиксированных через 5 дней после разделения корневой системы растений пшеницы при гетерогенном распределении макроэлементов (1 – низкая концентрация (половинка продольного среза – слева), 2 – высокая концентрация питательного раствора (половинка продольного среза – справа), масштабная линейка 200 мкм).

ОБСУЖДЕНИЕ
Снижение осмотического потенциала 300% питательного раствора Х-А могло способствовать торможению роста корней за счет снижения доступности воды для растений. Однако корни проявляли способность к накоплению осмотически активных веществ, и даже в случае 300% раствора Х-А осмотический потенциал корней был почти в 4 раза ниже, чем у питательного раствора, что обеспечивало поглощение воды ВК-корнями [15]. Кроме того, на фоне 300% Х-А корни были короче, чем на содержащем ПЭГ-6000 растворе с тем же осмотическим потенциалом. И наконец, корни Гом-растений были относительно короткими, несмотря на то, что осмотический потенциал их питательного раствора был близок к стандартному Х-А. Таким образом, торможение роста корней в длину, зарегистрированное на 300% Х-А, нельзя объяснить только осмотическими эффектами, что позволяет предполагать участие в этом процессе регуляторных факторов, например, гормонов.
Важно было понять, какие изменения в содержании гормонов в ответ на изменение концентрации и распределения элементов минерального питания могли способствовать подавлению роста корней в длину при повышении уровня ЭМП. Ранее высказывалось предположение, что торможение роста ВК-корней связано с накоплением в них АБК [4], что соответствует данным, полученным в настоящих экспериментах. Вместе с тем, уровень АБК в корнях при гомогенном распределении ионов был таким же, как в НК-корнях (рис. 5б), в то время как корни Гом-растений были короче, чем НК-корни (рис. 3б).
Известно, что ауксины стимулируют рост боковых корней и тормозят удлинение главного корня [16]. Это свойство ауксинов позволило связать укорочение ВК-корней с более высоким содержанием в них ауксинов. Однако, как и в случае АБК, уровень ауксинов в корнях Гом-растений был таким же, как и в НК-корнях.
Более короткие ВК-корни и корни Гом-растений отличались повышенным содержанием цитокининов по сравнению с НК-корнями. С помощью иммуногистохимического подхода в наших экспериментах впервые показано, что возрастание содержания цитокининов под влиянием повышенного уровня минерального питания наблюдается именно в кончиках корней, где происходит активный рост (рис. 7). Зависимость уровня цитокининов от минерального питания хорошо известна, и неоднократно было показано повышение продукции цитокининов под влиянием, например, нитратов [7]. Разбавление питательного раствора, напротив, приводило к снижению содержания цитокининов в корнях растений пшеницы [17]. Известно, что фитогормоны цитокинины способны ингибировать рост корней: как их удлинение, так и накопление массы [18, 19]. Двукратное повышение суммарного содержания цитокининов в корнях (в результате поглощения экзогенного зеатина) ингибировало удлинение корней пшеницы и в наших экспериментах. Более высокий уровень этих гормонов наблюдали в корнях Гом-растений по сравнению с НК-корнями Гет-растений (различия между НК- и ВК-корнями были еще более значительными). Таким образом, в наших экспериментах повышенный уровень цитокининов мог способствовать торможению удлинения корней в ответ на возрастание концентрации ЭМП в среде. На фоне 300% Х-А корни были короче, чем на растворе ПЭГ-6000 с тем же осмотическим потенциалом, а при этом накопления цитокининов на фоне ПЭГ не было зарегистрировано. Эти результаты свидетельствуют о том, что замедление роста корня при высокой концентрации макроэлементов обусловлено именно накоплением цитокининов, а не пониженным осмотическим потенциалом питательного раствора.
Хотя роли цитокинов в реакции на изменение уровня минерального питания уделялось много внимания, в основном обсуждалось их значение в передаче сигналов из корней и регуляция процессов, которые происходят в побеге [7]. В работе Kiba с соавторами отмечалась возможная роль цитокининов в регуляции архитектуры корней при изменении уровня нитратов в питательной среде [20]. Вместе с тем, нет четких доказательств участия цитокининов в регуляции роста корней при изменении уровня нитратов, что указывает на значимость полученных нами результатов, свидетельствующих о связи между накоплением цитокининов в кончиках корней и скоростью их удлинения. Содержание цитокининов именно в кончиках корней при изменении уровня минерального питания оценивалось впервые. Повышение уровня цитокининов под влиянием нитратов было зарегистрировано ранее в целых корнях, а не в их кончиках [21].
Поскольку экспрессия гена AtIPT5 была выявлена в примордиях боковых корней [22], можно предполагать, что повышенный уровень цитокининов у Гет-растений является следствием усиления ветвления, зарегистрированного на фоне неравномерного распределения элементов минерального питания [6]. Однако при сборе образцов на анализ не обнаружено различий по сумме боковых корней и их примордиев. Вероятно, в корнях 4-дневных растений повышенный уровень цитокининов мог быть скорее следствием способности нитратов активировать синтез цитокининов [21, 22]. Косвенным свидетельством возможности такого объяснения является более интенсивное окрашивание на цитокинины кончиков ВК-корней по сравнению с НК-корнями (рис. 7). На повышенный уровень синтеза цитокининов в ВК-корнях указывает также большее суммарное содержание цитокининов в расчете на целые Гет-растения по сравнению с Гом-растениями.
Таким образом, наши результаты свидетельствуют о том, что уровень ЭМП сказывается на содержании гормонов в растениях Triticum durum, что может обеспечивать изменение роста и развития корневой системы. Снижение уровня АБК и ИУК в НК-корнях может способствовать активации их удлинения, а повышенный уровень цитокининов в корнях на фоне повышения уровня ЭМП – укорочению корней.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (проект № 18-04-00460).
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Forde B., Lorenzo H. The nutritional control of root development // Plant and Soil. 2001. V. 232. P. 51–68.
Chun L., Mi G., Li J., Chen F., Zhang F. Genetic analysis of maize root characteristics in response to low nitrogen stress // Plant and Soil. 2005. V. 276. P. 369–382.
Agren G.I., Franklin O. Root: shoot ratios, optimization and nitrogen productivity // Annals of Botany. 2003. V. 92. P. 795–800.
Trapeznikov V.K., Ivanov I.I., Kudoyarova G.R. Effect of heterogeneous distribution of nutrients on root growth, ABA content and drought resistance of wheat plants // Plant and Soil. 2003. V. 252. P. 207–214.
Specht J.E., Chase K., Macrander M., Graef G.L., Chung J., Markwell J.P., Germann M., Orf J.H., Lark K.G. Soybean response to water: a QTL analysis of drought tolerance // Crop Science. 2001. V. 41. P. 493–509.
Иванов И.И. Эндогенные ауксины и ветвление корней при изолированном питании растений пшеницы // Физиология растений. 2009. Т. 56. С. 241–246.
Kudoyarova G.R., Veselov D.S., Dodd I.C., Rothwell S.A., Veselov S.Yu. Common and specific responses to availability of mineral nutrients and water // Journal of E-xperimental Botany. 2015. V. 66. P. 2133–2144.
Шарипова Г.В., Веселов Д.С., Кудоярова Г.Р., Тимергалин М.Д., Wilkinson S. Влияние ингибитора рецепции этилена на рост, водный обмен и содержание абсцизовой кислоты у растений пшеницы при дефиците воды // Физиология растений. 2012. Т. 59. С. 619–626.
Veselov S.U., Kudoyarova G.R., Egutkin N.L., Gyuli-Zade V.G., Mustafina A.R., Kof E.K. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole 3-acetic acid // Physiologia Plantarum. 1992. V. 86. P. 93–96.
Веселов С.Ю., Вальке Р.С. ван Онкелен Х., Кудоярова Г.Р. Содержание и локализация цитокининов в листьях исходных и трансгенных растений табака // Физиология растений. 1999. Т. 46. С. 34–40.
Kudoyarova G.R., Korobova A.V., Akhiyarova G.R., Arkhipova T.N., Zaytsev D.Yu, Prinsen E., Egutkin N.L., Medvedev S.S., Veselov S.Yu. Accumulation of cytokinins in roots and their export to the shoots of durum wheat plants treated with the protonophore carbonyl cyanide m-chlorophenylhydrazone (CCCP) // Journal of Experimental Botany. 2014. V. 65. P. 2287–2294.
Dewitte W., Chiappetta A., Azmi A., Witters E., Strnad M., Rembur J., Noin M., Chriqui D., Van Onckelen H. Dynamics of cytokinins in apical shoot meristems of a day-neutral tobacco during floral transition and flower formation // Plant Physiology. 1999. V. 119. P. 111–122.
Sharipova G., Veselov D., Kudoyarova G., Fricke W., Dodd I.C., M. Katsuhara, Furuichi T., Ivanov I. and Veselov S. Exogenous application of abscisic acid (ABA) increases root and cell hydraulic conductivity and abundance of some aquaporin isoforms in the ABA-deficient barley mutant Az34 // Annals of Botany. 2016. V. 118. P. 777–785.
Высоцкая Л.Б., Ахиярова Г.Р., Шарипова Г.В., Дедова М.А., Веселов С.Ю., Зайцев Д.Ю., Кудоярова Г.Р. Влияние локальной индукции гена ipt в корнях на содержание цитокининов в клетках листьев табака // Цитология. 2014. Т. 56. С. 816–821.
Кудоярова Г.Р., Трапезников В.К., Иванов И.И. Гидравлическая проводимость корней при гетерогенном распределении элементов минерального питания // Известия УНЦ РАН. 2013. № 2. С. 33–37.
Overvoorde P., Fukaki H., Beeckman T. Auxin control of root development // Cold Spring Harb. Perspect. Biol. 2010. V. 2(6): a001537. https://doi.org/10.1101/cshperspect.a001537
Vysotskaya L.B., Korobova A.V., Veselov S.Yu., Dodd I.C., Kudoyarova G.R. ABA mediation of shoot cytokinin oxidase activity: assessing its impacts on cytokinin status and biomass allocation of nutrient deprived durum wheat // Functional Plant Biology. 2009. V. 36. P. 66–72.
Ivanov V.B., Filin A.N. Cytokinins regulate root growth through its action on meristematic cell proliferation but not on the transition to differentiation // Functional Plant Biology. 2018. V. 45. P. 215–221.
Коробова А.В., Высоцкая Л.Б., Васинская А.Н., Кулуев Б.Р., Веселов С.Ю., Кудоярова Г.Р. Связь накопления биомассы корней с содержанием и метаболизмом цитокининов у нечувствительных к этилену растений // Физиология растений. 2016. Т. 63. С. 636–643.
Kiba T, Kudo T, Kojima M, Sakakibara H. Hormonal control of nitrogen acquisition: roles of auxin, abscisic acid, and cytokinin //Journal of Experimental Botany. 2011. V. 62. P. 1399–1409.
Takei, K., Sakakibara, H., Taniguchi, M. and Sugiyama, T. Nitrogen-dependent accumulation of cytokinins in root and the translocation to leaf: implication of cytokinin species that induces gene expression of maize response regulator // Plant Cell Physiology. 2001. V. 42. P. 85–93.
Miyawaki K, Matsumoto-Kitano M, Kakimoto T. Expression of cytokinin biosynthetic isopentenyltransferase genes in Arabidopsis: tissue specificity and regulation by auxin, cytokinin, and nitrate // The Plant Journal. 2004. V. 37. P. 128–138.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


