Физиология растений, 2019, T. 66, № 5, стр. 360-366
Влияние различных по симбиотической эффективности штаммов Rhizobium leguminosarum bv. viceae на изменение концентрации цАМФ и пероксида водорода в клетках проростков гороха
О. В. Кузакова a, Л. А. Ломоватская a, *, А. М. Гончарова a, А. С. Романенко a
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: LidaL@sifibr.irk.ru
Поступила в редакцию 02.07.2018
После доработки 26.11.2018
Принята к публикации 12.12.2018
Аннотация
Изучали изменение концентраций пероксида водорода (Н2О2) и циклического аденозинмонофосфата (цАМФ) в зависимости от интенсивности сорбции штаммов Rhizobium leguminosarum bv. viceae Frank (Rlv), различающихся по эффективности симбиотической азотфиксации, в зонах роста корня проростков гороха (Pisum sativum L.). Использовали планктонные культуры эффективного штамма Rlv (RCAM 1022) и неэффективных, высококонкурентных штаммов Rlv (RCAM 1064 и RCAM 1065). Интенсивность сорбции всех штаммов через 6 ч существенно различалась между собой в зонах корня, отличающихся по чувствительности к инфицированию Rlv (I–V зоны). Эффективный штамм Rlv 1022 обладал наиболее высокой сорбционной активностью, наименьшей – неэффективный штамм Rlv 1065. Под влиянием эффективного штамма Rlv 1022 повышенная концентрация цАМФ (120–130%) детектировалась в I–III зонах и понижалась практически до уровня контроля в IV, V зонах и эпикотиле. Под влиянием неэффективного штамма Rlv 1064 тенденция была близка к таковой у штамма Rlv 1022, однако под воздействием штамма Rlv 1065, также неэффективного, динамика изменения концентрации этой сигнальной молекулы была противоположной: в I–IV зонах концентрация цАМФ была близка к контролю и возрастала в V зоне и, особенно, в эпикотиле. Штаммы оказывали неодинаковый эффект на изменение концентраций пероксида водорода в зонах роста корня: под влиянием неэффективных штаммов концентрация Н2О2 в I–II зонах была на уровне (Rlv 1064) и ниже (Rlv 1065) контроля, существенно понижаясь под воздействием обоих штаммов в III зоне и незначительно повышаясь в IV–V зонах. При инфицировании эффективным штаммом Rlv 1022 содержание Н2О2 существенно превышало контрольные значения в I–II зонах, но планомерно снижалось в III–V зонах. В эпикотиле проростков гороха его концентрация в большей степени возрастала под влиянием неэффективных штаммов. Таким образом, при взаимодействии бактериальных мутуалистов с растениями-хозяевами активация сигналинга последних осуществляется в соответствии со степенью эффективности штаммов Rlv, направляя развитие инфицирования по пути мутуализма или патогенеза.
ВВЕДЕНИЕ
Формирование бобово-ризобиального симбиоза представляет собой многоступенчатый процесс, в котором контролирующая роль принадлежит растению-хозяину [1]. На его начальной стадии существенная роль отводится сорбционной способности ризобий на корнях бобовых, поскольку в этот период происходит узнавание партнеров и обмен сигналами. Известно, что у гороха не весь корень одинаково восприимчив к инфицированию ризобиями: наиболее чувствительным для проникновения микросимбионтов является участок, на котором расположены корневые волоски различной степени зрелости [2]. Ранее нами было показано, что эффективный штамм Rhizobium leguminosarum bv. viceae наиболее интенсивно сорбировался в зонах, содержащих сформированные и зрелые корневые волоски [3]. Интенсивность и специфичность сорбции бактерий тесно связана с активностью сигнальных систем растений, которые воспринимают микробные сигналы и в дальнейшем способствуют перестройке метаболизма растений. Одним из наиболее хорошо изученных вторичных мессенджеров растений, контролирующих эффективность симбиоза, является пероксид водорода [4, 5]. Большое количество работ посвящено изменению концентрации этой сигнальной молекулы на продвинутых стадиях бобово-ризобиального симбиоза спустя 24 ч и более [4, 6, 7]. Показано, что при инфицировании эффективным штаммом R. leguminosarum корня проростка гороха концентрация Н2О2 снижалась в зоне молодых, но сформированных корневых волосков, тем самым облегчая проникновение ризобий именно в эту зону корня [2]. О роли другого вторичного мессенджера, цАМФ, в регуляции бобово-ризобиального симбиоза известно намного меньше. Имеются лишь отдельные сведения о том, что его уровень может меняться в зрелых клубеньках в зависимости от вида растений [7]. По нашим данным, в условиях эффективного симбиоза концентрация цАМФ в зонах корня гороха, содержащих корневые волоски, возрастала в течение 2 ч инфицирования [3]. Таким образом, показано участие вторичных мессенджеров растений в регуляции продвинутых стадий эффективного симбиоза. Однако остается открытым вопрос о том, какова роль вышеупомянутых сигнальных молекул в клетках бобовых на ранних этапах взаимодействия с неэффективными по азотфиксации штаммами R. leguminosarum.
Поскольку все вторичные мессенджеры растений взаимосвязаны и образуют единую сигнальную сеть [8, 9], целью данной работы было провести сравнительную оценку изменения динамики концентраций двух сигнальных молекул, цАМФ и Н2О2, в зонах роста корня проростков гороха в связи с интенсивностью сорбции штаммов Rhizobium leguminosarum, различающихся по эффективности симбиоза.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили 3-суточные проростки гороха (Pisum sativum, сорт Рондо) и планктонные культуры Rhizobium leguminosarum bv. viceae (эффективный штамм RCAM 1022; неэффективные, высококонкурентные штаммы RCAM 1064 и RCAM 1065), полученные из Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения Федерального государственного бюджетного учреждения Всероссийского научно-исследовательского института сельского хозяйства (ФГБНУ ВНИИСХМ). Бактериальные культуры выращивали в колбах на жидкой питательной среде, содержащей 10 г/л диализата дрожжевого экстракта и 15 г/л глюкозы, рН 7.0. Плотность планктонной культуры бактерий определяли на планшетном спектрофотометре Immunochem-2100 (“High Technology Inc.”, США) при длине волны 655 нм.
Семена гороха последовательно стерилизовали и промывали 5 мин в 94% этаноле, 5 мин в 5% растворе перманганата калия и 5 мин в 3% пероксиде водорода. На конечном этапе отмывали стерильной водой и замачивали при 60°С на 4 ч. Затем семена проращивали в стерильных чашках Петри на увлажненной фильтровальной бумаге в течение 3 суток в темноте при 23–25°С. Далее проростки, имеющие длину корня не менее 35–40 мм, промывали стерильным 0.01% раствором нонидета (неионный детергент) для удаления экзогенной микрофлоры, отмывали трижды стерильной дистиллированной водой и инокулировали одним из штаммов бактерий, находящихся на стационарной фазе роста. Титр планктонной культуры бактерий составлял 0.1 × 108. Инокуляцию проводили в течение 6 ч, после чего корни проростков отделяли от горошины, промывали в стерильном 0.01% растворе нонидета для удаления слабосвязанных бактерий и промывали трижды в стерильной воде.
В исследованиях использовали пять участков первичного корня проростка гороха, отличающихся по чувствительности к ризобиальной инфекции: I – меристема (2 мм); II – зона без корневых волосков (2–7 мм); III – зона, содержащая зачатки корневых волосков (7–12 мм); IV – зона молодых корневых волосков (12–17 мм); V – зона сформированных корневых волосков (17–22 мм от кончика корня). И отдельно эпикотиль – VI зона [3].
Определение интенсивности сорбции бактерий. Корни проростков нарезали на отрезки в соответствии с указанными зонами и каждый образец растирали в стерильной воде, после чего делали рассеянный посев на чашки Петри с агаризованной питательной средой, аналогичной по составу жидкой среде для культивирования бактерий. Через 3 суток подсчитывали колониеобразующие единицы (КОЕ), отражающие количество бактерий, сорбирующихся в каждой зоне корня. В экспериментах использовали по 10 проростков.
Определение концентрации цАМФ. Для определения концентрации цАМФ корни проростков после коинкубации с бактериями и отмывки фиксировали в жидком азоте, разрезали по зонам, которые затем растирали в среде выделения следующего состава: 0.02 М фосфатный буфер, рН 7.2; 10 мМ теофиллин (ингибитор 3',5′-цАМФ фосфодиэстеразы); 1 мМ дитиотрейтол; 50 мкг/мл фенилметилсульфонилфторид (ФМСФ); 50 мкг/мл гидроксимеркурийбензоат (ГМБ); 1 мкг/мл лейпептин. Для отделения обломков клеточных стенок гомогенат центрифугировали при 16 000 g 20 мин (“Allegra 64 R”, США). Полученный супернатант центрифугировали при 105 000 g 90 мин (“Sorvall Discovery 90 SE”, США). Супернатант нагревали до 100°С в течение 3 мин для инактивации ферментов.
Концентрацию цАМФ определяли иммуноферментным анализом (ELISA) [10]. Содержание цАМФ в клетках корня проростков гороха рассчитывали в нмоль на мг белка. Белок в пробе определяли по методу Брэдфорд [10].
Определение концентрации Н2О2. Концентрацию пероксида водорода в зонах корня гороха определяли в тех же образцах FOX-методом, основанным на изменении окраски ксиленолового оранжевого [11]. Концентрацию пероксида водорода выражали в мкмоль на мг белка.
Все эксперименты проводили в 3-кратной биологической повторности. Определение уровня цАМФ и Н2О2 – в 8-кратной аналитической повторности. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. Использовали критерий Стьюдента (t) и значимость различий между вариантами опыта (Р). На графиках представлены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Как указывалось ранее, не весь корень проростка гороха одинаково восприимчив к инфицированию клубеньковыми бактериями Rlv [2, 3]. Внедрение ризобий также ограничено по времени, что связано, в основном, со старением корневых волосков, через которые проникновение не происходит [11, 12].
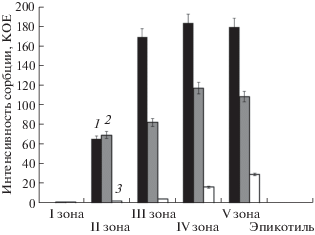
Интенсивность сорбции различных штаммов Rhizobium leguminosarum bv. viceae в зонах роста корня проростка гороха
Проведенные эксперименты выявили существенные отличия по интенсивности сорбции различных по эффективности штаммов Rlv. Все три штамма в наибольшей степени сорбировались в III–V зонах корня, однако наиболее интенсивно это происходило у штамма Rlv 1022 (эффективный). Несмотря на то, что два других штамма являлись неэффективными, по сорбции они отличались почти на порядок: в наименьшей степени сорбировался штамм Rlv 1065 (рис. 1). В эпикотиле, как в органе, не контактирующем с бактериями, сорбции не наблюдалось.
Изменение концентрации цАМФ в различных зонах корня под влиянием штаммов Rhizobium leguminosarum bv. viceаe
Под влиянием эффективного штамма Rlv 1022 повышенный уровень цАМФ (120–130%) детектировался в I–III зонах и понижался практически до уровня контроля в IV, V зонах и эпикотиле. Под влиянием неэффективного штамма Rlv 1064 тенденция была близка к таковой у штамма Rlv 1022, однако под воздействием штамма Rlv 1065, также неэффективного, динамика изменения концентрации этой сигнальной молекулы была противоположной: в I–IV зонах концентрация цАМФ была близка к контролю, и возрастала в V зоне и, особенно, в эпикотиле (рис. 2).
Рис. 2.
Изменение концентрации цАМФ в зонах корня проростка гороха при инфицировании различными штаммами Rhyzobium leguminosarum bv. vicea. 1 – Rlv штамм 1022; 2 – Rlv штамм 1064; 3 – Rlv штамм 1065. Представлены средние значения ± стандартные ошибки (n = 3). *P > 0.05 (различия статистически не достоверны). В остальных случаях P ≤ 0.01; сравнение с контролем.

Изменение концентрации Н2О2 в различных зонах корня проростков гороха при инфицировании различными штаммами Rhizobium leguminosarum bv. viceаe
Тенденция изменения концентрации Н2О2 по зонам корня под влиянием всех трех штаммов была практически одинаковой, хотя значительно различалась по интенсивности: у всех штаммов наиболее высокая концентрация пероксида водорода детектировалась в меристеме и постепенно снижалась к V зоне.
Интересно, что под влиянием неэффективных штаммов концентрация Н2О2 в I–II зонах была на уровне (штамм Rlv 1064) и ниже (штамм Rlv 1065) контроля, существенно понижаясь под воздействием обоих штаммов в III зоне и незначительно, оставаясь при этом ниже контроля, повышалась в IV–V зонах. Иная картина наблюдалась при инфицировании эффективным штаммом Rlv 1022, где содержание Н2О2 существенно превышало контрольные значения в I–II зонах, но планомерно снижалось в III–V зонах. В эпикотиле проростков гороха его концентрация в большей степени возрастала под влиянием неэффективных штаммов (рис. 3).
ОБСУЖДЕНИЕ
Ризобии, как подавляющее большинство бактерий, склонны к образованию биопленок как на растениях-хозяевах, так и на растениях, не принадлежащих к бобовым [13]. По литературным данным, образование микроколоний бактерий на корнях растений занимает от нескольких минут до 2–6 часов, а в их прикреплении к корням бобовых существенную роль играют внеклеточные гликополимеры: экзополисахариды, капсулярные полисахариды, липохитоолигосахариды и другие экзометаболиты [14, 15].
Известно, что неодинаковые по эффективности штаммы ризобий различаются по составу экзополисахаридов, липополисахаридов и глюканов [14]. Так, штаммы, дефектные по наличию экзополисахаридов и липополисахаридов, не только хуже образуют биопленки на корнях бобовых, но и вызывают интенсивные защитные реакции у растений на ранних этапах взаимодействия [13]. При этом, как правило, дефицитные по экзополисахаридам штаммы Rlv образуют неэффективные клубеньки белого или зеленого цвета [16]. Штаммы RCAM 1064 и RCAM 1065, используемые нами в работе, не эффективны в симбиозе (паспорт штаммов из Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения). Учитывая это и опираясь на литературные данные [15, 17], можно предположить, что причиной пониженной сорбции неэффективных штаммов является недостаточное количество экзо- и липополисахаридов в их оболочке.
Экзо- и липополисахариды, в числе других экзометаболитов, выполняют множественные функции, включая сорбцию бактерий и активацию неспецифического иммунитета [18]. Nod-факторы бобовых также представляют собой липохитоолигосахариды и, помимо вклада в установление специфических взаимоотношений с бобовыми, на ранних этапах взаимодействия они вызывают защитные реакции у растений и активируют их внутриклеточный сигналинг. У Lotus japonicus эти метаболиты способны вызывать LjNFR1-зависимую (от Nod Factor Receptors – рецепторы к Nod-факторам, NFR) экспрессию защитных генов [19].
Как показывают современные исследования, в реализации распознавания молекулярного образа микросимбионта большое значение принадлежит LysM-рецепторным киназам растений, направленным на восприятие сигналов от экзометаболитов ризобий, в частности, экзополисахаридов и Nod-факторов [20]. Лиганд-рецепторные взаимодействия позволяют сигнальным системам растений адекватно и вовремя реагировать на биотические стрессоры. Так, аденилатциклазная сигнальная система через изменение активности трансмембранной аденилатциклазы, являющейся основным источником цАМФ, осуществляет тонкую регуляцию метаболических реакций растений при воздействии биотических стрессовых факторов [3, 20]. Ранее было показано также на сорте гороха Рондо, что под воздействием эффективного штамма Rlv и специфического патогена гороха Pseudomonas siringae pv. pisi менялась активность трансмембранной аденилатциклазы, причем существенные отличия наблюдались по зонам корня [3]. Поэтому представляется, что изменение концентрации цАМФ в различных зонах корня в данном случае является результатом изменения, в частности, активности аденилатциклазы под влиянием экзометаболитов ризобий. По литературным данным повышение концентрации внутриклеточного цАМФ при биотических стрессах носит защитный характер [9, 21] и позволяет растениям активировать соответствующие молекулярные механизмы. В соответствии с такой концепцией, повышение уровня цАМФ под воздействием штаммов Rlv 1022 (эффективный) и Rlv 1064 (неэффективный) в I и II зонах выглядит вполне закономерным и является, вероятно, одним из механизмов авторегуляции, когда растение активирует защитные механизмы для предотвращения нежелательного проникновения ризобий в определенные участки корня. С III зоны начинается тенденция к снижению концентрации этой сигнальной молекулы, которая наиболее выраженно понижается в IV и V зонах, несмотря на практически неизменные уровни сорбции обоих штаммов. Возможно, это также направлено на регуляцию проникновения бактерий: снижение концентрации цАМФ не приводит к включению защитных реакций и позволяет бактериям проникать в клетки корня. При этом в варианте с неэффективным штаммом Rlv 1065 тенденция изменения концентрации цАМФ выглядит иначе: с I по IV зоны его содержание детектируется практически на уровне контроля, однако существенно возрастает в V зоне, что совпадает с его максимальной сорбцией в этой зоне. Возможно, что данный штамм Rlv отличается очень низким содержанием экзополисахаридов, что позволяет ему неспецифически сорбироваться только в зоне с наиболее длинными корневыми волосками, а повышение инфекционной нагрузки вызывает активацию АСС в этой зоне. Такой феномен очень напоминает эффект от воздействия неспецифического для гороха патогена, возбудителя кольцевой гнили картофеля, на корни проростков того же сорта гороха Рондо, где наиболее высокая концентрация цАМФ наблюдалась также в V зоне [3]. Поскольку специфичность взаимодействия бобовых с ризобиями в основном обеспечивается экзометаболитами, можно предположить, что штамм Rlv 1065 вызывает у растения защитные реакции в соответствии со степенью инфекционной нагрузки. Представляется интересным тот факт, что наиболее высокая концентрация цАМФ наблюдалась в эпикотиле проростка. В литературе давно обсуждается вопрос системной устойчивости при бобово-ризобиальном симбиозе [12]. Вероятно, что более высокая концентрация цАМФ в эпикотиле, чем в корне, опосредованно защищает эпикотиль от заражения, что в противном случае могло бы привести только к ослаблению растительного организма.
Одной из наиболее хорошо изученных неспецифических защитных реакций растений при воздействии биотических стрессоров является изменение содержания пероксида водорода в клетках [22, 23]. При инфицировании бобовых симбиотическими бактериями подобный механизм может включаться как на начальных этапах инфицирования, когда в клетках Medicago truncatula индуцируется активация более 300 генов [24], так и на более поздних стадиях симбиоза [12]. Н2О2 обладает не только противомикробной активностью, но может активно влиять на деятельность сигнальных каскадов, активируя работу МАП-киназ, фосфатаз и протеинкиназ [22]. Важное значение при этом, как и для всякой сигнальной молекулы, имеет как концентрация пероксида водорода, так и его временны́е колебания: показано, что последние необходимы для процессов, ведущих к скручиванию корневых волосков и последующей инвазии клубеньковых бактерий [12], а интенсивная деградация Н2О2 при инфицировании мутанта люцерны Sinorhizobium meliloti вызывает пониженное количество клубеньков [18].
У эффективного штамма наблюдалась устойчивая тенденция к снижению концентрации пероксида водорода ниже контроля по зонам: от I до V. Вероятно, это направлено на регуляцию проникновения ризобий в соответствующие зоны корня. В данном случае пероксид водорода, наряду с сигнальной ролью, выполняет функции антибактериального агента, “правильно” перераспределяя инфекционную нагрузку по зонам корня. Интересно, что под воздействием неэффективных штаммов тенденция изменения концентрации пероксида водорода по зонам очень похожа между штаммами. При этом, несмотря на более высокую интенсивность сорбции штамма Rlv 1064, чем штамма Rlv 1065, концентрация Н2О2 существенно снижалась ниже контроля только в III и V зонах, тогда как под воздействием Rlv 1065 во всех зонах была ниже контроля, что сопровождалось весьма незначительной сорбцией (рис. 1, 3). При такой динамике этого вторичного мессенджера отсутствует закономерность, присущая эффективным микросимбионтам, скорее ее можно рассматривать как реакцию на слабовирулентные патогены. В поддержку такого предположения можно рассматривать и концентрацию пероксида водорода в эпикотиле: наиболее высокие его концентрации детектировались под воздействием обоих неэффективных штаммов.
Известно, что все сигнальные молекулы в клетках растений функционируют взаимосвязано, что позволяет их объединить в сигнальную сеть [7, 25, 26]. Большое разнообразие сигнальных молекул и способов трансдукции сигналов увеличивает надежность механизмов устойчивости растений. В настоящее время большое количество работ посвящено роли отдельных вторичных мессенджеров в становлении бобово-ризобиального симбиоза. Однако, вероятно, следует говорить о том, что на биотический стрессор реагируют все сигнальные системы одновременно и, скорее всего, выявляемые результаты их активации являются итогом взаимодействия компонентов различных систем. В отдельных работах указывается, что под воздействием стрессоров у растений первичным триггером сигналов является цАМФ, поскольку показано, что под воздействием бактериальных элиситоров в растениях повышается концентрация цАМФ, сопровождающаяся изменениями в концентрациях внутриклеточного кальция и пероксида водорода [7]. Аналогичный эффект был получен и при активации аденилатциклазы как источника цАМФ [8]. Однако нельзя категорично утверждать, что одна сигнальная молекула может запускать все остальные сигнальные события в клетках растений. Это следует хотя бы из того, что одним из индукторов “кальциевых волн” на ранних стадиях симбиоза выступают Nod-факторы, активирующие 3-гидрокси-3-метилглутарил-CoA-редуктазу (HMGR), которая через посредников передает сигналы от цитоплазмы к ядру для инициирования Ca2+ колебаний [27]. Увеличение концентрации цАМФ в результате активации трансмембранной аденилатциклазы под воздействием бактериальных экзометаболитов активирует цАМФ-регулируемые кальциевые ионные каналы. Циклический нуклеотид связывается со специфическими сайтами таких каналов [28], что также приводит к повышению концентрации внутриклеточного Ca2+ и вызывает кратковременную “кальциевую волну” [29]. В свою очередь, кальций действует как активатор НАДФ ∙ H-оксидазы, что приводит к повышению концентрации пероксида водорода, который индуцирует активацию соответствующих протеинкиназ, фосфорилирующих НАДФ ∙ H-оксидазу [27], что также приводит к повышению внутриклеточного содержания пероксида водорода. Поэтому правильнее говорить о сигнальных молекулах первого порядка, непосредственно зависимых от рецепторов, воспринимающих MAMPs, и запускающих разветвленные сети внутриклеточной трансдукции сигналов [30].
Таким образом, даже при взаимодействии бактериальных мутуалистов с растениями-хозяевами активация сигналинга последних осуществляется в соответствии со степенью эффективности штаммов Rlv, направляя развитие инфицирования по пути мутуализма или патогенеза.
Работа выполнена на оборудовании Центра коллективного пользования “Биоаналитика” с использованием коллекций Центра коллективного пользования “Биоресурсный центр” Сибирского института физиологии и биохимии растений Сибирского отделения Российской академии наук (г. Иркутск).
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Gourion B., Berrabah F., Ratet P., Stacey G. Rhizobium-legume symbioses: the crucial role of plant immunity // Trends Plant Science. 2015. V. 20. P. 186–194.
Макарова Л.Е., Нурминский В.Н. Влияние температуры на локализацию “свободных” фенольных соединений в тканях корней и деформацию корневых волосков у инокулированных Rhizobium проростков гороха // Цитология. 2005. Т. 47. С. 519–525.
Ломоватская Л.А., Кузакова О.В., Романенко А.С., Гончарова А.М. Активность аденилатциклаз и изменение концентрации цАМФ в клетках корня проростков гороха при инфицировании мутуалистами и фитопатогенами // Физиология растений. 2018. Т. 65. С. 310–320.
Васильева Г.Г., Глянько А.К., Миронова Н.В. Содержание пероксида водорода и активность каталазы при инокуляции клубеньковыми бактериями проростков гороха с разной способностью к нодуляции // Прикладная биохимия и микробиология. 2005. Т. 41. С. 621–625.
Иванова К.А., Цыганов В.Е. Защитные реакции в бобово-ризобиальном симбиозе: индукция и супрессия // Сельскохозяйственная биология. 2014. С. 3–12.
Глянько А.К., Макарова Л.Е., Васильева Г.Г., Миронова Н.В. Возможное участие перекиси водорода и салициловой кислоты в бобово-ризобиальном симбиозе // Известия РАН. Серия биол. 2005. С. 300–305.
Terakado I., Fujihara S., Yoneyama T. Changes in cyclic nucleotides during nodule formation // Oil. Sci. Plant Nutl. 2003. V. 49. P. 459–462.
Bindschedler L.V, Minibayeva F., Gardner S.L., Gerrish C., Davies D.R., Bolwell G.P. Early signaling events in the apoplastic oxidative burst in suspension cultured French bean cells involve cAMP and Ca2+ // New Phytologist. 2001. V. 151. P. 185–194.
Zhao J., Guo Y., Fujita K., Sakai K. Involvement of cAMP signaling in elicitor-induced phytoalexin accumulation in Cupressus lusitanica cell cultures // New Phytol. 2004. V. 161. P. 723–731.
Lomovatskaya L.A., Romanenko A.S., Filinova N.V., Dudareva L.V. Determination of cAMP in plant cells by a modified enzyme immunoassay method // Plant Cell Rep. 2011. V. 30. P. 125–132.
Galletti R., Denoux C., Gambetta S., Dewdney J., Ausubel F.M., De Lorenzo G., Ferrari S. The AtrbohD-mediated oxidative burst elicited by oligogalacturonides in Arabidopsis is dispensable for the activation of defense responses effective against Botrytis cinerea // Plant. Physiol. 2008. V. 148. P. 1695–1706.
Глянько А.К., Ищенко А.А. Влияние ризобиальной (Rhizobium leguminosarum) инокуляции и ионов кальция на активность НАДФН-оксидазы в корнях этиолированных проростков гороха (Pisum sativum L.) // Прикладная биохимия и микробиология. 2013. Т. 49. С. 236–241.
Fujishige N.A., Kapadia N.N., De Hoff P.L., Hirsch A.M. Investigations of Rhizobium biofilm formation // FEMS Microbiology Ecology. 2006. V. 56. P. 195–206.
Janczarek M., Rachwał K., Marzec A., Grza J., Palusinska-Szysz M. Signal molecules and cell-surface components involved in early stages of the legume–rhizobium interactions // Applied Soil Ecology. 2015. V. 85. P. 94–113.
Kumar M.S., SwarnaLakshmi K., Annapurna K. Exopolysaccharide from Rhizobia: Production and Role in Symbiosis // Rhizobium Biology and Biotechnology / Ed. Hansen A.P. Sankt Augustin, NRW, Germany: Springer, 2017. V. 50. P. 257–293.
Сидорова К.К., Шумный В.К., Власова Е.Ю., Гляненко М.Н., Мищенко Т.М., Майстренко Г.Г. Симбиогенетика и селекция макросимбионта на повышение азотфиксации на примере гороха (Pisum sativum L.) // Вестник ВОГиС. 2010. Т. 14. С. 357–374.
Антипчук А.Ф., Косенко Л.В. Влияние липополисахаридов и глюканов двух штаммов Rhizobium leguminosarum bv. viciae на формирование и эффективность их симбиоза с растениями гороха // Микробиология. 2004. С. 62–67.
Luo L., Lu D. Immunosuppression during Rhizobium-legume symbiosis // Plant Signaling & Behavior. 2014. V. 9. P. 281–292.
Libault M., Farmer A., Brechenmacher L., Drnevich J., Landley R.L., Bilgin D.D., Radwan O., Neece D.J., Clough S.J., May G.D., Stacey G. Complete transcriptome of the soybean root hair cell, a single-cell model, and its alteration in response to Bradyrhizobium japonicum infection // Plant Physiol. 2010. V. 152. P. 541–552.
Kelly S., Radutoiu S., Stougaard J. Legume LysM receptors mediate symbiotic and pathogenic signaling // Current Opinion in Plant Biology. 2017. V. 39. P. 152–158.
Gehring C. Adenyl cyclases and cAMP in plant signaling – past and present // Cell Commun. Signal. 2010. V. 8 (15). P. 1–5.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов В.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. С. 163–178.
Suzuki N., Katano K. Coordination between ROS regulatory systems and other pathways under heat stress and pathogen attack // Frontiers in Plant Science. 2018. V. 9. P. 490.
Lohar D.P., Sharopova N., Endre G., Penuela S., Samac D., Town C., Silverstein K.A.T., Vanden Bosch K.A. Transcript analysis of early nodulation events in Medicago truncatula // Plant Physiol. 2006. V. 140. P. 221–234.
Granqvist E., Sun J., Camp R.O., Pujic P., Hill L., Normand P., Morris R.J., Downie A.J., Geurts R., Oldroyd G.E.D. Bacterial-induced calcium oscillations are common to nitrogen-fixing associations of nodulating legumes and non-legumes // New Phytol. 2015. V. 207. P. 551–558.
Ma W., Qi Z., Smigel A., Walker R.K., Verma R., Berkowitz G.A. Ca2+, cAMP, and transduction of non-self-perception during plant immune responses // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 20995–21000.
Venkateshwarana M., Jayaramana D., Chabaudb M., Genrec A., Balloond A.J., Maedaa J., Forsheya K., Osa den D., Kwieciend N.W., Coond J.J., Barkerb D.G., Anéa J.-M. A role for the mevalonate pathway in early plant symbiotic signaling // PNAS. 2015. V. 112 (31). P. 9781–9786.
Saand M.A., Xu Y.-P., Munyampundu J.-P., Li W., Zhang X.-R., Cai X.-Z. Phylogeny and evolution of plant cyclic nucleotide-gated ion channel (CNGC) gene family and functional analyses of tomato CNGCs // DNA Research. 2015. V. 22 (6). P. 471–483.
Clúa J., Roda C., Zanetti M.E., Blanco F.A. Compatibility between legumes and rhizobia for the establishment of a successful nitrogen-fixing symbiosis // Genes. 2018. V. 9. T. 125. P. 1–21.
Popp C., Ott T. Regulation of signal transduction and bacterial infection during root nodule symbiosis // Current Opinion in Plant Biology. 2011. V. 14. P. 458–467.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений