Физиология растений, 2020, T. 67, № 1, стр. 50-66
Постаноксия у растений: причины, последствия и возможные механизмы
А. Е. Шиков a, Т. В. Чиркова a, В. В. Емельянов a, *
a Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: bootika@mail.ru
Поступила в редакцию 30.12.2018
После доработки 07.04.2019
Принята к публикации 08.04.2019
Аннотация
Одним из неблагоприятных факторов, действующих на растения, является кислородная недостаточность, которая развивается вследствие избыточного увлажнения и затопления. В естественной среде обитания вслед за периодом кислородной недостаточности обычно следует восстановление аэробных условий, в результате чего растения оказываются в условиях постаноксического окисления. Накопившиеся во время кислородного голодания эндогенные восстановленные метаболиты и почвенные токсины начинают окисляться кислородом воздуха, что приводит к генерации активных форм кислорода (АФК) и развитию повреждений, которые могут вызывать гибель растения даже в том случае, если оно пережило условия аноксии. Исследования последних лет, рассмотренные в обзоре, свидетельствуют, что основные механизмы адаптации к постаноксическому периоду заключаются, главным образом, в биосинтезе антиоксидантов и эффективном функционировании антиоксидантных систем, активации альтернативной оксидазы и ферментов детоксикации анаэробных метаболитов. В обеспечении регуляции приспособления к постаноксическим условиям большую роль играют этилен-зависимые транскрипционные факторы ERF-VII, которые участвуют и в регуляции адаптации непосредственно к кислородной недостаточности, а также такие фитогормоны, как жасмоновая и абсцизовая кислоты. Постаноксию не следует рассматривать в качестве самостоятельного стрессорного фактора, поскольку она представляет собой комплексное воздействие (последствия аноксии, окислительный стресс и иссушение вносят совместный вклад в развитие повреждений), а механизмы адаптации и их регуляция имеет много общих элементов с адаптацией к дефициту кислорода.
ВВЕДЕНИЕ
Растения являются облигатными аэробными организмами. Кислород необходим им для нормального функционирования − прежде всего, для осуществления окислительного фосфорилирования и эффективного энергетического метаболизма. В общей сложности кислород принимает участие более чем в 200 реакциях в растительной клетке [1]. Следует отметить, что ферменты оксидазы, обеспечивающие аэробное дыхание, обладают чрезвычайно высокой аффинностью к кислороду (KM = 0.08–1 мМ) [2]. Прикрепленный образ жизни растений не позволяет им, в отличие от животных, покинуть неблагоприятную среду обитания, вследствие чего им приходится переживать периоды кислородной недостаточности. У многоклеточных животных доступ кислорода к тканям обеспечивается кровеносной системой. Отсутствие таковой у растений приводит к тому, что даже в нормальных условиях растительные организмы имеют ткани, в которых содержание кислорода сильно снижено. Это касается, в первую очередь, нефотосинтезирующих мясистых тканей, которые остаются гипоксическими преимущественно из-за сопротивления диффузии кислорода [3]. Концентрация кислорода внутри разных частей растений неодинакова − от почти полной аноксии в семенах гороха, бобов, ячменя [2] до 50 мкМ во флоэме у клещевины [3].
Наиболее сильное воздействие кислородной недостаточности проявляется в результате затопления растений [4]. В водной среде диффузия газообразных молекул, таких как кислород, углекислый газ и этилен, снижается более чем в 100 раз по сравнению с воздушной средой, что создает гипоксические (недостаток кислорода) или даже аноксические (полное отсутствие кислорода) условия [5–7].
Последствиями недостатка кислорода является снижение образования АТФ в силу того, что недостает терминального акцептора электронов – молекулярного кислорода [8]. При обычном содержании кислорода окислительное фосфорилирование позволяет образовать до 38 молекул АТФ, тогда как анаэробное брожение и гликолиз способны снабдить устойчивые растения до 4–8 молекул АТФ при участии пирофосфат-зависимой фосфофруктокиназы, а также УДФ-зависимой сахарозосинтазы вместо инвертазы, что реализуется в цитозоле устойчивых растений [7, 9]. Тем не менее, пирофосфат-зависимых ферментов не обнаружено в пластидах, поэтому энергетический выход бескислородного окисления углеводов в них – только 2 молекулы АТФ. Поэтому единственным надежным поставщиком АТФ становится гликолиз, переходящий в молочнокислое и спиртовое брожения. Помимо энергетической неэффективности, брожения приводят к накоплению в клетке этанола и лактата, токсичных в высоких концентрациях. Кроме того, лактат вызывает закисление цитоплазмы [10]. Уже во время дефицита кислорода в связи с нарушением потока электронов в ЭТЦ митохондрий начинают развиваться окислительные повреждения, которые существенно усиливаются при возвращении в условия нормальной аэрации [11].
Способность растений адаптироваться к низким концентрациям кислорода сильно варьирует. Это связано с активацией быстрых молекулярных и метаболических механизмов [12]. К примеру, резуховидка Таля (Arabidopsis thaliana), картофель (Solanum tuberosum) и кукуруза (Zea mays) могут переживать лишь короткие периоды аноксии, а различные гидрофиты, такие как рис (Oryza sativa), ежовник (Echinochloa spp.) и щавель болотный (Rumex palustris), способны находиться под водой в течение длительного времени [9, 13, 14]. Большинство злаковых культур, в том числе хозяйственно важные пшеница и ячмень, не обладают устойчивостью к недостатку кислорода [9].
В последнее время во многих странах зафиксированы серьезные климатические изменения, касающиеся увеличения вероятности ежегодных наводнений, что может существенно повлиять на сельское хозяйство. Например, в США около 16% почв непригодны для земледелия из-за повышенного содержания воды, а потери урожая от затопления уступают лишь потерям от засухи [15]. За последние 25 лет годовые убытки от последствий наводнений составили миллионы долларов, причем это зафиксировано в разных частях света. Помимо этого, из-за таяния ледников и повышения уровня моря может серьезно пострадать выращивание культурных растений в прибрежных областях и эстуариях рек [16].
Таким образом, последствия недостатка кислорода представляют большую проблему для сельского хозяйства, а выявление механизмов адаптации к гипоксии и аноксии очень актуально. В природных условиях после периода затопления уровень воды всегда снижается и в среду возвращается кислород, поэтому исследования, сфокусированные не только на изучении действия гипо- и аноксии, но и на постаноксическом периоде также представляют большой интерес не только с научной точки зрения, но и для решения прикладных задач, связанных с повышением устойчивости растений. Однако нужно заметить, что большая часть исследований, посвященных окислительным повреждениям растений и защите от них, сконцентрирована на моделировании бескислородной среды в лабораторных условиях, тогда как постгипоксический или постаноксический этапы изучены очень скудно, и в работах, посвященных этой проблеме, зачастую отсутствует четкая терминология. Чаще всего говорят о постаноксических повреждениях [17–19], при этом многие авторы не выделяют постаноксию в особый тип воздействия, считая ее прямым продолжением деструктивных процессов, которые были начаты во время пребывания растения в условиях кислородной недостаточности [1, 20]. Тем не менее, в литературе встречается также и термин “постаноксический стресс” [13, 21]. В настоящем обзоре систематизированы накопленные данные по исследованию постаноксии, что позволило четко выделить ключевые особенности данного воздействия.
ВЛИЯНИЕ КИСЛОРОДНОЙ НЕДОСТАТОЧНОСТИ НА РАСТЕНИЯ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
Детальное рассмотрение результатов воздействия кислородной недостаточности на растения не является целью данного обзора (подробно описано в [4–7, 9, 13]), однако совсем обойти стороной этот вопрос нельзя. Молекулярные события, происходящие во время аноксии, могут оказаться значимыми и в постаноксический период, причем как для возникающих повреждений, так и развития преадаптивного состояния к последующему появлению кислорода в среде.
Как указано выше, растения могут оказаться в среде с полным отсутствием кислорода (аноксия) или с его пониженной концентрацией (гипоксия). Существует несколько сценариев затопления, провоцирующих кислородную недостаточность: подтопление ризосферы (waterlogging), приводящее к локальной корневой гипоксии или аноксии (развивается вследствие деятельности почвенных бактерий, корневых систем растений и прочей почвенной биоты) [8], а также полное затопление растения (submergence, flooding), чаще являющееся причиной тотальной аноксии. Последствиями затопления являются сокращение диффузии кислорода [22], углекислого газа [23] и этилена [24], а также накопление токсичных ионов в почве [5], что влечет за собой ингибирование аэробного дыхания [7, 9, 13, 25] и нарушение фотосинтеза [26].
В целом, длительное кислородное голодание вызывает энергетический кризис, ацидоз цитоплазмы, провоцирует накопление токсичных продуктов обмена, в частности, ацетальдегида [5, 9]. Помимо этого анаэробиоз снижает общий синтез белка [9], индуцирует генерацию активных форм кислорода и азота [19, 27, 28], которые запускают перекисное окисление липидов (ПОЛ) [29]. В условиях анаэробиоза стимулируется гликолиз, а также спиртовое и молочнокислое брожения [5, 9]. При этом быстрая активация лактатдегидрогеназы, наблюдаемая у многих растений, может быть причиной первоначального закисления цитоплазмы, а затем со временем начинает преобладать спиртовое брожение [6, 30].
Устойчивость к кислородной недостаточности представляет собой континуум физиологических и метаболических приспособлений, крайними вариантами которого являются две стратегии: активное избегание кислородной недостаточности (low oxygen escape syndrome, LOES) и пассивная стратегия покоя (low oxygen quiescence syndrome, LOQS) [31]. Первая стратегия характеризуется избеганием гипоксии с соответствующими морфологическими изменениями – быстрым ростом побегов, гипонастическим изгибом листьев, образованием аэренхимы, закладкой придаточных корней, преобразованием анатомии листьев для улучшения диффузии газов и т.п. [4–6, 23, 32–34]. Формирование аэренхимы происходит под контролем гормональной системы, в первую очередь, этилена. В ее закладку также вовлечены активные формы кислорода и кальциевые волны [4, 6, 35–37]. Роль этилена в этом процессе перекликается с другими фитогормонами: он тормозит сигналинг АБК, негативно влияя не ее содержание в побегах, и одновременно повышает содержание гибберелинов и ауксина [35]. Помимо образования аэренхимы, важной адаптацией является формирование газовой пленки на гидрофобной поверхности стеблей и листьев затопленных растений, которая необходима как для транспорта воздуха с надводной поверхности, так и для протекания подводного фотосинтеза [4, 6]. Рис, например, способен поддерживать такую газовую пленку на протяжении 4–5 дней затопления [38]. Другой адаптацией является формирование поверхностных придаточных корней [4]. У некоторых гидрофитов, например, ладонника (Cotula coronopifolia) и сланоягодника (Meionectes brownii), в этих корнях развиваются хлоропласты, что позволяет вырабатывать кислород при наличии света [39]. LOES у риса контролируется экспрессией генов SNORKEL1 (SK1) и SNORKEL2 (SK2) из семейства ERF-VII (ethylene response factor). Они стимулируют накопление ГК и повышают чувствительность к ним в междоузлиях, что запускает интеркалярный рост [40]. Киназа SnRK1A (sucrose-nonfermenting1-related protein kinase 1A) отвечает за регуляцию распада углеводов для обеспечения ускоренного роста. В результате взаимодействия с фактором транскрипции MYBS1 она приводит к запуску экспрессии гена α-амилазы, что особенно важно при прорастании семян. В условиях недостатка кислорода протеинкиназа CIPK15 (calcineurin B-like protein-interacting protein kinase15) инициирует SnRK1A-зависимый каскад анаэробного расщепления крахмала [41].
Вторая стратегия (LOQS) характеризуется снижением скорости роста и сохранением метаболической энергии. При этом АТФ, генерированная за счет метаболизма крахмала, гликолиза и брожения, расходуется, прежде всего, на синтез белков, вовлеченных в мембранный транспорт, защиту от АФК и шаперонную активность [4, 42, 43]. Это сочетается с экономией энергии за счет торможения клеточного деления и роста, синтеза ДНК, белка, сборки рибосом и синтеза компонентов клеточной стенки [44]. SUB1A (также относящийся к ERF-VII) – главный фактор регуляции LOQS у риса, подавляющий синтез этилена, что приводит к репрессии продукции гиббереловой кислоты (ГК), а также увеличивает уровень брассиностероидов, способствующих деградации биологически активной ГК и аккумуляции белка SLENDER RICE1 (SLR1), дополнительно репрессирующего сигналинг ГК [45]. SUB1A тормозит потребление углеводов путем подавления экспрессии генов сахарозосинтазы и амилазы [46].
Принципиально важно, что в обеих стратегиях метаболический и физиологический ответы запускаются этилен-зависимыми транскрипционными факторами SK1, 2 и SUB1A, относящимися к ERF-VII [47]. У A. thaliana в регуляции аноксического ответа тоже принимают участие факторы ERF-VII. Три фактора RAP2 (RELATED TO AP2) – RAP2.2 (ERF75), RAP2.3 (ERF72/EBP) и RAP2.12 (ERF74) – конститутивно синтезируются при нормоксии и стимулируются под действием этилена [43]. Еще два фактора HRE (HYPOXIA RESPONSIVE ERF) – HRE1 (ERF73) и HRE2 (ERF71) – активно индуцируются в бескислородной среде [4]. Эти ERF-VII факторы в присутствии кислорода очень быстро подвергаются протеолизу по правилу N-конца. В бескислородной среде, наоборот, они стабилизируются, RAP2.12 мигрирует в ядро, где запускает экспрессию генов гипоксического ответа, в том числе HRE1/2 [2, 47].
В гипо/аноксических условиях генерация АФК в тканях A. thaliana происходит, главным образом, в плазматический мембране через RBOH (Respiratory Burst Oxidase Homologs) и в митохондриях [48]. RBOH – это трансмембранные регулируемые связыванием кальция и фосфорилированием НАДФH-оксидазы, катализирующие формирование супероксида с окислением восстановленного НАДФH. RbohD – один из 10 RBOH генов, активирующийся при низких концентрациях кислорода [48]. Активация RBOH также возможна на уровне синтеза белка при помощи малых G-белков, таких как ROP у A. thaliana [49] и OsRac1 у риса [50]. В регуляции образования АФК в митохондриях принимает участие киназа MAPK6, которая необходима для поддержания жизнеспособности в бескислородных условиях [51].
Защита от АФК может обеспечиваться альтернативной оксидазой (АОХ). Она транспортирует 4 электрона от убихинона к кислороду, тем самым предотвращая генерацию АФК из-за перевосстановленного пула убихинонов. Активация AOX у A. thaliana или сверхэкспрессия AOX1a из A. thaliana в табаке существенно понижала продукцию АФК в митохондриях [52], тогда как ее ингибирование, напротив, влекло за собой интенсификацию свободно-радикальных реакций. В корнях ячменя активность AOX возрастала под действием аноксии [53].
В защиту от активных форм азота вносят свой вклад фитоглобины (растительные несимбиотические гемоглобины), которые нейтрализуют оксид азота (NO) [54]. Экспрессия генов фитоглобинов возрастает при гипоксии [52, 55], а уровень экспрессии связан с устойчивостью к затоплению [55]. При экспериментальной индукции фитоглобинов было получено улучшение энергетического состояния и роста клеток арабидопсиса, люцерны и кукурузы [55]. Источником оксида азота является восстановление нитрата, которое позволяет реокислять НАД(Ф)H в ходе так называемого “нитратного дыхания”, что особенно значимо в восстановительной анаэробной атмосфере [6, 7, 9, 27, 54].
ПОВРЕЖДЕНИЯ РАСТЕНИЙ ПРИ ПОСТАНОКСИИ
Возвращение растения в условия нормальной аэрации после нахождения в бескислородной среде называется реаэрацией или реоксигенацией. Очевидно, что оно зависит от типа предшествующего бескислородного воздействия: за гипоксией следует постгипоксия, за аноксией – постаноксия. В природе этот феномен имеет место при уходе воды после затопления – постзатоплении (desubmergence). Во всех вышеописанных случаях в растении развиваются постгипоксические/постаноксические повреждения, порожденные, главным образом, интенсификацией деструктивных окислительных модификаций.
Впервые на феномен постаноксического повреждения обратил внимание R. Crawford с соавт. [56–58]. Позже было отмечено сходство постаноксических повреждений у растений и животных [17]. По возвращении в условия нормальной аэрации возможна быстрая продукция АФК: после накопления супероксида во время аноксии начинается продукция перекиси водорода, что впоследствии приводит к образованию гидроксильного радикала и синглетного кислорода (рис. 1) [59].
Рис. 1.
Основные механизмы повреждений при постаноксии и способы борьбы с ними. Воздействие постаноксии сводится в первую очередь к накоплению АФК и связанным с ними повреждениям (им противостоят низкомолекулярные восстановители и антиоксидантные ферменты), вторая группа повреждений вызывается токсичными продуктами обмена, ацетальдегидом и метилглиоксалем. Метаболическими приспособлениями в борьбе с ними является активация работы алкоголь- и альдегиддегидрогеназ, аланинаминотрасфераз и лактоглутатионлиаз. Третью группу повреждений составляют последствия иссушения, а также возникающая вследствие действия вышеупомянутых факторов повышенная чувствительность к патогенам и фитофагам (для противостояния этому в растении задействованы механизмы защиты от засухи и патогенов). В регуляции этих приспособлений участвуют стрессовые транскрипционные факторы и фитогормоны. Таким образом, уникальность постаноксических повреждений состоит в комплексном действии последствий аноксии, засухи и патогенеза.
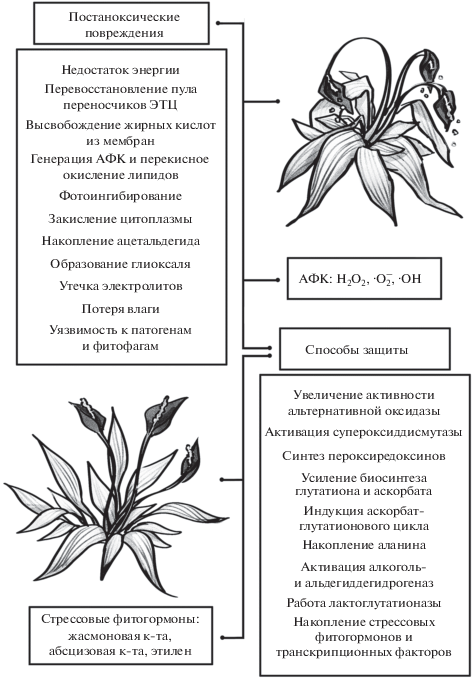
При снижении дыхательного метаболизма в митохондриях продуцируется супероксид, который при участии супероксиддисмутазы (СОД) превращается в перекись водорода [60]. Именно супероксид и перекись можно считать маркерными АФК в период постаноксии [27]. Помимо этого, супероксид способен образовываться в митохондриях из-за утечки электронов [59]. Продукция перекиси водорода, индуцированная еще в период аноксии, впервые была визуализирована методом электронной микроскопии [28]. Устойчивые к аноксии рис (O. sativa) и ирис болотный (Iris pseudacorus) демонстрировали аккумуляцию пероксида водорода только после продолжительной аноксии (7 дней для O. sativa и 45 дней для I. pseudacorus), тогда как в тканях неустойчивых видов (пшеницы (Triticum aestivum) и ириса германского (I. germanica)) пероксид водорода образовывался в клетках корневой паренхимы в значительных количествах уже при краткосрочном воздействии (3 и 8 дней, соответственно) [28].
Синтезу АФК способствует характерное для аноксических тканей истощение запасов АТФ (рис. 1), перевосстановленный пул электронов в ЭТЦ и восстановительная атмосфера в целом, так что неудивительно, что диффузия кислорода в еще недавно анаэробные ткани кислорода обеспечивает немедленное развитие постаноксических окислительных повреждений [61]. Кроме того, из-за дефицита энергии при аноксии, в период реоксигенации метаболизм ускоряется молниеносно, становясь причиной напряженной работы митохондрий и последующего повсеместного образования АФК и развития постаноксических повреждений [19].
Окислительный стресс провоцирует оксидативную деструкцию белков, нуклеиновых кислот и, в первую очередь, липидов [58, 59]. Липидные перокси-радикалы впоследствии усугубляют процесс фрагментации и деградации мембран [59]. Наиболее подверженными свободнорадикальным повреждениям молекулами в клетке являются полиненасыщенные жирные кислоты. Повреждение жирных кислот в ходе постаноксии считается основным пагубным механизмом деструктивных модификаций. Помимо этого, сокращение энергии, ацидоз цитоплазмы, утечка электролитов, потеря влаги и накопление токсичных продуктов анаэробного метаболизма в совокупности существенно снижают выживаемость растений, внося свой вклад в постаноксические повреждения и приводя к программируемой клеточной гибели или некрозу [41, 62]. Достаточно распространено мнение о том, что повреждения во время реоксигенации могут быть более серьезными, чем от гипоксии/аноксии как таковой [10].
Фиксация растительного материала в аэробных условиях после длительного анаэробиоза приводила к усилению пероксидации липидов и аккумуляции конечных продуктов ПОЛ в корнях проростков пшеницы и риса, при этом у пшеницы накапливалось на треть больше продуктов ПОЛ, чем у более устойчивого риса [63]. Интересно, что при анаэробной фиксации уровень измеряемого ПОЛ был меньше. Иными словами, процессы деструктивного окисления мембран начинались еще при аноксии, но существенно интенсифицировались лишь при реоксигенации. Добавление α-токоферола (витамина Е) вызывало уменьшение ПОЛ, при этом у пшеницы воздействие было значимым лишь на длительных сроках анаэробиоза [63]. Схожие результаты были получены и при изучении влияния аноксии на уровень ПОЛ и защитное действие токоферола в побегах проростков пшеницы и риса [29].
Постаноксия ассоциирована с накоплением диеновых и триеновых конъюгатов жирных кислот (первичные интермедиаты ПОЛ) и ТБК-реактивных (конечных) продуктов ПОЛ в корнях неустойчивых I. germanica и T. aestivum, а также овса (Avena sativa), а долговременное пребывание в аноксии (45 дней) приводило к схожему эффекту в тканях устойчивого I. pseudacorus [64]. Продолжительность аноксического воздействия, предшествующего реаэрации, служит определяющим фактором для интенсивности постаноксических повреждений. Например, для культуры клеток картофеля показан двухфазный ответ на аноксию. На сроках кислородного голодания до 12 ч не было зафиксировано высвобождения жирных кислот из мембран, тогда как после 12 ч воздействия наблюдали продукцию свободных жирных кислот, поддерживаемую ацилгидролазой. Похожая ситуация была выявлена и при реаэрации: интенсивный гидролиз липидов замечали только в ходе реэрации, которой предшествовала длительная аноксия [21].
Детальное исследование постаноксии было проделано и в клубнях картофеля. Они характеризовались высокой чувствительностью к недостатку кислорода [65]. Аноксия в течение 48–72 ч приводила к тому, что растения картофеля теряли жизнеспособность. Это коррелировало с истощением содержания АТФ и подавлением митохондриального дыхания. Помимо этого, реоксигенация провоцировала накопление продуктов ПОЛ, в частности, существенное накопление этана наблюдали в течение 2 ч постаноксии, что связывали также с аккумуляцией аминоциклопропанкарбоновой кислоты и ее конъюгата с малонатом [65]. Показано также, что 1–2 ч аноксическое воздействие вызывало более серьезные повреждения корней сои (Glycine max), чем 3–5 ч воздействие. При этом краткосрочная аноксия с последующей реоксигенацией характеризовалась более интенсивным образованием АФК и меньшей активностью СОД. По всей видимости, в некоторых случаях длительная аноксия позволяет растению лучше подготовиться к постаноксии [61].
В листьях ячменя, подвергнутого действию аноксии в темноте, возрастало содержание НАДН, а во время постаноксии происходило окисление НАДН до контрольных значений [53]. В корнях аноксия и постаноксия не влияли на уровень НАД(Н) вовсе. Содержание АТФ в листьях в темноте снижалось на 80%, достигая 47% от контроля в постаноксии. В корнях концентрация АТФ снижалась до 65% от контроля, а после 1 ч реаэрации оставалось неизменным. Постаноксия приводила к двукратному усилению респираторного окисления экзогенного НАДН и малата в митохондриях корней, не оказав влияния на митохондрии побегов. Также постаноксия индуцировала альтернативную оксидазу в корнях и практически не затрагивала побеги. Уровень ТБК-реактивных продуктов и содержание перекиси водорода возрастали в постаноксии в корнях, тогда как в побегах увеличивался только уровень перекиси. Содержание окисленного аскорбата увеличивалось в побегах, а в корнях, напротив, постаноксия провоцировала накопление восстановленного аскорбата, а уровень глутатиона в корнях и побегах в постаноксии уменьшался [53]. Таким образом, даже в пределах одного и того же растения последствия постаноксии и способы борьбы с нею отличались в разных органах (корнях и побегах), на что следует обращать особое внимание при сравнительных исследованиях.
Небольшое по времени воздействие гипоксии (2–12 ч) на корни люпина (Lupinus luteus) приводило к продукции АФК, что сопутствовало некоторой индукции антиоксидантных ферментов (СОД и пероксидазы). Только длительная гипоксия с последующей реоксигенацией существенно изменяла выживаемость клеток корня. Авторы предполагают, что основной причиной повреждений в кончиках корней была не реоксигенация, а предшествующий ей дефицит кислорода, однако следует учитывать, что растения подвергались воздействию постгипоксии, а не постаноксии [66]. Кроме того, еще одним негативным фактором, связанным с окислительной реакционноспособностью АФК при постаноксии, является резкое возвращение света в окружающую среду при оттоке воды, которое может привести к фототоксическому повреждению ФСII, снижая интенсивность фотосинтеза (рис. 1) [67]. Реоксигенация уменьшает квантовый выход ФСII, тем не менее, наличие газовой пленки на поверхности листьев может снизить этот эффект [4].
Образование ацетальдегида из этанола, конечного анаэробного метаболита, также является причиной постаноксического повреждения клеток (рис. 1) [68]. Окисление этанола может происходить классическим способом в обратной реакции, катализируемой алкогольдегидрогеназой (АДГ) [9]. Накопление ацетальдегида может быть ускорено при наличии в среде перекиси водорода, что создает субстрат для каталазы путем конвертации этанола до ацетальдегида без НАД+. Была показана корреляция постаноксической каталазной активности и чувствительности к аноксии: у менее устойчивых видов (манник (Glyceria maxima), ситник (Juncus effusus) и I. germanica) она возрастала в бескислородных условиях, тогда как у устойчивых видов – аира (Acorus calamus), камыша (Schoenoplectus lacustris) и I. pseudacorus – ее активность оставалась постоянной [57]. 5–7-кратное накопление ацетальдегида наблюдалось в клубнях неустойчивого картофеля в период реоксигенации, однако метаболического взрывного окисления этанола не происходило, т. к. образцы были собраны через 5 ч после возвращения в воздушную среду, а концентрации этанола оставались высокими [25, 68]. Была высказана гипотеза, что в клубнях картофеля очень мало АДГ, а для обеспечения толерантности к постаноксическому повреждению необходим синтез этого фермента, если только исходные его уровни не высокие [25].
Во время постаноксии, помимо АФК, продуктов ПОЛ и ацетальдегида, зачастую образуются другие токсичные метаболиты, в первую очередь, метилглиоксаль (рис. 1). Метилглиоксаль является результатом дефосфорлирования интермедиатов гликолиза, таких как глицеральдегид-3-фосфат или дигидроксиацетонфосфат, что происходит как ферментативно, так и спонтанно [69].
Интересно, что снижение водной проводимости при реоксигенации наблюдается даже при наличии доступной влаги [70]. При этом интенсивность постаноксического воздействия зависит от длительности бескислородного воздействия. Например, 7 дней аноксии провоцировали непоправимый клеточный ущерб в листьях риса, тогда как 3 дня аноксии с последующей реоксигенацией не вызывали значительного накопления АФК и продуктов ПОЛ, что приводило к быстрому восстановлению нормального функционального состояния [70]. Обезвоживание приводило к потере тургесцентности листьев. Все вышеописанные факторы существенно ослабляли защитные резервы растения, что повышало вероятность их заражения патогенами и повреждения различными фитофагами [71].
Тем не менее, далеко не всегда можно понять, является ли постаноксическое повреждение последствием окислительного стресса из-за реоксигенации или продолжением аноксических повреждений [1], что создает проблемы в интерпретации получаемых результатов. В некоторых случаях было четко показано, что повреждения возникают только в аноксических условиях. Например, аноксия провоцирует увядание кончиков корней кукурузы [72]. Также была высказана гипотеза, что постаноксическое повреждение является всего лишь биохимическим продолжением уже начатых во время аноксии деструктивных процессов [20].
Относительно возможной специфичности постаноксических повреждений можно привести реакцию африканского риса (Oryza glaberrima) на затопление. Этот рис произрастает на территориях бассейнов африканских рек, для которых характерны частые наводнения, вследствие чего он очень хорошо адаптирован к длительному затоплению и способен к активному подводному росту [73]. Сравнительное исследование O. glaberrima и O. sativa выявило, что в условиях 31–37-дневного непрерывного нахождения под водой O. glaberrima демонстрировал более интенсивное накопление биомассы, удлинение, большую площадь листьев и интенсивность ассимиляционных процессов, показывая тем самым превосходящую O. sativa резистентность к дефициту кислорода. Несмотря на это, по возвращении в аэробные условия O. glaberrima демонстрировал пониженный уровень выживаемости по сравнению с O. sativa [74]. Однако приведенный единственный обнаруженный нами пример свидетельствует лишь о том, что необходимы дальнейшие исследования данного феномена.
МЕХАНИЗМЫ ЗАЩИТЫ ОТ ПОСТАНОКСИЧЕСКИХ ПОВРЕЖДЕНИЙ
Выживаемость растений в условиях кислородной недостаточности также зависит от их способности защищаться от окислительного стресса, который возникает по возвращении в условия нормальной аэрации [6, 16]. Генерация свободных радикалов, безусловно, зависит от эффективности работы антиоксидантных систем (рис. 1), например, от работы СОД [58]. Перекись водорода впоследствии может ликвидироваться работой аскорбат-глутатионового цикла [59]. Таким образом, защита от окислительных повреждений определяется антиоксидантным статусом клетки, который подразумевает активность антиоксидантных ферментов и достаточное содержание низкомолекулярных антиоксидантов, в т.ч. аскобрата и глутатиона, а также токоферола [58, 59].
В корнях пшеницы длительная аноксия приводила к уменьшению пула восстановленного глутатиона, что снижало отношение окисленного глутатиона к восстановленному и было маркером окислительного стресса вследствие сильного уменьшения активности глутатионредуктазы во время аноксии [75]. Аноксия вызывала накопление восстановленных форм глутатиона и аскорбата, тогда как реаэрация провоцировала сдвиг в сторону окисленных форм, что являлось одним из маркеров окислительного стресса. Во время корневой аноксии снижались активности аскорбатпероксидазы и глутатионредуктазы, однако восстановление условий нормоксии способствовало возвращению активности ферментов к контрольному уровню, что показывает вовлеченность аскорбат-глутатионового цикла в противостояние неблагоприятным последствиям постаноксии в корнях пшеницы, хотя оно было менее успешным, чем в тканях устойчивых растений [11].
Обработка проростков нута 10 мМ аскорбиновой кислотой улучшала выживаемость растений при аноксии и 24 ч реоксигенации [76]. После воздействия 72 ч аноксии, аскорбиновая кислота повышала выживаемость растений с 65 до 88%, а также удлинение корней от 8 до 64% от контроля. При этом аскорбиновая кислота не оказывала влияние на растения в условиях нормоксии. В проростках устойчивого риса отношение содержания восстановленных и окисленных форм к общему содержанию низкомолекулярных антиоксидантов было выше в побегах погруженных в воду растений по сравнению с нормально аэрированными проростками [77].
На видах незабудки (Myosotis) и крестовника (Senecio) было продемонстрировано, что ПОЛ снижалось в период аноксии и увеличивалось во время реаэрации [78]. Интересно, что реаэрация вызывала увеличение общего уровня глутатиона у неустойчивых Myosotis arvensis и Senecio jacobaea, тогда как у устойчивых M. palustris и S. aquaticus были отмечены небольшие изменения окисленной и восстановленной форм глутатиона. Это коррелировало с активностью глутатонредуктазы: в клетках неустойчивого S. jacobaea ее активность возрастала на 65%, тогда как у S. aquaticus она возрастала лишь на 25% [78]. Таким образом, метаболические изменения у неустойчивых растений были более существенными, чем у устойчивых.
В постаноксии постепенное увеличение активности СОД наблюдали у устойчивых видов. Например, после 28 дней аноксии активность этого фермента в корневищах I. pseudacorus была в 13 раз больше по сравнению с нормоксическим контролем [79]. При этом активность СОД у устойчивого I. pseudacorus была выше, чем у неустойчивого I. germanica [79]. Оценка уровня свободных радикалов методом электронного парамагнитного резонанса показала присутствие АФК у неустойчивого I. germanica после 7 дней аноксии, но не в клетках устойчивого I. pseudacorus [17]. У неустойчивых видов накопление АФК было менее интенсивным при добавлении глутатиона или аскорбиновой кислоты [17]. Таким образом, в тканях устойчивых растений механизмы защиты от АФК подготавливаются еще во время аноксии, до появления в среде кислорода. Адаптация к дефициту кислорода может быть связана с работой пероксидаз [80]. Например, в апопласте риса наблюдали повышение активности работы пероксидаз, что помогает в детоксикации анаэробно продуцируемой перекиси [81].
Исследование антиоксидантого статуса I. germanica, I. pseudacorus, T. aestivum и O. sativa в период реоксигенации выявило истощение пула восстановленного глутатиона и аскорбата у всех растений, кроме экстремально устойчивого к аноксии I. pseudacorus. При этом прямой зависимости выживаемости растений в постаноксии от уровня антиоксидантов замечено не было. Поддержание интегративного состояния мембран при истощении пула гидрофильных антиоксидантов выполняли гидрофобные токоферолы [82]. В погруженном в воду рисе наблюдали небольшое увеличение активности антиоксидантных ферментов (СОД, пероксидазы, монодегидроаскорбатредуктазы, дегидроаскорбатредуктазы, глутатионредуктазы и каталазы) в течение 24 часов постгипоксии после 6-дневного подводного роста, тогда как низкомолекулярный глутатион накапливался очень быстро в 7-кратном объеме [77].
Другим важным механизмом защиты растений от постаноксического воздействия является детоксикация продуктов анаэробного обмена (рис. 1). Реаэрация влияет на гликолиз, цикл Кребса и брожение. Ацетальдегид, накапливающийся в результате анаэробного брожения, может поступать в митохондрии или оставаться в цитозоле, где он превращается в этанол [83]. У риса при прорастании, а также под действием аноксии в колеоптилях повышался уровень экспрессии гена альдегиддегидрогеназы (ALDH2a – LOC_Os02g49720.1) [83]. Тем не менее, количество белка этого фермента снижалось [84]. Уровень ALDH2a несколько возрастал только после 24 ч реаэрации при одновременном интенсивном накоплении мРНК. ALDH2a продолжал накапливаться в постаноксический период, достигая максимума в 4 ч, а затем снижаясь к 24 ч, однако уровень белка все равно был выше, чем до аноксии [85]. Содержание ALDH2b уменьшалось под действием кислородной недостаточности и достигало максимума только при реаэрации, и хотя уровни ацетальдегида и этанола возрастали во время аноксии, активность АЛДГ индуцировалась лишь в постаноксический период [85]. Уже было отмечено, что во время реаэрации может возрастать обратная активность АДГ, а также конверсия этанола в ацетальдегид при помощи каталазы [85]. Таким образом, ацетальдегид способен превращаться в ацетил-КоА для обеспечения быстрой интенсификации аэробного дыхания и включения в обмен веществ анаэробных метаболитов. Наряду с этим, уже через 3 ч реоксигенации гены, кодирующие ферменты цикла Кребса, активировались наряду с накоплением таких метаболитов, как цитрат и α-кетоглутарат, при этом содержание сукцината и фумарата снижалось [83]. Кроме того, в этот же момент активировались гены, вовлеченные в гликолиз, к примеру, кодирующие фосфоглицератмутазу и енолазу [83]. Накопление аланина, наблюдаемое в анаэробных условиях, также может служить адаптацией к реаэрации. Так, нокаутные мутанты A. thaliana по AlaAT1 могут переживать гипоксию, но оказываются менее устойчивыми к реоксигенации по сравнению с диким типом [62]. При этом сам аланин расходуется достаточно быстро при увеличении содержания и активности аланин-аминотрансферазы. Он может преобразовываться в пируват или метаболизироваться до ацетил-КоА. Накопление аланина характерно для устойчивых к аноксии растений, например, риса, и не замечено у пшеницы [5, 6, 86, 87].
Детоксикация метилглиоксаля и других активных альдегидов обеспечивается двумя ферментами: лактоглутатионлиазой (GLX1) и гидроксиацилглутатионгидролазой (GLX2). Эти ферменты действуют на ациклические α-оксоальдегиды, превращая их в менее токсичные α-гидроксикислоты [69]. Основной мишенью упомянутых ферментов является именно метилглиоксаль. Анализ экспрессии генов GLX2-1, GLX2-2 и GLX2-5 выявил, что они задействованы в стресс-ответах у A. thaliana, включая разнообразные воздействия: гипоксию, аноксию, засуху, повышенную инсоляцию, осмотический и солевой стресс. При этом glx2-1 мутанты были наименее устойчивыми к аноксии, а растения со сверхэкспрессией GLX2-1-OE оказались более устойчивыми, чем дикий тип. Интересно, что растения glx2-1 сильнее всего реагировали на реоксигенацию, что предполагает задействование этого фермента в осуществлении защиты от токсичных продуктов окисления, появляющихся во время окислительного стресса при постаноксии [69].
Как уже было отмечено, при реоксигенации активируется антиоксидантная система защиты. Высокий антиоксидантный статус представляет защиту от многих типов негативных воздействий, включая засуху, засоление, холод, воздействие тяжелых металлов, заражение патогенами. Жасмоновая кислота может служить сигналом для регуляции ответа растения на окислительный стресс, модулируя биосинтез антиоксидантов [88]. В побегах A. thaliana уровни эндогенного жасмоната и метилжасмоната снижались в ходе гипоксии, но быстро восстанавливались в период реоксигенации. Кроме того, инкубация растений с метилжасмонатом улучшала устойчивость A. thaliana к периоду реоксигенации, а мутанты, напротив, были уязвимыми. Также показано, что MYC2, главный регулятор действия жасмоната, вносил вклад в развитие устойчивости, активируя гены семейств VTC (vitamin C defective) и GSS (glutathione synthetase), вовлеченные в биосинтез аскорбата и глутатиона, соответственно [88].
На уровне транскрипционных факторов и фитогормонов ответы на постаноксическое воздействие и недостаток кислорода запускаются схожими механизмами, в частности, с участием этилена и ERF-VIII. Этилен служит основным регулятором ответа растений на гипоксический стресс [43, 89]. Его содержание в тканях растений увеличивается в условиях дефицита кислорода [35, 90]. У риса SUB1A1 физически соприкасается с МАР-киназой MPK3, которая его фосфорилирует [91]. В клетках A. thaliana MPK3, 4 и 6 активируются аноксией и постаноксией – эти киназы участвуют в АФК-сигналинге при ответе на абиотические и биотические стрессоры [51]. Таким образом, SUB1A, главный фактор устойчивости к затоплению у риса, также участвует в регуляции устойчивости к постаноксии. SUB1A вызывал накопление транкскриптов, связанных с восстановлением водного баланса, снижением потерь влаги в листьях и защитой от ПОЛ благодаря немедленному ответу на абсцизовую кислоту [70]. Помимо этого, SUB1A приводил к накоплению транскриптов, связанных с нейтрализацией АФК, снижая образование последних в постаноксических тканях. Недавно показано, что в адаптации к постаноксии принимают участие факторы защиты от засухи, к примеру, EREBP1, относящийся к семейству ERF-VII, как и SUB1A [41]. Конститутивная экспрессия EREBP1 способствовала накоплению транскриптов, связанных с биосинтезом АБК, причем даже в нормальных нестрессовых условиях. Сверхэкспрессия EREBP1 приводила к повышенной устойчивости к дефициту кислорода [41]. Помимо EREBP1, SUB1A ассоциирован с индукцией целого ряда факторов транскрипции, общих для ответа растения на засуху и важных в защите от обезвоживания. Таковыми являются факторы AP37 (ERF3) и AP59 (APETALA), относящиеся к AP2/ERF-VIIIa и IXa группам соответственно, а также LEA-белки (Late Embryogenesis Abundant) с ярко выраженными гидрофильными свойствами, необходимые для поддержания нормального состояния растения в условиях засухи или засоления (для риса это RAB16A (RAB21), LEA3 и LIP9 (Dehydrin DHN1/DIP1)) [70]. Дегидрины, как и другие LEA-белки, относятся к RAB-белкам (Responsive to ABA), т.е. подключаются компоненты стрессорных каскадов, опосредованных АБК.
Аналогичный результат участия ERF-VII был получен на A. thaliana. Накопление транскрипта HRE2, помимо дефицита кислорода, вызывалось осмотическим и окислительным стрессами [41]. Сверхэкспрессия этого гена усиливала устойчивость растений к вышеуказанным воздействиям. Другие гены из этого семейства – RAP2.2, RAP2.3 и RAP2.12 – при постгипоксии тоже участвовали в регуляции экспрессии АБК-зависимых генов, связанных с устойчивостью к обезвоживанию [41]. Как можно заметить, защита от засухи, окислительного стресса и аноксии включает некоторый общий набор генов, активизирующихся во время действия этих стрессоров. Помимо транскрипционных факторов ERF-VII, транскрипционный фактор HaWRKY76 из семейства WRKY в подсолнечнике (Helianthus annuus) схожим образом увеличивал устойчивость к затоплению [41]. Попытка вызвать сверхэкспрессию этого гена в арабидопсисе сделала это растение более устойчивым к постаноксии, сдерживая накопление АФК и приводя к экономному расходованию углеводов.
Во время реаэрации немедленное поступление кислорода в ткани способно усиливать Arg/N-концевой путь деградации белков, в том числе ERF-VII посредством растительных Cys-оксидаз PCO1/2 (plant cysteine oxidase), что будет приводить к репрессии транскрипции анаэробных мРНК [4]. Иными молекулярными адаптациями можно считать освобождение секвестрированных мРНК от рибосом и регуляцию мембранных переносчиков: при анаэробном прорастании у риса возрастало число переносчиков основных аминокислот вместе с активностью митохондриальной аргиназы и концентрациями аргинина и орнитина [92]. Продукция этилена увеличивалась в период постаноксии у устойчивых видов. В проростках A. thaliana реаэрация запускала накопление транскриптов, ассоциированных с биосинтезом этилена, кроме того мутанты ein2-5 (ethylene insensitive) оказывались неспособными к регуляции ряда генов, важных для приспособления к реоксигенации (генов, вовлеченных в стабилизацию белков, минимизацию воздействия АФК, защиту от высыхания) [93]. Таким образом, этиленовый сигналинг может работать в период реаэрации, независимо от ERF-VIIs. Это согласуется с тем фактом, что только 10% генов, относящихся к семейству ERF, регулируются посредством этилена [94].
Считается, что главным механизмом повреждения ФСII является разрушение хлорофилла, которое снижено в клетках устойчивого SUB1A риса [4]. Показана также корреляция между устойчивостью к затоплению и способностью к восстановлению фотосинтетической активности, что демонстрирует наличие у некоторых устойчивых видов способности сохранять функциональность комплексов ФСII после долгих периодов дефицита кислорода или темноты [4]. Так, хлоропласты из листьев риса характеризовались полным восстановлением фотохимической активности после 72 ч аноксии, тогда как у пшеницы они повреждались при более коротких сроках анаэробного воздействия, причем нарушения были характерны именно для ФСII [26]. Наличие SUB1A в геноме риса коррелировало с эффективностью нефотохимического тушения сразу после реоксигенации и накоплением некоторых аминокислот (аргинина, фенилаланина и валина) по сравнению с O. sativa, лишенного аллели SUB1A [95].
Изучение толерантности 4 прибрежных видов растений (свинороя (Cynodon dactylon), взморника (Zostera japonica), гречки (Paspalum vaginatum) и полевицы (Agrostis stolonifera)) к аноксическому воздействию показало, что практически все растения погибали в период реаэрации, за исключением P. vaginatum. Устойчивость определялась скоростью метаболизации углеводов – чем медленнее они окислялись в растении, тем выше была устойчивость, независимо от исходного содержания сахаров. При этом, эффективность ФСII различных генотипов P. vaginatum детерминировала способность противодействовать негативным эффектам постаноксии [96].
Интересен эффект постаноксии на митохондрии. Так, в проростках пшеницы аноксия приводила к существенным повреждениям митохондрий, тогда как реоксигенация возвращала их к нормальному состоянию, если аноксическое воздействие не было очень длительным [62]. Влияние аноксии на траскриптом растений изучено довольно подробно, тогда как, к сожалению, исследований постаноксического транскрипома значительно меньше. Основные данные представлены постаноксическими транскриптомами риса и сои [83, 97]. Их результаты уже частично упоминались и обсуждались ранее. Для риса были проанализированы разные экспериментальные условия – рост в аэробных/анаэробных условиях; 24 ч анаэробного роста с реаэрацией в течение 6 ч; 24 ч аэробного роста с переключением на анаэробные условия длительностью 6 ч, что позволило выявить общие аэробные и анаэробные транскрипты [83]. Существенная перестройка транскриптома риса была обнаружена при анаэробном росте и последующей реаэрации. Около 4000 генов были индуцированы во время 6 ч реоксигенации, при этом 50% из них имели более высокий уровень экспрессии, чем во время анаэробного роста, что указывало на моментальное переключение на аэробный метаболизм [83]. Другие 15% генов были специфичны для реаэрации, они репрессировались при переключении условий от аэробных к анаэробным [83]. У арабидопсиса аноксия приводила к распаду полисом на 50% с одновременным увеличением содержания 80S моносом. Эта деполимеризация была обратима, при непродолжительном анаэробиозе число полисом возвращалось к контрольному уровню уже в течение часа реоксигенации [98]. Гипоксия приводила к транслированию матриц генов, связанных с ростом, например, ксилоглюкан-эндо-трансфераз, как полисомами, так и одиночными рибосомами. При этом транскрипты, связанные с брожением и гликолизом, а также некоторые специфичные транскрипты, обеспечивающие растяжение клеток, транслировались преимущественно в полисомной фракции. Интересно, что гипоксия уменьшала уровень транскриптов, связанных с образованием клеточной стенки, сигналингом, транскрипцией, делением, метаболизмом гормонов, однако уже через час после реаэрации репрессия прекращалась. Важно отметить, что 80% полисомной мРНК, которая была сильно индуцирована после 9 ч гипоксии, не снижалась и при 1 ч реаэрации. Таким образом, транскрипты, важные для реоксигенации, накапливались еще при гипоксии, что подтверждается наличием целого кластера генов, которые индуцировались во время гипоксии, но были ассоциированы с рибосомами только в период реоксигенации [98].
После 7 дней аноксии дыхательная активность в колеоптилях риса значительно понижалась [99]. Тем не менее, после одного дня реаэрации интенсивность дыхания возвращалась к контрольному уровню [99], что сочеталось с индукцией генов дыхательной цепи и генов альтернативной оксидазы [83]. При этом аноксический и постаносический протеомы митохондрий риса были во многом схожими. Реоксигенированный протеом имел более высокие уровни шаперонов и белков, вовлеченных в метаболизм углеводов. Протеомы при реаэрации и аноксии отличались содержанием цитохромного b/c1 комплекса (III) и цитохромоксидазы (IV), тогда как отличий в количестве первого комплекса (НАДН-оксидоредуктазы) и АТФ-синтезы не было обнаружено. Это сочеталось с более высоким содержанием цитохрома с и гема [99]. Увеличение содержания и активности альтернативной оксидазы позволяло предотвратить чрезмерное образование АФК во время реоксигенации [83, 99]. Помимо этого, в проростках риса при постаноксии интенсифицировался биогенез митохондрий [62]. Проростки сои показывали индукцию 1-Cys пероксиредоксина – белка, нейтрализующего перекись водорода – как во время затопления (аноксии), так и после аноксического воздействия (реаэрация) [97]. Это поддерживает гипотезу о преадаптации на уровне антиоксидантных систем еще во время аноксии для ликвидации последствий окислительного стресса при появлении в среде кислорода. Индукция пероксиредоксина также обнаружена у риса [100]. Вполне вероятно, что высокий уровень пероксиредоксина может быть вызван задержкой деградации белка [62]. Недостаток мРНК пероксиредоксина в подверженных действию затопления проростках сои также поддерживает эту гипотезу [97]. В целом, в реоксигенированых проростках сои наблюдали увеличение содержания белков, вовлеченных в биосинтез компонентов клеточной стенки, реорганизацию цитоскелета и рост клеток, с одновременным уменьшением белков, отвечающих за метаболизм аминокислот и гликолиз, которые в большинстве своем являются анаэробными стрессовыми белками [97]. Хотя в геноме сои не обнаружено гомологов SUB1A и SK, в проростках сои во время аноксии аккумулировались некоторые ERFVII (ERFVII1, ERFVII5, ERFVII6 и ERFVII8), имеющие гомологию с HRE1, HRE2, RAP2.2 и RAP2.12 A. thaliana [44]. Важно отметить, что как и в случае риса или арабидопсиса, в период реоксигенации эти факторы быстро деградировали, осуществляя тем самым переключение транскрипции с анаэробной на аэробную. Таким образом, на уровне транскриптов, белков, метаболитов и активности ферментов продемонстрировано, что многие ответные реакции на постаноксию запускаются еще в ходе аноксии как преадаптация к последующему окислительному стрессу.
ЗАКЛЮЧЕНИЕ И ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ ИССЛЕДОВАНИЙ
Изучение постаноксического воздействия в последнее время интенсифицировалось на уровне транскриптомных, протеомных и метаболомных исследований. У растений, подвергающихся воздействию бескислородной среды, запускаются транскриптомный, белковый и метаболический ответы на недостаток кислорода. Бескислородный этап при этом связан с синтезом анаэробных белков, главным образом, предназначенных для поддержания целостности мембран, обеспечения метаболизма углеводов, гликолиза, брожений, регуляции pH, ассимиляции азота и синтеза аминокислот [4, 6, 7, 9, 13, 41]. Во время реаэрации активизируются антиоксидантные системы, альтернативная оксидаза, ферменты биосинтеза антиоксидантов. В обеспечении регуляции преадаптации к постаноксическим условиям принимают участие факторы ERF-VII, которые также важны для регуляции устойчивости в период аноксии, а также фитогормоны, в частности жасмоновая и абсцизовая кислоты [41, 62, 88].
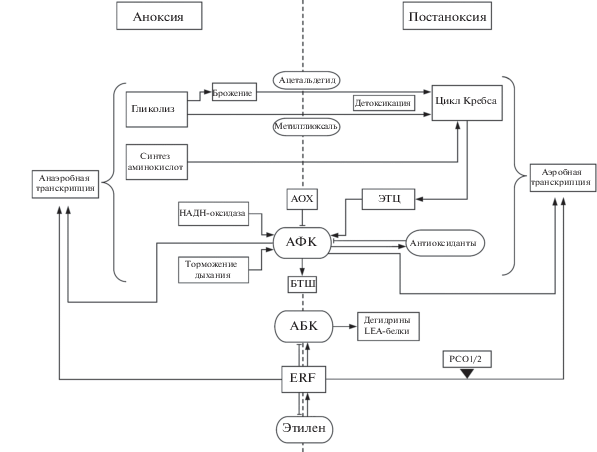
Общие метаболические и молекулярные события, обсуждаемые в обзоре, суммированы на рис. 2. В условиях аноксии индуцируется спиртовое брожение, что приводит к накоплению токсичного ацетальдегида. Его нейтрализация происходит за счет индукции альдегиддегидрогеназы. Детоксикацию метилглиоксаля и других α-оксоальдегидов обеспечивают лактоглутатионлиаза и гидроксиацилглутатионгидролаза. Накопленный при аноксии аланин в условиях реоксигенации посредством активации аланинаминотрасферазы может поступать в цикл Кребса для обеспечения клетки энергией в условиях дефицита АТФ. Интенсивная активация дыхания в ЭТЦ митохондрий при появлении кислорода неизбежно приводит к генерации АФК. Этот процесс может несколько тормозиться альтернативной оксидазой. Главным механизмом защиты от АФК являются антиоксиданты и антиоксидантные ферменты. АФК-индуцируемый сигналинг приводит к биосинтезу пероксиредоксинов, низкомолекулярных антиоксидантов (глутатиона и аскорбата), а также активации антиоксидантных ферментов (в частности, аскорбат-глутатионового цикла). Улучшение антиоксидантного статуса клетки поддерживается работой стрессовых фитогормонов и транскрипционных факторов их сигнальных каскадов (главным образом, жасмоновой кислоты и ERF-VII факторов). Во время аноксии происходит остановка кислород-зависимого N-концевого пути деградации ERF-факторов, которые активируют стресс-индуцируемые гены, связанные с усилением работы антиоксидантных систем и увеличением содержания абсцизовой кислоты для минимизации потерь влаги, возникающих уже в фазе реоксигенации. При возвращении кислорода в среду эти факторы, наоборот, подвергаются деградации под действием Cys-оксидаз (PCO), что блокирует синтез анаэробных транскриптов и переключает метаболизм с анаэробного на аэробный. Тем не менее, уже накопленные в условиях аноксии продукты успешно справляются со своими защитными функциями. Увеличение синтеза этилена в ходе реаэрации может происходить независимо от ERF, при этом этиленовый сигналинг вносит свой вклад в защиту от высыхания и деструктивных окислительных модификаций от свободных радикалов.
Рис. 2.
Обобщенная схема молекулярных и метаболических событий при аноксии и постаноксии. Объяснения в тексте. AOX – альтернативная оксидаза, ERF – ethylene response factors, PCO – растительные Cys-оксидазы.
Рассмотренные данные дают понимание того, что постаноксия представляет собой комплексное воздействие, являющееся, прежде всего, продолжением бескислородного стресса, поэтому говорить об отдельном “постаноксическом стрессе” не вполне корректно, однако усиление окислительных процессов в совокупности с иссушением растительных тканей происходят при постаноксии интенсивнее, чем в период предшествующего ей кислородного голодания, что позволяет говорить о существовании специфичных постаноксических повреждений. Более того, постаноксия является восстановлением нормальных дострессовых условий и представляет собой четвертую фазу стресса по классической схеме стрессорного ответа Селье – фазу регенерации.
Тем не менее, исследований постаноксии в растениях все еще очень мало, особенно по сравнению с количеством работ по изучению механизмов адаптации к аноксии и другим неблагоприятным воздействиям. Для того чтобы углубить наше понимание этих процессов, необходимы сравнительные исследования видов с разной степенью устойчивости к кислородной недостаточности и/или последующему повреждению. Выявление наиболее значимых транскриптов, вносящих вклад в устойчивость как к дефициту кислорода, так и к реаэрации, позволит впоследствии получить более устойчивые к неблагоприятным воздействиям формы растений и увеличить продуктивность земледелия.
Авторы выражают благодарность В.В. Орловой за помощь в подготовке рисунков.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты № 12-04-01029 и № 18-04-00157).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Hendry G.A.F. Oxygen and environmental stress in plants: and evolutionary context // Proc. R. Soc. Edin. B-Bi. 1994. V. 102. P. 155. https://doi.org/10.1017/S026972700001407X
Borisjuk L., Rolletschek H. The oxygen status of the developing seed // New Phytol. 2009. V. 182. P. 17. https://doi.org/10.1111/j.1469-8137.2008.02752.x
van Dongen J.T., Schurr U., Pfister M., Geigenberger P. Phloem metabolism and function have to cope with low internal oxygen // Plant Physiol. 2003. V. 131. P. 1529. https://doi.org/10.1104/pp.102.017202
Voesenek L.A.C.J., Bailey-Serres J. Flood adaptive traits and processes: an overview // New Phytol. 2015. V. 206. P. 57. https://doi.org/10.1111/nph.13209
Bailey-Serres J., Voesenek L.A.C.J. Flooding stress: Acclimations and genetic diversity // Annu. Rev. Plant Biol. 2008. V. 59. P. 313. https://doi.org/10.1146/annurev.arplant.59.032607.092752
Chirkova T., Yemelyanov V. The study of plant adaptation to oxygen deficiency in Saint Petersburg University // Bio. Comm. 2018. V. 63. P. 17. https://doi.org/10.21638/spbu03.2018.104
Чиркова Т.В. Пути адаптации растений к гипоксии и аноксии. Ленинград: ЛГУ, 1988. 244 с.
Gupta K.J., Zabalza A., Van Dongen J.T. Regulation of respiration when the oxygen availability changes // Physiol. Plant. 2009. V. 137. P. 383. https://doi.org/10.1111/j.1399-3054.2009.01253.x
Чиркова Т.В. Растение и анаэробиоз // Вестник С.-Петербург. ун-та. Серия 3. Биология. 1998. № 2. С. 41.
Drew M.C. Oxygen deficiency and root metabolism: injury and acclimation under hypoxia and anoxia // Annu. Rev. Plant Phys. 1997. V. 48. P. 223. https://doi.org/10.1146/annurev.arplant.48.1.223
Biemelt S., Keetman U., Albrecht G. Re-aeration following hypoxia or anoxia leads to activation of the antioxidative defense system in roots of wheat seedlings // Plant Physiol. 1998. V. 116. P. 651. https://doi.org/10.1104/pp.116.2.651
van Dongen J.T., Licausi F. Oxygen sensing and signaling // Annu. Rev. Plant Biol. 2015. V. 66. P. 345. https://doi.org/10.1146/annurev-arplant-043014-114813
Vartapetian B.B., Jackson M.B. Plant Adaptations to environmental stress // Ann. Bot. 1997. V. 79. P. 3. https://doi.org/10.1093/oxfordjournals.aob.a010303
Fukao T., Kennedy R.A., Yamasue Y., Rumpho M.E. Genetic and biochemical analysis of anaerobically-induced eenzymes during seed germination of Echinochloa crus-galli varieties tolerant and intolerant of anoxia // J. Exp. Bot. 2003. V. 54. P. 1421. https://doi.org/10.1093/jxb/erg140
Boyer J.S. Plant productivity and environment // Science. 1982. V. 218. P. 443: https://doi.org/10.1126/science.218.4571.443
Bailey-Serres J., Lee S.C., Brinton E. Waterproofing crops: Effective flooding survival strategies // Plant Physiol. 2012. V. 160. P. 1698. https://doi.org/10.1104/pp.112.208173
Crawford R.M.M., Walton J.C., Wollenweberratzer B. Similarities between postischemic injury to animal tissues and postanoxic injury in plants // Proc. R. Soc. Edin. B-Bi. 1994. V. 102. P. 325. https://doi.org/10.1017/S0269727000014317
Das A., Uchimiya H. Oxygen stress and adaptation of a semi-aquatic plant: Rice (Oryza sativa) // J. Plant Res. 2002. V. 115. P. 315.
Blokhina O., Virolainen E., Fagerstedt K.V. Antioxidants, oxidative damage and oxygen deprivation stress: a review // Ann. Bot. 2003. V. 91. P. 179. https://doi.org/10.1093/aob/mcf118
Rawyler A., Pavelic D., Gianinazzi C., Oberson J., Braendle R. Membrane lipid integrity relies on a threshold of ATP production rate in potato cell cultures submitted to anoxia // Plant Physiol. 1999. V. 120. P. 293. https://doi.org/10.1104/pp.120.1.293
Pavelic D., Arpagaus S., Rawyler A., Brändle R. Impact of post-anoxia stress on membrane lipids of anoxia-pretreated potato cells a re-appraisal // Plant Physiol. 2000. V. 124. P. 1285. https://doi.org/10.1104/pp.124.3.1285
Armstrong W., Cousins D., Armstrong J., Turner D.W., Beckett P.M. Oxygen distribution in wetland plant roots and permeability barriers to gas-exchange with the rhizosphere: a microelectrode and modelling study with Phragmites australis // Ann. Bot. 2000. V. 86. P. 687. https://doi.org/10.1006/anbo.2000.1236
Mommer L., Visser E.J.W. Underwater photosynthesis in flooded trrestrial plants: a matter of leaf plasticity // Ann. Bot. 2005. V. 96. P. 581. https://doi.org/10.1093/aob/mci212
Voesenek L.A.C.J., Colmer T.D., Pierik R., Millenaar F.F., Peeters A.J.M. How plants cope with complete submergence // New Phytol. 2006. V. 170. P. 213. https://doi.org/10.1111/j.1469-8137.2006.01692.x
Gibbs J., Greenway H. Mechanisms of anoxia tolerance in plants. I. Growth, survival and anaerobic catabolism // Func. Plant Biol. 2003. V. 30. P. 1. https://doi.org/10.1071/PP98095
Чиркова Т.В., Вальтер Г., Леффер С., Новицкая Л.О. Некоторые особенности состояния хлоропластов и митохондрий листьев проростков пшеницы и риса в условиях аноксии и длительной темноты // Физиология растений. 1995. Т. 42. С. 368.
Blokhina O., Fagerstedt K.V. Oxidative metabolism, ROS and NO under oxygen deprivation // Plant Physiol. Biochem. 2010. V. 48. P. 359. https://doi.org/10.1016/j.plaphy.2010.01.007
Blokhina O.B., Chirkova T.V., Fagerstedt K.V. Anoxic stress leads to hydrogen peroxide formation in plant cells // J. Exp. Bot. 2001. V. 52. P. 1179. https://doi.org/10.1093/jxb/52.359.1179
Чиркова Т.В., Новицкая Л.О., Блохина О.Б. Перекисное окисление липидов и активность антиоксидантных систем при аноксии у растений с разной устойчивостью к недостатку кислорода // Физиология растений. 1998. Т. 45. С. 65.
Sweetlove L., Dunford R., Ratcliffe R.G., Kruger N.J. Lactate metabolism in potato tubers deficient in lactate dehydrogenase activity // Plant Cell Environ. 2000. V. 23. P. 873.
Voesenek L.A.C.J., Bailey-Serres J. Flooding tolerance: O2 sensing and survival strategies // Curr. Opin. Plant Biol. 2013. V. 16. P. 647. https://doi.org/10.1016/j.pbi.2013.06.008
Rich S.M., Ludwig M., Colmer T.D. Photosynthesis in aquatic adventitious roots of the halophytic stem-succulent Tecticornia pergranulata (formerly Halosarcia pergranulata) // Plant Cell Environ. 2008. V. 31. P. 1007. https://doi.org/10.1111/j.1365-3040.2008.01813.x
Polko J.K., Voesenek L.A.C.J., Peeters A.J.M., Pierik R. Petiole hyponasty: an ethylene-driven, adaptive response to changes in the environment // AoB Plants. 2011. V. 11. P. 1. https://doi.org/10.1093/aobpla/plr031
Sauter M. Root responses to flooding // Curr. Opin. Plant Biol. 2013. V. 16. P. 282. https://doi.org/10.1016/j.pbi.2013.03.013
Yemelyanov V.V., Shishova M.F. The role of phytohormones in the control of plant adaptation to oxygen depletion // Phytohormones and abiotic stress tolerance in plants / ed. Khan N.A. et al. Berlin–Heidelberg: Springer-Verlag, 2012. P. 229.
Sauter M., Steffens B. Biogenesis of adventitious roots and their involvement in the adaptation to oxygen limitations // Low-oxygen stress in plants, plant cell monographs / ed. van Dongen J.T., Licausi F. Wien: Springer-Verlag, 2014. P. 299.
Hu Z., Qi X., Zhang M., Chen X., Nakazono M. Roles of phytohormones in morphological and anatomical responses of plants to flooding stress // Plant hormones under challenging environmental factors / ed. Ahammed G. J., Yu J.-Q. Dordrecht: Springer Science+Business Media, 2016. P. 117.
Winkel A., Pedersen O., Ella E., Ismail A.M., Colmer T.D. Gas film retention and underwater photosynthesis during field submergence of four contrasting rice genotypes // J. Exp. Bot. 2014. V. 65. P. 3225. https://doi.org/10.1093/jxb/eru166
Rich S.M., Ludwig M., Colmer T.D. Aquatic adventitious root development in partially and completely submerged wetland plants Cotula coronopifolia and Meionectes brownii // Ann. Bot. 2012. V. 110. P. 405. https://doi.org/10.1093/aob/mcs051
Hattori Y., Nagai K., Furukawa S., Song X.J., Kawano R., Sakakibara H., Wu J., Matsumoto T., Yoshimura A., Kitano H., Matsuoka M., Mori H., Ashikari M. The ethylene response factors SNORKEL1 and SNORKEL2 allow rice to adapt to deep water // Nature. 2009. V. 460. P. 1026. https://doi.org/10.1038/nature08258
Tamang B.G., Fukao T. Plant adaptation to multiple stresses during submergence and following desubmergence // Int. J. Mol. Sci. 2015. V. 16. P. 30164. https://doi.org/10.3390/ijms161226226
Bailey-Serres J., Voesenek L.A.C.J. Life in the balance: a signaling network controlling survival of flooding // Curr. Opin. Plant Biol. 2010. V. 13. P. 489. https://doi.org/10.1016/j.pbi.2010.08.002
Bailey-Serres J., Fukao T., Gibbs D.J., Holdsworth M.J., Lee S.C., Licausi F., Perata P., Voesenek L.A.C.J., van Dongen J.T. Making sense of low oxygen sensing // Trends Plant Sci. 2012. V. 17. P. 129. https://doi.org/10.1016/j.tplants.2011.12.004
Tamang B.G., Magliozzi J.O., Maroof M.A.S., Fukao T. Physiological and transcriptomic characterization of submergence and reoxygenation responses in soybean seedlings // Plant Cell Environ. 2014. V. 37. P. 2350. https://doi.org/10.1111/pce.12277
Schmitz A.J., Folsom J.J., Jikamaru Y., Ronald P., Walia H. SUB1A-mediated submergence tolerance response in rice involves differential regulation of the brassinosteroid pathway // New Phytol. 2013. V. 198. P. 1060. https://doi.org/10.1111/nph.12202
Fukao T. A variable cluster of ethylene response factor-like genes regulates metabolic and developmental acclimation responses to submergence in rice // Plant Cell. 2006. V. 18. P. 2021. https://doi.org/10.1105/tpc.106.043000
Licausi F., Kosmacz M., Weits D.A., Giuntoli B., Giorgi F.M., Voesenek L.A.C.J., Perata P., Van Dongen J.T. Oxygen sensing in plants is mediated by an N-end rule pathway for protein destabilization // Nature. 2011. V. 479. P. 419. https://doi.org/10.1038/nature10536
Steffens B., Steffen-Heins A., Sauter M. Reactive oxygen species mediate growth and death in submerged plants // Front. Plant Sci. 2013. V. 4. P. 1. https://doi.org/10.3389/fpls.2013.00179
Baxter-Burrell A., Yang Z., Springer P.S., Bailey-Serres J. RopGAP4-dependent Rop GTPase rheostat control of Arabidopsis oxygen deprivation tolerance // Science. 2002. V. 296. P. 2026–2028. https://doi.org/10.1126/science.1071505
Wong H.L., Pinontoan R., Hayashi K., Tabata R., Yaeno T., Hasegawa K., Kojima C., Yoshioka H., Iba K., Kawasaki T., Shimamoto K. Regulation of rice NADPH oxidase by binding of Rac GTPase to its N-terminal extension // Plant Cell. 2007. V. 19. P. 4022. https://doi.org/10.1105/tpc.107.055624
Chang R., Jang C.J.H., Branco-Price C., Nghiem P., Bailey-Serres J. Transient MPK6 activation in response to oxygen deprivation and reoxygenation is mediated by mitochondria and aids seedling survival in Arabidopsis // Plant Mol. Biol. 2012. V. 78. P. 109. https://doi.org/10.1007/s11103-011-9850-5
Maxwell D.P., Wang Y., McIntosh L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells // Proc. Natl. Acad. Sci. U.S.A. 1999. V. 96. P. 8271. https://doi.org/10.1073/pnas.96.14.8271
Skutnik M., Rychter A.M. Differential response of antioxidant systems in leaves and roots of barley subjected to anoxia and post-anoxia // J. Plant Physiol. 2009. V. 166. P. 926. https://doi.org/10.1016/j.jplph.2008.11.010
Igamberdiev A.U., Hill R.D. Nitrate, NO and haemoglobin in plant adaptation to hypoxia: an alternative to classic fermentation pathways // J. Exp. Bot. 2004. V. 55. P. 2473. https://doi.org/10.1093/ixb/erh272
Youssef M.S., Mira M.M., Renault S., Hill R.D., Stasolla C. Phytoglobin expression influences soil flooding response of corn plants // Ann. Bot. 2016. V. 118. P. 919. https://doi.org/10.1093/aob/mcw146
Crawford R.M.M., Zochowski Z.M. Tolerance of anoxia and ethanol toxicity in chickpea seedlings (Cicer a-rietinum L.) // J. Exp. Bot. 1984. V. 35. P. 1472. https://doi.org/10.1093/jxb/35.10.1472
Monk L.S., Braendle R., Crawford R.M.M. Catalase activity and post-anoxic injury in monocotledonous species // J. Exp. Bot. 1987. V. 3. P. 233.
Monk L.S., Fagerstedt K.V., Crawford R.M.M. Oxygen toxicity and superoxide dismutase as an antioxidant in physiological stress // Physiol. Plant. 1989. V. 76. P. 456. https://doi.org/10.1111/j.1399-3054.1989.tb06219.x
Smirnoff N. Antioxidant systems and plant response to the environment // Environment and plant metabolism: flexibility and acclimation / ed. Smirnoff V. Oxford: Bios Scientific Publishers, 1995. P. 217.
Santosa I.E., Ram P.C., Boamfa E.I., Laarhoven L.J.J., Reuss J., Jackson M.B., Harren F.J.M. Patterns of peroxidative ethane emission from submerged rice seedlings indicate that damage from reactive oxygen species takes place during submergence and is not necessarily a post-anoxic phenomenon // Planta. 2007. V. 226. P. 193. https://doi.org/10.1007/s00425-006-0457-z
Van Toai T.T., Bolles C.S. Postanoxic injury in soybean (Glycine max) seedlings // Plant Physiol. 1991. V. 97. P. 588. https://doi.org/10.1104/pp.97.2.588
Shingaki-Wells R., Millar A.H., Whelan J., Narsai R. What happens to plant mitochondria under low oxygen? An omics review of the responses to low oxygen and reoxygenation // Plant Cell Environ. 2014. V. 37. P. 2260. https://doi.org/10.1111/pce.12312
Чиркова Т.В., Блохина О.Б. Влияние аноксии на уровень эндогенного перекисного окисления липидов в корнях растений, различающихся по устойчивости к недостатку кислорода // Вестник Ленинградского университета. Серия 3. Биология. 1991. № 3. С. 85.
Blokhina O.B., Fagerstedt K.V., Chirkova T.V. Relationships between lipid peroxidation and anoxia tolerance in a range of species during post-anoxic reaeration // Physiol. Plant. 1999. V. 105. P. 625. https://doi.org/10.1034/j.1399-3054.1999.105405.x
Sieber M., Brandle R. Energy-metabolism in rhizomes of Acorus calamus (L.) and in tubers of Solanum tuberosum (L.) with regard to their anoxia tolerance // Bot. Acta. 1991. V. 104. P. 279. https://doi.org/10.1111/j.1438-8677.1991.tb00230.x
Garnczarska M., Bednarski W. Effect of a short-term hypoxic treatment followed by re-aeration on free radicals level and antioxidative enzymes in lupine roots // Plant Physiol. Biochem. 2004. V. 42. P. 233. https://doi.org/10.1016/j.plaphy.2004.01.005
Ruban A.V. Evolution under the sun: Optimizing light harvesting in photosynthesis // J. Exp. Bot. 2015. V. 66. P. 7. https://doi.org/10.1093/jxb/eru400
Pfister-Sieber M., Brändle R. Aspects of plant behaviour under anoxia and post-anoxia // Proc. R. Soc. Edin. B-Bi. Biological Sciences. 1994. V. 102. P. 313. https://doi.org/10.1017/S0269727000014305
Devanathan S., Erban A., Perez-Torres R., Kopka J., Makaroff C.A. Arabidopsis thaliana Glyoxalase 2-1 is required during abiotic stress but is not essential under normal plant gowth // PLoS ONE. 2014. V. 9. https://doi.org/10.1371/journal.pone.0095971
Fukao T., Yeung E., Bailey-Serres J. The submergence tolerance regulator SUB1A mediates crosstalk between submergence and drought tolerance in rice // Plant Cell. 2011. V. 23. P. 412. https://doi.org/10.1105/tpc.110.080325
Setter T.L., Bhekasut P., Greenway H. Desiccation of leaves after de-submergence is one cause for intolerance to complete submergence of the rice cultivar IR 42 // Func. Plant Biol. 2010. V. 37. P. 1096. https://doi.org/10.1071/FP10025
Johnson J.R., Cobb B.G., Drew M.C. Hypoxic induction of anoxia tolerance in roots of Adh1 null Zea mays L. // Plant Physiol. 1994. V. 105. P. 61. https://doi.org/10.1104/pp.105.1.61
Sakagami J.I., Joho Y., Ito O. Contrasting physiological responses by cultivars of Oryza sativa and O. glaberrima to prolonged submergence // Ann. Bot. 2009. V. 103. P. 171. https://doi.org/10.1093/aob/mcn201
Sakagami J.I., Joho Y., Sone C. Complete submergence escape with shoot elongation ability by underwater photosynthesis in african rice, Oryza glaberrima Steud // Field Crop. Res. 2013. V. 152. P. 17. https://doi.org/10.1016/j.fcr.2012.12.015
Albrecht G., Wiedenroth E.-M. Protection against activated oxygen following re-aeration of hypoxically pretreated wheat roots. The response of the glutathione system // J. Exp. Bot. 1994. V. 45. P. 449. https://doi.org/10.1093/jxb/45.4.449
Crawford R.M.M., Wollenweberratzer B. Influence of L-ascorbic-acid on postanoxic growth and survival of chickpea seedlings (Cicer arietinum L.) // J. Exp. Bot. 1992. V. 43. P. 703.
Ushimaru T., Shibasaka M., Tsuji H. Development of the O2(–)-detoxification system during adaptation to air of submerged rice seedlings // Plant Cell Physiol. 1992. V. 33. P. 1065. https://doi.org/10.1093/oxfordjournals.pcp.a078357
Biemelt S., Albrecht G., Wiedenroth E.M. The effect of post-hypoxia on roots in Senecio and Myosotis species related to the glutathione system // Folia Geobot. 1996. V. 31. P. 65.
Monk L.S., Fagerstedt K.V., Crawford R.M. Superoxide dismutase as an anaerobic polypeptide : a key factor in recovery from oxygen deprivation in Iris pseudacorus? // Plant Physiol. 1987. V. 85. P. 1016. https://doi.org/10.1104/pp.85.4.1016
Чиркова Т.В., Соколовская Е.Л., Хазова И.В. Активность и изоферментный состав пероксидазы корней растений в зависимости от условий временного анаэробиоза // Физиология растений. 1973. Т. 20. С. 1236.
Ласточкин В.В., Емельянов В.В., Чиркова Т.В. Активность пероксидазы в проростках пшеницы и риса в связи с воздействием аноксии // Вестник С.-Петербург. ун-та. Серия 3. Биология. 2000. № 3. С. 58.
Blokhina O., Virolainen E., Fagerstedt K.V., Hoikkala A., Wähälä K., Chirkova T.V. Antioxidant status of anoxia-tolerant and intolerant plant species under anoxia and reaeration // Physiol. Plant. 2000. V. 109. P. 396. https://doi.org/10.1034/j.1399-3054.2000.100405.x
Narsai R., Howell K.A., Carroll A., Ivanova A., Millar A.H., Whelan J. Defining core metabolic and transcriptomic responses to oxygen availability in rice embryos and young seedlings // Plant Physiol. 2009. V. 151. P. 306. https://doi.org/10.1104/pp.109.142026
Sadiq I., Fanucchi F., Paparelli E., Alpi E., Bachi A., Alpi A., Perata P. Proteomic identification of differentially expressed proteins in the anoxic rice coleoptile // J. Plant Physiol. 2011. V. 168. P. 2234. https://doi.org/10.1016/j.jplph.2011.07.009
Tsuji H., Meguro N., Suzuki Y., Tsutsumi N., Hirai A., Nakazono M. Induction of mitochondrial aldehyde dehydrogenase by submergence facilitates oxidation of acetaldehyde during re-aeration in rice // FEBS Lett. 2003. V. 546. P. 369. https://doi.org/10.1016/S0014-5793(03)00631-8
Licausi F., Perata P. Low oxygen signaling and tolerance in plants // Adv. Bot. Res. 2009. V. 50. P. 139. https://doi.org/10.1016/S0065-2296(08)00804-5
Shingaki-Wells R.N., Huang S., Taylor N.L., Harvey Millar A. Pursuing the identification of O2 deprivation survival mechanisms in plants related to selective mRNA translation, hormone-independent cellular elongation and preparation for the arrival of oxygen // Plant Signal. Behav. 2011. V. 6. P. 1612. https://doi.org/10.4161.6.10.17107
Yuan L.-B., Dai Y.-S., Xie L.-J., Yu L.-J., Zhou Y., Lai Y.-X., Yang Y.-C., Xu L., Chen Q.-F., Xiao S. Jasmonate regulates plant responses to postsubmergence reoxygenation through transcriptional activation of antioxidant synthesis // Plant Physiol. 2017. V. 173. P. 1864. https://doi.org/10.1104/pp.16.01803
Sasidharan R., Voesenek L.A.C.J. Ethylene-mediated acclimations to flooding stress // Plant Physiol. 2015. V. 169. P. 3. https://doi.org/10.1104/pp.15.00387
Voesenek L.A.C.J., Sasidharan R. Ethylene and oxygen signalling drive plant survival during flooding // Plant Biol. 2013. V. 15. P. 426. https://doi.org/10.1111/plb.12014
Singh P., Sinha A.K. A Positive feedback loop governed by SUB1A1 Interaction with MITOGEN-ACTIVATED PROTEIN KINASE3 imparts submergence tolerance in rice // Plant Cell. 2016. V. 28. P. 1127. https://doi.org/10.1105/tpc.15.01001
Taylor N.L., Howell K.A., Heazlewood J.L., Tan T.Y.W., Narsai R., Huang S., Whelan J., Millar A.H. Analysis of the rice mitochondrial carrier family reveals anaerobic accumulation of a basic amino acid carrier involved in arginine metabolism during seed germination // Plant Physiol.2010. V. 154. P. 691. https://doi.org/10.1104/pp.110.162214
Tsai K.J., Chou S.J., Shih M.C. Ethylene plays an essential role in the recovery of Arabidopsis during post-anaerobiosis reoxygenation // Plant Cell Environ. 2014. V. 37. P. 2391. https://doi.org/10.1111/pce.12292
Nakano T., Suzuki K., Fujimura T., Shinshi H. Genome-wide analysis of the ERF gene family // Plant Physiol. 2006. V. 140. P. 411. https://doi.org/10.1104/pp.105.073783.currently
Alpuerto J., Hussain R.M.F., Fukao T. The key regulator of submergence tolerance, SUB1A, Promotes photosynthetic and metabolic recovery from submergence damage in rice leaves // Plant Cell Environ. 2016. V. 39. P. 672.
Pompeiano A., Huarancca Reyes T., Moles T.M., Villani M., Volterrani M., Guglielminetti L., Scartazza A. Inter- and intraspecific variability in physiological traits and post-anoxia recovery of photosynthetic efficiency in grasses under oxygen deprivation // Physiol. Plant. 2017. V. 161. P. 385. https://doi.org/10.1111/ppl.12608
Salavati A., Khatoon A., Nanjo Y., Komatsu S. Analysis of proteomic changes in roots of soybean seedlings during recovery after flooding // J. Proteomics. 2012. V. 75. P. 878. https://doi.org/10.1016/j.jprot.2011.10.002
Branco-Price C., Kaiser K.A., Jang C.J.H., Larive C.K., Bailey-Serres J. Selective mRNA translation coordinates energetic and metabolic adjustments to cellular oxygen deprivation and reoxygenation in Arabidopsis thaliana // Plant J. 2008. V. 56. P. 743. https://doi.org/10.1111/j.1365-313X.2008.03642.x
Millar A.H., Trend A.E., Heazlewood J.L. Changes in the mitochondrial proteome during the anoxia to air transition in rice focus around cytochrome-containing respiratory complexes // J. Biol. Chem. 2004. V. 279. P. 39471. https://doi.org/10.1074/jbc.M406015200
Shingaki-Wells R.N., Huang S., Taylor N.L., Carroll A.J., Zhou W., Millar A.H. Differential molecular responses of rice and wheat coleoptiles to anoxia reveal novel metabolic adaptations in amino acid metabolism for tissue tolerance // Plant Physiol. 2011. V. 156. P. 1706. https://doi.org/10.1104/pp.111.175570
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


