Физиология растений, 2020, T. 67, № 2, стр. 168-176
Накопление никеля исключателем Thlaspi arvense и гипераккумулятором Noccaea caerulescens при кратковременной и длительной инкубации
А. Д. Кожевникова a, *, И. В. Серегин a, Х. Схат b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Свободный Университет
Амстердам, Нидерланды
* E-mail: urtica8127@yandex.ru
Поступила в редакцию 22.03.2019
После доработки 09.06.2019
Принята к публикации 19.06.2019
Аннотация
В работе проведен сравнительный анализ способности к накоплению никеля (Ni) гипераккумулятором Noccaea сaerulescens F.K. Mey и исключателем Thlaspi arvense L. при кратковременной (1, 2 или 3 сут) и длительной (8 нед.) инкубации. Растения T. arvense и четырех экотипов N. сaerulescens (La Calamine (LC), Saint Félix de Palliéres (SF), Monte Prinzera (MP), Lellingen (LE) выращивали на 0.5 N раствора Хогланда в присутствии 25 мкМ Ni(NO3)2 (N. сaerulescens и T. arvense) и 250 мкМ Ni(NO3)2 (N. сaerulescens, а T. arvense – только 1–3 сут). Содержание металла в корнях и побегах определяли методом атомно-абсорбционной спектрофотометрии. При краткосрочной инкубации содержание Ni на единицу массы в корнях и побегах N. сaerulescens в большинстве случаев существенно не различалось. При концентрации 25 мкМ Ni в среде содержание Ni в корнях у растений экотипа LC через 2–3 сут было ниже, чем у T. arvense, а в побегах практически не различалось. У растений других экотипов N. сaerulescens в большинстве случаев содержание Ni как в корнях, так и в побегах было выше по сравнению с T. arvense. При концентрации 250 мкМ Ni различия в содержании Ni в корнях были незначительны, а содержание Ni в побегах у растений всех экотипов гипераккумулятора было существенно выше, чем у исключателя. Фактор транслокации Ni для N. сaerulescens был выше, чем для T. arvense, и был больше единицы только у растений экотипа MP. При длительной инкубации значение фактора транслокации Ni было больше единицы для растений всех экотипов N. сaerulescens и уменьшалось в ряду: MP ≈ LC > LE ≥ SF, а для T. arvense не превышало 0.3. При длительной и кратковременной инкубации способность к накоплению Ni растениями разных экотипов N. сaerulescens в целом возрастала в следующем порядке: LC < SF < LE < MP, хотя незначительные изменения наблюдались в зависимости от времени инкубации и концентрации Ni в растворе. Таким образом, существенные отличия по способности накапливать Ni между растениями разных экотипов гипераккумулятора N. сaerulescens проявляются уже в первые дни инкубации в присутствии Ni и в значительной степени не зависят ни от времени инкубации, ни от концентрации металла в растворе. Полученные данные свидетельствуют в пользу предположения о наличии конститутивной, генетически обусловленной способности растений разных экотипов N. сaerulescens накапливать Ni.
ВВЕДЕНИЕ
Одной из важных задач современной экологической физиологии растений является изучение механизмов, определяющих способность растений к избирательному накоплению металлов. По существующей в настоящее время классификации выделяют две контрастных группы растений: исключатели, у которых металлы накапливаются главным образом в корневой системе, и аккумуляторы, у которых они накапливаются преимущественно в надземных органах [1]. Среди аккумуляторов выделяют особую группу растений гипераккумуляторов. К гипераккумуляторам относят виды растений, содержание цинка (Zn) и марганца (Mn) у которых превышает 1%; содержание никеля (Ni), кобальта (Co), меди (Cu) и селена (Se) превышает 0.1%, а кадмия (Сd) и мышьяка (As) превышает 0.01% от сухой массы побегов [2]. Всего в настоящее время известно около 500 видов гипераккумуляторов, большинство из которых принадлежит к гипераккумуляторам Ni, относящимся к семействам Asteraceae, Brassicaceae, Buxaceae, Euphorbiaceae, Flacourtiaceae, Rubiaceae, Violaceae и способным накапливать в побегах более 1000 мг Ni/кг сухой массы [2–4].
Растения гипераккумуляторы сочетают в себе высокую устойчивость к одному или нескольким металлам и способность накапливать их в побегах, причем содержание металлов в побегах у этих видов часто во много раз превышает содержание металлов в корневой системе исключателей и в окружающей среде [2, 4]. Предполагается, что устойчивость к металлам и способность к гипераккумуляции находятся под независимым генетическим контролем [3, 5, 6] и гены, определяющие способность к гипераккумуляции и устойчивость, не являются видоспецифичными, а скорее по-разному экспрессируются у гипераккумуляторов и исключателей [3, 7].
Способность к накоплению металлов в побегах растений неоднократно возникала в процессе эволюции не только в разных семействах покрытосеменных растений [8], но и у разных триб и родов внутри одного семейства. Так, например, в семействе Brassicaceae, которое наиболее богато видами гипераккумуляторами, способность к накоплению Ni возникала, по крайней мере, шесть раз, а способность к гипераккумуляции Zn – по крайней мере, трижды [4]. К этому семейству относится гипераккумулятор Noccaea сaerulescens (ранее Thlaspi caerulescens), который рассматривается в качестве модельного объекта при изучении феномена гипераккумуляции [6, 9–11] и широко используется при изучении физиологических, генетических, экологических и эволюционных аспектов этого явления [3, 4, 7]. Несмотря на монофилетическое происхождение всех представителей секции Noccaea [10], способность разных видов гипераккумуляторов из этого рода накапливать Ni, Zn и Cd может существенно различаться, с чем во многом может быть связана различная их устойчивость к металлам [4, 12]. Noccaea goesingensis является гипераккумулятором Ni, Noccaea praecox – гипераккумулятором Zn, а Noccaea сaerulescens способна накапливать три металла: Ni, Zn и Cd, что является редким случаем у видов металлофитной флоры [3, 4].
Не только разные виды гипераккумуляторов, но и различные экотипы одного и того же гипераккумулятора могут существенно различаться по способности накапливать металлы и по устойчивости к их токсическому действию [6, 13–19]. Учитывая, что экотипы принадлежат к одному и тому же виду, важно понять причины, определяющие их разную устойчивость и способность к накоплению металлов. Во многом подобные различия могут быть связаны с эволюцией разных популяций одного вида гипераккумулятора на разных типах почв [20]. Наибольшее содержание Cd и Zn в естественных условиях часто наблюдается у популяций с каламиновых почв, богатых Zn, Cd и Pb, а Ni – у популяций с серпентиновых почв, богатых Ni, Со и Cr [6]. Ранее нами в экспериментах на гидропонике показано, что растения N. caerulescens экотипа Lellingen (LЕ) c неметаллоносных почв накапливали больше Zn, но были менее устойчивы по сравнению с растениями экотипов Saint Félix de Palliéres (SF) и La Calamine (LC), произрастающими на каламиновых почвах. В то же время растения экотипа Monte Prinzera (MP) с серпентиновых почв отличались не только значительно большей устойчивостью к Ni по сравнению с другими изученными экотипами, но и наибольшим его накоплением [18]. Растения экотипа LС, как и в случае Ni и Zn, накапливали меньше Cd и, возможно, отчасти, поэтому были более устойчивы к нему по сравнению с другими экотипами. Растения экотипа SF, также произрастающие на каламиновых почвах, отличались не только высокой устойчивостью к Cd, но и наибольшим его накоплением что, вероятно, связано с более эффективными механизмами детоксикации Cd [19]. Полученные результаты свидетельствуют о существовании различий в механизмах и причинах устойчивости к металлам у растений разных экотипов N. caerulescens, а высокая корреляция между содержанием Ni и Zn у растений N. сaerulescens [6, 21] подтверждает гипотезу о неспецифичности путей поступления этих металлов в растение.
В опубликованных ранее многочисленных работах, обобщенных в обзорах [2–4, 7, 12, 22–24], анализ содержания металлов обычно проводили либо у растений, произрастающих в естественных условиях обитания, либо у растений, выращенных в лабораторных условиях после длительной инкубации в присутствии солей металлов. Несмотря на достаточно большой объем полученных разными авторами данных, остается неясным, во-первых, насколько быстро гипераккумуляторы могут накапливать металлы и, во-вторых, сохраняются ли различия между экотипами при краткосрочной и длительной инкубации растений в присутствии металлов. Решение этих вопросов необходимо для подтверждения гипотезы о конститутивной способности растений различных экотипов одного вида гипераккумулятора накапливать отдельные металлы. Поэтому основной задачей настоящей работы являлся сравнительный анализ способности к накоплению Ni растениями различных экотипов гипераккумулятора N. сaerulescens и исключателем Thlaspi arvense – широко распространенным рудеральным видом из семейства Brassicaceae – при краткосрочной и длительной инкубации растений в присутствии разных концентраций соли Ni (25 и 250 мкМ).
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений. Семена гипераккумулятора Noccaea сaerulescens F.K. Mey (ранее Thlaspi caerulescens J. & C. Presl) экотипов La Calamine (LC, Бельгия) и Saint Félix de Palliéres (SF, Франция) были собраны с растений, произрастающих на богатых Zn, Cd и Pb каламиновых почвах, экотипа Monte Prinzera (MP, Италия) − с растений, произрастающих на богатых Ni, Со и Cr серпентиновых почвах, а экотипа Lellingen (LE, Люксембург) − с растений, произрастающих на неметаллоносных почвах. Семена гипераккумулятора Noccaea сaerulescens F.K. Mey и исключателя Thlaspi arvense L. проращивали в чашках Петри на смоченной водопроводной водой фильтровальной бумаге в течение двух недель при температуре 20°С в темном термостате. Проростки пересаживали в вегетационные сосуды объемом 1 л (по 4 проростка на сосуд) на 0.5 N раствора Хогланда и выращивали в течение 8 нед. в климатической камере (23/18°C день/ночь, 14-часовой световой день). В качестве среды Хогланда использовали следующие концентрации солей: KNO3 (3 мМ); Ca(NO3)2 (2 мМ); NH4HPO4 (1 мМ); MgSO4 (0.5 мМ); KCl (1 мкМ); H3BO3 (25 мкМ); ZnSO4 (2 мкМ); MnSO4 (2 мкМ); CuSO4 (0.1 мкМ); (NH4)6Mo7O24 (0.1 мкМ); Fe(Na)ЕДТА (20 мкМ). Среду доводили до рН 5.25 с помощью MES (2 мМ)/КОН [18]. Питательную среду сменяли еженедельно. Растения выращивали в присутствии 25 мкМ Ni(NO3)2 (N. сaerulescens и T. arvense) и 250 мкМ Ni(NO3)2 (N. сaerulescens) в течение 8 нед. Контрольные растения выращивали на 0.5 N среды Хогланда в отсутствие Ni. Часть контрольных растений N. caerulescens и T. arvense на 8 нед. выращивания переносили на 0.5 N среды Хогланда с добавлением Ni(NO3)2 в концентрациях 25 или 250 мкМ и инкубировали в течение 1, 2 или 3 суток. Концентрации соли Ni были подобраны в предыдущих экспериментах при выращивании растений в аналогичных условиях [18].
Определение содержания никеля. Содержание Ni определяли в корнях, черешках листьев и в листовых пластинках. Перед проведением анализа корни последовательно отмывали 20 мМ ЭДТА в течение 10 мин при комнатной температуре, а затем дистиллированной водой. Растительный материал собирали после 8 недель инкубации растений, высушивали в сушильном шкафу до постоянного веса при 80°С в течение 24 ч и затем взвешивали. Высушенные до постоянного веса образцы подвергали мокрому озолению при 140°С в течение 7 ч в тефлоновых бомбах, добавив к образцам смесь 65% HNO3 и 37% HCl в соотношении 4 : 1. Количественный анализ проводили по стандартной методике на атомно-абсорбционном спектрофотометре Perkin Elmer 1100В (Perkin Elmer, Нидерланды). Анализ проведен в трех независимых аналитических повторностях. На основании полученных данных был вычислен фактор транслокации – отношение содержания Ni в побегах к его содержанию в корнях.
Статистическая обработка данных. Эксперименты были проведены в трех независимых повторностях. Каждая повторность включала три растения на вариант. Количественные данные были обработаны с помощью однофакторного дисперсионного анализа. Данные представлены как средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
К концу эксперимента во всех вариантах опыта растения имели развитую розетку листьев. Признаков хлороза и некроза не наблюдалось.
При краткосрочной инкубации содержание Ni на единицу массы в корнях и побегах N. сaerulescens в большинстве случаев существенно не различалось (рис. 1а–1в, 2а–2в), а у растений экотипа LE через 2–3 сут инкубации при 25 мкМ Ni(NO3)2 (рис. 1б, 1в) и у растений экотипов SF и LC через 1–2 сут инкубации при 250 мкМ Ni(NO3)2 (рис. 2a, 2б) оно было даже выше в корнях, чем в побегах.
Рис. 1.
Содержание Ni (мг/кг сухой массы) в корнях (1), черешках листьев (2) и листовых пластинках (3) исключателя Thlaspi arvense (Т.а.) и четырех экотипов гипераккумулятора Noccaea сaerulescens (N.c.) (MP, LE, SF, LC) после 1 (а), 2 (б), 3 (в) сут и 8 нед. (г) инкубации на 0.5 N раствора Хогланда с добавлением Ni(NO3)2 в концентрации 25 мкМ. Достоверно различающиеся между собой значения содержания Ni при P < 0.05 обозначены разными буквами (однофакторный дисперсионный анализ). Анализ проведен отдельно для корней, черешков листьев и листовых пластинок. Статистически достоверные различия между содержанием Ni в корнях и листьях показаны звездочками: * при P < 0.05; ** при P < 0.01; *** при P < 0.001 (однофакторный дисперсионный анализ).

Рис. 2.
Содержание Ni (мг/кг сухой массы) в корнях (1), черешках листьев (2) и листовых пластинках (3) исключателя Thlaspi arvense (Т.а.) и четырех экотипов гипераккумулятора Noccaea сaerulescens (N.c.) (MP, LE, SF, LC) после 1 (а), 2 (б), 3 (в) сут и 8 нед. (N. сaerulescens) (г) инкубации на 0.5 N раствора Хогланда с добавлением Ni(NO3)2 в концентрации 250 мкМ. Достоверно различающиеся между собой значения содержания Ni при P < 0.05 обозначены разными буквами (однофакторный дисперсионный анализ). Анализ проведен отдельно для корней, черешков листьев и листовых пластинок. Статистически достоверные различия между содержанием Ni в корнях и листьях показаны звездочками: * при P < 0.05; ** при P < 0.01; *** при P < 0.001 (однофакторный дисперсионный анализ).
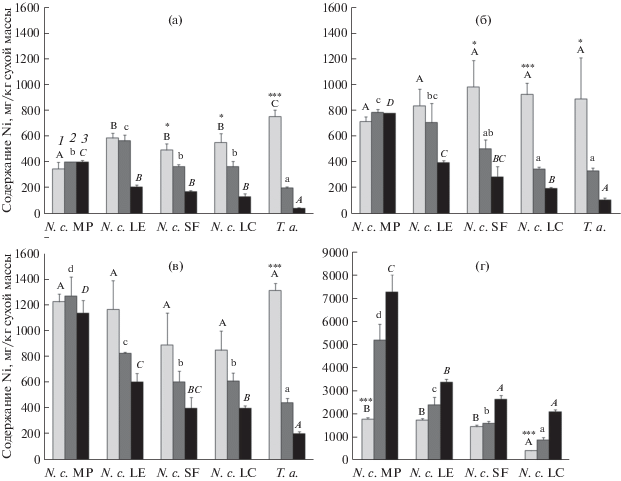
При низкой концентрации Ni в среде содержание металла в корнях растений экотипа LC через 2–3 сут было ниже, чем у исключателя T. arvense, а содержание Ni в побегах этих растений практически не различалось (рис. 1б–1в). В то же время у растений других изученных экотипов содержание металла как в корнях, так и в побегах было существенно выше по сравнению с T. arvense (рис. 1а–1в), за исключением растений экотипа SF, у которого содержание Ni в корнях на 2–3 сут инкубации практически не отличалось от содержания металла в корнях T. arvense. При высокой концентрации различия в содержании Ni в корнях были незначительны, в то время как содержание Ni в побегах у растений всех экотипов гипераккумулятора было существенно выше, чем у исключателя (рис. 2а–2в). Содержание Ni на единицу массы в листовых пластинках в большинстве случаев было ниже, чем в черешках, однако достоверных различий не было обнаружено у растений экотипа MP через 1–3 сут инкубации при обеих концентрациях Ni (рис. 1а–1в, 2а–2в), а также у растений LC на 3 сут и растений SF на 2–3 сут инкубации в присутствии 25 мкМ Ni(NO3)2 (рис. 1б, 1в). При длительной инкубации содержание Ni в листовых пластинках N. сaerulescens было выше, чем в черешках и корнях (рис. 1г, 2г).
При обеих концентрациях (25 и 250 мкМ Ni(NO3)2) к 3 сут инкубации у исключателя и гипераккумулятора наблюдалось увеличение содержания Ni как в корнях, так и в побегах по сравнению с 1 сутками инкубации (рис. 1а–1в, 2а–2в). Исключением являются растения экотипа LC, у которых при концентрации 25 мкМ Ni(NO3)2 содержание металла на единицу массы в корнях и черешках практически не изменялось, а в листовых пластинках увеличивалось (рис. 1а–1в).
Фактор транслокации, то есть отношение содержания Ni в побегах к его содержанию в корнях, при кратковременной инкубации был достоверно больше единицы только у растений N. сaerulescens экотипа MP, в природе произрастающих на серпентиновых почвах, богатых Ni (рис. 3). Для растений N. сaerulescens остальных экотипов, произрастающих как на каламиновых почвах, богатых Zn, Cd и Pb (SF и LC), так и на неметаллоносных почвах (LE), фактор транслокации Ni был ниже единицы, но был выше, чем у исключателя T. arvense, за исключением растений SF и LC на 2 сут инкубации при 250 мкМ Ni(NO3)2. При длительной инкубации значения фактора транслокации Ni существенно возрастали для растений всех экотипов и, в особенности, для экотипа LC. Через 8 нед. инкубации фактор транслокации Ni был больше единицы для растений всех изученных экотипов N. сaerulescens и уменьшался в ряду: MP ≈ LC > LE ≥ SF. Наименьшие значения фактора транслокации во всех вариантах эксперимента были характерны для исключателя T. arvense (рис. 3).
Рис. 3.
Отношение содержания Ni в побегах к его содержанию в корнях (фактор транслокации) у исключателя Thlaspi arvense (Т.а.) и четырех экотипов гипераккумулятора Noccaea сaerulescens (N.c.) (MP, LE, SF, LC) после 1 (1), 2 (2), 3 (3) суток и 8 нед. (4) инкубации на 0.5 N раствора Хогланда с добавлением Ni(NO3)2 в концентрациях 25 (а) и 250 (б) мкМ. В присутствии 250 мкМ Ni(NO3)2 в течение 8 нед. выращивали только растения гипераккумулятора N. сaerulescens, так как для исключателя Ni в данной концентрации при длительной инкубации оказывал токсическое действие. Достоверно различающиеся между собой значения фактора транслокации при P < 0.05 обозначены разными буквами (однофакторный дисперсионный анализ). Анализ проведен отдельно для каждой временной точки.

Полученные данные свидетельствуют о существовании значительных различий в скорости и способности к накоплению Ni уже в первые дни инкубации не только между исключателем и гипераккумулятором, но и между растениями разных экотипов одного вида гипераккумулятора. Как при краткосрочной, так и при длительной инкубации наибольшее содержание Ni наблюдали у растений экотипа MP (рис. 1, 2). Уже через 3 сут при 250 мкМ Ni(NO3)2 содержание металла в побегах и корнях растений этого экотипа превышало 1000 мг/кг сухой массы (рис. 2в). У растений экотипа МР наблюдалось также наиболее значительное увеличение накопления металла со временем при краткосрочной инкубации (рис. 1а–1в, 2а–2в). Для растений N. сaerulescens разных экотипов в целом способность к накоплению Ni возрастала в следующем порядке: LC < SF < LE < MP, хотя, как следует из данных статистического анализа, незначительные изменения могут наблюдаться в зависимости от времени инкубации и концентрации Ni в растворе (рис. 1, 2).
ОБСУЖДЕНИЕ
Результаты наших исследований, полученные в этой и других работах [15, 16, 18, 19], а также данные других авторов [6, 13, 14, 17] ясно свидетельствуют, что не только исключатели и гипераккумуляторы, но и растения разных экотипов одного вида гипераккумулятора могут существенно различаться по способности накапливать металлы. Растения всех экотипов N. сaerulescens способны накапливать Zn, тогда как к гипераккумуляции Ni способны в большей степени растения экотипов, эволюция которых проходила на серпентиновых почвах, богатых Ni, Со и Cr [6, 18, 25]. Содержание Ni у растений экотипа MP, в природе произрастающего на серпентиновых почвах, было существенно выше, чем у растений экотипов SF и LC, произрастающих на каламиновых почвах, богатых Zn, Cd и Pb (рис. 1, 2). Полученные данные подтверждают гипотезу о том, что способность растений разных экотипов накапливать отдельные металлы сформировалась в процессе длительной эволюции на определенном типе почв [20] и зависит от количества доступного металла в почве [6]. Кроме того, MP является единственным из изученных нами экотипов, у которого наблюдается стимуляция роста при невысокой концентрации Ni [18]. Именно со стимуляцией роста при низкой концентрации Ni в растворе может быть связано уменьшение содержания Ni в расчете на единицу сухой массы у растений экотипа МР при длительной инкубации по сравнению с кратковременной.
Содержание Ni у растений экотипа LE с неметаллоносных почв было часто ниже, чем у растений экотипа МP, но выше, чем у растений экотипов LC и SF с каламиновых почв. Однако через 8 нед. инкубации при низких концентрациях Ni в среде, его содержание у представителей популяции с неметаллоносных почв было даже незначительно выше, чем у растений с каламиновых или серпентиновых почв (рис. 1, 2). Несмотря на способность растений с неметаллоносных почв накапливать Ni при низких концентрациях металла в среде, устойчивость к токсическому действию Ni у них ниже, что подтверждается и более ранними наблюдениями [6, 18].
Содержание металла в растениях, выращенных на гидропонике, может быть выше, чем у растений, произрастающих в естественных условиях, даже при одинаковом количестве доступного металла. Например, растения N. сaerulescens с каламиновых и неметаллоносных почв, выращенные на гидропонике, накапливали сходные количества Zn, но содержание в них металла было в три раза больше, чем в растениях, произрастающих в почве [6]. Это определяется гетерогенностью почвы, неравномерным распределением металла по почвенному профилю, а также иным соотношением макро- и микроэлементов. В то же время при сходном содержании Zn в побегах N. сaerulescens, распределение металла по тканям было одинаковым, что дает возможность экстраполировать полученные в лаборатории данные на растения из природных популяций [26]. Поэтому правомерно сравнивать только данные по накоплению металлов, полученные в идентичных условиях. Вследствие этого сравнивать данные разных авторов бывает затруднительно. В наших экспериментах способность к накоплению Ni у растений разных экотипов N. сaerulescens возрастала в следующем ряду: LC < SF < LE < MP (рис. 1, 2), что в целом согласуется с данными, полученными в идентичных условиях ранее при длительной инкубации растений в присутствии Ni при других концентрациях Ni(NO3)2 в растворе [18]. Сходство полученных рядов при разных концентрациях металла в растворе свидетельствует о слабой зависимости способности растений разных экотипов накапливать Ni от концентрации металла в растворе. Однако при высоких концентрациях этот порядок может меняться из-за токсического действия металла.
Значения фактора транслокации у растений экотипа МР превышало единицу уже через сутки после начала инкубации, тогда как у растений остальных экотипов этого не наблюдалось и через 3 сут инкубации (рис. 3). Учитывая, что фактор транслокации показывает отношение содержания металла в побегах к его содержанию в корнях, можно заключить, что растения экотипа с серпентиновых почв обладает высокой эффективностью транспортных систем, определяющих эффективное поступление Ni в надземные органы растения уже в первые часы инкубации. У растений других экотипов эта способность реализуется позже во времени и к 8 нед. растения всех экотипов гипераккумулятора N. сaerulescens имеют фактор транслокации больше единицы (рис. 3). В этой связи представляют интерес растения экотипа LC с каламиновых почв. У растений этого экотипа практически не наблюдалось накопления Ni в течение первых суток инкубации (рис. 1), что свидетельствует о низкой скорости поглощения металла, тогда как через 8 нед. инкубации значения фактора транслокации у LC и МР практически не различались (рис. 3). Причины этого явления пока не ясны. Однако очевидно, что значения фактора транслокации не только различаются для растений разных экотипов, но и могут меняться со временем и в зависимости от концентрации металла в растворе, что подтверждается данными других исследователей [17]. Исключатели имеют значительно более низкие значения фактора транслокации за счет более эффективных механизмов связывания и детоксикации металла в корнях, главным образом в результате накопления Ni в вакуолях клеток коры корня [15, 22].
Физиологические механизмы, определяющие феномен гипераккумуляции и обеспечивающие различную способность растений разных видов и экотипов накапливать металлы, в настоящее время активно изучаются. Однако, по сравнению с Zn и Cd, механизмы, участвующие в поглощении и транспорте Ni, остаются малоизученными. Известно, что гипераккумуляторы характеризуются: 1) более эффективным поглощением ионов металлов; 2) большей мобильностью металлов по тканям корня в результате менее эффективного, по сравнению с исключателями, транспорта металлов в вакуоли клеток корня; 3) повышенной скоростью загрузки металлов в ксилему и 4) эффективными механизмами детоксикации металлов в вакуолях клеток надземных органов, что в совокупности направлено на поддержание гомеостаза [22].
Сравнительный анализ способности растений разных экотипов N. сaerulescens накапливать Ni и Zn выявил сходные закономерности [18]. Универсальность выявленных для разных металлов закономерностей свидетельствует в пользу существования неспецифических путей поступления и транспорта металлов у растений. Предполагается, что транспорт Ni у N. сaerulescens может осуществляться с помощью неспецифических транспортеров Zn или Fe, причем транспортеры Zn обеспечивают более эффективное поступление Ni в клетку, чем транспортеры Fe [11], чем может определяться высокая корреляция между накоплением Ni и Zn у растений N. сaerulescens [6, 21]. Уровень экспрессии генов ZIP 10 и IRT1, кодирующих белки, участвующие в транспорте Zn и Fe, соответственно, существенно возрастал при действии Ni, что, наряду с увеличением поступления Ni при дефиците Zn и Fe, также подтверждает высказанную точку зрения о существовании неспецифических механизмов поступления и транспорта металлов [11].
Выявленные между экотипами различия по способности накапливать Ni могут быть следствием разного уровня экспрессии генов, кодирующих транспортеры металлов [4]. Повышенный уровень экспрессии генов ZNT1 и ZNT2, кодирующих транспортеры, расположенные на плазматической мембране и участвующие в поступлении Ni в клетки листа, наблюдался у растений экотипа MP, растущих как в природной популяции, так и на гидропонике, что может определять их способность накапливать Ni [17]. Уровень экспрессии гена ZTP1, который кодирует транспортер, участвующий в транспорте Zn из цитоплазмы в люмен органелл или из клетки и относящийся к СDF семейству, был, напротив, выше у растений экотипов N. сaerulescens с каламиновых почв по сравнению с экотипами с серпентиновых почв [13], с чем, возможно, связано различное накопление Zn у этих растений.
Важную роль в транспорте металлов играют органические хелаторы: гистидин (для Ni, Zn) и никотианамин (для Ni, Zn) [7, 15, 16, 23]. Как показали наши исследования, предобработка гистидином стимулировала загрузку Ni и Zn в ксилему только у гипераккумулятора N. caerulescens, но не у исключателя T. arvense. Более высокая скорость загрузки Ni и Zn в сосуды ксилемы N. caerulescens связана с более высоким эндогенным содержанием свободного гистидина в корнях N. caerulescens по сравнению с T. arvense [15, 16]. Конститутивно повышенное содержание гистидина в корнях и менее эффективный транспорт комплексов Ni и Zn с гистидином в вакуоли клеток корня у N. caerulescens по сравнению с исключателем T. arvense позволяет предположить, что образование комплексов Ni и Zn с гистидином предотвращает их поступление в вакуоли клеток корня N. caerulescens и обеспечивает более эффективную загрузку металлов в сосуды ксилемы [15, 16]. Несмотря на существенные различия в способности накапливать металлы и по устойчивости к ним, растения разных экотипов N. caerulescens существенно не различались по эндогенному содержанию гистидина в корнях и побегах [15]. Поэтому повышенный эндогенный уровень гистидина в корнях связан с механизмами, определяющими феномен гипераккумуляции, но не объясняет различий в устойчивости и способности к накоплению металлов, выявленные у растений разных экотипов одного вида гипераккумулятора.
В загрузке Zn и Cd в ксилему участвует АТФаза P-типа НМА4, локализованная на плазмалемме, высокий уровень экспрессии генов которой достигается за счет увеличения числа их копий у гипераккумуляторов [4, 5, 27, 28]. Число копий одного и того же гена может различаться не только у разных видов [5, 29], но и у разных экотипов одного и того же вида [30]. Уровень экспрессии гена NcHMA4 у растений экотипа Puente Basadre (PB) гипераккумулятора N. caerulescens, произрастающего на богатых Ni серпентиновых почвах, был ниже по сравнению с экотипами Prayon (Pr), SF и Saint Laurent le Minier (SLM) (ранее Ganges), произрастающими на богатых Zn каламиновых почвах. Это коррелирует с наличием четырех копий гена NcHMA4 у растений экотипов SLM и SF, трех копий у растений экотипа Pr и только двух копий – у растений экотипа PB [30]. Кроме того, у растений экотипа LC, произрастающего на каламиновых почвах, при действии Ni уровень экспрессии гена HMA4 был выше, чем у растений экотипа MP с серпентиновых почв [17]. Однако при сходном уровне экспрессии генов НМА4 способность к накоплению Zn и Cd растениями отдельных экотипов N. caerulescens может различаться. Поэтому высокий уровень экспрессии генов, кодирующих транспортеры металлов, не является единственной причиной, определяющей способность к гипераккумуляции. Механизм загрузки Ni или комплексов Ni в ксилему еще предстоит выяснить. Однако, очевидно, что мультипликация генов, кодирующих транспортеры металлов – важнейший микроэволюционный процесс, определяющий феномен гипераккумуляции.
Способность к накоплению металлов растениями различных экотипов гипераккумулятора N. сaerulescens проявлялась начиная с первых суток инкубации и практически не менялась со временем. Это подтверждает точку зрения, что представители разных экотипов обладают конститутивной, генетически обусловленной способностью накапливать металлы, которая и реализуется через очень короткий промежуток времени. Именно эта способность позволяет растениям с серпентиновых почв накопить более 1000 мг/кг сухой массы уже на 3 сут инкубации (рис. 1в, 2в). Однако, по-видимому, это не исключает существования и индуцибельных механизмов. Подтверждением этого является изменение уровня экспрессии ряда генов при действии Ni [17]. Так, например, у контрольных растений экотипов LC и MP найдена высокая конститутивная экспрессия генов NRAMP3, NRAMP4, кодирующих вакуолярные транспортеры, а также НМА4, а уровень экспрессии ZNT1 и ZNT2 был выше у LC по сравнению с МР. При действии 10 мкМ Ni в течение месяца у MP наблюдалась индукция экспрессии генов ZNT1, ZNT2 и NRAMP 4, а у LC – только НМА4 [17]. Однако насколько быстро могут происходить эти изменения и могут ли они проявляться через сутки после начала инкубации, играя заметную роль в накоплении металлов, остается неизвестным. Можно полагать, что при кратковременной инкубации ведущий вклад вносят имеющиеся у растений гипераккумуляторов конститутивные механизмы, определяющие феномен гипераккумуляции.
Таким образом, растения разных экотипов гипераккумулятора N. сaerulescens существенно отличаются между собой по способности накапливать Ni, причем эти отличия проявляются уже в первые дни инкубации в присутствии Ni и в значительной степени не зависят ни от времени инкубации, ни от концентрации металла в растворе. Однако, несмотря на очевидный прогресс в данной области науки, мы еще очень мало знаем о механизмах, определяющих избирательное накопление металлов в корнях исключателей и побегах гипераккумуляторов, а также различную способность растений разных экотипов одного вида накапливать металлы. Данное направление исследований активно развивается в современной иономике и экологической физиологии растений и является перспективным направлением будущих исследований.
Авторы выражают глубокую благодарность В.Б. Иванову за критическое обсуждение полученных результатов.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (№ 19-04-00369), а также Международной научной программы LOCOMET.
Авторы Кожевникова А.Д. и Серегин И.В. внесли одинаковый вклад в эту работу.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Brooks R.R., Lee J., Reeves R.D., Jaffré T. Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants // J. Geochem. Explor. 1977. V. 7. P. 49.
Reeves R.D., Baker A.J.M. Metal-accumulating plants // Phytoremediation of Toxic Metals Using Plants to Clean Up the Environment / Ed. Raskin I., Ensley B.D. John Wiley & Sons, Inc. 2000. P. 193.
Verbruggen N., Hermans C., Schat H. Molecular mechanisms of metal hyperaccumulation in plants // New Phytol. 2009. V. 181. P. 759.
Krämer U. Metal hyperaccumulation in plants // Ann. Rev. Plant Biol. 2010. V. 61. P. 517.
Hanikenne M., Talke I.N., Haydon M.J., Lanz C., Nolte A., Motte P., Kroymann J., Weigel D., Krämer U. Evolution of metal hyperaccumulation required Cis-regulatory changes and triplication of HMA4 // Nature. 2008. V. 453. P. 391.
Sterckeman T., Cazes Y., Gonneau C., Sirguey C. Phenotyping 60 populations of Noccaea caerulescens provides a broader knowledge of variation in traits of interest for phytoextraction // Plant Soil. 2017. V. 418. P. 523.
Lin Y.-F., Aarts M.G.M. The molecular mechanism of zinc and cadmium stress response in plants // Cell. Mol. Life Sci. 2012. V. 69. P. 3187.
Ernst W.H.O. Evolution of metal hyperaccumulation and phytoremediation hype // New Phytol. 2000. V. 146. P. 357.
Assunção A.G.L., Schat H., Aarts M.G.M. Thlaspi caerulescens, an attractive model species to study heavy metal hyperaccumulation in plants // New Phytol. 2003. V. 159. P. 351.
Macnair M.R. The hyperaccumulation of metals by plants // Advances in Botanical Research. 2003. V. 40. P. 63.
Deng T.H.B., Tang Y.T., Sterckeman T., Echevarria G., Morel J.L., Qiu R.L. Effects of the interactions between nickel and other trace metals on their accumulation in the hyperaccumulator Noccaea caerulescens // Environ. Exp. Bot. 2019. V. 158. P. 73.
Sinclair S.A., Krämer U. The zinc homeostasis network of land plants // Bioch. Bioph. Acta. 2012. V. 1823. P. 1553.
Assunção A.G.L., da Costa Martins P., de Folter S., Voojis R., Schat H., Aarts M.G.M. Elevated expression of metal transporter genes in three accessions of the metal hyperaccumulator Thlaspi caerulescens // Plant, Cell Environ. 2001. V. 24. P. 217.
Meharg A.A. Mechanisms of plant resistance to metal and metalloid ions and potential biotechnological applications // Plant Soil. 2005. V. 274. P. 163.
Richau K.H., Kozhevnikova A.D., Seregin I.V., Vooijs R., Koevoets P.L.M., Smith J.A.C., Ivanov V.B., Schat H. Chelation by histidine inhibits the vacuolar sequestration of nickel in roots of the hyperaccumulator, Thlaspi caerulescens // New Phytol. 2009. V. 183. P. 106.
Kozhevnikova A.D., Seregin I.V., Erlikh N.T., Shevyreva T.A., Andreev I.M., Verweij R., Schat H. Histidine-mediated xylem loading of zinc is a species-wide character in Noccaea caerulescens // New Phytol. 2014. V. 203. P. 508.
Visioli G., Gullì M., Marmiroli N. Noccaea caerulescens populations adapted to grow in metalliferous and non-metalliferous soils: Ni tolerance, accumulation and expression analysis of genes involved in metal homeostasis // Environ. Exp. Bot. 2014. V. 105. P. 10.
Серегин И.В., Эрлих Н.Т., Кожевникова А.Д. Устойчивость и способность к накоплению никеля и цинка исключателя Thlaspi arvense и гипераккумулятора Noccaea caerulescens // Физиология растений. 2014. Т. 61. С. 224.
Серегин И.В., Кожевникова А.Д., Жуковская Н.В., Схат Х. Устойчивость и накопление кадмия исключателем Thlaspi arvense и различными экотипами гипераккумулятора Noccaea caerulescens // Физиология растений. 2015. Т. 62. С. 854.
Callahan D.L., Baker A.J., Kolev S.D., Wedd A.G. Metal ion ligands in hyperaccumulating plants // J. Biol. Inorg. Chem. 2006. V. 11. P. 2.
Richau K.H., Schat H. Intraspecific variation of nickel and zinc accumulation and tolerance in the hyperaccumulator Thlaspi caerulescens // Plant Soil. 2009. V. 314. P. 253.
Серегин И.В., Кожевникова А.Д. Физиологическая роль никеля и его токсическое действие на высшие растения // Физиология растений. 2006. Т. 53. С. 285.
Leitenmaier B., Küpper H. Compartmentation and complexation of metals in hyperaccumulator plants // Front Plant Sci. 2013. V. 4. P. 1.
Deng T.H.B., van der Ent A., Tang Y.T., Sterckeman T., Echevarria G., Morel J.L., Qiu R.L. Nickel hyperaccumulation mechanisms: a review on the current state of knowledge // Plant Soil. 2018. V. 423. P. 1.
Lombi E., Zhao F.J., Dunham S.J., McGrath S.P. Cadmium accumulation in populations of Thlaspi caerulescens and Thlaspi goesingense // New Phytol. 2000. V. 145. P. 11.
Kozhevnikova A.D., Seregin I.V., Gosti F., Schat H. Zinc accumulation and distribution over tissues in Noccaea caerulescens in nature and in hydroponics: a comparison // Plant Soil. 2017. V. 411. P. 5.
Hussain D., Haydon M.J., Wang Y., Wong E., Sherson S.M., Young J., Camakaris J., Harper J.F., Cobbett C.S. P-type ATPase heavy metal transporters with roles in essential zinc homeostasis in Arabidopsis // Plant Cell. 2004. V. 16. P. 1327.
Bernard C., Roosens N., Czernic P., Lebrun M., Verbruggen N. A novel CPx-ATPase from the cadmium hyperaccumulator Thlaspi caerulescens // FEBS Lett. 2004. V. 569. P. 140.
Drager D.B., Desbrosses-Fonrouge A.G., Krach C., Chardonnens A.N., Meyer R.C., Saumitou-Laprade P., Krämer U. Two genes encoding Arabidopsis halleri MTP1 metal transport proteins co-segregate with zinc tolerance and account for high MTP1 transcript levels // Plant J. 2004. V. 39. P. 425.
Craciun A.R., Meyer C.-L. Chen J., Roosens N., Groodt R.D., Hilson P., Verbruggen N. Variation in HMA4 gene copy number and expression among Noccaea caerulescens populations presenting different levels of Cd tolerance and accumulation // J. Exp. Bot. 2012. V. 63. P. 4179.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


