Физиология растений, 2020, T. 67, № 2, стр. 141-148
Изменение гормонального статуса и экспрессии генов лектинов в проростках пшеницы под действием стевиозида и низких положительных температур
У. А. Огороднова a, *, А. М. Ахметова a, Ф. М. Шакирова b, О. А. Тимофеева a
a Федеральное государственное автономное образовательное учреждение высшего образования
“Казанский (Приволжский) федеральный университет”
Казань, Россия
b Институт биохимии и генетики – обособленное структурное подразделение,
Уфимский федеральный исследовательский центр Российской академии наук
Уфа, Россия
* E-mail: uliana_ogo@mail.ru
Поступила в редакцию 28.03.2019
После доработки 29.05.2019
Принята к публикации 07.06.2019
Аннотация
Исследовали влияние предпосевной обработки стевиозидом (10–8 М) на активность, содержание и экспрессию генов агглютинина зародыша пшеницы (АЗП), а также содержание фитогормонов в 4‑дневных проростках пшеницы (Triticum aestivum L.) в условиях низких положительных температур. Предобработка стевиозидом вызвала существенное увеличение защитного потенциала растений в ответ на низкотемпературный стресс. Получены результаты, свидетельствующие об АБК-зависимом действии стевиозида на АЗП, несмотря на гиббереллин подобную химическую структуру исследуемого регулятора роста.
ВВЕДЕНИЕ
Получение стабильных урожаев сельскохозяйственных культур во многом зависит от грамотного использования агротехнических приемов, регуляторов роста и развития растений. Причем на сегодняшний день предпочтение все больше отдается природным веществам, проявляющим биологическую активность различных типов, но безопасным для человека и окружающей среды, и к тому же относительно недорогим.
Дитерпеноиды – одна из интересных в этом отношении групп соединений, к которым относятся природные вещества, имеющие различную химическую структуру, и чаще всего проявляющие широкий спектр биологической активности. К таким соединениям, в частности, относятся энт-кауреновые гликозиды, выделенные из растения Stevia rebaudiana. Гликозиды стевии характеризуются сладким вкусом (примерно в 300 раз слаще сахара) [1]. С 2008 года стевиозид был признан не токсичным соединением, согласно данным Food and Drug Administration (Агентство Министерства здравоохранения и социальных служб США). Благодаря этому, стевиозид получил широкое применение в пищевой и фармацевтической промышленности в качестве природного заменителя сахара. Кроме того, он имеет ряд терапевтических эффектов, выражающихся в снижении гликемического индекса, а также обладает гипотензивным, антибактериальным и другими полезными действиями [2, 3].
Известно, что общим агликоном для всех гликозидов стевии является стевиол [4]. Следует отметить, что до промежуточного продукта – каурена синтез гибберелловой кислоты и стевиола в растениях стевии происходит по одному пути [5]. Следовательно, все стевиол-гликозиды характеризуются сходством химической структуры с хорошо известными фитогормонами – гиббереллинами. Гиббереллин в растениях выполняет ряд важнейших функций. Наиболее типичные из них – увеличение роста стебля карликовых форм растений, вытягивание стебля у нормальных растений, участие в цветении растений и других не менее значимых физиологических процессов [6]. В литературе имеются данные о стимуляции агликоном стевиолом роста карликовых мутантов кукурузы, чувствительных только к гиббереллинам [7]. Отсутствие влияния изостевиола на рост мутантов кукурузы [8], вероятно, связано с особенностями его химического строения. В отличие от стевиола и гиббереллиновой кислоты (соединения энт-кауренового ряда) изостевиол имеет энт-бейерановый углеводородный каркас.
Ранее нами впервые было показано, что рострегулирующая активность различных стевиолгликозидов зависит от состава и количества углеводных остатков, связанных с агликоном. Среди всех проанализированных соединений наибольшим эффектом обладал стевиозид [8], который, наряду с активацией роста, увеличивал урожайность и устойчивость растений пшеницы к низким температурам, засухе и тяжелым металлам [9]. Вместе с тем, стевиозид не обладал всем спектром действия гиббереллинов. Было высказано предположение, что обнаруженные эффекты стевиозида могут быть опосредованы его влиянием на активность растворимых лектинов. Ранее было выявлено значительное увеличение содержания АЗП в клетках пшеницы в ответ на засоление среды, гипер- и гипотермию, при водном стрессе обнаружено усиление экспрессии гена АЗП [10–12]. В свою очередь, АЗП, участвуя в регуляции деления клеток, содержания фитогормонов и активности про- и антиоксидантных ферментов [11], может способствовать поддержанию интенсивности ростовых процессов в условиях стресса на уровне, близком к контролю.
Однако данных, касающихся влияния стевиозида на содержание, регуляцию экспрессии генов АЗП в неблагоприятных условиях внешней среды, в настоящее время нет. Вместе с тем, такие сведения могут внести существенный вклад в понимание механизма действия стевиозида. Работа посвящена выяснению роли фитогормонов и лектинов пшеницы в проявлении рострегулирующего и защитного действия ствиозида.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили корни и листья озимой пшеницы (Triticum aestivum L.) сорта Казанская 560, созданного в ГУ Татарского. Сорт среднеспелый, отличается повышенным уровнем морозо-зимостойкости, обладает высокой устойчивостью к засухе, слабо восприимчив к мучнистой росе и бурой листовой ржавчине.
Семена пшеницы замачивали в 10–8 М растворе стевиозида, выделенного из листьев стевии в ИОФХ имени А.Е. Арбузова РАН (Казань) в лаборатории фосфорных аналогов природных соединений под руководством член-корреспондента РАН В.Ф. Миронова. Используемая концентрация стевиозида была ранее экспериментально подобрана [8].
В первой серии экспериментов семена перед посевом стерилизовали 2% раствором перманганата калия (20 мин), промывали дистиллированной водой и замачивали в растворе стевиозида (10–8 М) в течение 3, 12 или 24 ч. Семена контрольных растений замачивали в воде. Затем все семена высаживали в кюветы и выращивали на воде при 23°С и 12 часовом светопериоде с интенсивностью освещения 100 Вт/м2 в течение 4 и 7 суток. Через 4 и 7 суток измеряли высоту надземной части и длину корней у 30 растений каждой группы.
Для выяснения влияния низких положительных температур на растения пшеницы семена замачивали в растворе стевиозида 24 ч, контрольный вариант замачивали в воде и затем высаживали в кюветы. 4-дневные растения помещали в низкотемпературную камеру (4°С) на 3 ч перед фиксацией материала. Часть растений на 3 сутки помещали на среду с добавлением ингибитора синтеза АБК флуридона (5 мг/л) на 24 ч. Другая часть – еще сутки росла на воде.
Корни 4-суточных проростков пшеницы использовали для выделения и определения активности лектинов, выделения РНК, а также для определения содержания фитогормонов и АЗП.
Растворимые лектины экстрагировали 0.05 н HCl, лектины клеточной стенки – смесью 0.9% NaCl и 0.05% раствора тритона Х-100. Лектиновую активность определяли по реакции гемагглютинации с эритроцитами 1 группы крови [13]. Содержание лектинов определяли методом иммуноферментного анализа (ИФА) [14].
Количество свободных ИУК, АБК и цитокининов определяли в корнях 4-дневных проростков пшеницы методом иммуноферментного анализа с использованием специфичных к зеатинрибозиду (ЗР), индолилуксусной и абсцизовой кислотам кроличьих сывороток и антикроличьих антител, меченых пероксидазой [14]. В тест-системе с антисывороткой к зеатинрибозиду, которая используется в данной работе, высокой иммунореактивностью обладают: зеатинрибозид, зеатин, зеатинриботид (нуклеотид зеатина) и 9-N-глюкозид.
Для определения относительного уровня транскриптов гена АЗП методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) в качестве референсных генов были выбраны: актин, тубулин и циклофилин [15].
Расчет уровня транскриптов целевого гена производили через сопоставление относительной величины содержания кДНК, соответствующей их транскриптам, с аналогичной величиной для референсных генов (т.е. генов стабильно экспрессирующихся в условиях эксперимента). При таком подходе уровень экспрессии референсных генов принимается за константу.
Нуклеотидные последовательности исследуемых генов искали в базе данных нуклеотидных последовательностей с использованием web-ресурсов сайта NCBI (https://www.ncbi.nlm.nih.gov/). Транскрипционную активность целевого гена оценивали с помощью подобранных на основе имеющихся последовательностей мРНК АЗП праймеров: F 5'-CCTGCCGCGCCGACATCAAGTG-3', R 5'-GCAGCCGCCGCCGCAGAAC-3' относительно референсных генов (табл. 1).
Таблица 1.
Последовательности праймеров изучаемых генов, подобранные с помощью программы VectorNTI (Invitrogen)
| Название гена | Последовательность 5'–3' | Название гена и ID |
|---|---|---|
| TaActF1 | ACCTTCAGTTGCCCAGCAAT | ACT – AB181991.1 |
| TaActR1 | TCGACCGCTGGCATACAAG | |
| TaTubF1 | AGGTCTCAGACACCGTCGTTG | Tubb4 –U76895.1 |
| TaTubR1 | ATGTGACACCGCTCATGGTAGC | |
| TaCflF1 | ACTACAAGGGCAGCTCGTTC | CYP18-2 – AY456122.1 |
| TaCflR1 | ATGAAGAACTGGGAGCCGTTGG |
Для выделения суммарной РНК из растительной ткани использовали коммерческий набор RNeasyMiniKit (“Qiagen”, Германия) согласно протоколу производителя.
Для получения кДНК использовали 6 мкг суммарной РНК. Реакцию обратной транскрипции проводили в реакционной смеси объемом 50 мкл, содержащей 50 мкМ олиго-dT18, а также 300 мкМ дезоксинуклеотидтрифосфатов, 100–200 ед обратной транскриптазы M-MuLVRevertAid (“Thermo”, США), с соответствующим буфером.
Полимеразную цепную реакцию проводили в реакционной смеси, в состав которой входили: 10-кратный буфер (335 мМ трис-HCl, рH 8.8; 83 мМ (NH4)2SO4; 12.5 мМ MgCl2; 10.5% Tween 20), по 150 мкМ каждого дезоксинуклеозидтрифосфата, 2 мкл кДНК-матрицы, 0.4 мкМ каждого праймера и флуоресцентного зонда TaqMan и 0.4 мкл фермента Hot start ДНК-полимеразы (“Евроген”, Москва). Для проведения ПЦР использовали амплификатор CFX-96 (“Bio-Rad Laboratories”, Inc., США). Стандартными параметрами стадий реакции были следующие: денатурация ДНК – 95°С, 5 секунд, присоединение праймеров, синтез новой цепи ДНК – 53°С, 20 секунд.
Отсутствие в полученных образцах кДНК геномной ДНК подтверждали экспериментально. Для этого проводили полимеразную цепную реакцию, с использованием в качестве матрицы образцов выделенной РНК.
Морозоустойчивость растений определяли по выходу электролитов [16].
В результатах представлены средние значения опытов, состоящих из трех-пяти биологических повторностей, и их стандартные отклонения. Достоверность рассчитывали по критерию Манна–Уитни.
РЕЗУЛЬТАТЫ
В результате проведенных экспериментов было установлено, что замачивание семян в стевиозиде в течение 12 и 24 ч вызывало увеличение длины надземной части проростков на 4 сутки, однако не изменяло длину корней. Увеличение срока выращивания до 7 суток показало, что предпосевная обработка стевиозидом в течение 24 ч была наиболее эффективна и увеличивала рост как побегов, так и корней (рис. 1).
Рис. 1.
Влияние предпосевной обработки стевиозидом на рост проростков пшеницы сорта Казанская-560: 0 ч – семена замачивали в воде (контроль), 3 ч – семена замачивали в растворе стевиозида 3 ч; 12 ч – семена замачивали в растворе стевиозида 12 ч; 24 ч – семена замачивали в растворе стевиозида 24 ч.
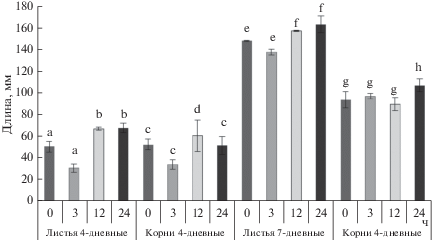
На основании этих результатов во всех последующих экспериментах стерилизованные семена пшеницы перед посадкой замачивали в течение 24 ч в растворе стевиозида (10–8 М).
Для изучения механизмов действия стевиозида в неблагоприятных условиях использовали низкотемпературный стресс (4°С, 3ч). Как видно из приведенных в табл. 2 данных, стевиозид повышал морозоустойчивость озимой пшеницы.
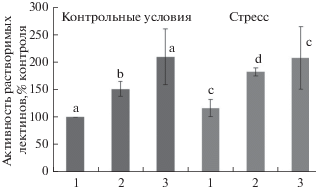
Предпосевная обработка семян стевиозидом (10–8 М) приводила к усилению активности растворимых лектинов на 50% (рис. 2). Низкие температуры в целом усиливали активность лектинов, при этом в условиях стресса эффект стевиозида проявлялся в большей степени, чем в контрольном варианте, о чем судили по повышению активности лектинов на 65%).
Рис. 2.
Активность растворимых лектинов в корнях 4‑дневных проростков озимой пшеницы при действии низкотемпературного стресса (4°С, 3 ч): 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М), 3 – растения, обработанные стевиозидом и флуридоном (5 мг/л).
В следующей серии экспериментов определяли содержание агглютинина зародыша пшеницы в корнях 4-дневных проростков пшеницы (рис. 3) и относительный уровень экспрессии генов данного лектина (рис. 4).
Рис. 3.
Влияние низкотемпературного стресса (3 ч, 4°С) на содержание агглютинина зародыша пшеницы (АЗП) в корнях 4-дневных проростков пшеницы: 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М), 3 – растения, обработанные стевиозидом и флуридоном (5 мг/л).
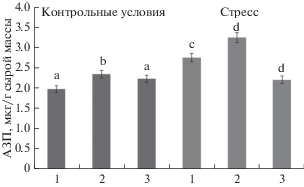
Рис. 4.
Относительное содержание транскриптов генов агглютинина зародыша пшеницы (АЗП) в корнях 4-дневных растений пшеницы при действии низкотемпературного стресса (4°С, 3 ч): 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М), 3 – растения, обработанные стевиозидом и флуридоном (5 мг/л).

Обработка стевиозидом семян в течение 24 ч привела к некоторому увеличению содержания АЗП в корнях 4-дневных проростков пшеницы относительно контрольного варианта. Кратковременный низкотемпературный стресс (4°С, 3 ч) также вызвал увеличение содержания исследуемого лектина. Причем предобработка стевиозидом инициировала еще большее накопление лектина в условиях низких положительных температур относительно контроля.
В контрольных условиях стевиозид не изменял относительный уровень мРНК гена АЗП. На фоне стресса накопление транскриптов АЗП наблюдалось только в корнях растений, предобработанных стевиозидом. Причем в неблагоприятных условиях под влиянием стевиозида происходило практически 2-кратное увеличение относительного уровня экспрессии гена АЗП (рис. 4).
Интересно отметить, что ни стевиозид, ни низкие температуры не изменяли относительный уровень транскриптов гена АЗП (рис. 4), несмотря на то, что содержание АЗП в этих условиях увеличивалось (рис. 3). Обращает на себя внимание также тот факт, что стевиозид в разной степени увеличивал активность и содержание лектинов. Исследуемый регулятор роста в большей степени повышал активность лектинов, чем их содержание (рис. 2 и 3).
В настоящее время известно, что экзогенные фиторегуляторы могут влиять на растения путем изменения в них соотношения эндогенных фитогормонов. Понимание механизма действия стевиозида на лектины через изменение гормонального баланса растений пшеницы является важным аспектом в изучении его протекторного действия. Более того, АБК является признанным индуктором экспрессии генов АЗП [17]. В связи с этим для выявления особенностей действия стевиозида важно было исследовать содержание фитогормонов в корнях 4-дневных проростков пшеницы в условиях низкотемпературного стресса.
Поскольку предпосевная обработка семян стевиозидом в течение 24 ч приводила к увеличению ростовых показателей, интересно было выяснить, как изменяется содержание свободных форм ауксинов и цитокининов в ответ на обработку исследуемым гликозидом.
По данным, полученным с использованием непрямого иммуноферментного анализа, обнаружено, что сама предобработка стевиозидом вызвала увеличение содержания ИУК и ЦК в 4-дневных проростках пшеницы, примерно, на 20% (рис. 5, 6).
Рис. 5.
Влияние низкотемпературного стресса (3 ч, 4°С) на содержание цитокининов (ЦК) в корнях 4‑дневных проростков пшеницы: 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М).

Рис. 6.
Влияние низкотемпературного стресса (3 ч, 4°С) на содержание ИУК в корнях 4-дневных проростков пшеницы: 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М).

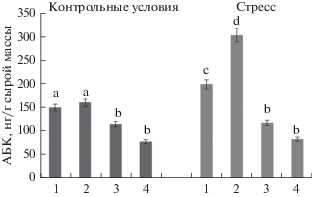
Низкотемпературный стресс индуцировал существенное снижение содержания исследуемых фитогормонов у контрольных растений, тогда как у предобработанных стевиозидом растений, подвергнутых кратковременному воздействию низких температур, концентрация цитокининов и ауксина поддерживалась на уровне близком к контрольным значениям. Анализ содержания АБК в корнях 4-дневных проростков пшеницы, подвергнутых низкотемпературному стрессу, выявил существенное увеличение уровня этого фитогормона. Концентрация АБК в корнях растений, обработанных стевиозидом в нормальных условиях, практически не изменялась, хотя и наблюдалась тенденция к увеличению (рис. 7). Предпосевная обработка семян стевиолгликозидом в течение 24 ч в условиях гипотермии способствовала дополнительному накоплению АБК.
Рис. 7.
Влияние низкотемпературного стресса (3 ч, 4°С) на содержание АБК в корнях 4-дневных проростков пшеницы: 1 – контроль (вода), 2 – растения, обработанные перед посадкой стевиозидом (24 ч, 10–8 М), 3 – растения, обработанные флуридоном (5 мг/л), 4 – растения, обработанные стевиозидом и флуридоном.
В литературе имеются данные о том, что увеличению количества АЗП в клетке предшествует накопление АБК, что неудивительно, поскольку гены, кодирующие лектин агглютинин зародыша пшеницы, относятся к семейству АБК-чувствительных генов, однако такие гормоны, как гиббереллин и эпибрассинолид, могут вызывать синтез АЗП независимо от АБК [11].
Поскольку стевиозид является структурным аналогом гибберелловой кислоты, возникает вопрос, АБК-зависимым или независимым путем он вызывает увеличение содержания АЗП. С целью получения ответа на этот вопрос, далее были проведены эксперименты с использованием флуридона, эффективного ингибитора синтеза АБК.
Из рис. 7 видно, что флуридон существенно снижал содержание АБК как в контроле, так и в присутствии стрессора. Стевиозид на фоне подавления синтеза АБК сохранял активность растворимых лектинов на одном уровне, как в нормальных условиях, так и при температурном стрессе (рис. 2). Однако содержание АЗП и экспрессия его генов снижались при действии флуридона в условиях низкотемпературного стресса (рис. 3 и 4).
ОБСУЖДЕНИЕ
На основании морфометрических данных определили наиболее эффективную схему предпосевной обработки семян стевиозидом в концентрации 10–8 М (замачивание семян на 24 ч в растворе исследуемого стевиолгликозида).
Способность обратимо связывать сахара без конформационных изменений молекул во многом объясняет полифункциональность фитолектинов. Существует большое количество исследований, посвященных изучению участия лектинов в процессах роста и развития растений, накопления и транспортировки веществ. Сигнальная функция данных молекул важна для формирования симбиоза и распознавания патогенов, а также показано участие лектинов в ответе на абиотический стресс [18, 19].
Имеются сведения о значительном повышении гемагглютинирующей активности лектинов при воздействии низких температур [12], усилении синтеза и повышении уровня лектинов при инфицировании фитопатогенами, гипертермии, засухе, засолении, действии тяжелых металлов [11], а также об индукции экспрессии генов лектинов при дефиците влаги [20], раневом [21] и солевом [22] стрессах. Показано участие АЗП в гормональной регуляции ростовых процессов растений пшеницы [11].
Как показали наши результаты, стевиозид повышает и активность лектинов, и их содержание. Вместе с тем, обращает на себя внимание тот факт, что стевиозид в большей степени увеличивал активность (рис. 2), чем содержание лектинов (рис. 3).
По-видимому, иногда изменение активности лектинов может происходить за счет посттрансляционных модификаций или конформационных перестроек молекулы белка, в результате чего изменяется доступность углевод связывающих сайтов в молекуле лектина. К тому же, при определенных условиях возможны изменения углеводного состава клетки [23], что может приводить к накоплению углеводов, являющихся специфическими лигандами для лектинов. В таком случае увеличение или уменьшение связывания лектинов со специфичными для них сахарами также может изменять их активность. В частности, нами было показано, что стевиозид инициировал увеличение содержания сахаров в растениях капусты кале [24].
Возникает вопрос, связано ли индуцируемое предобработкой стевиозидом повышение содержания АЗП с усилением экспрессии генов данного лектина? Как видно из рис. 4, стевиозид, не изменял относительное содержание транскриптов гена АЗП в контроле, несмотря на то, что содержание АЗП в этих условиях увеличивалось. Одной из причин может быть особенность синтеза этого белка: в растениях пшеницы обнаружено наличие пула запасных нетранслируемых лектиновых мРНК АЗП [25]. К тому же, лектины злаков сначала синтезируются в форме белка-предшественника, после чего в ходе созревания молекул происходят обязательные структурные преобразования. В частности, АЗП синтезируется в форме предшественника с молекулярной массой 23 кД, который после отщепления концевого участка превращается в мономер (18 кД) зрелого лектина. Затем образуется димерная активная форма АЗП (36 кД). По всей видимости, в нормальных условиях изменение содержания АЗП под действием стевиозида связано с его влиянием на посттранскрипционый и посттрансляцинный уровни регуляции данного белка.
В наших экспериментах увеличение транскриптов наблюдали только при совместном действии низких температур и стевиозида. По-видимому, влияние стевиозида на экспрессию генов АЗП проявляется только в стрессовых условиях.
Протекторное и рост стимулирующее действие многих регуляторов роста растений опосредовано их влиянием на соотношение эндогенных фитогормонов. Понимание регуляторного действия стевиозида на лектины через изменение гормонального баланса растений пшеницы является важным аспектом в изучении механизма действия исследуемого регулятора, обладающего протекторными свойствами. При этом следует отметить, что абсцизовая кислота является индуктором синтеза АЗП [17].
Интересно отметить, что предобработка стевиозидом увеличивала содержание ЦК и ИУК не только в контрольных условиях, но и на фоне низких температур, в то время, как у контрольных растений содержание этих фитогормонов при стрессе существенно снижалось (рис. 5 и 6).
Предотвращение торможения роста корневой системы растений после воздействия краткосрочного стресса, в частности, низких положительных температур, имеет важное значение для сохранения высокого и качественного урожая пшеницы. Известно, что даже кратковременный стресс вызывает у растений глобальные изменения в метаболизме, что может привести к необратимому снижению продуктивности вследствие активации защитных механизмов и замедления процесса роста [23].
В свою очередь, в неблагоприятных условиях наблюдается быстрое увеличение содержания АБК (рис.7), которая, наряду с торможением роста побега, стимулирует рост корня. Безусловно, в условиях стресса у растений меняется гормональный баланс, накапливаются стрессовые фитогормоны и усиливаются процессы торможения роста. Однако степень проявления этих реакций напрямую зависит от устойчивости конкретного вида растения [26, стр. 61–68].
Так, при действии стевиозида в стрессовых условиях наблюдается существенное увеличение содержания АБК, но меньшее снижение содержания ИУК и ЦК в сравнении с контрольным вариантом. Таким образом, как видно из рис. 5–7, применение стевиозида позволяет поддерживать содержание ИУК и ЦК при стрессе на уровне контроля и в большей мере адаптировать организм к стрессу за счет практически двукратного увеличения уровня АБК.
С помощью ингибитора АБК флуридона продемонстрирована зависимость повышения количества АЗП от увеличения содержания АБК в растениях пшеницы [14]. В то же время, в регуляции количества АЗП могут участвовать и другие гормоны. Параллельный анализ содержания АБК и лектина пшеницы в одних и тех же растениях выявил способность гиббереллина и эпибрассинолида индуцировать транзиторное накопление АЗП в корнях проростков пшеницы независимо от АБК. В то же время ИУК- и ЦК-зависимой активации экспрессии гена АЗП и накоплению лектина предшествовало кратковременное возрастание содержания АБК [11].
Стевиозид имеет структурное сходство с гибберелловой кислотой и проявляет некоторые характерные для нее свойства, хотя и не обладает всем спектром действия гиббереллинов [9]. В связи с этим важно было выяснить, АБК-зависимым или независимым путем он вызывает увеличение содержания АЗП. Для выяснения этого вопроса использовали ингибитор синтеза АБК – флуридон.
Действительно, добавление в среду выращивания флуридона снижало уровень АБК как в контроле, так и при действии низких положительных температур.
Стевиозид на фоне подавления синтеза АБК поддерживал активность растворимых лектинов на одном уровне, как в нормальных условиях, так и при температурном стрессе (рис. 2). Однако содержание АЗП и экспрессия его генов снижались при действии флуридона в условиях низкотемпературного стресса (рис. 3 и 4).
Полученные данные свидетельствуют о том, что, несмотря на структурное сходство с гиббереллином, стевиозид, тем не менее, вызывает увеличение экспрессии генов и содержания АЗП, главным образом, АБК-зависимым путем.
По-видимому, регуляция стевиозидом содержания АЗП может осуществляться разными путями. Приведенные данные свидетельствуют о том, что в нормальных условиях стевиозид увеличивает содержание АЗП, вероятно, за счет посттрансляционных модификаций этого белка. Причем эти изменения, скорее всего, не зависят от АБК, поскольку в этих условиях не наблюдалось достоверного увеличения содержания АБК под влиянием стевиозида. На фоне действия низких температур стевиозид вызывает АБК-опосредуемое увеличение экспрессии генов АЗП.
Таким образом, повышение уровня АЗП под влиянием стевиозида может изменить гормональный баланс в сторону накопления ауксинов и цитокининов [27], что приводит к активации ростовых процессов. С другой стороны, вызванное стевиозидом увеличение АЗП в условиях действия низких температур, активирует защитные реакции пшеницы, подавляя перекисное окисление липидов и увеличивая активность антиоксидантных ферментов [9] и, в конечном итоге, повышает ее устойчивость.
Работа была выполнена в рамках программы повышения конкурентоспособности Казанского (Приволжского) федерального университета среди ведущих мировых научно-образовательных центров.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Barriocanal, L., Palacios, M., Benitez, G. Apparent lack of pharmacological effect of stevio glycosides used as sweeteners in humans, a pilot study of repeated exposures in some normatensive and hypotensive individuals and in type 1 and type 2 diabetics // Regul. Toxicol. Pharmacol. 2008. V. 51. P. 37.
Pol, J., Hohnova, B., Hyötyläinen, T. Characterization of Stevia rebaudiana by comprehensive two-dimensional liquid chromatography time of-flight mass spectrometry // J. Chromatogr. A. 2007, V. 1150. P. 85.
Chatsudthipong, V., Muanprasat, C. Stevioside and related compounds: Therapeutic benefits beyond sweetness. // Pharmacol. Ther. 2009. V. 121. P. 41.
Ruddat M., Heftman E., Lang A. Conversion of steviol to a gibberellin-like compound by Fusarium moniforme // Arch. Biochem. Biophys. 1965. V. 111. P. 187.
Kumar H., Kaul K., Bajpai-Gupta S, Kaul V.K., Kumar S. A comprehensive analysis of fifteen genes of steviol glycosides biosynthesis pathway in Stevia rebaudiana (Bertoni) // Gene. 2012. V. 492. P. 276.
Gupta R., Chakrabarty S.K. Gibberellic acid in plant // Plant Signal Behav. 2013. V. 8. P. e25504.
Ruddat M., Lang A., Mosetting E. Gibberellin activity of steviol, a plant terpenoid // Sci. Nat. 1963. V. 50. P. 23.
Ogorodnova U.A., Nevmerzhitskaya J.Y., Strobykina A.S., Timofeeva O.A. The chemical structure of steviol-glycosides as base of biological activity // Int. J. Pharm. Technol. 2016. V. 8. P. 14936.
Mikhailov A.L., Nevmerzhitskaya J.Y., Timofeeva O.A. The antioxidant properties of stevioside under the influence of heavy metals // Res. J. Pharm., Biol. Chem. Sci. 2016. V. 7. P. 1721.
Безрукова М.В., Лубянова А.Р., Гималов Ф.Р., Шакирова Ф.М. Участие агглютинина зародышей пшеницы в формировании устойчивости растений к гипотермии // Агрохимия. 2012. Т. 4. С. 37.
Шакирова Ф.М., Безрукова М.В. Современные представления о предполагаемых функциях лектинов растений // Журнал общей биологии. 2007. Т. 68. С. 109.
Тимофеева О.А., Невмержицкая Ю.Ю., Московкина М.А. Активность и состав лектинов клеточной стенки пшеницы при действии низких температур и ингибиторов кальциевой сигнальной системы // Физиология растений. 2010. Т. 57. С.209.
Roopashree S., Singh S.A., Gowda L.R., Rao A.G. Dual-function protein in plant defence: seed lectin from Dolichos biflorus (horse gram) exhibits lipoxygenase activity // Biochem. J. 2006. V. 395. P. 629.
Шакирова Ф.М., Безрукова М.В., Авальбаев А.М., Фатхутдинова Р.А. Механизмы регуляции накопления лектина в проростках пшеницы при засолении // Физиология растений. 2003. Т. 50. С. 341.
Jurczyk B., Pociecha E., Janeczko A., Paczyński R., Rapacz M. Assessment of candidate reference genes for the expression studies with brassinosteroids in Lolium perenne and Triticum aestivum // J. Plant Physiol. 2014. V. 171. P. 1541.
Тимофеева О.А. Гараева Л.Д., Чулкова Ю.Ю., Хохлова Л.П. Влияние картолина на оризалин-индуцированные изменения активности лектинов при низкотемпературном закаливании растений // Физиология растений. 2008. Т. 55. С.368.
Shakirova F.M., Avalbaev A.M., Bezrukova M.V., Gimalov F.R. Induction of wheat germ agglutinin synthesis by abscisic and gibberellic acids in roots of wheat seedlings // Plant Growth Regul. 2001. V. 33. P. 111.
De Hoff P.L., Brill L.M., Hirsch A.M. Plant lectins: the ties that bind in root symbiosis and plant defense // Mol. Genet. Genomics. 2009. V. 282. P. 1.
Kovalchuk N.V., Melnykova N.M., Musatenko L.I. Role of phytolectin in the life cycle of plants // Biopolym. Cell. 2012. V 28. P. 171.
Singh P.S., Braglal P., Bhullar S.S. Wheat germ agglutinin gene expression and ABA accumulation in the developing embryos of wheat (Triticum aestivum) in response to drought // Plant Growth Regul. 2000. V. 30. P. 145.
Zhu-Salzman K., Salzman R.A., Koiwa H., Murdock L.L., Bressan R.A., Hasegawa P.M. Ethylene negatively regulates local expression of plant defense lectin genes // Physiol. Plant. 1998. V. 104. P. 365.
Zhang W., Peumans W., Barre A., Astoul C.H., Rovira P., Rougé P., Proost P., Truffa-Bachi P., Jalali A.A., Van Damme E.J. Isolation and characterization of a jacalinrelated mannose-binding lectin from salt-stressed rice (Oryza sativa) plants // Planta. 2000. V. 210. P. 970.
Трунова Т.И. Растение и низкотемпературный стресс. 64-е Тимирязевское чтение. Москва: Наука, 2007. 54 с.
Алмуграби Е., Калимуллин М.И., Тимофеева О.А. Фитохимический состав Brassica oleracea var. Sabellica в разных условиях выращивания // Известия Уфимского научного центра РАН. 2018. Т. 3. С. 16.
Peumans W.J., Stinissen H.M., Carlier A.R. Isolation and partial characterization of wheat-germ-agglutinin-like lectins from rye (Secale cereale) and barley (Hordeum vulgare) embryos // Biochem. J. 1982. V. 2. P. 239.
Усманов И.Ю., Рахманкулова З.Ф., Кулагин А.Ю. Экологическая физиология растений. Москва: Логос, 2001. 224 с.
Безрукова М.В., Лубянова А.Р., Фатхутдинова Р.А. Участие лектинов пшеницы и фасоли в регуляции деления клеток апикальной меристемы корней разных видов растений // Физиология растений. 2011. Т. 58. С. 174.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


