Физиология растений, 2020, T. 67, № 2, стр. 157-167
Мутант Arabidopsis thaliana со вставкой T-ДНК в промоторе гена Flot1 (At5g25250) обладает повышеной устойчивостью к NaCl
Л. А. Халилова a, О. В. Сергиенко a, Ю. В. Орлова a, Н. А. Мясоедов a, И. В. Карпычев a, Ю. В. Балнокин a, *
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: balnokin@mail.ru
Поступила в редакцию 08.07.2019
После доработки 26.08.2019
Принята к публикации 28.08.2019
Аннотация
Мембранные белки флотиллины вовлечены во множество клеточных процессов и физиологических функций. Однако их участие в процессах, определяющих устойчивость растений к стрессовым воздействиям, остается малоизученным. В настоящей работе у Arabidopsis thaliana исследовали возможное вовлечение флотиллина Flot1 в Na+ и K+ гомеостатирование клеток в условиях засоления среды хлористым натрием. С этой целью в корнях и листьях растений дикого типа (ДТ) и мутанта flot1, имеющего вставку Т-ДНК в промоторе, анализировали транскрипцию гена Flot1 методом количественной полимеразной цепной реакции в реальном времени c обратной транскрипцией (кОТ-ПЦР). Наряду с этим, исследовали мутантный фенотип (рост, содержание ионов Na+ и K+ в органах, ультраструктуру клеток корня) в нормальных условиях и в присутствии 100 мМ NaCl в среде культивирования. Мутация привела к активированию экспрессии AtFlot1, что было более заметно в корнях при засолении. У мутантов в этих условиях масса органов была больше, содержание в них Na+ ниже, а содержание K+ выше, чем у ДТ. Исследование ультраструктуры клеток корня A. thaliana продемонстрировало у мутантных растений более интенсивное, по сравнению с ДТ, формирование в цитоплазме пост-Гольджи везикул и мультивезикулярных тел (МВТ). У мутантных растений и растений ДТ наличие хлористого натрия в питательном растворе приводило к стимуляции образования в цитоплазме МВТ и микровакуолей, слиянию последних в более крупные структуры. Предполагается, что изменения в ультраструктуре клеток корня, вызванные мутацией и засолением, отражают стимуляцию, соответственно, везикулярного трафика и биогенеза вакуолей − процессов, участвующих в поддержании Na+ и K+ гомеостаза клеток.
ВВЕДЕНИЕ
Важную роль в устойчивости растений к биогенным и абиогенным стресс-факторам отводят мембранным белкам флотиллинам [1]. Геном Arabidopsis thaliana содержит три кодирующие области гомологов флотиллинов (At5g25250, At5g25260, и At5g64870), названных, соответственно, AtFlot1, AtFlot2 и AtFlot3 [1]. Флотиллины являются членами большого суперсемейства белков, несущих SPFH (stomatin/prohibitin/flotillin/HflK/C) домен. Это суперсемейство состоит из нескольких типов белков, выполняющих различные функции. Его представители обнаружены у организмов всех царств. В растениях оно представлено прогибитинами, флотиллинами, стоматинами, эрлинами и уникальными для растений белками, индуцирующими реакцию сверхчувствительности (HIRs) в ответ на внедрение патогенов [2].
Флотиллины являются компонентами микро-/ нанодоменов (НД) плазмалеммы и эндосомальных структур [3, 4]. По химическому составу и свойствам НД отличаются от своего окружения в мембране. Они обогащены стеринами, сфинголипидами, насыщенными фосфолипидами и содержат глюкозилфосфатидилинозитол (GPI)-заякоренные и интегральные белки [3]. НД отождествляют [1] с описанными ранее липидными рафтами мембран [5]. На клетках животных показано, что НД эндосом функционируют как “распределяющие (sorting) платформы” для белков, доставляемых к плазмалемме (ПМ) [6].
Находясь в составе НД, флотиллины выполняют множество функций. В клетках млекопитающих они участвуют в сигналинге, эндоцитозе и экзоцитозе, контроле везикулярного трафика белков и межклеточных коммуникациях, а также во взаимодействии с патогенными микроорганизмами и в канцерогенезе [7–10]. Хотя функции флотиллинов у растений исследованы в значительно меньшей степени, чем у представителей других царств, их участие в ряде процессов тоже было показано. В частности, продемонстрировано вовлечение флотиллинов в эндоцитоз растительных клеток [11], во взаимодействие бобовых растений с ризобиями [12] и в ответ растений на инфицирование патогенными бактериями [13].
Эндосомальный транспорт с участием флотиллинов определяют как клатрин-независимый эндоцитозный путь. Эндоцитозные везикулы, образовавшиеся из плазмалеммы клеток корней A. thaliana, содержали Flot1 и отличались по размерам и подвижности от клатрин-содержащих везикул [11]. Представление о важной роли флотиллинов в эндосомальном транспорте у растений подкрепляется способностью флотиллинов взаимодействовать с белками, которые являются непосредственными исполнителями или регуляторами эндоцитоза, такими, например, как SYP131 (cубъединица SNARE) и GB2 (Rab5 ГТФаза), или подвергаются эндоцитозу и переносятся посредством везикул, не будучи при этом непосредственно вовлечены в его механизм, например, аквапорины [1, 14]. Крайне мало информации имеется об участии флотиллинов в процессах, лежащих в основе устойчивости растений к стрессовым факторам абиотической природы. Тем не менее их вовлечение в эти процессы представляется весьма вероятным, поскольку ряд белков, переносимых везикулами, прямо или косвенно участвует в ответе растений на стрессовые воздействия, в частности, на солевой стресс и дегидратацию. К таким белкам относятся рецептор-подобные киназы, белок MAP-киназного каскада МАРККК, Ca2+-связывающие белки, ионные транспортеры, H+-АТФаза плазмалеммы; белки, индуцируемые осмотическим шоком; аквапорины [1, 14].
Недавно была исследована роль флотиллинов в ответной реакции растений A. thaliana на ряд стрессовых факторов путем измерения и сравнения экспрессии AtFlot1, AtFlot2 и AtFlot3 в нормальных и стрессовых условиях, в частности, при высокой солености, низкой температуре, азотном и фосфорном голодании, инфицировании растений патогенной бактерией Pseudomonas syringae и некротрофным грибом Botrytis cinerea, при действии элиситоров flg22 и elf18 и фитогормонов, 1-нафталин уксусной и абсцизовой кислот [15]. Результаты этих экспериментов подтвердили участие флотиллинов в ответной реакции A. thaliana на разные стрессовые воздействия биотической и абиотической природы.
Цель работы – исследование возможной роли флотиллина AtFlot1 в Na+ и K+ гомеостатировании клеток A. thaliana в условиях засоления. Для этого мы определяли содержание транскриптов гена AtFlot1 у ДТ и его инсерционного мутанта Atflot1, имеющего вставку в промоторе, а также исследовали мутантный фенотип (рост, содержание ионов Na+ и K+ в органах, ультраструктуру клеток корня) в нормальных условиях и в присутствии 100 мМ NaCl в среде культивирования.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и выращивание растений. Работу выполняли на растениях Arabidopsis thaliana (L.) Heynh. (экотип Col-0) дикого типа (ДТ) и его инсерционном мутанте flot1 (CS444812 GK). Вставка находится в промоторе гена AtFlot1 (согласно информации на www.arabidopsis.org). Все эксперименты, за исключением исследования ультраструктуры клеток, проводили на растениях, выращенных в условиях водной культуры. Семена проращивали на агаризованной среде, приготовленной на 33% питательном растворе (ПР) Хогланда при температуре 23 ± 2°С, относительной влажности воздуха 70 ± 5%, фотопериоде 16 ч в сутки и интенсивности света 80 мкмоль квантов/(м2 с), полученного от люминесцентных ламп ЛБ-80 (Россия). Проростки 15-дневного возраста переносили на жидкий 50% питательный раствор Хогланда, который барботировали воздухом. Остальные условия выращивания растений на жидком ПР были такими же, как при проращивании семян. В вариантах с засолением через 10 суток после перенесения растений на жидкие ПР в них вносили NaCl до конечных концентраций 50 или 100 мМ. Смену ПР осуществляли еженедельно. Измерения массы органов, содержания в них ионов и исследование экспрессии AtFlot1 проводили на растениях 45-дневного возраста. Для исследования ультраструктуры клеток корня использовали 4-дневные проростки, выращенные на агаризованной 50% питательной среде Мурасиге-Скуга, содержащей 1% сахарозу, с добавлением или без добавления 100 мМ NaCl. Температурный и световой режимы были такими же, как для водной культуры.
Определение содержания Na+ и K+ в органах растений. Высушенные при 90°С органы растений измельчали. Ионы из образцов извлекали кипячением в течение 2 мин, затем экстракт фильтровали. Концентрацию Na+ и K+ в фильтратах определяли с помощью пламенного фотометра ФПА-2-01 (ОАО “ЗОМЗ”, Россия).
Исследование ультраструктуры клеток корней проростков. Ультраструктуру клеток эпидермы и коры корней проростков A. thaliana мутанта и ДТ проводили с помощью трансмиссионной электронной микроскопии. Образцы подготавливали в соответствии со стандартной методикой [16]. Срезы на сеточках контрастировали уранилацетатом и цитратом свинца и просматривали в электронном микроскопе LIBRA 120 (“Carl Zeiss”, Германия). Площади органелл на срезах определяли с помощью программы ZEN-2012 Microsoft, используя инструмент “контур”.
Выделение геномной ДНК и определение гомозиготности растений. Геномную ДНК выделяли из листьев методом, приведенным на сайте http:// www.monsanto.com/products/documents/dna-detection/dna_im.pdf. Полученную ДНК использовали в качестве матрицы для выявления гомозиготных растений методом полимеразной цепной реакции (ПЦР) и для амплификации других необходимых фрагментов. Последовательности использованных праймеров приведены в таблице 1. Амплифицированные фрагменты при необходимости секвенировали в ЗАО “Евроген” (Россия).
Таблица 1.
Последовательность праймеров для выявления растений гомозиготных по мутантной аллели Atflot1 и для количественной ОТ – ПЦР в реальном времени
| Название | Последовательность | Эксперимент |
|---|---|---|
| FLot1mut | CTTAAACTCCTTTGTCCCTTCAAA | Выявление растений, гомозиготных по мутантному аллелю Atflot1 |
| LB-GK | CCCATTTGGACGTGAATGTAGACAC | |
| Flot1f | GCAGCCACTTTGTAAAATAAATCA | Выявление растений, гомозиготных по аллелю AtFlot1 дикого типа |
| Flot1r | TCAACCTAGCATACAAAATCAGCG | |
| FlotRT_F | GGAACCGAAGCAAGTGACTC | Количественная ОТ-ПЦР в реальном времени для гена Atflot1 |
| FlotRT_R | TTCGCATGGATGTTCAACCAC | |
| ACT2F | CTTGCACCAAGCAGCATGAA | Количественная ОТ-ПЦР в реальном времени для гена ACT2 |
| ACT2R | CCGATCCAGACACTGTACTTCCTT |
Выделение суммарной РНК из A. thaliana и синтез первой цепи кДНК. Суммарную РНК из корней и листьев выделяли фенольным методом. Для дополнительной очистки от примесей фенола выделенную РНК переосаждали тремя объемами этанола, предварительно внося в раствор РНК 1/10 объема 3 М ацетата натрия (pH 5.9). Для проверки целостности препараты РНК анализировали методом электрофореза в неденатурирующем агарозном геле, содержащем бромистый этидий. Примеси геномной ДНК в выделенных препаратах РНК удаляли при помощи ДНКазы I (“Thermo Fisher Scientific”, США) в соответствии с инструкцией изготовителя. Синтез первой цепи кДНК осуществляли на матрице суммарной РНК, используя набор реагентов MMLV RV (“Евроген”, Россия).
Количественный анализ экспрессии гена AtFlot1. Транскрипцию гена AtFlot1 в органах A. thaliana анализировали путем определения относительного содержания мРНК методом количественной ПЦР в реальном времени c обратной транскрипцией (кОТ-ПЦР) с использованием интеркалирующего красителя SYBR Green I на приборе Light Cycler 96 (“Roсhe”, США). Праймеры подбирали с помощью программы Light Cycler Probe Design 2.0 (“Roсhe”, США). Последовательности генов были взяты из базы данных http://www.arabidopsis.org. В качестве референсного гена использовали ACT2. Программа для амплификации была создана в соответствии с рекомендациями производителя прибора и инструкцией к набору “Готовая cмесь для ПЦР qPCRmix-HS SYBR mix” (“Евроген”, Россия), тот же набор использовали для приготовления реакционной смеси. В образец вносили 30 нг матрицы (исходя из количества РНК, взятой для синтеза кДНК). Относительный уровень представленности транскрипта (R) определяли с помощью программы MicrosoftExcel по формуле:
где С(GENE) – пороговый цикл.Статистический анализ. Статистическую обработку проводили с помощью двухфакторного дисперсионного анализа (ANOVA), используя Microsoft Excel 2007. Данные представлены как средние значения и их стандартные ошибки. Разными латинскими буквами обозначены достоверные различия при Р < 0.05.
РЕЗУЛЬТАТЫ
Экспрессия гена AtFlot1 у мутанта Atflot1 и растений ДТ
Согласно информации, содержащейся на сайте www.arabidopsis.org, мутант Atflot1 (CS444812GK) получен на основе экотипа Col-0 путем инсерционного мутагенеза, причем вставка Т-ДНК находится в промоторе гена. Секвенирование показало, что Т-ДНК расположена в положении −41 п. н. от старта транскрипции. Для проверки наличия вставки была использована ПЦР с геномной ДНК. У отобранных растений обе хромосомы содержали вставку в гене AtFlot1, что указывает на гомозиготность растений по мутантному аллелю.
Анализ экспрессии гена AtFlot1 (At5g25250) проводили на гомозиготных мутантных растениях Atflot1 (CS444812GK) и растениях ДТ 45-дневного возраста. Влияние хлористого натрия на экспрессию AtFlot1 исследовали при его длительном и краткосрочном действии на растения. NaCl в конечной концентрации 100 мМ был внесен в ПР в первом случае за 20 суток (рис. 1а), во втором – за 8 ч (рис. 1б) до выделения из растений РНК и проведения анализа. В контрольных вариантах NaCl отсутствовал в ПР.
Рис. 1.
Экспрессия гена Flot1 в корнях и листьях 45-дневных растений A. thaliana ДТ и инсерционного мутанта flot1 cо вставкой Т-ДНК в промоторе. Растения выращивали на 50% питательном растворе Хогланда, NaCl в конечной концентрации 100 мМ добавляли к ПР за 20 дней (а) или за 8 ч (б) до анализа. Контроль – NaCl не добавляли к ПР. 1 – ДТ, корни; 2 –Atflot1, корни; 3 – ДТ, листья; 4 – Atflot1, листья. Даны средние значения и их стандартные ошибки (n = 3). Разные буквы над столбиками указывают на статистически достоверные различия между средними значениями (ANOVA; P < 0.05), одни и те же буквы указывают на отсутствие достоверных различий.

В случае 20-дневного действия NaCl наблюдалась стимуляция транскрипции AtFlot1 в корнях и листьях, как мутанта, так и растений ДТ, хотя эффект NaCl, особенно в листьях мутанта, был умеренным (рис. 1а). В случае 8-часового действия соли экспрессия AtFlot1 в корнях была более чем на порядок выше по сравнению с контролем как у мутантных растений, так и у растений ДТ (рис. 1б). При этом экспрессия AtFlot1 у первых была заметно выше, чем у вторых. В листьях, однако, и при длительном, и при краткосрочном действии соли уровень экспрессии AtFlot1у мутанта и ДТ оставался одинаковым и таким же низким, как в контроле (рис. 1б).
Фенотип инсерционного мутанта Atflot1
Вызванные мутацией изменения в экспрессии гена AtFlot1 сопровождались изменениями в росте и ионном статусе органов растений, а также в ультраструктуре клеток корня. Измерение массы органов растений и содержания в них ионов K+ и Na+ проводили на растениях 45-дневного возраста при 20-дневном действии на растения NaCl. Хлористый натрий приводил к подавлению роста листьев A. thaliana (рис. 2). Снижение массы листьев наблюдалось как у растений ДТ, так и мутанта Atflot1 при концентрациях NaCl в ПР 50 и 100 мМ (рис. 3б). Хлористый натрий в концентрации 100 мМ подавлял рост сильнее, чем 50 мМ NaCl. Достоверное снижение массы корней под действием засоления наблюдалось у мутанта и ДТ при 100 мМ NaCl в ПР (рис. 3а).
Рис. 2.
Растения A. thaliana 45-дневного возраста ДТ и мутанта flot1, выращенные на 50% питательном растворе Хогланда. NaCl в конечных концентрациях 50 мМ или 100 мМ добавляли к ПР за 20 дней до проведения анализов (на 25 день роста). Контроль – NaCl не добавляли к ПР. Масштабная линейка 10 см.
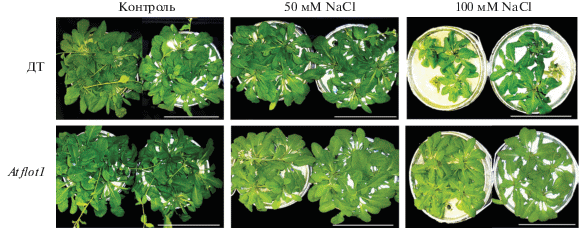
Рис. 3.
Сырая масса корней (а) и листьев (б) растений A. thaliana 45-дневного возраста ДТ (1) и мутанта flot1 (2). Растения выращивали на 50% питательном растворе Хогланда. NaCl в конечных концентрациях 50 мМ или 100 мМ добавляли к ПР за 20 дней до проведения анализа. Контроль – NaCl не добавляли к ПР. Даны средние значения и их стандартные ошибки (n = 3). Разные буквы над столбиками указывают на статистически достоверные различия между средними значениями (ANOVA; P < 0.05), одни и те же буквы указывают на отсутствие достоверных различий.

Мутация Atflot1 оказала стимулирующее действие на рост корней (рис. 3а) и листьев (рис. 3б) A. thaliana. Вызванное мутацией увеличение массы органов обнаружилось и в контроле, и в условиях засоления при 50 мМ NaCl в ПР. Стимуляция роста листьев у мутанта наблюдалась не только при 50 мМ, но и при 100 мМ NaCl. В целом рост-стимулирующий эффект мутации проявился в большей степени на листьях, чем на корнях.
Как NaCl, так и мутация Atflot1 оказали влияние на содержание K+ и Na+ в корнях и листьях растений (рис. 4). При отсутствии засоления содержание K+ в органах ДТ и мутанта было одинаковым, ионы Na+ присутствовали лишь в следовых количествах. Внесение NaCl в ПР привело к снижению содержания K+ (рис. 4а, 4в) и к резкому возрастанию содержания Na+ (рис. 4б, 4г) в корнях и листьях как ДТ, так и мутанта. Среднее содержание K+ в корнях мутанта было выше, чем у ДТ, при концентрациях NaCl в ПР 50 и 100 мМ (рис. 4а). В листьях мутанта более высокое содержание K+ по сравнению с ДТ наблюдалось при 100 мМ NaCl в ПР (рис. 4б). Содержание Na+ в органах растений возрастало по мере увеличения концентрации NaCl в ПР, однако возрастание содержания Na+ у мутанта было выражено в меньшей степени, чем у ДТ (рис. 4б, 4г). В целом можно заключить, что мутация Atflot1 привела к снижению содержания Na+ и к увеличению содержания К+ в корнях и листьях A. thaliana.
Рис. 4.
Содержание K+ (а, в) и Na+ (б, г) в корнях и листьях растений A. thaliana 45-дневного возраста ДТ (1) и мутанта flot1 (2). Растения выращивали на 50% питательном растворе Хогланда. NaCl в конечных концентрациях 50 мМ или 100 мМ добавляли к ПР за 20 дней до проведения анализов. Контроль – NaCl не добавляли к ПР. (а), (б) – Корни, (в), (г) – листья. Даны средние значения и их стандартные ошибки (n = 3). Разные буквы над столбиками указывают на статистически достоверные различия между средними значениями (ANOVA; P < 0.05), одни и те же буквы указывают на отсутствие достоверных различий.

Клетки корня проростков A. thaliana ДТ, выращенных на ПР без NaCl, обнаружили типичную для растительных клеток ультраструктуру (рис. 5а). Выращивание проростков ДТ на среде, содержащей 100 мМ NaCl, привело к ряду изменений в ультраструктуре клеток корня. Эти изменения в основном затронули эндоплазматический ретикулум (ЭР), вакуолярную систему, комплекс Гольджи (КГ) и пост-Гольджи структуры. В условиях засоления активировались процессы вакуолизации цитоплазмы (рис. 5б–5е). Наблюдалось набухание цистерн ЭР, которые, по-видимому, формировали микровакуоли (МВ) (рис. 5б, 5д). Как показали морфометрические измерения, под действием NaCl в цитоплазме возросло количество МВ в клетках (табл. 2), одновременно возросла доля МВ больших размерных классов и уменьшилась доля МВ малых размерных классов (рис. 6а), т.е. увеличился их размер. Эти результаты указывают на слияние МВ в более крупные структуры. Сливающиеся МВ были чаще видны на микрофотографиях в варианте с NaCl (рис. 5б, 5д), чем в контроле. Суммарная площадь, занятая микровакуолями на срезах, при этом увеличилась почти в 4 раза (табл. 2).
Рис. 5.
Ультраструктура клеток корней 4-дневных проростков A. thaliana ДТ (а–е) и мутанта flot1 (ж–н), исследованная с помощью трансмиссионной электронной микроскопии. Проростки выращивали на агаризованном 50% питательном растворе Мурасиге-Скуга, содержавшем 1% сахарозу, с добавлением 100 мМ NaCl или без добавления NaCl (контроль). (а) – ДТ, контроль; (б–е) – ДТ, 100 мМ NaCl; (ж–и) – Atflot1, контроль; (к–н) – Atflot1, 100 мМ NaCl. Обозначения: МВ – микровакуоли, МВТ – мультивезикулярные тела, В – вакуоль, АФ – аутофагосома, ЭР – эндоплазматический ретикулум, КГ – комплекс Гольджи, черные стрелки указывают на плазмалемму, черные треугольники указывают на структуры, сливающиеся с тонопластом. Масштабная линейка 0.5 мкм.

Таблица 2.
Количество микровакуолей (МВ) и мультивезикулярных тел (МВТ), процент площади, занимаемой МВ и МВТ, и количество внутренних везикул МВТ на срезах клеток корней проростков ДТ и мутанта flot1 А. thaliana, выращенных на средах с добавлением или без добавления 100 мМ NaCl
| Варианты | Количество МВ/100 мкм2 | % площади, занимаемой МВ на срезах | Количество МВТ/100 мкм2 | % площади, занимаемой МВТ на срезах | Количество везикул/МВТ |
|---|---|---|---|---|---|
| ДТ, контроль | 9.6 ± 0.5b | 4.3 | 1.2 ± 0.1a | 0.5 | 5.6 ± 0.2b |
| ДТ, NaCl | 16.8 ± 0.4d | 16.0 | 2.2 ± 0.1b | 1.1 | 2.8 ± 0.2a |
| Atflot1, контроль | 6.3 ± 0.3a | 6.2 | 2.7 ± 0.1c | 3.1 | 6.7 ± 0.3c |
| Atflot1, NaCl | 14.5 ± 0.4c | 11.1 | 4.4 ± 0.2d | 5.2 | 8.8 ± 0.4d |
Рис. 6.
Относительная частота встречаемости МВ (а) и МВТ (б) в клетках корней 4-дневных проростков A. thaliana ДТ и мутанта flot1, рассчитанная по данным электронных микрофотографий. Проростки выращивали на агаризованном 50% питательном растворе Мурасиге-Скуга, содержавшем 1% сахарозу, с добавлением 100 мМ NaCl или без добавления NaCl (контроль). 1 – ДТ, контроль; 2 – flot1, контроль; 3 – ДТ, 100 мМ NaCl; 4 – flot1, 100 мМ NaCl.
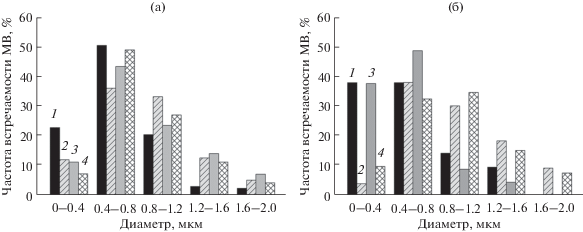
В условиях засоления, по сравнению с контролем, чаще наблюдалось отпочковывание везикул транс-Гольджи сети/ранних эндосом (ТГС/РЭ) от секреторного полюса КГ (рис. 5в–5е). Мелкие везикулы часто наблюдались внутри более крупных везикул, что, по-видимому, указывает на формирование поздних эндосом/мультивезикулярных тел (ПЭ/МВТ) (рис. 5б, 5в). Количество структур, предположительно являющихся МВТ, в цитоплазме под действием NaCl увеличилось (табл. 2), что, возможно, было результатом активирования процесса отпочковывания пост-Гольджи везикул от КГ и созревания их в МВТ. Измерение относительной частоты встречаемости МВТ разных размерных классов показало, что условия засоления мало изменили их размеры (рис. 6б). Часто наблюдалось слияние МВТ с ПМ или тонопластом и выход везикул, содержащихся внутри МВТ, в вакуоль или периплазматическое пространство (рис. 5б, 5д). Число везикул, содержащихся внутри МВТ, в условиях засоления было меньше, чем в контроле (табл. 2).
Сравнение ультраструктуры клеток мутанта и растений ДТ, морфометрия их структур показали, что мутация Atflot1, как и условия засоления, повлияла на процессы везикуляции и образования эндосом. В цитоплазме накапливались везикулы диаметром приблизительно 1–2 мкм (рис. 5ж–5к, 5м, 5н), в некоторых клетках они занимали значительную часть объема цитоплазмы (рис. 5к). Содержание МВТ в расчете на единицу поверхности среза, их средний размер и среднее число везикул в люмене МВТ у мутанта были существенно больше, чем у растений ДТ (рис. 6б, табл. 2). Интенсификация образования везикул и МВТ-подобных структур, а также слияния последних с тонопластом и ПМ, была результатом как мутации, так и действия NaCl. Мутация оказала более сильное действие, чем засоление, а эффекты этих двух факторов суммировались (рис. 5ж–5н, 6б, табл. 2). У мутанта обнаружилось также снижение числа диктиосом в комплексах Гольджи и их деформация с образованием кольцеподобных структур на транс-стороне КГ, что было особенно заметно в условиях засоления (рис. 5к). Такие изменения КГ также могут отражать активирование везикулярного транспорта и ускоренное расходование материала комплексов Гольджи на образование эндосом. Следует отметить, что совместное действие двух факторов, а именно засоления и мутации Atflot1, заметно увеличило число комплексов Гольджи в цитоплазме (табл. 3), что указывает на активировании их биогенеза.
Таблица 3.
Количество комплексов Гольджи (КГ), аутофагосом (АФ) и аутофагических тел (АТ) на срезах клеток корней проростков ДТ и мутанта flot1 А. thaliana, выращенных на средах с добавлением или без добавления 100 мМ NaCl
| Варианты | Количество КГ/100 мкм2 | Количество АФ/100 мкм2 | Количество АТ/100 мкм2 |
|---|---|---|---|
| ДТ, контроль | 4.8 ± 0.1a | 0.7 ± 0.1a | 2.35 ± 0.3a |
| ДТ, NaCl | 5.1 ± 0.2a | 0.9 ± 0.1b | 2.6 ± 0.4b |
| Atflot1, контроль | 5.2 ± 0.4a | 1.6 ± 0.1c | 3.00 ± 0.2c |
| Atflot1, NaCl | 6.7 ± 0.1b | 2.3 ± 0.2d | 4.4 ± 0.2d |
Мутация, в отличие от NaCl, оказала лишь слабое влияние на образование МВ в цитоплазме. В клетках проростков, выращенных в отсутствие NaCl в ПР, некоторое снижение содержания МВ в цитоплазме под действием мутации сопровождалось увеличением их размеров (табл. 2, рис 6а). В условиях засоления мутация практически не оказала влияния на количество и размеры микровакуолей (рис. 5к–5н, табл. 2). Клетки мутанта, выращенного на ПР с NaCl, характеризовались повышенным содержанием аутофагосом (АФ) в цитоплазме и аутофагических тел (АТ) в вакуолях, что может указывать на активированный перенос цитоплазматического материала в вакуоль посредством аутофагии (табл. 3). При этом возросшее содержание аутофагических структур в клетках было результатом синергического действия засоления и мутации.
ОБСУЖДЕНИЕ
Одним из наиболее выраженных эффектов засоления в наших экспериментах была повышенная вакуолизация цитоплазмы и слияние образующихся МВ в более крупные структуры. Важная роль вакуолярной системы в солеустойчивости растений в настоящее время не вызывает сомнений. Компартментализация токсичных ионов Na+ и Cl– в вакуолях понижает содержание этих ионов в цитоплазме и вносит вклад в снижение водного потенциала в клетках в условиях засоления [17–20]. Транспорт Na+ и Cl– из цитозоля растительных клеток в вакуоли осуществляют Na+/H+ и Cl–/H+, соответственно, антипортеры тонопласта. Первые являются Na+/H+-обменниками NHX типа [21], вторые относятся к семейству хлоридных каналов CLC [19]. Источником энергии для переноса Na+ и Cl– является ΔμH+ тонопласта, который создается вакуолярными H+-АТФазой (V-АТФазой) и H+-транслоцирующей пирофосфатазой (V-PPазой) [17, 18, 20]. Наряду с компартментализацией Na+ и Cl– в вакуолях важную роль в поддержании концентраций этих ионов в цитозоле на нетоксическом уровне играет их экспорт в наружную среду [17, 18]. Экспорт Na+ осуществляет Na+/H+-антипортер плазмалеммы, энергизуемый H+-АТФазой P-типа [17, 18, 21]. В транспорт Na+, K+ и Cl– через плазмалемму и тонопласт вовлечены также ионные каналы и другие транспортеры [19, 20].
Ряд исследований указывает на вовлечение в механизмы ионного гомеостатирования и солеустойчивости растений везикулярного транспорта. Нокаут-мутация по гену ARA6 семейства Rab5 малых ГТФаз, участвующего в регуляции ВТ, вызывала у A. thaliana сверхчувствительность к NaCl, а сверхэкспрессия мутантного гена ARA6Q93L, фиксирующего ARA6 в ГТФ-связанной форме, повышала их солеустойчивость [22]. Сверхэкспрессия гена AtRabG3e (AtRab7) активировала эндоцитоз в клетках A. thaliana, приводила к накоплению ионов Na+ в вакуолях и увеличению их содержания в побегах. По сравнению с ДТ, трансгенные растения демонстрировали более высокую устойчивость к NaCl [23]. На клетках корней A. thaliana было показано, что в ответ на повышение наружной концентрации NaCl происходит быстрое увеличение объема центральной вакуоли с сопутствующим уменьшением числа мелких вакуолей и возрастанием вакуолярной концентрации соли [24]. В настоящей работе мы также наблюдали под действием NaCl возрастание вакуолизации цитоплазмы и слияние МВ в более крупные структуры у A. thaliana.
Модификации белкового состава мембран, приводящие к изменению ионного статуса растений и влияющие на их солеустойчивость, могут происходить не только за счет изменений в экспрессии белков и их посттрансляционных модификаций, но и за счет изменений в активности эндоцитозного и секреторного путей ВТ. Имеются прямые указания на динамическую регуляцию содержания ион-транспортирующих белков в мембранах посредством ВТ. Например, абсцизовая кислота (АБК), контролирующая ионный транспорт и транспирацию при водном дефиците, индуцировала селективный эндоцитоз входного (inward rectifying) K+-канала KAT1 из ПМ замыкающих клеток устьиц A. thaliana. Это, в свою очередь, уменьшало поток K+ в клетки, приводило к снижению тургорного давления и стимулировало закрывание устьиц [25]. Другим примером регуляции транспортного белка посредством ВТ у растений являются индуцированные высокими концентрациями бора в среде изменения в содержании транспортера BOR1 плазмалеммы, который загружает борат в ксилему корня A.thaliana. BOR1 в этих условиях подвергался эндоцитозу, везикулами переносился в цитоплазму и таким образом исключался из процесса загрузки бора в ксилему [26].
Результаты электронно-микроскопического исследования ультраструктуры указывают на активирование процессов ВТ у мутанта Atflot1 (CS444812GK), характеризующегося повышенной транскрипцией AtFlot1. Об этом свидетельствует возрастание числа МВТ-подобных структур и их размеров, а также числа внутренних везикул у мутанта. Такое действие мутации проявилось в наибольшей степени при засолении. В соответствии с этим, структурные изменения в аппарате Гольджи, наблюдавшиеся у мутанта в этих условиях, указывают на ускоренный биогенез этой органеллы. Наблюдавшееся нами у мутанта возросшее число аутофагических структур в условиях засоления может указывать на активирование деградационных процессов и доставку в вакуоль подлежащего деградации материала. Показано, что в стрессовых условиях аутофагия и деградационные процессы активируются [27].
Изменения ионного статуса A. thaliana, вызванные мутацией flot1 (CS444812 GK) являются косвенным свидетельством вовлечения Flot1 в ионное гомеостатирование клеток корней A. thaliana в условиях засоления. Снижение содержания Na+ и повышение содержания K+ в органах у мутанта могут быть результатом флотиллин-зависимых изменений в содержании Na+- и K+-транспортирующих белков в плазмалемме. Как показано для некоторых растительных белков, транспортируемых преимущественно клатрин-содержащими везикулами, в частности для аквапорина PIP2;1 и NADPH оксидазы RbohD, доля флотиллин-зависимого пути резко возрастает в условиях солевого стресса [28, 29]. Рецептор брассиностероида BRI1 подвергался эндоцитозу в основном через клатрин-зависимый путь при наличии только эндогенного гормона. Добавленный эпибрассинолид существенно активировал AtFlot1-зависимый эндоцитоз BRI1 [30]. Предполагается, что для указанных белков клатрин-зависимый путь функционирует как конститутивный эндоцитозный механизм, тогда как эндоцитоз, основанный на содержащих флотиллины НД, индуцируется стрессом или в ответ на какие-то другие сигналы [1]. Флотиллин-опосредованный эндоцитоз [12] может быть непосредственным участником ремоделирования белкового состава мембран и таким образом вносить вклад в изменение ионного статуса клеток растений.
Работа поддержана грантом Российского фонда фундаментальных исследований 18-04-00504/18.
Л.А. Халилова и О.В. Сергиенко внесли равный вклад в проведенное исследование.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Daněk M., Valentová O., Martinec J. Flotillins, erlins, and HIRs: From animal base camp to plant new horizons // Crit. Rev. Plant Sci. 2016. V. 35. P. 191.
Di C., Xu W.Y., Su Z., Yuan J.S. Comparative genome analysis of PHB gene family reveals deep volutionary origins and diverse gene function // BMC Bioinf. 2010. V. 11: S22.
Jarsch I.K., Konrad S.S.A., Stratil T.F., Urbanus S.L., Szymanski W., Braun P., Braun K.H., Ott T. Plasma membranes are subcompartmentalized into a plethora of coexisting and diverse microdomains in Arabidopsis and Nicotiana benthamiana // Plant Cell. 2014. V. 6. P. 1698.
Tapken W., Murphy A.S. Membrane nanodomains in plants: capturing form, function, and movement // J. Exp. Bot. 2015. V. 66. P. 1573.
Mongrand S., Morel J., Laroche J., Claverol S., Carde J.P., Hartmann M.A., Bonneu M., Simon-Plas F., Lessire R., Bessoule J.J. Lipid rafts in higher plant cells – purification and characterization of triton X-100-insoluble microdomains from tobacco plasma membrane // J. Biol. Chem. 2004. V. 279. P. 36277.
Ikonen E. Roles of lipid rafts in membrane transport // Curr. Opin. Cell Biol. 2001. V. 13. P. 470.
Banning A., Tomasovic A., Tikkanen R. Functional aspects of membrane association of reggie/flotillin proteins // Curr. Protein Pept. Sci. 2011. V. 12. P. 725.
Otto G.P., Nichols B.J. The roles of flotillin microdomains – endocytosis and beyond // J. Cell Sci. 2011. V. 124. P. 3933.
Bodin S., Planchon D., Morris E.R., Comunale F., Gauthier-Rouvière C. Flotillins in intercellular adhesion – from cellular physiology to human diseases // J. Cell Sci. 2014. V. 127. P. 5139.
Meister M., Tikkanen R. Endocytic trafficking of membrane-bound cargo: a flotillin point of view // Membranes. 2014. V. 4. P. 356.
Li R.L., Liu P., Wan Y.L., Chen T., Wang Q.L., Mettbach U., Baluska F., Samaj J., Fang X.H., Lucas W.J., Lin J. A membrane microdomain-associated protein, Arabidopsis Flot1, is involved in a clathrin-independent endocytic pathway and is required for seedling development // Plant Cell. 2012. V. 24. P. 2105.
Haney C.H., Long S.R. Plant flotillins are required for infection by nitrogen-fixing bacteria // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 478.
Yu M., Liu H.J., Dong Z.Y., Xiao J.W., Su B.D., Fan L.S., Komis G., Šamaj J., Lin J., Li R. The dynamics and endocytosis of Flot1 protein in response to flg22 in Arabidopsis // J. Plant Physiol. 2017. V. 215. P. 73.
Junková P., Daněk M., Brouzdová J., Kroumanová K., Zelazny E., Janda M., Hynek R., Martinec J., Valentová O. Mapping of plasma membrane proteins interacting with Arabidopsis thaliana flotillin 2 // Front. Plant Sci. 2018. V. 9. Art. 991.
Kroumanova K., Kocourkova D., Daněk M., Lamparova L. Pospichalova R., Malinska K., Krĉkova Z., Burketova L. Valentová O., Martinec J., Janda M. Characterisation of Arabidopsis flotillins in response to stresses // Biologia Plantarum. 2019. V. 63. P. 144.
Balnokin Yu.V., Kurkova E.B., Khalilova L.A, Myasoedov N.A., Yusufov A.G. Pinocytosis in the root cells of a salt-accumulating halophyte Suaeda altissima and its possible involvement in chloride transport // Russ. J. Plant Physiol. 2007. V. 54. P. 797.
Apse M.P., Blumwald E. Na+ transport in plants // FEBS Letters. 2007. V. 581. P. 2247.
Munns R., Tester M. Mechanisms of salinity tolerance // Ann. Rev. Plant Biol. 2008. V. 59. P. 651.
Barbier-Brygoo H., De Angeli A., Filleur S., Frachisse J.-M., Gambale F., Thomine S., Wege S. Anion channels/transporters in plants: from molecular bases to regulatory networks // Ann. Rev. Plant Biol. 2011. V. 62. P. 25.
Martinoia E., Meyer S., De Angeli A., Nagy R. Vacuolar transporters in their physiological context // Ann. Rev. Plant Biol. 2012. V. 63. P. 183.
Bassil E., Coku A., Blumwald E. Cellular ion homeostasis: emerging roles of intracellular NHX Na+/H+ antiporters in plant growth and development // J. Exp. Bot. 2012. V. 63. P. 5727.
Ebine K., Fujimoto M., Okatani Y., Nishiyama T., Goh T., Ito E., Dainobu T., Nishitani A., Uemura T., Sato M.H., Thordal-Christensen H., Tsutsumi N., Nakano A., Ueda T. A membrane trafficking pathway regulated by the plant-specific RAB GTPase ARA6 // Nat. Cell Biol. 2011. V. 13. P. 853.
Mazel A., Leshem Y., Tiwari B.S., Levine A. Induction of salt and osmotic stress tolerance by overexpression of an intracellular vesicle trafficking protein AtRab7 (AtRa-bG3e) // Plant Physiol. 2004. V. 134. P. 118.
Hamaji K., Nagira M., Yoshida K., Ohnishi M., Oda Y., Uemura T., Goh T., Sato M.H., Morita M.T., Tasaka M., Hasezawa S., Nakano A., Hara-Nishimura I., Maeshima M., Fukaki H. et al. Dynamic aspects of ion accumulation by vesicle traffic under salt stress in Arabidopsis // Plant Cell Physiol. 2009. V. 50. P. 2023.
Sutter J.-U., Sieben C., Hartel A., Eisenach C., Thiel G., Blatt M.R. Abscisic acid triggers the endocytosis of the Arabidopsis KAT1 K+ channel and its recycling to the plasma membrane // Curr. Biol. 2007. V. 17. P. 1396.
Kasai K., Takano J., Miwa K., Toyoda A., Fujiwara T. High boron-induced ubiquitination regulates vacuolar sorting of the BOR1 borate transporter in Arabidopsis thaliana // J. Biol. Chem. 2011. V. 286. P. 6175.
Minibayeva F., Dmitrieva S., Ponomareva A., Ryabovol V. Oxidative stress-induced autophagy in plants: The role of mitochondria // Plant Physiol. Biochem. 2012. V. 59. P. 11.
Li X. J., Wang X.H., Yang Y., Li R.L., He Q.H., Fang X.H., Luu D.T., Maurel C., Lin J.X. Single-molecule analysis of PIP2;1 dynamics and partitioning reveals multiple modes of Arabidopsis plasma membrane aquaporin regulation // Plant Cell. 2011. V. 23. P. 3780.
Hao H.Q., Fan L.S., Chen T., Li R.L., Li X.J., He Q.H., Botella M.A., Lin, J.X. Clathrin and membrane microdomains cooperatively regulate RbohD dynamics and activity in Arabidopsis // Plant Cell. 2014. V. 26. P. 1729.
Wang L., Li H., Lv X.Q., Chen T., Li R.L., Xue Y.Q., Jiang J.J., Jin B., Baluska F., Samaj J., Wang X. Spatiotemporal dynamics of the BRI1 receptor and its regulation by membrane microdomains in living Arabidopsis cells // Mol. Plant. 2015. V. 8. P. 1334.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


