Физиология растений, 2020, T. 67, № 3, стр. 312-318
Реакция дыхания проростков озимой пшеницы на продолжительное и кратковременное ежесуточное понижение температуры
Е. Н. Икконен a, *, Т. Г. Шибаева a, Е. Г. Шерудило a, А. Ф. Титов a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр “Карельский научный центр РАН”
Петрозаводск, Россия
* E-mail: likkonen@gmail.com
Поступила в редакцию 21.05.2019
После доработки 11.07.2019
Принята к публикации 18.07.2019
Аннотация
В условиях контролируемой среды изучали влияние длительного (6 сут) действия низкой положительной температуры (4°С, вариант НТ) и кратковременных (3 ч) ежесуточных (в течение 6 суток) понижений температуры до 4°С (вариант ДРОП, от англ. drop − понижение) на дыхание листьев озимой пшеницы (Triticum aestivum L., с. Московская 39). В результате НТ-воздействий скорость дыхания листьев в темноте (Rd) увеличивалась на 36%, а при ДРОП-воздействиях выявлена лишь тенденция к ее повышению. ДРОП- и НТ-воздействия cлабо влияли на скорость дыхания на свету (Rl) и температурную чувствительность Rd и Rl. В отличие от ДРОП-воздействий, действие НТ увеличило степень ингибирования светом дыхания растений. При 12°С скорость гросс-фотосинтеза (Ag) листьев вариантов НТ и ДРОП увеличивалась соответственно на 23 и 54% по сравнению с контрольными растениями. ДРОП-воздействия не повлияли на соотношение Rd/Ag и Rl/Ag растений. При 22°С величина Rd/Ag у растений варианта НТ была выше, а при 12°С величина Rl/Ag была ниже, чем у контрольных растений. ДРОП-воздействие не повлияло на чувствительность дыхания к действию ингибитора альтернативного пути дыхания СГК (салицилгидроксамовая кислота). НТ-воздействие увеличило долю СГК-чувствительного дыхания в общем дыхании листьев растений в среднем на 25%, что косвенно отражает активизацию альтернативного пути переноса электронов в дыхательной цепи. Таким образом, продолжительное непрерывное пребывание проростков озимой пшеницы при низкой положительной температуре оказывало модифицирующее действие на дыхание, что проявлялось в изменении скорости дыхания, активности СГК-чувствительного дыхания и соотношения дыхания и гросс-фотосинтеза. В условиях кратковременных ежесуточных воздействий пониженной температурой дыхание проявляло высокую стабильность.
ВВЕДЕНИЕ
Возможность выращивания озимой пшеницы в различных почвенно-климатических условиях определяется наличием у нее значительного адаптивного потенциала [1], который в условиях действия пониженных температур проявляется через разнообразные структурно-функциональные изменения, носящие адаптивный характер и направленные на повышение устойчивости и выживаемости растений. Одним из основных механизмов повышения холодоустойчивости растений является изменение характера СО2-газообмена, необходимое для ряда структурно-функциональных перестроек [2, 3]. При этом дыхание в большей степени, чем фотосинтез подвержено изменениям в процессе закаливания из-за его более высокой зависимости от температуры [4]. На начальном этапе холодового воздействия скорость дыхания снижается как реакция на стресс, но с повышением периода действия низкой температуры у растений активизируются защитно-приспособительные механизмы, приводящие к ряду преобразований, в том числе и в дыхательном метаболизме [5]. Данные преобразования могут проявиться уже в течение суток после понижения окружающей температуры и способствовать частичному или даже полному восстановлению скорости дыхания в холоде [6].
Поскольку во многих регионах понижение температуры в период активной вегетации растений нередко носит затяжной характер (неделя и более), то именно такого типа холодовые воздействия всегда привлекали наибольшее внимание исследователей и тщательно изучены [7–9]. Кратковременные (часы) ежесуточные понижения температуры исследованы гораздо в меньшей степени и, главным образом, на теплолюбивых культурах [10–12]. Холодостойкие растения также попадают под их воздействие, поэтому необходимо знать, как наиболее широко культивируемые из них, например, пшеница, реагируют на данный вид температурных воздействий, и насколько их реакция отлична от той, которая наблюдается при длительном холоде. Логично предположить, что кратковременные понижения температуры способны оказывать определенное влияние на дыхание растений, однако неизвестно, могут ли они вызывать у холодостойких растений те же адаптивные изменения, которые были выявлены ранее у теплолюбивых растений [13].
Температура влияет на процесс дыхания независимо от световых условий, но дыхание на свету часто слабее, чем дыхание в темноте вследствие ингибирования его светом [14, 15] и менее чувствительно к изменениям температуры [16]. Определено, что адаптивные изменения дыхания растений при смене условий роста могут проявляться как в темноте, так и на свету [17], однако вопрос о том, в равной ли степени дыхание на свету и дыхание в темноте реагируют на низкую температуру как продолжительного, так и кратковременного действия, пока недостаточно изучен.
Одним из механизмов повышения устойчивости дыхания растений к холоду может выступать активизация переноса электронов в митохондриях на альтернативную оксидазу, часто приводящая к смене соотношения путей дыхательного метаболизма [18, 19]. Но если активизация альтернативного энергетически малоэффективного пути дыхания холодостойких растений в результате длительного действия низких температур показана на примере озимой пшеницы [20], то вопрос о переключении переноса электронов на альтернативную оксидазу и повышение доли альтернативного пути в общем дыхании при кратковременных ежесуточных понижениях температуры остается пока открытым.
Цель работы – сравнительная оценка влияния продолжительного действия низкой положительной температуры и кратковременных ежесуточных понижений температуры на дыхание озимой пшеницы. Для этого были изучены особенности холодовой адаптации дыхания растений на свету и в темноте и оценено возможное участие альтернативного пути дыхания растений в процессе его холодовой адаптации.
МАТЕРИАЛЫ И МЕТОДЫ
Растения озимой пшеницы (Triticum aestivum L., с. Московская 39) выращивали в рулонах фильтровальной бумаги на питательном растворе (pH 6.2–6.4) в камере искусственного климата (“Vötsch”, Германия) при температуре воздуха 22°С, 150 мкмоль/(м2 с) фотосинтетически активной радиации (ФАР), фотопериоде 12 ч, влажности воздуха 70%. Часть растений в возрасте 7 сут ежедневно в течение 6 сут переносили в конце темнового периода на 3 ч в камеру (“Snijders Microclima 1750”; “Snijders Scientific BV”, Нидерланды) с температурой 4°C (вариант ДРОП, от англ.: drop − понижение), вторую часть растений выращивали в течение 6 суток при температуре 4°C, 100 мкмоль/(м2 с) ФАР и прочих сохраненных условиях (вариант НТ), а растения, не подвергавшиеся действию холода, служили контролем.
СО2-газообмен измеряли с использованием портативной фотосинтетической системы HCM-1000 (“Walz”, Германия) при температуре листа 12 и 22°С. Газообмен на свету определяли последовательно при ФАР, равной 1000, 800, 300, 100, 60, 40 и 20 мкмоль/(м2 с). При каждой интенсивности ФАР величину газообмена измеряли после полной его стабилизации. После окончания измерений газообмена листа на свету растение выдерживали в течение 30 мин в темноте и определяли скорость газообмена при 0 мкмоль/(м2 с) ФАР, приняв данную величину за дыхание листьев в темноте (Rd). Митохондриальное дыхание листьев на свету (Rl) рассчитывали согласно методу Kok [21] путем экстраполяции на ось Y прямой линии, аппроксимирующей значения СО2-газообмена при 60, 40 и 20 мкмоль/(м2 с) ФАР. Точка пересечения аппроксимирующей прямой с осью Y отражала величину газообмена при 0 мкмоль/(м2 с) ФАР и была принята за Rl [22]. Степень ингибирования светом дыхания выявляли посредством величины отношения Rl/Rd, показывающей долю дыхания на свету в темновом дыхании листьев. Снижение значения Rl/Rd отражает увеличение степени ингибирования светом дыхания.
По завершению измерений СО2-газообмена определяли площадь листьев и их сухую биомассу путем высушивания при 105°С. Рассчитывали величину отношения сухой массы листьев к их площади (LMA, от англ.: leaf mass per area). Видимый квантовый выход фотосинтеза (α) и световой компенсационный пункт (СКП) вычисляли по значениям скорости видимого фотосинтеза при 60, 40 и 20 мкмоль/(м2 с) ФАР [23]. Скорость гросс-фотосинтеза (Ag) рассчитывали как сумму величины СО2-газообмена при 1000 мкмоль/(м2 с) ФАР и Rl.
Интенсивность дыхания листьев определяли полярографически с использованием электрода Кларка (Oxygraph System Plus, “Hansatech”, UK). Для этого у растений из средней части листа острой бритвой вырезали образцы и термостатировали их в темноте не менее 15 мин. В среднем сухая масса образцов составляла 6.9 мг. Затем отобранные образцы разрезали на полоски не более 2 мм по ширине и помещали в измерительную кювету с 2 мл буферного раствора 100 мМ HEPES (pH 7.5) с добавлением или без добавления ингибитора альтернативного пути дыхания 30 мМ салицилгидроксамовой кислоты (СГК), предварительно растворенной в спирте. Буферный раствор насыщали кислородом перед каждым измерением. Образцы выдерживали в буферном растворе в темноте не менее 15 мин и после стабилизации процесса скорость снижения содержания кислорода измеряли в течение 5 мин. Концентрацию ингибитора и длительность инкубации подбирали в предварительном эксперименте. Интенсивность поглощения кислорода растительным материалом в буферном растворе, не содержащем СГК, была принята за общее дыхание, в буферном растворе, содержащем СГК – за совместное цитохромное и остаточное дыхание. Различия скорости поглощения кислорода из буфера, не содержащего и содержащего СГК, были приняты за СГК-чувствительное дыхание, косвенно отражающее активность альтернативного пути (АП) дыхания. Измерения проводили при температуре буферного раствора 12 и 22°С. Для создания требуемой температуры камеру с измерительной кюветой, содержащей буферный раствор, подсоединяли к жидкостному термостату MLW (VEB MLW “PRUFGERATE-WERK”, Германия). Калибровку электрода проводили при каждой температуре измерения.
В работе представлены средние значения из шести и более биологических повторностей и их стандартные ошибки. Достоверность различий между средними значениями определяли при P < 0.05 на основе дисперсионного анализа (LSD-тест) с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”).
РЕЗУЛЬТАТЫ
Влияние ДРОП- и НТ-воздействий на СО2-газообмен озимой пшеницы проявилось в большей степени при температуре измерения 12°С, чем при 22°С (рис. 1). При 12°С в области светового насыщения величина видимого поглощения СО2 у листьев вариантов ДРОП и НТ была, соответственно, на 23 и 57% выше, чем у контрольных значений. Темновое дыхание листьев, определенное по выделению углекислого газа, изменялось в большей степени при продолжительном действии низкой температуры (вариант НТ), чем в случае кратковременных ежесуточных понижений температуры (вариант ДРОП). При 22°С величина Rd у растений варианта НТ была выше на 36 и 25%, чем в контроле и в варианте ДРОП, соответственно (рис. 2а). Низкотемпературные воздействия обоих видов мало влияли на величину Rl независимо от температуры измерения (рис. 2б). Величина Rl/Rd у растений в варианте НТ была в среднем на 43% ниже, чем в контроле и в варианте ДРОП (рис. 2в). Скорость дыхания увеличивалась с повышением температуры листа независимо от того, на свету или в темноте осуществлялся этот процесс, и независимо от того, подвергались растения действию низкой температуры или нет. При этом ДРОП- и НТ-воздействия, судя по значениям Q10, не влияли на температурную чувствительность дыхания листьев (табл. 1). Также не было выявлено значимых различий в величине Q10 для Rd и Rl.
Рис. 1.
Влияние интенсивности ФАР на СО2-газообмен проростков озимой пшеницы, не подвергавшихся (1) и подвергавшихся кратковременному (3 ч) ежесуточному (6 сут) понижению температуры в конце ночи до 4°С (2) или постоянному (6 сут) воздействию температуры 4°С (3). Измерения выполнены при температуре листа 12°С (а) и 22°С (б).
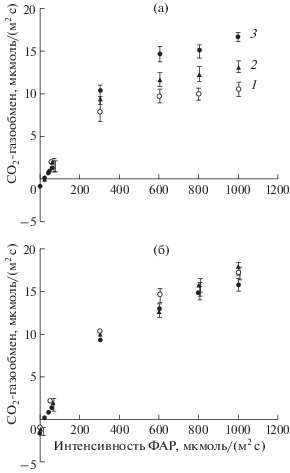
Рис. 2.
Дыхание в темноте (Rd, а), на свету (Rl, б) и отношение Rl/Rd (в) в листьях озимой пшеницы, не подвергавшихся (1) и подвергавшихся кратковременному (3 ч) ежесуточному (6 сут) понижению температуры в конце ночи до 4°С (2, вариант ДРОП) или постоянному (6 сут) воздействию температуры 4°С (3, вариант НТ). Измерения выполнены при температуре листа 12 и 22°С. В пределах каждого параметра и каждой температуры измерения разные буквы указывают на достоверность различий средних значений при Р < 0.05.
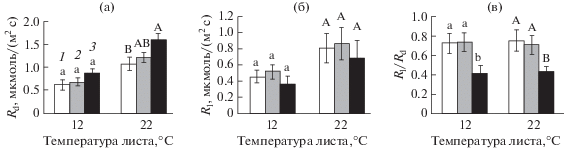
Таблица 1.
Величина Q10 дыхания листьев озимой пшеницы в темноте (Rd) и на свету (Rl)
| Контроль | ДРОП | НТ | |
|---|---|---|---|
| Rd | 1.7 | 1.8 | 1.8 |
| Rl | 1.8 | 1.7 | 1.9 |
Влияние ДРОП- и НТ-воздействий на скорость гросс-фотосинтеза (Ag) проявилось при низкой температуре измерения (рис. 3а). Так, при 12°С значения Ag в вариантах ДРОП и НТ были выше контрольных, соответственно, на 23 и 54%. Оба типа низкотемпературных воздействий снижали зависимость фотосинтеза от температуры, но в большей степени это проявлялось в варианте НТ. Соотношение дыхания к фотосинтезу изменялось только в результате НТ-воздействия (рис. 3б, 3в). У растений в варианте НТ величина Rd/Ag была на 62% выше, чем в контроле при температуре измерения 22°С, а Rl/Ag было на 52% ниже контрольных значений при 12°С. Последнее в большей степени обусловливалось усилением скорости ассимиляции углерода, чем снижением дыхания на свету. Оба типа низкотемпературного воздействия незначительно повлияли на такие показатели как отношение сухой массы листьев к их площади (LMA) и световой компенсационный пункт (СКП) (табл. 2). Однако прослеживается тенденция к снижению величины LMA и повышению СКП у растений в варианте ДРОП, а также к повышению LMA и снижению СКП в варианте НТ. Понижение СКП, видимо, было вызвано усилением дыхания в темноте. Величина видимого квантового выхода фотосинтеза у растений в варианте ДРОП была немного выше, а в варианте НТ существенно ниже, чем у контрольных растений (табл. 2).
Рис. 3.
Скорость гросс-фотосинтеза (Ag, а), отношение Rd/Ag (б) и Rl/Ag (в) в листьях озимой пшеницы, не подвергавшихся (1) и подвергавшихся кратковременному (3 ч) ежесуточному (6 сут) понижению температуры в конце ночи до 4°С (2, вариант ДРОП) или постоянному (6 сут) воздействию температуры 4°С (3, вариант НТ). Измерения выполнены при температуре листа 12 и 22°С. В пределах каждого параметра и каждой температуры измерения разные буквы указывают на достоверность различий средних значений при Р < 0.05.
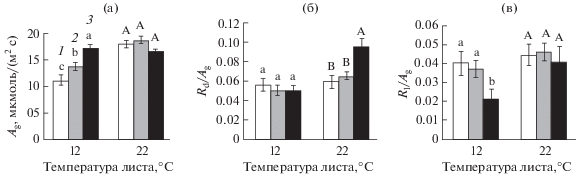
Таблица 2.
Отношение сухой массы листьев к их площади (LMA), видимый квантовый выход фотосинтеза (α), световой компенсационный пункт (СКП) у растений пшеницы в последействии кратковременного ежесуточного (ДРОП) или длительного (НТ) охлаждения до 4°С
| Контроль | ДРОП | НТ | |
|---|---|---|---|
| LMA, мг/см2 | 2.93 ± 0.05а | 2.52 ± 0.11а | 3.12 ± 0.06а |
| α, моль СО2/моль квант | 0.045 ± 0.003а | 0.052 ± 0.002а | 0.028 ± 0.003b |
| СКП, мкмоль/(м2 с) | 17.8 ± 3.5а | 18.8 ± 3.1а | 15.8 ± 4.6а |
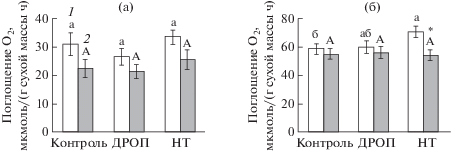
Темновое дыхание, измеренное по поглощению кислорода, не было чувствительно к действию ингибитора альтернативного пути дыхания СГК у контрольных растений и растений варианта ДРОП (рис. 4). Температура измерения влияла на скорость дыхания растений всех опытных вариантов независимо от того, в присутствии или отсутствии СГК в буферном растворе было определено дыхание. В результате ингибирования скорость дыхания достоверно снижалась только у растений в варианте НТ при температуре измерения 22°, что может отражать функционирование у них альтернативного пути (АП) дыхания. Доля СГК-чувствительного дыхания в общем дыхании листьев в варианте НТ составляла в среднем 25%.
Рис. 4.
Темновое дыхание листьев пшеницы без ингибитора (1) и с ингибитором (2) альтернативного пути дыхания (СГК), не подвергавшихся (контроль) и подвергавшихся кратковременному (3 ч) ежесуточному (6 сут) понижению температуры до 4°С (ДРОП) или продолжительному (6 сут) действию низкой (4°С) температуры (НТ). Измерения выполнены при температуре листа 12°С (а) и 22°С (б). * – достоверность различий средних значений дыхания без ингибирования и с ингибированием СГК альтернативного пути дыхания при каждой температуре измерения для каждого варианта опыта отдельно.
ОБСУЖДЕНИЕ
Как показали результаты исследования, у растений озимой пшеницы, подвергавшихся действию НТ, изменения процесса дыхания проявились в гораздо большей степени, чем у растений, испытавших ДРОП (рис. 1). Повышение интенсивности дыхания растений при действии низких, но не повреждающих температур, отмечалось ранее и другими авторами [24–26]. Причиной изменения дыхательной активности растений может являться рост потребности в энергии и интермедиатах, необходимых для структурно-функциональной реорганизации клеток и обеспечения возможности сохранения жизнедеятельности в холоде [25]. Наряду со скоростью дыхания, показателем, по которому можно судить о способности растения к адаптации, является величина температурного коэффициента Q10 [25]. Холодовая адаптация дыхания может проявляться в снижении величины Q10 [6], однако не редки случаи, когда данный параметр не изменялся при смене температурных условий роста растений [27]. Результаты данной работы не выявили снижения температурной чувствительности дыхания листьев пшеницы в результате ДРОП и НТ воздействий (табл. 1). Стабильность величины Q10 дыхания листьев пшеницы на фоне увеличения интенсивности их дыхания при НТ-воздействии может отражать высокий уровень гомеостатической регуляции дыхания растений [6].
Дыхание листьев пшеницы на свету (Rl) отреагировало на НТ-воздействие в меньшей степени, чем дыхание в темноте (Rd) (рис. 2), что согласуется с результатами некоторых более ранних исследований, показавших, что чувствительность дыхания растений к изменениям температуры ниже на свету, чем в темноте [16]. Различие в реакции Rl и Rd на длительное действие пониженной температуры обусловило снижение величины соотношения Rl/Rd (рис. 2б), что отражает повышение степени ингибирования светом дыхания. Последнее могло быть вызвано усилением фотодыхания при активизации оксигеназной активности Рубиско [22] и связанными с этим изменениями в энергетическом обмене клеток.
В способности растений сохранять жизнеспособность в стрессовых условиях ключевую роль часто играет устойчивость фотосинтетического аппарата [2, 9]. В частности, повышение холодостойкости растений в процессе адаптации может достигаться в результате увеличения скорости ассимиляции СО2 [9]. ДРОП-и НТ-воздействия повлияли на фотосинтетическую активность растений в условиях пониженной температуры, при этом увеличение скорости фотосинтеза было более выраженным при НТ (рис. 1а, 3а). Поскольку процессы дыхания и фотосинтеза различаются по способности к холодовой адаптации, доля дыхательных затрат от фотосинтеза может различаться у растений, выросших в тепле и холоде [26]. В отличие от ДРОП-воздействий, действие НТ вызывало изменение величины соотношения дыхания к фотосинтезу. Повышение величины Rd/Ag в варианте НТ при оптимальной температуре (рис. 3б) отражает, видимо, увеличение энергетических потребностей клеток, связанных с их реорганизацией и формированием адаптированной структуры. При низкой температуре, напротив, доля дыхательных затрат фотосинтезирующих клеток снижалась (рис. 3в), что может способствовать накоплению водорастворимых углеводов, необходимых для формирования устойчивой к низким температурам ультраструктуры клеток, органелл, мембран [3].
Как известно, низкие температуры могут вызывать определенные изменения в дыхательном метаболизме растений, например, изменения активности путей дыхания [6, 28]. Смена соотношений путей дыхательного метаболизма может происходить за счет увеличения доли альтернативного пути (АП) дыхания [18], что может рассматриваться как один из механизмов процесса адаптации [19] и повышения устойчивости дыхания растений к холоду. ДРОП-воздействия не повлияли на интенсивность СГК-чувствительного дыхания, которое косвенно отражает поток электронов по АП дыхания (рис. 4). НТ-воздействие повышало скорость дыхания листьев пшеницы за счет активизации АП, что согласуется с результатами, полученными О.И. Грабельных с соавт. [20]. При этом НТ не лимитировало СГК-устойчивое дыхание, основную долю которого составляет цитохромный путь дыхания, что, по-видимому, связано с необходимостью поддержания максимально возможной энергетической эффективности дыхания для обеспечения энергией всех процессов, осуществляемых в холоде. Вовлечение АП в дыхание пшеницы в этом случае могло способствовать поддержанию сбалансированных митохондриально-хлоропластных отношений, оптимального энергетического баланса и редокс-статуса клеток, препятствуя накоплению избыточного количества активных форм кислорода [19, 20].
Таким образом, продолжительное действие низкой положительной температуры, в отличие от ее кратковременных ежесуточных понижений, оказывало модифицирующее действие на дыхание проростков озимой пшеницы. При этом адаптивные преобразования затрагивали в большей степени дыхание в темноте, чем на свету. Различия в изменении скорости дыхания и фотосинтеза в ответ на продолжительный рост растений при низкой температуре отражались на соотношении этих двух процессов. Вовлечение в дыхание альтернативного пути потока электронов проявилось при длительном пребывании проростков в условиях низкой температуры, но не при кратковременных ежесуточных понижениях температуры. Видимо, при ДРОП-воздействиях не происходит столь глубокой перестройки процесса дыхания и поэтому становится понятным, почему они не сказываются или сказываются незначительно на накоплении биомассы и развитии растений [29]. Высокая стабильность и эффективная регуляция процесса дыхания является важным фактором, благодаря которому растения, часто испытывающие в природных условиях понижения температуры, способны сохранять и поддерживать активную жизнедеятельность, которая в конечном итоге выражается в сохранении высокой продуктивности.
Работа выполнена в рамках государственного задания Карельского научного центра РАН (0218-2019-0074) и при частичной поддержке Российского фонда фундаментальных исследований (проект № 14-04-00840а). В работе использовано оборудование Центра коллективного пользования ФИЦ “Карельский научный центр РАН”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Жученко А.А. Адаптивное растениеводство (эколого-генетические основы). Теория и практика. Москва: Агрорус, 2008. 816 с.
Креславский В.Д., Карпентиер Р., Климов В.В., Мурата Н., Аллахвердиев С.И. Молекулярные механизмы устойчивости фотосинтетического аппарата к стрессу // Биологические мембраны. 2007. Т. 24. С. 195.
Климов С.В. Адаптация растений к стрессам через изменение донорно-акцепторных отношений на разных уровнях структурной организации // Успехи соврем. биологии. 2008. Т. 128. С. 281.
Campbell C., Atkinson L., Zaragoza-Castells J., Lundmark M., Atkin O., Hurry V. Acclimation of photosynthesis and respiration is asynchronous in response to changes in temperature regardless of plant functional group // New Phytol. 2007. V. 176. P. 375.
Loveys B.R., Atkinson L.J., Sherlock D.J., Roberts R.L., Fitter A.H., Atkin O.K. Thermal acclimation of leaf and root respiration: an investigation comparing inherently fast- and slow-growing plant species // Global Change Biology. 2003. V. 9. P. 895.
Atkin O.W., Tjoelker M.G. Thermal acclimation and the dynamic response of plant respiration to temperature // TRENDS in Plant Science. 2003. V. 8. P. 343.
Головко Т.К. Дыхание растений. Санкт-Петербург: Наука, 1999. 229 с.
Титов А.Ф., Акимова Т.В., Таланова В.В., Топчиева Л.В. Устойчивость растений в начальный период действия неблагоприятных температур. Москва: Наука, 2006. 143 с.
Трунова Т.И. Растение и низкотемпературный стресс. 64-ое Тимирязевское чтение. М.: Наука, 2007. 54 с.
Марковская Е.Ф., Сысоева М.И., Шерудило Е.Г. Кратковременная гипотермия и растение. Петрозаводск: Карельский научный центр РАН, 2013. 194 с.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Влияние кратковременных ежесуточных понижений температуры на соотношение дыхания и фотосинтеза у теплолюбивых растений // Физиология растений. 2018. Т. 65. С. 45.
Шибаева Т.Г., Икконен Е.Н., Шерудило Е.Г., Титов А.Ф. Влияние ежесуточных кратковременных понижений температуры на теплолюбивые и холодостойкие растения // Физиология растений. 2019. Т. 66. С. 266.
Икконен Е.Н., Грабельных О.И., Шерудило Е.Г., Шибаева Т.Г. Устойчивое и чувствительное к салицилгидроксамовой кислоте дыхание теплолюбивых растений в условиях кратковременных ежесуточных понижений температуры // Физиология растений. 2020. Т. 67. С. 67.
Hurry V., Igamberdiev A.U., Keerberg O., Pärnik T.R., Atkin O.K., Zaragoza-Castells J., Gardestrøm P. Respiration in photosynthetic cells: gas exchange components, interactions with photorespiration and the operation of mitochondria in the light // Advances in Photosynthesis and Respiration, H. Lambers, M. Ribas-Carbo (Eds.). Kluwer Academic Publishers, Dordrecht. 2005. P. 43.
Гармаш Е.В. Митохондриальное дыхание фотосинтезирующей клетки // Физиология растений. 2016. Т. 63. С. 17.
Zaragoza-Castells J., Sanchez-Gomez D., Valladares F., Hurry V., Atkin O.K. Does growth irrdiance affect temperature dependence and thermal acclimation of leaf respiration? Insights from a Mediterranean tree with long-lived leaves // Plant, Cell and Environment. 2007. V. 30. P. 820.
Atkin O.K., Scheurwater I., Pons T.L. High thermal acclimation potential of both photosynthesis and respiration in two lowland Plantago species in contrast to an alpine congeneric // Global Change Biology. 2006. V. 12. P. 500.
Шугаев А.Г., Шугаева Н.А., Выскребенцева Э.И. Цианид- и ротенон-резистентное дыхание митохондрий корнеплода сахарной свеклы в ходе онтогенеза // Физиология растений. 2006. Т. 53. С. 503.
Гармаш Е.В. Альтернативный путь дыхания в растениях: Регуляция и функции // Известия Коми научного центра УрО РАН. 2010. Выпуск 3. С. 26.
Грабельных О.И., Побежимова Т.П., Корзун А.М., Возненко С.А., Королева Н.А., Павловская Н. С., Боровик О.А., Войников В.К. Участие цианид-резистентного дыхания в термогенерации и антиокислительной защите клетки в проростках озимой пшеницы при холодовом воздействии // J. Stress Physiol. Biochem. 2011. V. 7. P. 447.
Kok B. A critical consideration of the quantum yield of Chlorella-photosynthesis // Enzymologia. 1948. V. 13. P. 1.
Ayub G., Zaragoza-Castells J., Griffin K.L., Atkin O.K. Leaf respiration in darkness and in the light under pre-industrial, current and elevated atmospheric CO2 concentrations // Plant Science. 2014. V. 226. P. 120.
Гармаш Е.В., Головко Т.К. СО2-газообмен и рост Rhaponticum carthamoides в условиях подзоны средней тайги европейского северо-востока. 1. Зависимость фотосинтеза и дыхания от внешних факторов // Физиология растений. 1997. Т. 44. С. 854.
Буболо Л.С., Палеева Т.В., Кислюк И.М. Влияние температуры выращивания и кратковременной температурной акклимации на ультраструктуру клеток, фотосинтез и дыхание листьев Tradescantia albiflora (Commelinaceae) // Ботанический журн. 1988. Т. 73. С. 45.
Семихатова О.А. Оценка адаптационной способности растения на основании исследований темнового дыхания // Физиология растений. 1998. Т. 45. С. 142.
Gorsuch P.A., Pandey S., Atkin O.K. Temporal heterogeneity of cold acclimation phenotypes in Arabidopsis leaves // Plant Cell Environ. 2010. V. 33. P. 244.
Ow L.F., Griffin K.L., Whitehead D., Walcroft A.S., Turnbull M.H. Thermal acclimation of leaf respiration but not photosynthesis in Populus deltoids × nigra // New Phytologist. 2008. V. 178. P. 123.
Grabelnych O.I., Kolesnichenko A.V., Pobezhimova T.P., Tourchaninova V.V., Korzun A.M., Koroleva N.A., Zykova V.V., Voinikov V.K. The role of different plant seedling shoots mitochondrial uncoupling systems in thermogenesis during low-temperature stress// Journal of Thermal Biology. 2003. V. 28. P. 571.
Шибаева Т.Г., Шерудило Е.Г., Титов А.Ф. Реакция растений Cucumis sativus L. на длительное постоянное и кратковременные ежесуточные воздействия низких температур // Физиология растений. 2018. Т. 65. С. 68.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


