Физиология растений, 2020, T. 67, № 3, стр. 298-311
Сравнительная оценка вклада компонентов СО2/Н2О обмена в процесс адаптации к засухе у ксерогалофитов семейства Chenopodiaceae с разным типом фотосинтеза
З. Ф. Рахманкулова a, *, Е. В. Шуйская a, **, М. Ю. Прокофьева a, А. М. Боровков a, П. Ю. Воронин a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: zulfirar@mail.ru
** E-mail: evshuya@gmail.com
Поступила в редакцию 17.07.2019
После доработки 30.10.2019
Принята к публикации 05.11.2019
Аннотация
Исследовали компоненты СО2/Н2О обмена (интенсивность видимого фотосинтеза, транспирации, темнового дыхания), а также эффективность фотосистемы I, интенсивность роста и содержание пролина у растений С3-вида (Atriplex verrucifera), двух популяций С4-вида (A. tatarica) и двух популяций промежуточного С3–С4-вида (Sedobassia sedoides) сем. Chenopodiaceae в процессе адаптации к ПЭГ-индуцированному умеренному осмотическому стрессу (–0.4…–0.5 МПа). В работе использовали две концентрации СО2 (400 и 200 ppm), позволяющие исследовать устьичный и метаболический вклад в формирование механизмов засухоустойчивости и оценить чувствительность устьиц. В условиях умеренного водного дефицита С3-вид проявил черты засухоустойчивости, суккулентности и характеризовался нечувствительностью устьиц. На основе анализа ростовых характеристик выявлены межпопуляционные различия по продуктивности и устойчивости у С4- и С3–С4-видов. У устойчивых к водному дефициту популяций, несмотря на разную природу углерод-концентрирующего механизма (у С4 – аспартатный, у С3–С4 – фотодыхательный) показаны общие черты: менее чувствительные устьица, наличие механизма стабилизации водного баланса клеток листьев, возможно, при участии пролина и циклического транспорта электронов. Реализация такой стратегии приводит к сохранению координации параметров СО2/Н2О обмена, что обеспечивает меньшую вариабельность темнового дыхания и большую устойчивость растений к умеренному осмотическому стрессу. У неустойчивых популяций адаптация осуществляется, в первую очередь, за счет закрытия устьиц, что, возможно, приводит к рассогласованию параметров СО2/Н2О обмена.
ВВЕДЕНИЕ
Засуха является одним из основных абиотических экологических стрессовых факторов, которые ограничивают рост и развитие растений, играют важную роль в географическом распространении видов. Актуальность изучения данного типа стресса возрастает в связи с глобальными климатическими изменениями и аридизацией климата. Способность растений адекватно отвечать на водный дефицит и вызванный им осмотический стресс, выживать в условиях осмотического стресса зависит от эффективности крайне энергозатратных защитных механизмов растений [1].
Энергетический обмен растений является многокомпонентным. Центральная роль в общей энергетике растений и в конструктивном обмене принадлежит фотосинтезу, состоящему из световых (ФС I и ФС II) и темновых биохимических процессов. Большая роль в обеспечении клетки энергией и метаболитами принадлежит также темновому митохондриальному дыханию. В условиях водного дефицита наблюдается ингибирование фотосинтетической активности и, часто, усиление диссипации энергии в ходе темнового дыхания [2]. Лимитирование фотосинтеза претерпевает последовательные фазы. На начальной стадии (устьичная фаза) происходит частичное или полное закрытие устьиц. Это тормозит газообмен и снижает поступление СО2 к центрам карбоксилирования. Далее в ходе неустьичной метаболической фазы наблюдается снижение активности ферментов цикла Кальвина [3].
Растения с С3- и С4-типом фотосинтетического метаболизма сильно отличаются по устойчивости к водному дефициту. Известно, что С4-растения обладают эффективным фотосинтетическим аппаратом в теплых и засушливых условиях обитания. Преимущество C4-растений, по сравнению С3-видами, заключается в более эффективном фотосинтетическом механизме, который включает в себя дополнительную пространственно отделенную метаболическую надстройку к основному фотосинтетическому циклу Кальвина, связанную с функционированием фосфоенолпируваткарбоксилазы [4]. Данная надстройка является углерод-концентрирующим механизмом (УКМ), который позволяет более эффективно использовать свет и воду при высокой температуре и водном дефиците, в первую очередь, за счет почти полной рефиксации фотодыхательного СО2. Высокая эффективность использования воды (WUE, англ.: water use efficiency) С4-растениями привела к общему мнению, что данный тип фотосинтеза устойчив к засухе [5]. Однако в последнее время появляется все больше информации о слабой засухоустойчивости некоторых С4-видов [6–8]. По мнению Sage и McKown [6], некоторые уникальные функции С4-фотосинтеза и более сложный биохимический путь могут снизить потенциал общей фенотипической пластичности и акклиматизации фотосинтеза к изменению окружающей среды. Ghannoum [7] считает, что причиной может быть ограниченная при C4-фотосинтезе интенсивность фотодыхания или реакции Мелера, которые являются значительными альтернативными стоками электронов в условиях водного стресса. Согласно гипотезе Osborne и Sack [8], возможно, слабая координация между углерод-концентрирующим С4-механизмом и гидравлической функцией приводит к слабой засухоустойчивости растений. На сегодняшний день противоречия относительно засухоустойчивости С4-растений остаются нерешенными, несмотря на большой интерес к растениям с кооперативным типом фотосинтеза в связи с их значительным вкладом в глобальный обмен углерода и продовольственную безопасность [7] на фоне изменения климата, и многочисленными попытками биотехнологически улучшить С3-растения путем оверэкспрессии в них С4-ферментов [9].
Показано, что снижение интенсивности С4-фотосинтеза в условиях водного дефицита, главным образом, является следствием метаболических ограничений в ассимиляции СО2, в то время как в C3-видах преобладающую роль в снижении фотосинтеза, вызванного засухой, играет устьичное лимитирование [3, 7]. Водный дефицит также приводит к нарушению функционирования ФС II, нециклического транспорта электронов и активации циклического транспорта [10], в результате чего изменяется соотношение АТФ/НАДФ · Н. Эффективное регулирование работы ЭТЦ посредством активации альтернативных путей или циклического транспорта электронов имеет большое значение для выживания растений в стрессовых условиях, в том числе в условиях засухи [10]. Темновое митохондриальное дыхание в условиях дефицита воды может снижаться в результате уменьшения затрат на рост, а может усиливаться при возрастании затрат на поддержание и адаптационные механизмы [2].
Необходимым условием и важным этапом С4-эволюции является появление фотодыхательного углеродного насоса, так называемого C2-фотосинтеза, который использует фотодыхательный глициновый челнок для концентрирования CO2 в клетках обкладки [11]. С2-фотосинтез рассматривается как связующее звено между С3- и С4-типами фотосинтеза [12]. С другой стороны, эволюционная траектория от С3- до С4-фотосинтеза через промежуточные C3–C4-виды с С2-фотосинтезом не так однозначна [8], и С3–С4-фотосинтез рассматривается как параллельный С4-фотосинтезу путь со своими характерными особенностями. С3–C4-промежуточные виды представляют большой интерес для изучения эволюции С4-фотосинтеза [11].
Известно, что эволюция C4 фотосинтеза происходила при низкой атмосферной концентрации СО2 [13] и высоком спросе на воду и, по мнению Osborne и Sack [8], сопровождалась одновременным улучшением углеродного и водного обмена растений. Отсутствие координации между механизмами усиления поступления углерода и потерей воды часто приводит к субоптимальным WUE и потерям фотосинтеза [14]. Дальнейшее изучение того, как эффективность водного обмена и фотосинтеза скоординированы внутри листьев, важно для изучения и прогнозирования физиологических последствий и производительности C4-фотосинтеза в условиях изменяющейся атмосферной концентрации СО2.
Особенностью растений семейства Маревые (Chenopodiaceae) – одного из самых больших семейств аридных и полуаридных территорий, является наличие видов ксерогалофитов с разным типом фотосинтетического метаболизма (С3, С4 и С3–С4) и разной устойчивостью к засухе. В настоящее время виды Chenopodiaceae используются в экологическом восстановлении деградированных агроландшафтов, а также в производстве кормов на засушливых землях. В рамках данной работы планируется изучение С3-, С4- и С3–С4- (с С2-фотосинтезом) ксерогалофитов семейства Сhenopodiaceae в условиях засухи и засоления. Особое внимание будет уделено изучению влияния изменяющейся атмосферной концентрации СО2 на координацию между фотосинтетической и гидравлической функциями.
Цель работы – сравнение параметров СО2/Н2О обмена и оценка степени их скоординированности у разных по устойчивости популяций С3-, С4- и С3–С4-видов семейства Chenopodiaceae в условиях умеренного ПЭГ-индуцированного водного дефицита при нормальной и низкой концентрации СО2.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили на растениях С3-вида (лебеда бородавчатая, Atriplex verrucifera M. Bieb), двух популяций (П1 и П2) С4-вида (лебеда татарская, A. tatarica L.) и двух популяций (М и П) промежуточного С3-С4-вида (седобассия очитковидная, Sedobassia sedoides (Pall.) Freitag & G. Kadereit) семейства Маревые (Chenopodiaceae) в процессе их адаптации к ПЭГ-индуцированному умеренному осмотическому стрессу (–0.4…–0.5 МПа).
Умеренный уровень осмотического стресса был выбран, поскольку (1) данные виды в естественных условиях произрастания продемонстрировали чувствительность и наличие морфологических и генетических различий между популяциями в условиях умеренной засухи [15]; (2) изучение низких и средних уровней засухи представляет особый интерес, т.к. они широко распространены по всему миру и при этом изучены в меньшей мере, чем экстремальные уровни стрессовых нагрузок [16]. Адаптация к умеренной засухе не является шоковой и позволяет лучше выявить и изучить адаптивные механизмы устойчивости.
Для проведения лабораторных экспериментов семена А. verrucifera, A. tatarica и S. sedoides проращивали в дистиллированной воде. Проростки в возрасте 3–4 дней пересаживали на перлит, пропитанный 50% питательным раствором Хогланда. Растения выращивали под люминесцентными лампами при плотности потоков квантов ФАР 200 мкмоль/(м2 с), 16-часовом фотопериоде и температуре 25°C. Растения в возрасте 30 дней переносили на экспериментальные растворы (полив перлита). Опыт длился 5–6 дней. ПЭГ-6000 (осмотический потенциал ψs = –0.4…–0.5 МПа) вносили в поддоны опытных вариантов дважды. В качестве контроля использовали 50% раствор Хогланда. Для определения сухой биомассы растительные пробы высушивали двое суток при 80°С. Содержание свободного пролина определяли с помощью кислого нингидринового реактива [17], результаты рассчитывали на 1 г сухой массы.
Для определения видимого фотосинтеза (А) и транспирации (Е) фрагмент листа помещали в термостатируемую при комнатной температуре листовую камеру и освещали оптоволоконным световодом от осветителя (KL 1500 LCD, “Shott”, Германия) с галогеновой лампой (150 Вт, “Philips”, Нидерланды) с интенсивностью ФАР в поле объекта 2000 мкмоль/(м2 с). Стационарный СО2/Н2О газообмен листа измеряли с помощью одноканального ИК-газоанализатора (LI-820, “LICOR”, США) в открытой схеме. Транспирацию листа рассчитывали на основании разности влажности газа на входе и выходе из листовой камеры. В данной установке в опорном газовом потоке на входе в листовую камеру поддерживали известную постоянную влажность с помощью увлажнителя LI-610 (“LICOR”, США). Для определения влажности на выходе из листовой камеры использовали психрометрический датчик HMP50 (“Vaisala INTERCAP”, Финляндия). Эффективность использования воды (WUE) рассчитывали как отношение скорости видимого фотосинтеза к транспирации (А/Е). Интенсивность темнового дыхания (Rd) оценивали через 20 мин после выключения света.
Исследования А, Е, WUE и Rd проводили при современной атмосферной (400 ppm) и низкой (200 ppm) концентрации СО2 в измерительной камере (древняя концентрация СО2, при которой осуществлялось эволюционное развитие C4-линий в течение 30 миллионов лет), что позволило в ходе эксперимента искусственно управлять открытием устьиц, оценивать чувствительность устьичного аппарата к внешним воздействиям [8, 13], а также дифференцировать устьичный и метаболический вклад в засухоустойчивость.
Продуктивность оценивали по накоплению сухой биомассы, устойчивость – по степени снижения данного параметра при стрессе. Степень скоординированности СО2/H2O газообмена оценивали по вариабельности темнового дыхания, т.е. по величине стандартного отклонения от средней арифметической, а также по степени снижения WUE и ростовых параметров.
Эффективность ФС I оценивали по изменению окислительно-восстановительного потенциала Р700 и измеряли путем мониторинга оптической плотности листьев при 820 нм с использованием “dual-wavelength” системы импульсной модуляции ED-P700DW (“Heinz-Walz, Effeltrich”, Германия) в сочетании с PAM101 (“Heinz-Walz”, Германия) [10]. Кинетика окисления P700 измерялась при освещении дальним красным светом (720 нм, 17.2 Вт/м2). Максимальное окисление P700 определяли с использованием ксеноновой газоразрядной лампы (50 мс, 1500 Вт/м2; “Heinz-Walz”, Германия) в присутствии дальнего красного света.
Во всех экспериментах было не менее трех биологических повторностей. Для факторного (ANOVA) анализа использовали программу SigmaPlot12.0. На графиках приведены средние арифметические значения полученных величин и их стандартные ошибки. Различия считались достоверными при P < 0.05.
Исследование ростовых параметров у С3-, С4- и С3–С4-видов сем. Chenopodiaceae в условиях ПЭГ-индуцированного умеренного осмотического стресса
Исследовали сухую биомассу растений С3-вида (Atriplex verrucifera), двух популяций С4-вида (A. tatarica) и двух популяций с разными подтипами промежуточного С3-С4-вида (Sedobassia sedoides) в процессе адаптации к ПЭГ-индуцированному умеренному осмотическому стрессу (‒0.4…–0.5 МПа) (рис. 1).
Рис. 1.
Сухая биомасса надземной части растений С3-вида (Atriplex verrucifera) (а), растений из двух популяций П1 (1) и П2 (2) С4-вида Atriplex tatarica (б) и двух популяций М (1) и П (2) С3-С4-вида Sedobassia sedoides (в) в условиях ПЭГ-индуцированного умеренного осмотического стресса. Достоверные различия на уровне P < 0.05 отмечены разными буквами.
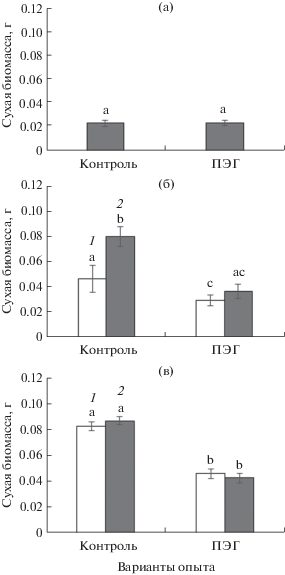
В ходе проведенных экспериментов установлено, что в контрольных условиях более продуктивными были растения С4-вида A. tatarica и С3‑С4-вида S. sedoides, у которых показатели сухой биомассы оказалась в 2–4 раза выше, чем у С3-вида А. verrucifera (рис. 1а–в). Между популяциями С4-вида наблюдались достоверные различия накопления сухой биомассы, растения популяции П2 были в 1.7 раз более продуктивными по сравнению с популяцией П1 (рис. 1б).
В условиях умеренного осмотического стресса у А. verrucifera накопление сухой биомассы не отличалось от контроля (рис. 1а). У двух популяций A. tatarica установлены различия: если растения П1 в условиях осмотического стресса снижали сухой вес на 30%, то растения П2 – в 2.2 раза (рис. 1б). Таким образом, выявленные различия между популяциями С4-вида A. tatarica показывают, что П1 характеризуется меньшей продуктивностью, но большей устойчивостью к осмотическому стрессу, а П2 – наоборот, является более продуктивной, но менее устойчивой популяцией. У S. sedoides в условиях слабого осмотического стресса обе популяции снижали сухую биомассу примерно в 2 раза (рис. 1в).
Исследование СО2/H2O газообмена при разных концентрациях СО2 (400 и 200 ppm) у С3-вида (Atriplex verrucifera) в условиях ПЭГ-индуцированного умеренного осмотического стресса
Использование низкой концентрации СО2 позволяет исследовать устьичный и метаболический вклад в засухоустойчивость вида, т.к. стимулирует открытие устьиц, а также дает возможность оценить чувствительность устьичного аппарата в целом. При снижении концентрации СО2 в измерительной камере до 200 ppm в контрольных условиях ассимиляция CO2 (интенсивность видимого фотосинтеза, А) у C3-вида (A. verrucifera) снижалась в 9 раз (рис. 2а). Такое значительное снижение связано как с устьичной, так и с метаболической компонентами. Устьичная компонента снижалась в 2 раза, поскольку наблюдалось 2-кратное снижение интенсивности транспирации при снижении концентрации СО2 в измерительной камере (рис. 2б). Метаболическая компонента, как правило, связана с активностью ферментов цикла Кальвина и в данном случае снижалась в 2 раза при 2-кратном снижении концентрации СО2.
Рис. 2.
Параметры СО2/H2O газообмена при разных концентрациях СО2 у С3-вида (A. verrucifera) в условиях ПЭГ-индуцированного умеренного осмотического стресса: (а) – интенсивность видимого фотосинтеза, А; (б) – транспирация, Е; (в) – темновое дыхание, Rd; (г) – эффективность использования воды, WUE. 1 – 400 ppm СО2; 2 – 200 ppm СО2. Разными латинскими буквами отмечены достоверные различия на уровне P < 0.05.
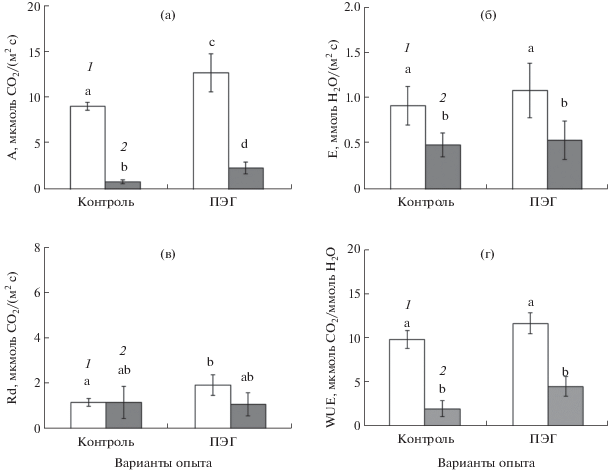
При действии умеренного осмотического стресса в условиях нормальной концентрации СО2 (400 ppm) наблюдалось небольшое возрастание WUE (рис. 2г), что связано с увеличением интенсивности видимого фотосинтеза в 1.4 раза (рис. 2а). При этом интенсивность транспирации не изменялась, т.е. устьица проявляли нечувствительность к осмотическому стрессу (рис. 2б). Увеличение интенсивности видимого фотосинтеза не сказалось на продуктивности (рис. 1а) и это, вероятно, связано с тем, что дополнительные ассимиляты диссипировались в ходе усиленного темнового дыхания (рис. 2в). Таким образом, для С3-вида была характерна высокая чувствительность устьиц при низкой концентрации СО2, хотя и имела место не совсем характерная реакция, а именно закрытие устьиц. При этом в условиях осмотического стресса устьица проявляли нечувствительность.
Исследование СО2/H2O газообмена при разных концентрациях СО2 (400 и 200 ppm) на примере двух популяций С4-вида (Atriplex tatarica) в условиях ПЭГ-индуцированного умеренного осмотического стресса
У С4-вида (A. tatarica) интенсивность видимого фотосинтеза была выше, чем у С3-вида (A. verrucifera) (рис. 2а, 3а). В контрольных условиях при снижении концентрации СО2 в измерительной камере до 200 ppm ассимиляция CO2 у C4-вида снижалась в П1 почти в 1.7 раз, в П2 – более чем в 2 раза (рис. 3а, д). Данное снижение обусловлено, в первую очередь, метаболической компонентой. Ожидаемое усиление транспирации при 200 ppm, связанное с искусственным открытием устьиц [13], произошло только в П2 (рис. 2е). У П1 устьица проявляли нечувствительность к низкой концентрации СО2 (рис. 3б). Можно предположить, что степень рассогласования компонентов энергетического и водного обмена и диссипации энергии у П1 при 200 ppm была ниже, чем у П2, поскольку колебания интенсивности темнового дыхания и снижение WUE было выражено в меньшей степени, чем у П2 (рис. 3в, г, ж, з).
Рис. 3.
Параметры СО2/H2O газообмена при разных концентрациях СО2 у растений популяции П1 (а–г) и популяции П2 (д–з) С4-вида (Atriplex tatarica) в условиях ПЭГ-индуцированного умеренного осмотического стресса: (а, д) – интенсивность видимого фотосинтеза, А; (б, е) – транспирация, Е; (в, ж) – темновое дыхание, Rd; (г, з) – эффективность использования воды, WUE. 1 – 400 ppm СО2; 2 – 200 ppm СО2. Достоверные различия (на уровне Р < 0.05) внутри популяций отмечены разными латинскими буквами, между популяциями – звездочкой.
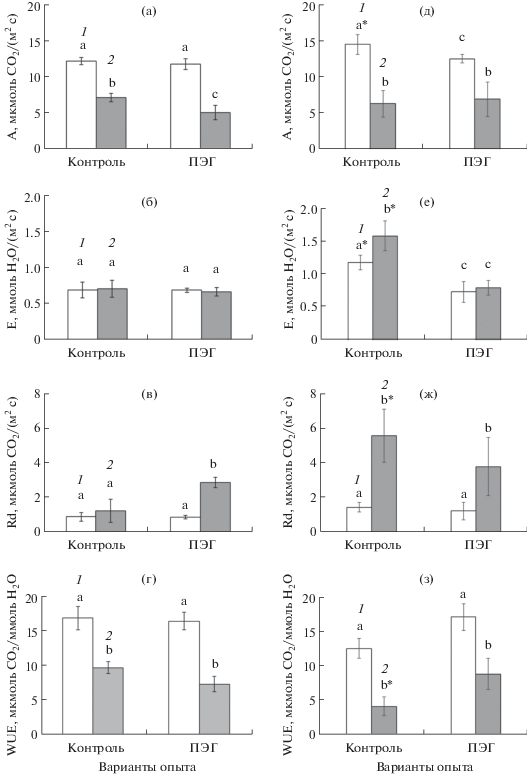
При действии умеренного осмотического стресса в условиях нормальной концентрации СО2 (400 ppm) интенсивность видимого фотосинтеза в П1 не изменялась, а в П2 имело место достоверное снижение (рис. 3а, д), которое в значительной степени связано с закрытием чувствительных устьиц, поскольку транспирация в условиях осмотического стресса снижалась в 1.7 раз по сравнению с контрольным вариантом (рис. 3е). Изменение интенсивности видимого фотосинтеза в условиях ПЭГ-индуцированного стресса у П2 отразилось на продуктивности (рис. 1б).
Таким образом, растения из двух исследуемых популяций С4-вида продемонстрировали разные способы поддержания СО2/H2O газообмена листьев. Популяция П1 оказалась более устойчивой: в условиях осмотического стресса и низкой концентрации СО2 (200 ppm) она характеризовалась нечувствительностью устьичного аппарата (рис. 3а, 3б). Снижение ассимиляции CO2 почти в 2 раза при 200 ppm связано с метаболической компонентой. Вторая популяция П2 в контрольных условиях была более продуктивной по интенсивности фотосинтеза (рис. 3д) и накоплению сухой биомассы (рис. 1б). При действии 200 ppm устьица проявили чувствительность, наблюдалось их открытие (рис. 3е). Происходящее при этом снижение ассимиляции CO2 более чем в 2 раза связано, в первую очередь, с метаболической компонентой и недостатком в камере СО2. Слабая устойчивость растений П2 к осмотическому стрессу проявилась через снижение интенсивности видимого фотосинтеза, главным образом, за счет устьичной составляющей, поскольку в данной популяции поддержание водного статуса листьев достигалось путем закрытия устьиц.
Исследование СО2/H2O газообмена при разных концентрациях СО2 (400 и 200 ppm) на примере двух популяций промежуточного С3–С4- вида (Sedobassia sedoides) в условиях умеренного ПЭГ-индуцированного осмотического стресса
Интенсивность видимого фотосинтеза (А) при низкой концентрации СО2 (200 ppm) в контрольных условиях снижалась у популяции М в 2 раза, а у популяции П – в 3 раза (рис. 4а, 4д), т.е. реакция растений на низкую концентрацию СО2 у С3–С4-вида была подобной реакции С4-вида, несмотря на разную природу УКМ: у С4 – аспартатный, а у С3–С4– фотодыхательный . При этом абсолютные значения А были ниже у С3–С4-вида (рис. 3а, 3д; 4а, 4д). Интенсивность транспирации при 200 ppm снижалась приблизительно в 2 раза в обеих популяциях, т.е. устьица проявляли чувствительность и закрывались (как у растений С3-вида A. verrucifera). Таким образом, снижение интенсивности видимого фотосинтеза у растений популяции М связано, в первую очередь, с устьичной составляющей, а у растений П – как с устьичной, так и с метаболической компонентами.
Рис. 4.
Параметры СО2/H2O газообмена у растений популяции М (а–г) и популяции П (д–з) промежуточного С3‒С4-вида (Sedobassia sedoides) при разных концентрациях СО2 в условиях ПЭГ-индуцированного умеренного осмотического стресса: (а, д) – интенсивность видимого фотосинтеза, А; (б, е) – транспирация, Е; (в, ж) – темновое дыхание, Rd; (г, з) – эффективность использования воды, WUE. 1 – 400 ppm СО2; 2 – 200 ppm СО2. Достоверные различия (на уровне Р < 0.05) внутри популяций отмечены разными латинскими буквами, между популяциями – звездочкой.
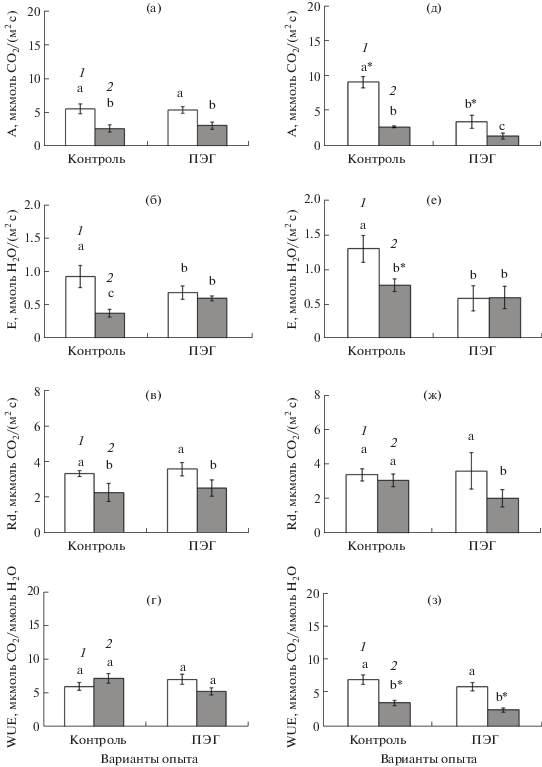
В условиях умеренного осмотического стресса при нормальной концентрации СО2 (400 ppm) интенсивность видимого фотосинтеза у растений популяции М достоверно не изменялась, а у растений популяции П снижалась в 3 раза (рис. 4а, 4д). Снижение ассимиляции СО2 у растений популяции П связано, в первую очередь, с закрытием устьиц, поскольку интенсивность транспирации при этом снижалась (относительно контрольного варианта) более чем в 2 раза (рис. 4е). У растений популяции М транспирация изменялась в меньшей степени (на 25%), т.е. устьица проявляли слабую чувствительность к ПЭГ-индуцированному стрессу (похожая реакция была у популяции П1 С4-вида). У растений обеих популяций наблюдалась вариабельность темного дыхания (рис. 4в, ж). Популяции С3-С4-вида характеризовались самыми низкими значениями WUE (в контроле). При этом у растений популяции М эффективность использования воды не реагировала на низкую концентрацию СО2 и на умеренный осмотический стресс, в то время как у растений популяции П при 200 ppm она снижалась в 2 раза, т.к. устьица проявляли чувствительность (рис. 4г, з). Таким образом, С3–С4-вид демонстрировал черты, сходные как с С3-, так и с С4-видами.
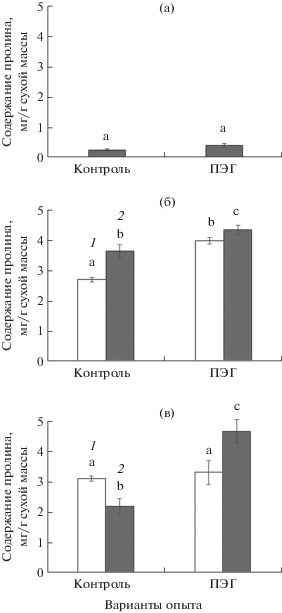
Содержание пролина у С3-, С4- и С3–С4-видов сем. Chenopodiaceae в условиях ПЭГ-индуцированного умеренного осмотического стресса
Самые низкие значения содержания пролина в контроле были у С3-вида A. verrucifera (рис. 5а), а воздействие умеренного осмотического стресса на него не выявило достоверных изменений. Содержание пролина у С4-вида A. tatarica в контроле было почти в 10 раз выше по сравнению с А. verrucifera (рис. 5а, б). В условиях осмотического стресса растения популяции П1 продемонстрировали возрастание содержания пролина в 1.5 раза, а в популяции П2 – на 20% (рис. 5б). У растений популяции М промежуточного С3-С4-вида S. sedoides содержание пролина в контроле было в 1.4 раза выше, чем у популяции П, и не изменялось в условиях ПЭГ-индуцированного осмотического стресса (рис. 5в). У растений популяции П наблюдалось возрастание содержания пролина более чем в 2 раза в условиях стресса.
Рис. 5.
Содержание пролина у растений С3-вида (Atriplex verrucifera) (а), растений из двух популяций П1 (1) и П2 (2) С4-вида Atriplex tatarica (б) и двух популяций М (1) и П (2) С3-С4-вида Sedobassia sedoides (в) в условиях ПЭГ-индуцированного умеренного осмотического стресса. Разными латинскими буквами отмечены достоверные различия на уровне Р < 0.05.
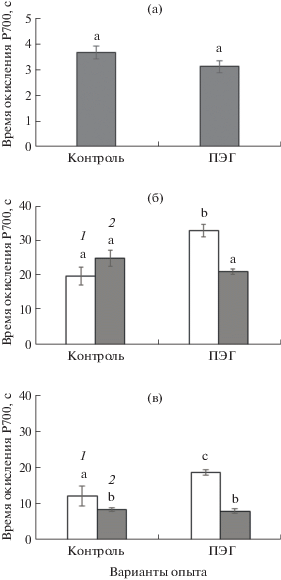
Эффективность ФС I и активность циклического транспорта электронов у С3-, С4- и С3–С4-видов сем. Chenopodiaceae в условиях ПЭГ-индуцированного умеренного осмотического стресса
Измерения ФС I показали, что значения времени выхода кинетической кривой окисления P700 на плато у растений исследуемых видов отличались. У растений С3-вида, популяции П2 С4-вида и популяции П промежуточного С3-С4-вида этот показатель в условиях осмотического стресса не изменялся (рис. 6). У растений популяции П1 С4-вида наблюдалось его возрастание в условиях осмотического стресса в 1.7 раз (рис. 6б), а у популяции М С3–С4-вида – в 1.6 раз (рис. 6в).
Рис. 6.
Эффективность ФС I у растений С3-вида (Atriplex verrucifera) (а), растений из двух популяций П1 (1) и П2 (2) С4-вида Atriplex tatarica (б) и двух популяций М (1) и П (2) С3–С4-вида Sedobassia sedoides (в) в условиях ПЭГ-индуцированного умеренного осмотического стресса. Разными латинскими буквами отмечены достоверные различия на уровне Р < 0.05.
ОБСУЖДЕНИЕ
Открытие или закрытие устьиц у растений обусловлено совокупностью действующих внешних и внутренних сигналов [18], а также чувствительностью устьиц, которая различается у разных видов [19]. Как известно, устьица открываются в ответ на свет (исключение составляют устьица САМ растений), низкую концентрацию CO2, высокую температуру и низкий уровень дефицита давления пара, в то время как закрытие стимулируется низким освещением или темнотой, высоким уровнем CO2 и дефицита давления пара [20]. Использование низкой концентрации СО2 в эксперименте при измерении СО2/H2O газообмена позволяет искусственно управлять открытием устьиц, оценивать устьичный и метаболический вклад в засухоустойчивость, тестировать чувствительность устьичного аппарата к внешним воздействиям [8, 13].
Используемый в нашей работе С3-вид A. verrucifera является засухоустойчивым (ксерогалофитом), имеет черты суккулентности [15], характеризуется низкой скоростью роста. При концентрации СО2 200 ppm ожидаемого усиления транспирации, обусловленного искусственным открытием устьиц, характерного для С3-растений [13], в нашем эксперименте не произошло. Имело место существенное снижение транспирации в 2 раза, что свидетельствует о высокой чувствительности устьиц и их быстром закрытии у С3-вида (рис. 2б). Хотя эта реакция не характерна для С3-вида, тем не менее, подобные результаты были ранее получены на пшенице [13]. У A. verrucifera при низкой концентрации СО2 наблюдались большие колебания интенсивности темнового дыхания и снижение WUE (в 5 раз), что свидетельствует о рассогласовании процессов СО2/H2O газообмена (рис. 2в, г). Таким образом, для С3-вида A. verrucifera характерна высокая чувствительность устьиц к низкой концентрации СО2 и слабая чувствительность к умеренному осмотическому стрессу.
Как известно, С4-растения имеют метаболические преимущества по сравнению с С3-видами, благодаря наличию углерод-концентрирующего механизма, одного из наиболее конвергентных эволюционных явлений в биологическом мире. Считается, что в ходе формирования С4 фотосинтеза УКМ возник как минимум в 66 независимых эволюционных линиях [11]. Эволюционное развитие C4-линий в течение 30 млн лет осуществлялось при относительно низких атмосферных концентрациях CO2, примерно, в 2 раза ниже современного уровня, что привело к снижению проводимости устьиц, их более низкой чувствительности (более медленные реакции устьиц на затенение) и более высокой абсолютной эффективности использования воды, что в результате обеспечило преимущество C4-видов по сравнению с С3-растениями [13]. С целью выявления причин слабой засухоустойчивости С4-растений и анализа вклада отдельных составляющих энергетического обмена в процессе адаптации исследовали действие умеренного осмотического стресса на рост, СО2/H2O газообмен листьев растений двух контрастных по продуктивности популяций (П1 и П2) ксерогалофита A. tatarica (С4 НАД-МЭ тип). Данные популяции в естественных условиях произрастания достоверно различались более чем в 2 раза по длине побегов (21 ± 0.8 и 48 ± 3.3 см) и в 10 раз по сырой и сухой биомассе (0.9 ± 0.1 и 13.7 ± 3.0 г; 0.3 ± 0.01 и 2.9 ± 0.62 г, соответственно) [15]. При проведении модельных экспериментов в лабораторных условиях в ходе исследования влияния ПЭГ-индуцированной засухи на морфофизиологические параметры, были выявлены достоверные различия между исследуемыми популяциями. Так, в контрольных условиях более продуктивной по накоплению сухой биомассы была популяция П2 по сравнению с П1 (рис. 1б). В условиях умеренного осмотического стресса популяция П2 проявляла меньшую устойчивость и снижала накопление сухой биомассы в 2.2 раза. У менее продуктивной популяции П1 снижение ростовых параметров в условиях осмотического стресса было выражено в меньшей степени (на 30%). Таким образом, выявленные различия между популяциями С4-вида A. tatarica показывают, что популяция П1 характеризуется меньшей продуктивностью, но большей устойчивостью к осмотическому стрессу, а П2, наоборот, является более продуктивной, но менее устойчивой популяцией (рис. 1б).
Растения из двух исследуемых популяций С4-вида продемонстрировали разные способы поддержания СО2/H2O газообмена листьев в условиях осмотического стресса и низкой концентрации СО2 (200 ppm). Популяция П1 оказалась более устойчивой и характеризовалась нечувствительностью устьичного аппарата (рис. 3а, б). Снижение ассимиляции CO2 при концентрации 200 ppm связано с метаболической компонентой, т.е. со снижением активности ферментов цикла Кальвина, вызванного нехваткой основного ресурса. У более продуктивной (по интенсивности фотосинтеза и накоплению сухой биомассы), но менее устойчивой популяции П2 при действии 200 ppm CO2 наблюдалось открытие устьиц, т.е. устьица проявляли чувствительность. Снижение ассимиляции CO2 при этом также связано с метаболической компонентой. Слабая устойчивость к осмотическому стрессу проявлялась через снижение интенсивности видимого фотосинтеза, в первую очередь за счет устьичной составляющей, поскольку в популяции П2 поддержание водного баланса листьев при стрессе достигалось путем закрытия устьиц. Таким образом, растения из менее устойчивой популяции П2 продемонстрировали высокую чувствительность устьиц, высокую степень рассогласования и диссипации, которая проявлялась в виде колебания интенсивности темнового дыхания при действии низкой концентрации СО2 (рис. 3ж).
В условиях осмотического стресса у более устойчивой популяции A. tatarica имело место снижение водного потенциала (неопубликованные данные), усиление циклического транспорта электронов ФС I и увеличение содержания пролина. На C4-растениях рода Flaveria установлено, что С4-виды проявляют более высокую активность циклического переноса электронов, чем С3-растения [21]. Это связано с тем, что у данных растений функционально активны как C3-, так и C4-цикл, что приводит к повышению энергетической стоимости ассимиляции СО2 по сравнению с С3-видами. Как следствие, две дополнительные молекулы АТФ требуются для каждой молекулы CO2, фиксированной в результате действия C4-цикла. Предполагается, что дополнительные молекулы АТФ производятся с помощью циклического транспорта электронов ФС I, что способствует генерации градиента рН на тилакоидной мембране без образования НАДФ·Н [21]. В наших исследованиях показано, что в условиях осмотического стресса у популяции П1 A. tatarica наблюдалось значительное увеличение содержания пролина (рис. 5б) и возрастание эффективности ФС I (рис. 6б). Можно предположить, что главным фактором поддержания водного баланса листа при стрессе у данной популяции является снижение водного потенциала в подустьичной полости при участии пролина в условиях постоянной транспирации. Источником дополнительной энергии может быть циклический транспорт электронов ФС I. Таким образом, сравнивая С3- и С4-виды сем. Chenopodiaceae можно сказать, что при низкой и нормальной концентрациях СО2 C4-виды имеют преимущества по сравнению с C3-видами из-за высокой интенсивности ассимиляции CO2, более низкой чувствительности устьиц и более высокой абсолютной эффективности использования воды. У П1 – менее продуктивной, но более устойчивой С4-популяции – высокие значения эффективности использования воды свидетельствуют о более высоком уровне согласования СО2 и H2O газообмена листьев. Как следует из изменений интенсивности темнового дыхания (повышенный уровень вариабельности), более высокий уровень рассогласования и диссипации у С3-видов имеет место в условиях низкой концентрации СО2 и умеренного осмотического стресса, у С4-видов – при низкой концентрации СО2.
Интересной и перспективной моделью изучения возникновения и эволюционного преобразования С4-пути являются промежуточные С3–С4-виды. Показано, что одним из путей формирования углерод-концентрирующего механизма является видоизменение фотодыхания [11], направленное на возвращение фотодыхательного СО2, количество которого в условиях засухи и высокой температуры очень высоко [22]. Данный фотодыхательный углеродный насос, так называемый “C2-фотосинтез”, использует фотодыхательный шаттл глицина для концентрирования CO2 в клетках обкладки [11]. С2-фотосинтез рассматривается как “эволюционный мост” между С3- и С4-растениями [12]. Данный путь на сегодняшний день показан и изучен на основе филогенетического анализа гликофитов рода Flaveria (сем. Asteraceae) [11, 23]. С3–С4-виды подразделяются на отдельные подтипы, соответствующие последовательным этапам С4-эволюции: С3 – прото-Кранц – С2 (I и II тип) – С4-подобные – С4 [11], и отражающие степень формирования С4-углерод-концентрирующего механизма. Промежуточные С3–С4-виды с С2-фотосинтезом определены также в сем. Chenopodiaceae [11]. В частности, представителем данного семейства является ксерогалофит Sedobassia sedoides (синоним Bassia sedoides), который был отнесен к С3–С4 промежуточным видам на основе анатомических особенностей [24], а также анализа газообмена и иммунолокализации глициндекарбоксилазы [25].
Ранее на примере двух популяций S. sedoides нами была показана генетическая пластичность в стрессовых условиях, которая проявлялась во внутривидовых различиях в устойчивости к осмотическому стрессу [26] и к засолению [27, 28]. С целью изучения механизмов засухоустойчивости на разных этапах формирования С4-фотосинтеза в процессе эволюции мы исследовали две популяции М и П промежуточного С3–С4-вида (S. sedoides), отличающиеся по продуктивности и устойчивости в естественных условиях произрастания. Предварительные эксперименты показали, что растения популяции М более продуктивны и устойчивы, а растения популяции П – низкопродуктивны и менее устойчивы [28]. В настоящих экспериментах при низкой концентрации СО2 обе популяции S. sedoides продемонстрировали связанное с метаболической и устьичной компонентами снижение интенсивности видимого фотосинтеза у растений популяции М в 2 раза, популяции П – в 3 раза. У обеих популяций наблюдалось рассогласование СО2 обмена, что проявлялось в вариабельности темнового дыхания. Однако растения популяции М проявляли большую стабильность, так как у них WUE изменялось незначительно. У растений популяции П снижение WUE при низкой концентрации СО2 свидетельствовало о значительном снижении ассимиляции СО2 в большей степени за счет метаболической компоненты, в отличие от растений популяции М.
Сравнительная оценка вклада отдельных составляющих энергетического обмена: фотосистемы I и циклического транспорта электронов, видимого фотосинтеза, темнового дыхания у С3‑ (Atriplex verrucifera), С4- (A. tatarica) и промежуточного С3–С4- (Sedobassia sedoides) видов сем. Chenopodiaceae в процесс адаптации к ПЭГ-индуцированному осмотическому стрессу представлена в таблице 1. Подводя итог сравнительного анализа механизмов устойчивости у представителей разных видов, отличающихся типом фотосинтетического метаболизма, в условиях осмотического стресса можно сформулировать следующие выводы (табл. 1):
Таблица 1.
Сравнительная оценка вклада составляющих СО2/H2O обмена: видимого фотосинтеза, транспирации, темнового дыхания в механизмы засухоустойчивости, а также данные по биомассе, содержанию пролина, эффективности циклического транспорта электронов у С3- (Atriplex verrucifera), С4- (A. tatarica) и промежуточного С3–С4- (Sedobassia sedoides) видов растений сем. Chenopodiaceae в условиях ПЭГ-индуцированного осмотического стресса при нормальной и низкой концентрации СО2
| Условия и итоговый вывод | Снижение устойчивости к осмотическому стрессу
 |
||
|---|---|---|---|
| С3-вид (Atriplex verrucifera) |
С4-вид (Atriplex tatarica) | ||
| П1 (устойчивая популяция) | П2 (неустойчивая популяция) | ||
| Низкая концентрация СО2 (200 ppm) | Устьица чувствительные
(закрываются). Темновое дыхание вариабельно. WUE снижается в 5 раз |
Устьица нечувствительные. Темновое дыхание вариабельно. WUE снижается почти в 2 раза |
Устьица чувствительные (открываются). Темновое дыхание вариабельно, может возрастать в 2–3 раза (диссипация). WUE снижается в 3 раза |
| Умеренный осмотический ПЭГ-индуцированный стресс (при 400 ppm СО2) | Сухой вес не изменяется. Устьица нечувствительные Темновое дыхание вариабельно, возрастает (диссипация). Содержание пролина не изменяется. Циклический транспорт ФСI не изменяется или снижается [29]. WUE не изменяется |
Сухой вес снижается на 30%. Устьица нечувствительные. Водный потенциал снижается [не опубликованные данные]. Содержание пролина увеличивается в 1.5 раза. Циклический транспорт ФСI усиливается в 1.7 раза. WUE не изменяется |
Сухой вес снижается в 2 раза. Устьица чувствительные (закрываются). Водный потенциал не изменяется [не опубликованные данные]. Содержание пролина увеличивается на 20%. Циклический транспорт ФС I не изменяется. WUE не изменяется |
| С3–С4-вид (Sedobassia sedoides) |
|||
| Популяция М | Популяция П | ||
| Низкая концентрация СО2 (200 ppm) | Устьица чувствительные (закрываются). WUE не изменяется |
Устьица чувствительные (закрываются). WUE снижается в 2 раза |
|
| Умеренный осмотический ПЭГ -индуцированный стресс (при 400 ppm СО2) | Сухой вес снижается в 1.7 раза. Устьица менее чувствительные. Транспирация снижается на 20%. Темновое дыхание вариабельно. Содержание пролина высокое в контроле и не изменяется при осмотическом стрессе. Циклический транспорт ФС I усиливается в 1.6 раза. WUE не изменяется |
Сухой вес снижается в 2 раза. Устьица более чувствительные (закрываются). Транспирация снижается в 2 раза. Темновое дыхание более вариабельно. Содержание пролина увеличивается в 2 раза. Циклический транспорт ФСI не изменяется. WUE не изменяется |
|
| Итоговый вывод о механизмах устойчивости: | Засухоустойчивый С3-вид. Суккулентный. Устьица чувствительные к низкой концентрации СО2 и нечувствительные к осмотическому стрессу. Излишки энергии диссипируются через темновое дыхание | Несмотря на разную природу УКМ, у С4- (аспартатный), у С3–С4- (фотодыхательный) видов, механизмы устойчивости у устойчивых популяций сходны: устьица менее чувствительные к осмотическому стрессу. Фактором поддержания водного баланса листьев при стрессе может быть снижение водного потенциала в подустьичной полости у С4-растений при участии пролина в условиях постоянной транспирации. Источником дополнительной энергии может быть циклический транспорт электронов ФС I | У неустойчивых популяций С4- и С3–С4-видов в условиях осмотического стресса стабилизация водного баланса листьев достигается закрыванием более чувствительных устьиц. Темновое дыхание вариабельно (результат метаболического и энергетического рассогласования). Излишки энергии диссипируются через темновое дыхание |
1. В условиях осмотического стресса С3-вид данного семейства проявил черты засухоустойчивости, суккулентности и характеризовался нечувствительными устьицами. Излишки энергии диссипировались через темновое дыхание.
2. Несмотря на разную природу УКМ (у С4-вида – аспартатный, у С3–С4 – фотодыхательный), механизмы устойчивости у устойчивых популяций подобны: устьица в меньшей степени чувствительны к осмотическому стрессу. Важным фактором поддержания водного баланса клеток листа при стрессе был пролин. Источником дополнительной энергии может быть циклический транспорт электронов ФС I.
3. У неустойчивых популяций С4- и С3–С4-видов в условиях осмотического стресса стабилизация водного баланса листьев достигалась закрыванием устьиц. Темновое дыхание было вариабельно (результат метаболического и энергетического рассогласования) и участвовало в диссипации излишней энергии.
Итак, главной причиной слабой засухоустойчивости некоторых популяций С4-ксерогалофитов сем. Chenopodiaceae является различие в способах поддержания водного баланса листьев. У неустойчивых популяций С4- и С3–С4-видов в условиях осмотического стресса отсутствует механизм стабилизации водного обмена листьев, который есть у устойчивых популяций с С4- и С3–С4-типом фотосинтеза и, несмотря на разную природу УКМ, имеет общие черты. Таким образом, в процессе эволюции совершенствовались УКМ (от фотодыхательного С3-С4 к нормальному С4) и механизм стабилизации Н2О обмена.
Работа выполнена при поддержке проекта Российского фонда фундаментальных исследований № 17-04-00853-а.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Ashraf M., Harris P.J.C. Photosynthesis under stressful environments: An overview // Photosynthetica. 2013. V. 51. P. 163. https://doi.org/10.1007/s11099-013-0021-6
Рахманкулова З.Ф. Взаимосвязь фотосинтеза и дыхания целого растения в норме и при неблагоприятных внешних условиях // Журн. общей биологии. 2002. Т. 63. № 3. С. 44.
Frole K., Gilbert M. Differences in drought sensitivities and photosynthetic limitations between co-occurring C3 and C4 (NADP-ME) Panicoid grasses // Ann. Bot. 2010. V. 105. P. 493. https://doi.org/10.1093/aob/mcp307
Way D.A., Katul G.G., Manzoni S., Vico G. Increasing water use efficiency along the C3-to-C4 evolutionary pathway: A stomatal optimization perspective // J. Exp. Bot. 2014. V. 65. P. 3683. https://doi.org/10.1093/jxb/eru205
Haxeltine A., Prentice I.C., BIOME3: An equilibrium terrestrial biosphere model based on ecophysiological constraints, resource availability, and competition among plant functional types // Global Biogeochem. Cycles. 1996. V. 10. P. 693.
Sage R.F., McKown A.D. Is C4 photosynthesis less phenotypically plastic than C3 photosynthesis? // J. Exp. Bot. 2006. V. 57. P. 303. https://doi.org/10.1093/jxb/erj040
Ghannoum O. C4 photosynthesis and water stress // Ann. Bot. 2009. V. 103. P. 635. https://doi.org/10.1093/aob/mcn093
Osborne C.P., Sack L. Evolution of C4 plants: A new hypothesis for an interaction of CO2 and water relations mediated by plant hydraulics // Phil. Trans. R. Soc. B. 2012. V. 367. P. 583. https://doi.org/10.1098/rstb.2011.0261
Shabala S. Learning from halophytes: Physiological basis and strategies to improve abiotic stress tolerance in crops // Ann. Bot. 2013. V. 112. P. 1209. https://doi.org/10.1093/aob/mct205
Klughammer C., Schreiber U. Measuring P700 absorbance changes in the near infrared spectral region with a dual wavelength pulse modulation system // Photosynthesis: Mechanisms and Effects / Ed. Garab G. Dordrecht: Kluwer Academic Publishers, 1998. V. 5. P. 4357.
Sage P.F., Sage T.L., Kocacinar F. Photorespiration and the evolution of X4 photosynthesis // Annu. Pev. Plant Biol. 2012. V. 63. P. 19. https://doi.ogr/https://doi.org/10.1146/annurev?arplant?042811?105511
Khoshravesh R., Stinson C.R., Stata M., Busch F.A., Sage R.F., Ludwig M., Sage T.L. C3–C4 intermediacy in grasses: Organelle enrichment and distribution, glycine decarboxylase expression, and the rise of C2 photosynthesis // J. Exp. Bot. 2016. V. 67. P. 3065. https://doi.org/10.1093/jxb/erw150
Taylor S.H., Aspinwall M.J., Blackman C.J., Choat B., Tissue D.T., Ghannoum O. CO2 availability influences hydraulic function of C3 and C4 grass leaves // J. Exp. Bot. 2018. V. 69. P. 2731. https://doi.org/10.1093/jxb/ery095
Bellasio C., Quirk J., Buckley T.N., Beerling D.J. A dynamic hydro-mechanical and biochemical model of stomatal conductance for C4 photosynthesis // Plant Physiol. 2017. V. 175. P. 104. https://doi.org/10.1104/pp.17.00666
Шуйская Е.В., Рахманкулова З.Ф., Биктимерова Г.Я., Щербаков А.В., Федяев В.В., Суюндуков Я.Т., Усманов И.Ю. Эколого-физиологический анализ представителей сем. Chenopodiaceae на засоленных почвах Южного Урала // Растительные ресурсы. 2014. Т. 50. С. 614.
Shavrukov Y. Salt stress or salt shock: Which genes are we studying? // J. Exp. Bot. 2013. V. 64. P. 119. https://doi.org/10.1093/jxb/ers316
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205.
Blatt M.R. Cellular signaling and volume control in stomatal movements in plants // Annu. Rev. Cell. Dev. Bio-l. 2000. V. 16. P. 221. https://doi.org/10.1146/annurev.cellbio.16.1.221
Lawson T. Guard cell photosynthesis and stomatal function // New Phytol. 2009. V. 181. P. 13. https://doi.org/10.1111/j.1469-8137.2008.02685.x
Outlaw W.H. Jr. Integration of cellular and physiological functions of guard cells // Crit. Rev. Plant Sci. 2003. V. 22. P. 503. https://doi.org/10.1080/713608316
Nakamura N., Iwano M., Havaux M., Yokota A., Munekage Y.N. Promotion of cyclic electron transport around photosystem I during the evolution of NADPmalic enzyme-type C photosynthesis in the genus Flaveria // New Phytol. 2013. V. 199. P. 832. https://doi.org/10.1111/nph.12296
Vogan P.J., Sage R.F. Effects of low atmospheric CO2 and elevated temperature during growth on the gas exchange responses of C3, C3–C4 intermediate, and C4 species from three evolutionary lineages of C4 photosynthesis // Oecologia. 2012. V. 169. P. 341. https://doi.org/10.1007/s00442-011-2201-z
Sage R.F., Khoshravesh R., Sage T.L. From proto-Kranz to C4 Kranz: Building the bridge to C4 photosynthesis // J. Exp. Bot. 2014. V. 65. P. 3341. https://doi.org/10.1093/jxb/eru180
Kadereit G., Freitag H. Molecular phylogeny of Camphorosmeae (Camphorosmoideae, Chenopodiaceae): Implications for biogeography, evolution of C4 photosynthesis and taxonomy // Taxon. 2011. V. 60. P. 51. https://doi.org/10.1002/tax.601006
Voznesenskaya E.V., Koteyeva N.K., Akhani H., Roalson E.H., Edwards G.E. Structural and physiological analyses in Salsoleae (Chenopodiaceae) indicate multiple transitions among C3, intermediate, and C4 photosynthesis // J. Exp. Bot. 2013. V. 64. P. 3583. https://doi.org/10.1093/jxb/ert191
Shuyskaya E., Rakhmankulova Z., Voronin P., Kuznetsova N., Biktimerova G., Usmanov I. Salt and osmotic stress tolerance of the C3–C4 xero-halophyte Bassia sedoides from two populations differ in productivity and genetic polymorphism // Acta Physiol. Plant. 2015. V. 37. P. 236.
Рахманкулова З.Ф., Шуйская Е.В., Суюндуков Я.Т., Усманов И.Ю., Воронин П.Ю. Различия в устойчивости к осмотическому и ионному фактору солевого стресса двух экотипов С3–C4 ксерогалофита Bassia sedoides // Физиология растений. 2016. Т. 63. С. 372.
Рахманкулова З.Ф., Шуйская Е.В., Воронин П.Ю., Веливецкая Т.А., Игнатьев А.В., Усманов И.Ю. Роль фотодыхания и циклического транспорта электронов в эволюции С4 фотосинтеза на примере промежуточного С3–С4 вида Sedobassia sedoides // Физиология растений. 2018. Т. 65. С. 232.
Рахманкулова З.Ф., Шуйская Е.В., Воронин П.Ю., Усманов И.Ю. Сравнительное изучение устойчивости С3 и С4 ксеро-галофитов рода Atriplex в условиях водного дефицита и засоления // Физиология растений. 2019. Т. 66. С. 112.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


