Физиология растений, 2020, T. 67, № 3, стр. 270-277
цАМФ участвует в регуляции уровня пероксида водорода в корне проростков гороха при биотическом стрессе
Л. А. Ломоватская a, О. В. Кузакова a, А. М. Гончарова a, А. С. Романенко a, *
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии
и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: LidaL@sifibr.irk.ru
Поступила в редакцию 26.06.2019
После доработки 29.07.2019
Принята к публикации 19.08.2019
Аннотация
Изучали взаимосвязь между изменениями концентрации внутриклеточного цАМФ и Н2О2 в зонах роста корня проростков гороха при инфицировании Rhizobium leguminosarum bv. viceae (Rlv), Pseudomonas syringae pv. pisi (Psp), или Clavibacter michiganensis ssp. sepedonicus (Cms). Ранее было установлено, что эти зоны отличались по чувствительности к Rlv. Исследования показали, что наиболее высокий уровень Н2О2 в зонах роста корня проростков гороха детектировался после кратковременной инокуляции, 5 мин, Rlv. Под воздействием как Psp, так и Сms концентрации пероксида были ниже, чем с Rlv и мало отличались между собой и в зонах роста. Во всех трех вариантах в эпикотиле проростков концентрация Н2О2 снижалась примерно на 20% от контроля. В этих условиях концентрация внутриклеточного цАМФ существенно повышалась почти во всех зонах роста корня проростка гороха. В наибольшей степени это происходило при инокуляции Cms. Для повышения внутриклеточного уровня цАМФ использовали различные концентрации экзогенного n-бутирил-цАМФ, хорошо проникающего в клетки. 5 и 10 нМ n-бутирил-цАМФ в одинаковой степени стимулировали Н2О2 во всех зонах, тогда как 50 нМ приводили к снижению концентрации пероксида водорода в зонах корня и эпикотиле. Инкубация в течение 30 мин с 10/50 нМ n-бутирил-цАМФ и последующее инфицирование Rlv, Psp и Cms в течение 5 мин существенно изменяли концентрацию пероксида водорода в зонах роста корня. Для уменьшения концентрации внутриклеточного цАМФ использовали сурамин, ингибитор трансмембранной аденилатциклазы. Под его воздействием концентрация цАМФ в зонах роста корня снижалась примерно на 40% и при этом наблюдалось повышение внутриклеточной концентрации пероксида водорода в тех же зонах и эпикотиле. Последовательная инкубация проростков с сурамином, а затем 5 мин с соответствующими микроорганизмами весьма незначительно понижала концентрацию этой сигнальной молекулы в вариантах с Rlv и Psp, тогда как в варианте “сурамин + Cms” более существенно, до уровня контроля. Сделан вывод о том, что определенный концентрационный статус вторичных мессенджеров в клетках растений под воздействием биотических стрессоров создается, в том числе, путем их взаимного влияния на компоненты других сигнальных систем растений.
ВВЕДЕНИЕ
При любых типах взаимодействия растений с бактериями (патогенез, мутуализм) важны самые ранние этапы, когда растительные сигнальные системы индуцируют новые, соответствующие типу взаимодействия метаболические программы. Большое разнообразие сигнальных молекул и способов трансдукции сигналов увеличивает надежность механизмов устойчивости растений и обеспечивает дифференцированные ответы на различные виды стрессоров [1].
Наиболее подробно роль некоторых вторичных мессенджеров растений изучена на модельной системе бобовых растений с симбиотическими азотфиксирующими бактериями, где показано участие пероксида водорода и оксида азота как сигнальных молекул в контроле ранних этапов азотфиксирующего симбиоза [2, 3]. Также в этой же системе весьма подробно исследована сигнальная роль ионов кальция, в частности, выявлены “кальциевые спайки”, декодирующие поступающие в клетку сигналы от микросимбионтов [4]. Участие циклического аденозинмонофосфата (цАМФ) в стрессовых реакциях растений хорошо исследовано при различных воздействиях [5, 6]. Между тем, очевидно, что все сигнальные молекулы в клетках растений функционируют взаимосвязано, что позволяет их объединить в сигнальную сеть [7–9]. В связи с этим, несмотря на то, что у растений при биотических стрессах довольно подробно изучены механизмы взаимного влияния пероксида водорода, ионов кальция и NO [8, 10], роль цАМФ в регуляции уровня других вторичных мессенджеров остается почти не изученной. Поэтому целью настоящего исследования было изучить влияние изменения концентрации внутриклеточного цАМФ на изменение уровня пероксида водорода в клетках корня проростков гороха при инфицировании Rhizobium leguminosarum bv. viceae, Pseudomonas syringae pv. pisi и Clavibacter michiganensis ssp. sepedonicus.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили трехсуточные проростки гороха (Pisum sativum, сорт Рондо) и планктонные культуры Rhizobium leguminosarum bv. viceae (эффективный штамм 1022), Pseudomonas syringae pv. pisi (штамм 1845) и Clavibacter michiganensis sps. sepedonicus (штамм 6889). Бактериальные культуры выращивали в колбах на жидкой среде, содержащей 10 г/л диализата дрожжевого экстракта и 15 г/л глюкозы, рН 7.0. Плотность планктонной культуры бактерий определяли на планшетном спектрофотометре “Униплан” (Россия) при длине волны 655 нм. Семена гороха последовательно стерилизовали и промывали 30 мин в 94% этаноле, 5 мин в 3% пероксиде водорода и 5 мин в 5% растворе перманганата калия. На конечном этапе отмывали стерильной водой и замачивали при 56°С на 4 ч. Затем семена проращивали в стерильных чашках Петри на увлажненной фильтровальной бумаге в течение 3 сут в темноте при 23–25°С. Для экспериментов отбирали проростки с длиной корня 35–40 мм.
Инкубация проростков гороха с n-бутирил-цАМФ. Для увеличения внутриклеточного уровня цАМФ в корнях проростков гороха, их инкубировали 30 мин с различными концентрациями n-бутирил-цАМФ (5/10/30/50 нМ). После окончания экспозиции проростки промывали водой и, в одном варианте опыта сразу анализировали на содержание Н2О2, в другом неотделенные корни проростков инкубировали еще 5 мин с одной из культур бактерий. После окончания экспозиций корни проростков делили на следующие зоны: I меристема, 2 мм; II зона без корневых волосков, 2–7 мм; III зона, содержащая зачатки корневых волосков, 7–12 мм; IV зона молодых корневых волосков, 12–17 мм; V зона закончивших рост корневых волосков, 17–22 мм от кончика корня. В этих зонах определяли концентрацию Н2О2 и цАМФ.
Титр бактерий для инокуляции составлял 107/мл. Влияние n-бутирил-цАМФ (опыт) оценивали, сравнивая с соответствующим результатом у проростков, экспонированных на воде (контроль). Влияние n-бутирил-цАМФ + бактерии (опыт) определяли, принимая за контроль вариант с соответствующей концентрацией n-бутирил-цАМФ.
Инкубация проростков гороха с сурамином. Для уменьшения концентрации внутриклеточного цАМФ проростки гороха на 30 мин помещали в 800 мкМ раствор сурамина, ингибитора трансмембранной аденилатциклазы [11], приготовленный на 0.3% растворе диметилсульфоксида (для облегчения проникновения). Далее проростки отмывали водой и в первом случае сразу использовали для определения концентрации пероксида водорода и цАМФ, во втором случае 5 мин инкубировали с суспензией одного из видов бактерий, а затем проводили анализ содержания Н2О2 и цАМФ. Результаты выражали в % к контролю. Влияние сурамина (опыт) определяли, сравнивая с соответствующим результатом у проростков, экспонированных на воде (контроль); последовательное влияние сурамина + бактерии (опыт) – принимая за контроль вариант “сурамин”.
Определение концентрации цАМФ. Для определения концентрации цАМФ корни проростков фиксировали в жидком азоте, разрезали по зонам, которые затем растирали в среде выделения следующего состава: 0.02 М фосфатный буфер, рН 7.2; 10 мМ теофиллин (ингибитор 3',5'-цАМФ фосфодиэстеразы); 1 мМ дитиотрейтол (протектор SH-групп); 50 мкг/мл фенилметилсульфонилфторид (ФМСФ, ингибитор сериновых протеаз), 50 мкг/мл гидроксимеркурийбензоат (ГМБ, ингибитор цистеиновых протеаз); 1 мкг/мл лейпептин (ингибитор протеаз). Для отделения обломков клеточных стенок гомогенат центрифугировали при 16 000 g 20 мин (“Allegra 64 R”, США). Полученный супернатант центрифугировали при 105 000 g 90 мин (“SorvallDiscovery 90 SE”, США). Полученный осадок отбрасывали, а супернатант нагревали до 100°С в течение 3 мин для инактивации ферментов. Концентрацию цАМФ в нем определяли иммуноферментным анализом (ELISA) [5]. Содержание цАМФ в клетках корня проростков гороха выражали в нмоль на мг белка. Белок в пробе определяли по методу Брэдфорд.
Определение внутриклеточной концентрации Н2О2. Концентрацию пероксида водорода в зонах корня гороха определяли в тех же образцах FOX-методом, основанном на изменении окраски ксиленолового оранжевого и выражали в мкмоль на мг белка.
Все эксперименты проводили в 3-кратной биологической повторности. Определение уровня цАМФ и Н2О2 – в 8-кратных аналитических повторностях. Результаты экспериментов обработаны статистически с помощью программы SigmaPlot 12.3. На графиках представлены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Сравнительный анализ показал, что наиболее высокий уровень Н2О2 в зонах роста корня проростков гороха детектировался после кратковременной инокуляции, 5 мин, Rlv: самая высокая концентрация наблюдалась во II и III зонах, тогда как в IV и V зонах достоверно снижалась, тем не менее, оставаясь выше контроля (рис. 1). Интересно, что под воздействием как Psp, так и Сms значения концентраций пероксида водорода мало отличались между собой, однако были ниже, чем с Rlv. Кроме того, в этих вариантах почти не наблюдалось отличий по этому показателю в зонах роста. Следует заметить, что во всех трех вариантах в эпикотиле проростков концентрация Н2О2 снижалась практически одинаково, примерно на 20% от контроля (рис. 1). В то же время при инфицировании концентрация внутриклеточного цАМФ повышалась почти во всех зонах роста корня проростка гороха. В наибольшей степени это происходило при инокуляции Cms (табл. 1).
Рис. 1.
Изменение содержания Н2О2 в зонах роста корня проростков гороха при инфицировании в течение 5 мин R. leguminosarum bv. vicea, P. syringaepv. pisi, C. michiganensiss sp. sepedonicus. Содержание Н2О2 в контроле по зонам роста корня, мкмоль/мг белка: 1 – I зона, 14.8 ± 1.3; 2 – II зона, 13.0 ± 1.1; 3 – III зона, 13.0 ± 1.1; 4 – IV зона, 15.3 ± 1.2; 5 – V зона, 17.0 ± 1.5; 6 – эпикотиль, 36.0 ± 2.9. Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.01.
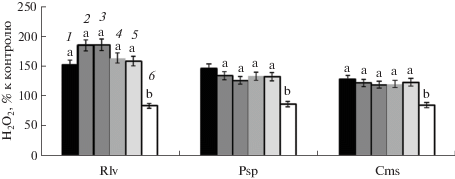
Таблица 1.
Влияние инфицирования и сурамина на изменение содержания цАМФ в клетках зон корня и эпикотиле проростков гороха, нмоль/мг белка
| Вариант | Зоны | |||||
|---|---|---|---|---|---|---|
| I | II | III | IV | V | эпикотиль | |
| Контроль | 5.2 ± 0.5 | 4.2 ± 0.38 | 3.6 ± 0.31 | 3.4 ± 0.32 | 3.5 ± 0.33 | 3.4 ± 0.31 |
| Rlv | 5.3 ± 0.3 | 5.0 ± 0.32 | 4.8 ± 0.39 | 5.0 ± 0.3 | 5.2 ± 0.4 | 3.3 ± 0.2 |
| Psp | 4.3 ± 0.3 | 5.0 ± 0.3 | 4.3 ± 0.3 | 4.9 ± 0.42 | 5.0 ± 0.49 | 3.5 ± 0.33 |
| Cms | 18.8 ± 1.6 | 21.6 ± 1.9 | 17.2 ± 1.3 | 19.3 ± 1.85 | 21.2 ± 1.9 | 26.9 ± 2.1 |
| Сурамин | 2.2 ± 0.21 | 1.7 ± 0.15 | 1.4 ± 0.12 | 1.5 ± 0.14 | 1.6 ± 0.13 | 3.4 ± 0.3 |
| Сурамин + Rlv | 2.7 ± 0.21 | 2.0 ± 0.18 | 1.6 ± 0.11 | 1.6 ± 0.12 | 1.8 ± 0.12 | 3.5 ± 0.3 |
| Сурамин + Psp | 2.2 ± 0.21 | 2.1 ± 0.18 | 1.9 ± 0.15 | 1.5 ± 0.15 | 1.3 ± 0.1 | 3.3 ± 1.2 |
| Сурамин + Cms | 2.4 ± 0.1 | 2.3 ± 0.2 | 1.9 ± 0.18 | 1.9 ± 0.17 | 1.8 ± 0.16 | 3.6 ± 0.29 |
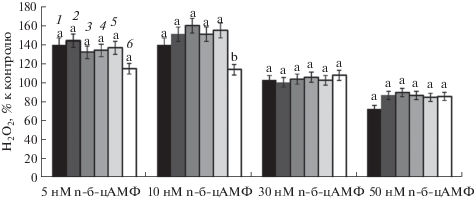
Для выявления возможной роли цАМФ в регуляции внутриклеточной концентрации Н2О2 в зонах роста корня проростков гороха, последние инкубировали 30 мин на растворах с различными концентрациями n-бутирил-цАМФ – жирорастворимого цАМФ, легко проникающего через клеточную стенку и плазмалемму [12]. Эксперименты выявили концентрационную зависимость изменения содержания внутриклеточного пероксида водорода в зонах роста корня проростков гороха от n-бутирил-цАМФ (рис. 2). 5 и 10 нМ n-бутирил-цАМФ практически в одинаковой степени стимулировали концентрацию Н2О2 во всех зонах, за исключением эпикотиля. 30 нМ не влияли на этот показатель, тогда как 50 нМ этого же соединения приводили к снижению концентрации пероксида водорода в зонах корня и эпикотиле (рис. 2).
Рис. 2.
Влияние n-бутирил-цАМФ на изменение концентрации Н2О2 в зонах роста корня проростков гороха. Контролем служили проростки, инкубированные на воде. 1 – I зона; 2 – II зона; 3 – III зона; 4 – IV зона; 5 – V зона; 6 – эпикотиль. Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.01.
Для дальнейших исследований были выбраны концентрации 10 и 50 нМ n-бутирил-цАМФ, как оказавшие наиболее выраженные эффекты. Инкубация в течение 30 мин с n-бутирил-цАМФ и последующее инфицирование Rlv, Psp и Cms в течение 5 мин существенно изменили концентрационную динамику пероксида водорода в зонах роста корня и эпикотиле (рис. 3).
Рис. 3.
Влияние 10 нМ (а) и 50 нМ (б) n-бутирил-цАМФ на изменение концентрации Н2О2 в зонах роста корня проростков гороха при инфицировании R. leguminosarum bv. vicea, P. syringae pv. pisi, C. michiganensis ssp. sepedonicus. 1 – I зона; 2 – II зона; 3 – III зона; 4 – IV зона; 5 – V зона; 6 – эпикотиль. Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.01.
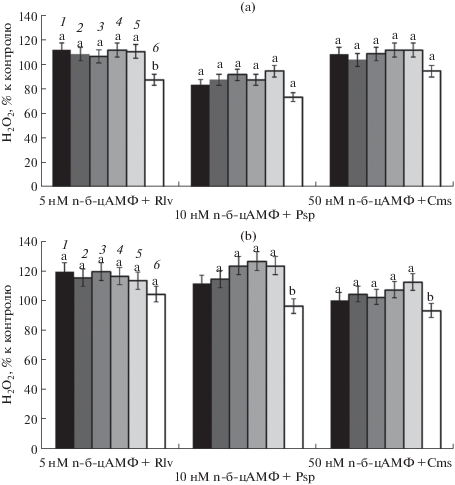
Воздействие Rlv на фоне обеих концентраций n-бутирил-цАМФ в одинаковой степени незначительно снижало уровень пероксида водорода по сравнению с вариантом “n-бутирил-цАМФ без инфицирования”: во всех зонах роста корня концентрация Н2О2 оставалась выше контроля на 10–15%, за исключением эпикотиля, где при 10 нМ n-бутирил-цАМФ этот показатель был ниже контроля примерно на 15%. Под воздействием Psp после 10 нМ n-бутирил-цАМФ концентрация Н2О2 в зонах роста корня была близка к контролю и сопоставима с таковой в варианте “Psp”, однако под воздействием 50 нМ n-бутирил-цАМФ и последующего инфицирования этот показатель поднялся примерно на 20% выше контроля. Инфицирование Cms в этих же условиях практически не оказало влияния (в пределах ошибки) на концентрацию пероксида водорода в зонах роста корня и эпикотиле (рис. 3а, 3б).
Поскольку проведенные эксперименты показали, что экзогенный цАМФ может влиять на концентрацию внутриклеточного пероксида водорода, вероятно, за счет повышения его внутриклеточного содержания, в следующей серии экспериментов исследовали изменение концентрации пероксида водорода в зонах роста корня и эпикотиле проростков гороха на фоне пониженного уровня внутриклеточного цАМФ. Для этого использовали 800 мкМ раствор сурамина, специфического ингибитора трансмембранной аденилатциклазы (тАЦ), разобщающего связь рецептора с G-белком. Исследования показали, что под его воздействием содержание цАМФ в зонах роста корня снижалось примерно на 40% (табл. 1) и при этом наблюдалось повышение внутриклеточной концентрации пероксида водорода во всех зонах корня и эпикотиле (рис. 4).
Рис. 4.
Влияние сурамина на концентрацию Н2О2 в зонах роста корня проростков гороха при инфицировании R. leguminosarum bv. vicea, P. syringae pv. pisi, C. michiganensis ssp. sepedonicus. 1 – I зона; 2 – II зона; 3 – III зона; 4 – IV зона; 5 – V зона; 6 – эпикотиль. Для значений, отмеченных разными буквами, различия достоверны при Р ≤ 0.01.
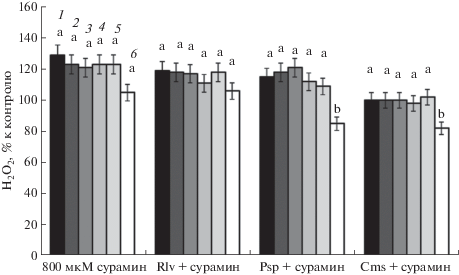
Последовательная инкубация проростков с сурамином, а затем 5 мин с соответствующими микроорганизмами весьма незначительно понижала концентрацию этой сигнальной молекулы в вариантах с Rlv и Psp (рис. 4), тогда как в варианте “сурамин + Cms” наблюдалось понижение уровня Н2О2 до уровня контроля во всех зонах корня. Несмотря на то, что в эпикотиле во всех вариантах эксперимента этот показатель был ниже, чем в других зонах, но только под воздействием Psp и Cms он снижался на 20% относительно контроля.
ОБСУЖДЕНИЕ
Одной из наиболее хорошо изученных неспецифических защитных реакций растений на биотический стресс является изменение уровня пероксида водорода в клетках [13, 14]. При инокуляции бобовых симбиотическими бактериями подобный механизм может включаться как на начальных этапах инфицирования, как было показано на Medicago truncatula [15], так и на более поздних стадиях симбиоза, что было продемонстрировано на горохе [2]. Причем, этот процесс затрагивает не только отдельные участки корня, отличающиеся по чувствительности к ризобиальной инфекции [2], но и проявляется системно: кратковременный пик генерации активных форм кислорода был обнаружен в листьях сои после 30 мин инокуляции корней Bradyrhizobium japonicum [16], а в эпикотиле проростков гороха, корни которых были инокулированы различными по эффективности штаммами Rhyzobium leguminosarum bv. viciae, через 6 ч [17]. Ранние защитные реакции, вызванные окислительной вспышкой и повышением уровня Н2О2, связывают с воздействием микробных PAMP (pathogen-associated molecular patterns) в роли которых чаще всего выступают различные экзолипо- и экзополисахариды бактерий [2], а также флагеллины [18] и другие белки, обеспечивающие бактериям эффективный тесный контакт с растениями. На этой стадии Н2О2 как сигнальная молекула, может активно влиять на деятельность сигнальных каскадов, активируя работу МАП-киназ, фосфатаз и протеинкиназ [13]. Однако Nod-факторы, представляющие собой липополисахариды, также способны стимулировать рост внутриклеточного уровня Н2О2 [16]. Мы полагаем, что наиболее высокая концентрация Н2О2 в зонах роста корня гороха через 5 мин инфицирования Rlv вполне может объясняться этим. При этом проявлением специфичности взаимоотношений в данном случае является и более низкий уровень данной сигнальной молекулы в III и IV зонах роста корня, наиболее чувствительных к ризобиальной инфекции. Таким образом растение облегчает проникновение ризобий в эти зоны. Как ранее было показано, на начальных этапах инфицирования в этих участках корня сорбируется больше всего ризобий [5]. Несмотря на то, что Psp и Cms принципиально отличаются по особенностям взаимоотношений с горохом (Psp – патоген гороха, Cms – патоген картофеля), вероятно, у обоих видов бактерий присутствуют патогенные детерминанты, относящиеся к PAMP, вызывающие кратковременное неспецифическое повышение концентрации внутриклеточного Н2О2 в зонах роста корня проростков гороха.
В литературе имеются единичные работы, указывающие на то, что цАМФ может быть одним из триггеров, запускающих молекулярные механизмы, способствующие повышению уровня внутриклеточного пероксида водорода [7, 19]. Это предположение подтверждается нашими экспериментами, где был обнаружен дозозависимый от цАМФ эффект изменения концентрации пероксида водорода в зонах роста корня. Из полученных данных следует, что стимулирующий эффект в клетках корня гороха цАМФ способен оказывать только в низких концентрациях, тогда как их повышение ведет к ингибированию этого показателя.
Ранее на таких же модельных системах “горохRlv/Psp/Cms” было показано, что внутриклеточный уровень цАМФ в зонах роста корня детектировался в наномолях, а его концентрация изменялась во времени и отличалась в зависимости от вида инокулянта [5]. Вероятно, с этим связан полученный эффект от последовательного воздействия n-бутирил-цАМФ и инфицирования на изменение концентрации пероксида водорода. Обращает на себя внимание то, что в этих условиях во всех зонах роста уровень пероксида водорода незначительно отличался между собой, что, скорее всего, свидетельствует о том, что суммирование эндогенного и экзогенного уровней цАМФ нивелировало индивидуальную концентрацию пероксида водорода, наблюдавшуюся в зонах роста корня только при инфицировании. Эксперименты по влиянию сурамина на этот показатель также подтверждают это предположение. Снижение внутриклеточной концентрации цАМФ способствовало повышению уровня Н2О2. Интересно, что в этом случае последующее инфицирование Rlv и Psp практически не изменило уровень внутриклеточного пероксида водорода в зонах роста корня в сравнении с вариантом в присутствии сурамина, тогда как инфицирование Cms снизило этот показатель до уровня контроля. Эта информация еще раз подтверждает тот факт, что на ранней стадии растительно-микробных взаимодействий тАЦ принадлежит значительная роль в повышении уровня внутриклеточного цАМФ в клетках корней проростков гороха. Можно предположить, что экзометаболиты Rlv и Psp воспринимаются, в том числе и рецепторами клеточных стенок корня гороха, передающих сигналы на трансмембранную аденилатциклазу. Ранее нами была описана активация этой формы аденилатциклазы при инфицировании Rlv и Psp [5], а по литературным данным в арабидопсисе обнаружена рецепторная аденилатциклаза, активирующаяся под воздействием Pseudomonas syringae [20]. Ингибирование тАЦ сурамином не позволило возрасти концентрации цАМФ при инфицировании, что сказалось на изменении концентрации внутриклеточного пероксида водорода. Поскольку Cms не является патогеном для гороха, весьма вероятно, что в оболочке клеток растений этого вида отсутствуют специфические рецепторы к его метаболитам. Однако, экзополисахариды этого патогена обладают весьма кислой реакцией, и это может оказывать неспецифическое стрессовое воздействие на растительные клетки, в частности вызывать кратковременный сдвиг электрохимического потенциала плазмалеммы клеток гороха. Такой феномен несет за собой множественные перестройки метаболизма, которые во многом зависят от длительности воздействия. В частности, известно, что возникающий потенциал действия может активировать тАЦ [21, 22]. Ранее нами было показано, что кратковременное воздействие Cms весьма значительно повышало активность тАЦ в клетках корня гороха [5]. Известно, что цАМФ может фософорилировать специфические белки, а также влиять на активность нуклеотид-зависимых кальциевых ионных каналов в клетках растений. Существование таких каналов в различных органеллах растительных клеток показано в литературе [23, 24]. Поэтому представляется, что одним из посредников в механизме регуляции концентрации пероксида водорода с помощью цАМФ являются нуклеотид-зависимые кальциевые каналы. Проведенные исследования позволяют предложить один из вариантов регуляции концентрации уровня пероксида водорода в клетках гороха при биотическом стрессе. Степень специфичности взаимодействий (с Rhl наиболее высокая степень, поскольку эти микроорганизмы в природе инфицируют только корни гороха в отличие от Psp, который, являясь патогеном гороха, инфицирует только листья) определяет степень активации тАЦ, создавая определенный локальный уровень цАМФ. Этот вторичный мессенджер может стимулировать открытие кальциевых каналов, а кратковременное повышение концентрации ионов кальция может запускать целый ряд последующих взаимосвязанных реакций, поскольку он является активатором многих ферментов растений: тАЦ из клеток растений картофеля [25], НАДФН-оксидазы из гороха [26], и каталазы из арабидопсиса [27]. Последние два фермента участвуют в поддержании редокс-гомеостаза растительной клетки и регулируют концентрацию внутриклеточного Н2О2 [27]. Следует заметить, что изменение концентрации пероксида водорода может активировать и пероксид-зависимые кальциевые каналы [28], что также приводит к модуляции активности кальций-зависимых ферментов [27]. Например, в суспензионной культуре клеток французских бобов (Phaseolu svulgaris) под воздействием элиситора из Colletotrichum lindemuthianum эти события происходили в течение 15 мин [7], а в модельной системе горох R. leguminosarum в чувствительных к инфицированию зонах было зафиксировано снижение уровня Н2О2 и ${\text{О}}_{2}^{ - }$ [29] наряду с осцилляциями внутриклеточного кальция [9].
Такие перестройки во внутриклеточном сигналинге оказывают влияние и на интенсивность прохождения системных сигналов, о чем можно судить по изменению концентрации Н2О2 в эпикотиле проростков гороха во всех вариантах экспериментов.
Таким образом, изменение уровня внутриклеточного цАМФ в зонах корня проростков гороха приводит к изменению содержания внутриклеточного пероксида водорода и на этот процесс существенное влияние оказывает инфицирование как мутуалистическими так и патогенными бактериями. Очевидно, что выявленная взаимосвязь пероксида водорода и цАМФ является лишь одним из звеньев весьма сложной, разветвленной, но пока еще мало изученной сигнальной сети растений.
Работа выполнена на оборудовании Центра коллективного пользования “Биоаналитика” и с использованием коллекций Центра коллективного пользования “Биоресурсный центр” Сибирского института физиологии и биохимии растений Сибирского отделения Российской академии наук (г. Иркутск).
Работа выполнена в соответствии с гос. заданием по базовому проекту VI.56.1.2. Исследование физиолого-биохимических основ механизмов растительно-микробных взаимодействий при различных видах стрессов. № гос. регистрации АААА-А17-117011810099-8.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Koorneef A., Pieterse C.M.J. Cross talk in defense signaling // Plant Physiol. 2008. V. 146. P. 839.
Глянько А.К., Ищенко А.А. Иммунитет бобового растения, инфицированного клубеньковыми бактериями Rhizobium spp. // Прикладная биохимия микробиология. 2017. Т. 53. С. 136.
Глянько А.К. Сигнальные системы ризобий (Rhizobiaceae) и бобовых растений (Fabaceae) при формировании бобово-ризобиального симбиоза // Прикладная биохимия и микробиология. 2015. Т. 51. С. 453.
Gough C. Calcium oscillations and Nod signal transduction in Rhizobium-legume symbiosis // J. Soc. Biol. 2001. V. 195. P. 297.
Ломоватская Л.А., Кузакова О.В., Романенко А.С., Гончарова А.М. Активность аденилатциклаз и изменение концентрации цАМФ в клетках корня проростков гороха при инфицировании мутуалистами и фитопатогенами // Физиология растений. 2018. Т. 65. С. 310.
Lemtiri-Chlieh F., Thomas L., Marondedze C., Irving H., Gehring C. Cyclic nucleotides and nucleotide cyclases in plant stress responses. Abiotic stress response in plants – physiological, biochemical and genetic perspectives. Croatia: InTech, 2011.
Bindschedler L.V, Minibayeva F., Gardner S.L., Gerrish C., Davies D.R., Bolwell G.P. Early signalling events in the apoplastic oxidative burst in suspension cultured French bean cells involve cAMP and Ca2+ // New Phytologist. 2001. V. 151. P. 185.
Niu L., Liao W. Hydrogen peroxide signaling in plant development and abiotic responses: crosstalk with nitric oxide and calcium // Front. Plant. Sci. 2016. V. 7. Art. 230.
Granqvist E., Sun J., Camp R.O., Pujic P., Hill L., Normand P., Morris R.J., Downie A.J., Geurts R., Oldroyd G.E.D. Bacterial-induced calcium oscillations are common to nitrogen-fixing associations of nodulating legumes and non-legumes // New Phytol. 2015. V. 207.P. 551.
Pei Z.-M., Murata Y., Benning G., Thomine S.,Klusener B., Allen G.A., Grill E., Schroede J.I. Calcium channels activated by hydrogen peroxide mediate abscisic acid signaling in guard cells // Nature. 2000. V. 406. P. 731.
Деркач К.В., Шпаков А.О., Кузнецова Л.А., Плеснева С.А., Успенская З.И., Перцева М.Н. Гормоночувствительная аденилатциклазная система инфузории Dileptus anser // Цитология. 2002. Т. 44. С. 1129.
Moutinho A., Hussey P.J., Trewavas A.T., Malho R. cAMP acts as a second messenger in pollen tube growth and reorientation // PNAS. 2001. V. 98. P. 10481.
Креславский В.Д., Лось Д.А., Аллахвердиев С.И., Кузнецов Вл.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012. Т. 59. С. 163.
Suzuki N., Katano K. Coordination between ROS regulatory systems and other pathways under heat stress and pathogen attack // Front. Plant Sci. 2018. V. 9. Art. 490.
Lohar D.P., Sharopova N., Endre G., Penuela S., Samac D., Town C., Silverstein K.A.T., Vanden Bosch K.A. Transcript analysis of early nodulation events in Medicago truncatula // Plant Physiol. 2006. V. 140. P. 221.
Fernandez-Göbel T.F., Deanna R., Muñoz N.B., Robert G., Asurmendi S., Lascano R. Redox systemic signaling and induced tolerance responses during soybean–Bradyrhizobium japonicum interaction: Involvement of nod factor receptor and autoregulation of nodulation // Front. Plant Sci. 2019. V. 10. Art. 141.
Кузакова О.В., Ломоватская Л.А., Романенко А.С. Влияние различных по эффективности штаммов Rhizobium leguminosarum bv. viceae на изменение концентрации цАМФи Н2О2 в клетках проростков гороха // Физиология растений. 2019. Т. 66. С. 360.
Hayashi F., Smith K.D., Ozinsky A., Hawn T.R., Yi E.C., Goodlett D.R., Eng J.K., Akira S., Underhill D.M., Aderem A. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5 // Nature. 2001. V. 410. P. 1099.
Sabetta W., Vannini C., Sgobba A., Milena Marsoni M., Paradiso A., Ortolani F., Bracale M., Viggiano L., Blanco E., de Pinto M.C. Cyclic AMP deficiency negatively affects cell growth and enhances stress-related responses in tobacco Bright Yellow-2 cells // Plant. Mol. Biol. 2016. V. 90. P. 467.
Biancheta C., Wong A., Quagliac M., Alqurashid M., Chris Gehring C., Ntoukakise V., Pasqualinia S. An Arabidopsis thaliana leucine-rich repeat protein harbors an adenylyl cyclase catalytic center and affects responses to pathogens // J. Plant Physiol. 2019. V. 232. P. 12.
Ломоватская Л.А., Романенко А.С., Криволапова Н.В., Копытчук В.Н., Саляев Р.К. Системная активация аденилатциклазы, локализованной в плазмалемме клеток картофеля при бактериальном патогенезе // ДАН. 2007. Т. 413. С. 420.
Cooper D.M.F., Schell M.J., Thorn P., Irvinei R.F. Regulation of adenylyl cyclase by membrane potential // J. Biol. Chem. 1998. V. 273. P. 27703.
Романенко А.С., Ломоватская Л.А. Влияние экзополисахаридов бактериального возбудителя кольцевой гнили на субклеточную локализацию регулируемых циклическими нуклеотидами ионных каналов (CNGC) в клетках корней картофеля // Биологические мембраны. 2017. Т. 34. С. 231.
Ordoñez N.M., Marondedze C., Thomas L., Pasqualini S., Shabala L., Shabala S., Gehring C. Cyclic mononucleotides modulate potassium and calcium flux responses to H2O2 in Arabidopsis roots // FEBS Letters. 2014. V. 588. P. 1008.
Филинова Н.В., Ломоватская Л.А., Романенко А.С., Саляев Р.К. Кальций как модулятор активности аденилатциклазы растений при биотическом стрессе // Доклады АН. 2018. Т. 483. С. 1.
Poovaiah Y.B.W. Hydrogen peroxide homeostasis: Activation of plant catalase by calcium-calmodulin // PNAS. 2002. V. 99. P. 4097.
Васильева Г.Г., Глянько А.К., Ищенко А.А., Миронова Н.В., Путилина Т.Е. Активность НАДФН-оксидазы в зонах роста корня проростков гороха, различающихся по чувствительности к ризобиальной инфекции // Вестник ХНАУ. Серия биология. 2007. Т. 2. С. 34.
Demidchik V. ROS-activated ion channels in plants: biophysical characteristics, physiological functions and molecular // Nature. Int. J. Mol. Sci. 2018. V. 19. P. 1263.
Saeki K. Rhizobial measures to evade host defense strategies and endogenous threats to persistent symbiotic nitrogen fixation: a focus on two legume rhizobium model systems // Cel. Mol. Life Sci. 2011. V. 68. P. 1327.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


