Физиология растений, 2020, T. 67, № 3, стр. 278-288
Сезонная динамика содержания хлорофиллов и каротиноидов в листьях степных и лесных растений на уровне вида и сообщества
Л. А. Иванов a, b, *, Д. А. Ронжина a, b, П. К. Юдина a, Н. В. Золотарева c, И. В. Калашникова a, Л. А. Иванова a, b
a Федеральное государственное бюджетное учреждение науки Ботанический сад Уральского отделения
Российской академии наук
Екатеринбург, Россия
b Федеральное государственное автономное образовательное учреждение высшего образования
Тюменский государственный университет
Тюмень, Россия
c Федеральное государственное бюджетное учреждение науки Институт экологии растений и животных
Уральского отделения Российской академии наук
Екатеринбург, Россия
* E-mail: Leonid.Ivanov@botgard.uran.ru
Поступила в редакцию 03.10.2019
После доработки 23.10.2019
Принята к публикации 23.10.2019
Аннотация
Изучено содержание хлорофиллов (Сhl) a, b и каротиноидов (Сar) в листьях 31 вида степных и лесных растений на Среднем Урале в течение вегетационного сезона. Степные растения отличались от лесных меньшим содержанием хлорофиллов и каротиноидов в массе листа (в 2 и 1.5 раза соответственно), низким соотношением Сhl/Сar, большим (в 1.5 раза) количеством каротиноидов в единице площади листа и высоким соотношением Сhl a/b. Несмотря на низкую концентрацию хлорофиллов в единице массы листа у степных растений, содержание хлорофиллов в единице площади листа было сходным с лесными видами (3–4 мг/дм2) из-за более толстых и плотных листьев. Это свидетельствует об одинаковой потенциальной способности листьев растений степных и лесных сообществ к перехвату солнечной энергии в данном районе. В период активной вегетации с середины июня до начала августа показатели пигментного комплекса были стабильными как в степном, так и в лесном сообществах. Однако у степных растений в начале и в конце сезона содержание Car и Сhl b и отношение Сhl/Сar и Chl a/b изменялись, демонстрируя перестройку светособирающего комплекса. Внутривидовое варьирование показателей в течение сезона было обычно в два-три раза меньше, чем различия между видами. Межвидовое варьирование показателей было выше в лесу вследствие наличия видов с толстыми долгоживущими листьями. Сделан вывод, что содержание хлорофиллов в единице площади характеризует адаптацию растений к климатическим условиям данного географического района, тогда как концентрация пигментов в массе листа демонстрирует приспособление к локальным условиям освещения (лес, степь).
ВВЕДЕНИЕ
Хлорофиллы и каротиноиды являются основными фотосинтетическими пигментами, обеспечивающими адсорбцию квантов света и фотосенсибилизацию у растений. Проведенные к настоящему времени исследования показали стабильность качественного состава пигментов у высших растений. Это два типа хлорофиллов и шесть основных типов каротиноидов [1]. Каждой из этих форм пигментов отводится определенная роль и место в фотосинтетической системе растения [2]. В настоящее время хорошо изучены структура и функционирование пигментного комплекса, что может служить основой для моделирования различных аспектов фотосинтеза [3]. Поскольку пигменты интегрированы в мембраны хлоропластов и связаны с белками, то их количественное содержание и соотношение в листе могут отражать особенности адаптации фотосинтетического аппарата в целом и обеспечивать его функциональную диагностику [2].
Количественные изменения в пигментном аппарате листьев растений могут происходить в ответ на изменение условий среды [2]. Показано, что в наибольшей степени условия среды оказывают влияние на содержание хлорофилла в массе листа, чем на качественный состав пигментов [4]. В целом, известно, что основным фактором, регулирующим содержание пигментов, является свет. При затенении увеличивается содержание хлорофиллов в расчете на единицу массы листа, уменьшается доля каротиноидов и увеличивается доля хлорофилла b [5–7]. Изменения температуры и влажности окружающей среды также могут вызывать сдвиги в пигментном составе листьев растений [2].
Несмотря на большой и разносторонний интерес к пигментному комплексу растений, остается еще много вопросов о закономерностях его адаптации к условиям обитания. Особенно это касается исследований в естественных условиях, где полученные немногочисленные данные зачастую носят противоречивый характер. Так, для растений Гоби (Монголия) показано, что мезофитные виды оазисов отличаются большим количеством хлорофиллов в единице массы листа по сравнению с пустынными ксерофитами, произрастающими в тех же широтах при том же уровне инсоляции [8]. В исследовании вдоль широтного градиента, напротив, было показано, что у степных растений Южного Урала с уменьшением широты содержание хлорофиллов в единице массы листа оставалось стабильным, а отношение форм пигментов значительно изменялось [9]. В то же время, в Поволжье у растений лесостепи содержание хлорофиллов было выше по сравнению с растениями степей [10]. Напротив, в лесной зоне показано уменьшение содержания хлорофиллов и соотношения Chl/Сar с увеличением географической широты местообитания [11, 12]. В связи с этим представляет интерес содержание пигментов у степных и лесных растений на границе соприкосновения и взаимного проникновения двух резко различных флористических комплексов – леса и степи, когда растения произрастают в одном географическом районе и находятся в одинаковых макроклиматических условиях.
Содержание фотосинтетических пигментов в растениях не является константной характеристикой, а имеет сезонный характер [2]. Это показано преимущественно на примере изучения видов древесных растений [4, 13]. В умеренной зоне в течение вегетационного сезона также происходят сильные изменения погодных условий, что оказывает влияние на формирование пигментного комплекса растений. Особенно это актуально для травянистых видов растений. Однако данных по сезонной динамике пигментного комплекса травянистых растений недостаточно и требуются дополнительные исследования.
Целью нашей работы было изучение количественных изменений пигментного комплекса листьев в течение вегетационного сезона у видов растений из двух различных типов сообществ (степного и лесного), находящихся в одинаковых макроклиматических условиях, но в силу различного рельефа имеющие разный мезоклимат.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика объектов исследования. Исследования проводили в течение вегетационного сезона 2014 г. у пос. Двуреченск в 50 км на юго-восток от г. Екатеринбурга. Район исследования находится в подзоне предлесостепных сосново-березовых лесов таежной зоны [14]. Были изучены растения травяно-кустарничкового яруса лесного и степного сообществ, находящихся на расстоянии 1 км друг от друга. Для изучения лесных растений было выбрано фоновое для данной территории лесное сообщество – тростниково вейниково-черничный сосновый лес. Степные растения изучали на реликтовом участке петрофитной разнотравно-перистоковыльной степи, участок которой располагается на крутом склоне южной экспозиции, имеет небольшую площадь и окружен лесной растительностью [15]. Исследованные виды растений относились к доминантным и наиболее обильным видам в каждом из сообществ (табл. 1). В степном сообществе было исследовано 15 видов, а в лесном – 16 видов растений. Сбор образцов и измерение параметров проводили 5 раз в течение вегетационного сезона 2014 г: 5 июня, 20 июня, 9 июля, 23 июля и 6 августа. Измеряли структурные параметры листьев и содержание фотосинтетических пигментов. В таблице 1 представлены исследованные в лесном и степном сообществах виды растений и значения изученных показателей в середине вегетационного сезона (9 июля).
Таблица 1.
Изученные виды растений и их характеристика
| Вид | ЖФ | Тип мезофилла | Tl, мкм | LMA, мг/дм2 | Chl (a + b), мг/г | Chl a/b | Chl/Car |
|---|---|---|---|---|---|---|---|
| Степь | |||||||
| Artemisia commutata Besser | ТМ | ДВ | 266 (23) | 826 (21) | 4.3 (44) | 2.8 (67) | 5.1 (63) |
| Campanula sibirica L. | ТМ | ДВ | 349 (16) | 719 (7) | 4.1 (27) | 3.0 (11) | 4.3 (5) |
| Centaurea sibirica L. | ТМ | ИП | 261 (14) | 693 (17) | 6.0 (32) | 3.4 (58) | 5.2 (63) |
| Chamaecytisus ruthenicus (Fisch. ex Vorosch.) Klask. | К | ДВ | 228 (11) | 733 (21) | 5.4 (42) | 3.7 (54) | 4.0 (53) |
| Dianthus acicularis Fisch. ex Ledeb. | ТМ | ИП | 241 (55) | 950 (20) | 4.1 (45) | 3.4 (66) | 4.7 (60) |
| Echinops crispus S.Majorov | ТМ | ДВ | 204 (48) | 1013 (31) | 3.8 (34) | 3.3 (15) | 4.7 (14) |
| Galium ruthenicum Willd. | ТМ | ДВ | 360 (6) | 914 (22) | 3.9 (40) | 3.2 (58) | 4.6 (59) |
| Genista tinctoria L. | ПК | ИП | 310 (39) | 882 (27) | 5.1 (50) | 3.6 (58) | 4.6 (58) |
| Gypsophila altissima L. | ТМ | ДВ | 390 (13) | 635 (7) | 5.8 (36) | 2.9 (1) | 3.7 (18) |
| Onosma simplicissima L. | Пкч | ДВ | 276 (40) | 978 (28) | 4.1 (51) | 3.4 (56) | 5.0 (44) |
| Potentilla humifusa Willd. ex Schltdl. | ТМ | ДВ | 204 (29) | 930 (19) | 3.6 (31) | 3.4 (60) | 4.7 (53) |
| Stipa pennata L. | ТМ | Гр | 249 (18) | 1089 (20) | 4.1 (44) | 3.3 (57) | 4.2 (49) |
| Thymus uralensis Klokov | ТМ | ДВ | 288 (29) | 831 (20) | 2.8 (47) | 3.2 (63) | 4.1 (56) |
| Veronica spicata L. | ТМ | ИП | 308 (18) | 999 (29) | 3.4 (40) | 3.1 (50) | 4.1 (37) |
| Vincetoxicum albowianum (Kusn.) Pobed. | ТМ | ДВ | 228 (22) | 547 (25) | 7.8 (18) | 3.4 (53) | 4.4 (31) |
| Лес | |||||||
| Antennaria dioica (L.) Gaertn. | ТМ | ДВ | 216 (9) | 474 (22) | 4.8 (29) | 3.0 (24) | 6.3 (41) |
| Calamagrostis epigeios (L.) Roth | ТМ | Гр | 140 (53) | 337 (33) | 11.9 (21) | 2.6 (18) | 7.0 (23) |
| Chimaphila umbellata (L.) W.P.C. Barton | Кчвз | ДВ | 384 (19) | 1286 (28) | 5.4 (16) | 2.4 (23) | 6.3 (30) |
| Fragaria vesca L. | ТМ | ДВ | 93 (49) | 234 (28) | 11.2 (27) | 1.8 (34) | 7.9 (42) |
| Galium boreale L. | ТМ | ДВ | 106 (68) | 247 (58) | 16.0 (69) | 2.6 (16) | 6.6 (31) |
| Lathyrus vernus (L.) Bernh. | ТМ | ГОМ | 118 (15) | 292 (27) | 12.4 (21) | 2.9 (6) | 6.5 (22) |
| Linnaea borealis L. | Пкчзз | ДВ | 134 (35) | 389 (33) | 6.6 (51) | 2.5 (41) | 7.4 (46) |
| Maianthemum bifolium (L.) F.W. Schmidt | ТМ | ГОМ | 150 (19) | 327 (34) | 11.5 (40) | 3.0 (3) | 6.5 (21) |
| Orthilia secunda (L.) House | Пкчзз | ГОМ | 140 (27) | 590 (45) | 7.1 (24) | 2.5 (32) | 6.3 (35) |
| Pulmonaria mollis Wulfen ex Hornem. | ТМ | ДВ | 319 (25) | 278 (26) | 14.2 (40) | 2.9 (5) | 7.3 (32) |
| Pyrola media Sw. | Пкчзз | ГОМ | 196 (19) | 604 (15) | 7.5 (38) | 2.8 (49) | 6.2 (55) |
| Rubus saxatilis L. | ТМ | ДВ | 116 (21) | 255 (16) | 10.4 (34) | 2.4 (18) | 7.1 (15) |
| Trientalis europaea L. | ТМ | ГОМ | 98 (28) | 255 (39) | 13.9 (26) | 2.9 (9) | 7.0 (19) |
| Vaccinium vitis-idaea L. | Кчвз | ДВ | 314 (24) | 877 (46) | 3.9 (14) | 3.1 (32) | 7.2 (25) |
| Vaccinium myrtillus L. | Кч | ДВ | 109 (24) | 312 (29) | 9.0 (35) | 2.7 (13) | 7.1 (28) |
| Viola nemoralis Kütz. | ТМ | ДВ | 147 (13) | 244 (34) | 13.2 (37) | 2.5 (14) | 5.7 (24) |
Примечание. Приведены данные на 9 июля. В скобках указан индекс вариабельности ×100. Жизненная форма (ЖФ): ТМ – травянистый многолетник, К – кустарник, ПК – полукустарник, Кч – кустарничек, Пкч – полукустарничек, вз – вечнозеленый, зз – зимнезеленый. Тип мезофилла: ИП – изопалисадный, ДВ – дорзовентральный, ГОМ – гомогенный, Гр – граминоидный. Tl – толщина листа, LMA – удельная поверхностная плотность листа, Chl – хлорофилл, Car – каротиноиды.
Климатические данные и микроклиматические измерения. Исследованные нами растительные сообщества расположены в одной климатической зоне и, следовательно, находятся под влиянием одинаковых климатических факторов. Климат района умеренно-континентальный со среднегодовой температурой воздуха 3°С и среднемноголетним количеством осадков 465 мм в год. Средняя температура июля составляет 17.4°С.
Наиболее значимым экологическим фактором, действующим на рост растений в изученных сообществах, был уровень освещения. Освещенность измеряли в 12 ч дня на высоте 20–30 см с помощью квантового датчика (Li-Cor, США). Под пологом леса интенсивность освещения в полдень при безоблачном небе составляла около 10% от освещенности в степном сообществе: на степном участке интенсивность освещения составляла 1500–2000 мкмоль фотонов/(м2 с), в то время как под пологом леса она составляла 100–200 мкмоль фотонов/(м2 с). Данные по суммарной (Q, Дж/см2) и диффузной (D, Дж/см2) радиации на горизонтальную поверхность в день взяты для метеостанции Екатеринбурга за 2014 год из базы Мирового центра радиационных данных (http://wrdc.mgo. rs-si.ru). Прямую солнечную радиацию (S ', Дж/см2) и фотосинтетически активную радиацию (ФАР) рассчитывали по формулам [16]:
Существенные различия между типами местообитаний были также в гидротермическом режиме. Относительную влажность (%) и температуру воздуха (°С) измеряли в травостое на высоте 10 см от поверхности земли в течение вегетационного сезона с периодичностью в 15 мин с помощью регистраторов DS1923-F5# (Maxim Integrated, США). На рис. 1 показано изменение среднесуточных температуры и относительной влажности воздуха в травяно-кустарничковом ярусе в течение лета 2014 г. В степном сообществе температура в среднем была на 0.5–1.5°С выше, особенно в диапазоне температур выше 15°С. Относительная влажность воздуха в степном сообществе была на 10–15% ниже, чем в лесном сообществе.
Рис. 1.
Среднесуточные температуры (a) и влажность воздуха (б) на высоте 10 см над уровнем почвы (в пологе) на лесном и степном участках, и изменение дневной радиации (в) в районе в период исследований. Сплошная линия – степь, пунктирная линия – лес. 1 – прямая радиация, 2 – диффузная радиация.
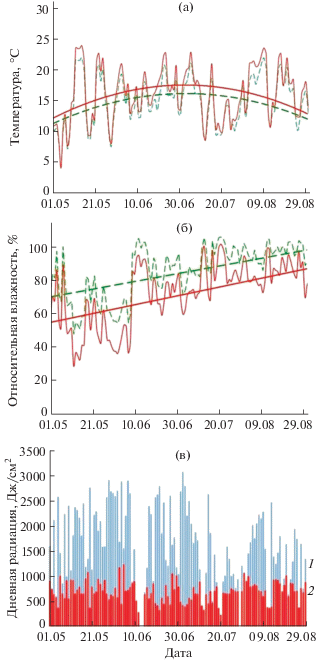
Для статистического анализа использовали средние значения метеоданных за 10 дней, предстоящих дате измерения пигментов у растений. Усредняемый период был выбран исходя из того, что структура пигментного комплекса растений является результатом его адаптации к условиям произрастания на протяжении предыдущих нескольких дней [17, стр. 280].
Определение содержания фотосинтетических пигментов и параметров листа. Для определения содержания фотосинтетических пигментов брали высечки из листьев среднего яруса у 10 растений каждого вида и фиксировали в жидком азоте. Содержание пигментов определяли на спектрофотометре Odyssey DR/2500 (Hach, США) после экстракции в 80% ацетоне. Концентрацию хлорофиллов и каротиноидов в полученных экстрактах рассчитывали по формулам [18]. Зная площадь листовых высечек, рассчитывали содержание пигментов в единице площади листа (Chl a/A, Chl b/A, Chl (a + b)/A, Сar/A). Используя параметр LMA (удельная поверхностная плотность листа, мг/дм2), пересчитывали содержание хлорофиллов на единицу сухой массы листа (Chl a, Chl b, Chl (a + b), Сar).
Для измерения LMA отбирали листья из среднего листового яруса с 10–15 хорошо развитых растений каждого вида в генеративном состоянии. LMA определяли по отношению сухой массы листьев к их площади. Определение площади листьев производили с помощью программы SIAMS Mesoplant (ООО СИАМС, Екатеринбург, Россия). Толщину листа (Tl, мкм) определяли с помощью электронного микрометра “PK-1012E” (Mitutoyo, Япония) у 10 листьев, собранных по одному листу со среднего яруса 10 растений каждого вида.
Индекс фенотипической пластичности вида, индекс межвидовой вариабельности и статистический анализ. Для оценки уровня варьирования признака рассчитывали индекс вариабельности, Iv − показатель размаха между минимальным (Xmin) и максимальным (Xmax) значением по формуле [19]:
(3)
$Iv = {{\left( {{{X}_{{{\text{max}}}}}--{{X}_{{{\text{min}}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{X}_{{{\text{max}}}}}--{{X}_{{{\text{min}}}}}} \right)} {{{X}_{{{\text{max}}}}}}}} \right. \kern-0em} {{{X}_{{{\text{max}}}}}}}.$Для оценки внутривидовой сезонной вариабельности использовали значения признака в пяти временных точках в течение сезона (n = 5). Для анализа межвидовой вариабельности использовали значения признака всех видов в каждом местообитании (степное n = 15, лесное n = 16) для каждой даты сбора.
Значимость различий между степными и лесными видами растений по индексу вариабельности определяли с помощью непараметрического парного U-теста Манна–Уитни (U). Анализ результатов исследований проводили с помощью двухфакторного дисперсионного анализа (ANOVA) по факторам “Сообщество” и “Дата сбора” (табл. 1). В таблицах и графиках представлены средние арифметические значения со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Различия между степными и лесными растениями на уровне сообщества
Обнаружены значимые различия между степными и лесными растениями по всем изученным показателям, которые сохранялись в течение вегетационного сезона. На рис. 2 представлены средние значения для сообщества и разброс между минимальным и максимальным значениями. Растения степного сообщества отличались от растений, произрастающих под пологом леса, большей толщиной (на 50–80%) и плотностью листа (на 80–100%) и меньшим содержанием хлорофиллов и каротиноидов в единице массы листа. Такие различия между степными и лесными видами сохранялись на протяжении всего вегетационного сезона (рис. 2). Содержание каротиноидов в единице площади листа у степных растений было выше в середине сезона, а в начале и конце периода измерений значения этого параметра в степном и лесном сообществах были сходными. По суммарному содержанию хлорофиллов в площади листа сообщества не различались. Другие закономерности наблюдали в соотношении форм пигментов. В середине вегетационного сезона у степных растений было выше отношение Chl а/b и ниже отношение Chl/Car, чем у лесных растений. Однако в начале сезона соотношение пигментов у степных растений не отличалось от лесных, а в позднелетний период различия менялись на противоположные – отношение Chl а/b у степных растений становилось ниже, чем у лесных, а отношение Chl/Car выше (рис. 2). При этом, в отличие от других параметров, размах значений по соотношению форм пигментов во время активного периода роста в середине сезона не перекрывался между лесными и степными видами.
Рис. 2.
Изменение изученных показателей в ходе вегетационного сезона в степи (заливка, сплошная линия) и в лесу (штриховка, пунктирная линия). Показаны средние значения, ошибка среднего и размах значений (min-мax значения). Значимость различий между степными и лесными сообществами: *P < 0.05. **P < 0.01. ***P < 0.001. Отсутствие знака – различие не значимо.
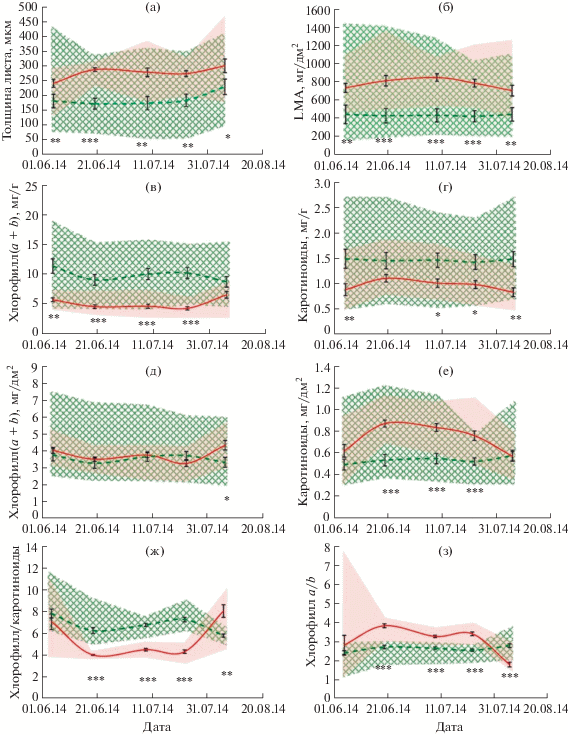
Двухфакторный дисперсионный анализ (ANOVA) (табл. 2) показал, что по большинству изученных параметров дата сбора образцов не влияла на средние для сообщества значения. Исключение составляли такие показатели как содержание Chl b и соотношения Chl а/b и Chl/Car, у которых время сбора определяло 15–20% варьирования. Максимальное влияние на структуру листа и содержание пигментов – до 50–80% – оказывали экологические условия произрастания. Фактор “Сообщество” был определяющим в различиях между лесными и степными растениями по изученным параметрам (табл. 2). Для содержания и соотношения форм пигментов в листе также имело значение взаимодействие условий произрастания и времени сбора.
Таблица 2.
Результаты дисперсионного анализа (ANOVA) по факторам “Сообщество” (лес, степь) и “Дата сбора” материала (05.06, 20.06, 09.07, 23.07, 06.08)
| Параметр | Фактор | Взаимодействие | R2 (×100) | |
|---|---|---|---|---|
| сообщество | дата сбора | сообщество × дата сбора | ||
| Tl | 33.3*** | 3.4 | 1.7 | 39 |
| LMA | 41.7*** | 0.8 | 0.4 | 44 |
| Chl a | 41.3*** | 1.0 | 1.6 | 45 |
| Chl b | 36.9*** | 8.4*** | 9.9*** | 57 |
| Chl (a + b) | 40.9*** | 2.9 | 3.7* | 49 |
| Car | 20.6*** | 0.9 | 1.3 | 22 |
| Chl a/A | 4.2* | 1.6 | 3.1 | 9 |
| Chl b/A | 0.5 | 13.4*** | 17.6*** | 30 |
| Chl (a + b)/A | 3.5* | 3.7 | 7.0* | 14 |
| Car/A | 26.8*** | 6.0* | 5.7* | 39 |
| Chl/Car | 22.4*** | 19.8*** | 24.6*** | 63 |
| Chl a/b | 1.0* | 23.7*** | 24.0*** | 48 |
Примечание. Представлены доля объясненной дисперсии (SSx/SSобщ × 100) и уровень значимости (*P < 0.05; **P < 0.01; ***P < 0.001) для каждого фактора и взаимодействия между ними. R2 (×100) – доля (процент) изменчивости, объясняемая построенной моделью. Для анализа использованы логарифмированные значения. Tl – толщина листа, LMA – удельная поверхностная плотность листа, Chl – хлорофилл, Car – каротиноиды.
Пределы варьирования (пластичность) параметров листьев и содержания пигментов в зависимости от вида, местообитания и даты сбора
Анализ индексов вариабельности, определенных нами на уровне вида и сообщества, показал, что межвидовое варьирование внутри каждого сообщества в конкретную дату сбора было больше, чем внутривидовые изменения в течение сезона. Большинство показателей варьировали внутри вида в течение сезона в пределах 20–40% (рис. 3). Исключение составили содержание хлорофилла b и соотношения Сhl a/b и Сhl/Сar, сезонная вариабельность которых достигала 50–70%. Межвидовой индекс вариабельности по большинству показателей составлял 0.5–0.7 (50–70%) за исключением соотношения форм пигментов Сhl a/b и Сhl/Сar, по которым межвидовое варьирование было вдвое ниже (табл. 3).
Рис. 3.
Сравнение внутривидовой пластичности для лесных (1) и степных (2) растений. Представлены медиана, 25–75% модальный класс и минимальные и максимальные значения (без вылетов). Значимость различий между степными и лесными сообществами: *P < 0.05, **P < 0.01, ***P < 0.001. Отсутствие знака – различие не значимо.
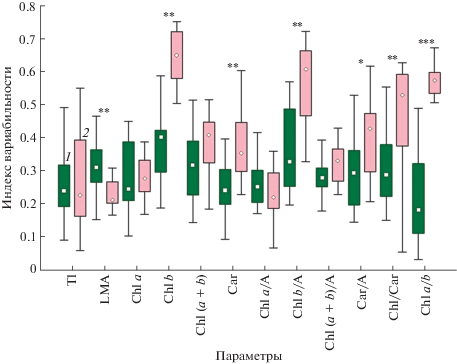
Таблица 3.
Межвидовой индекс варьирования (Iv) в течение сезона для степных (n = 5) и лесных (n = 5) растений
| Параметр | Лес | Степь | U |
|---|---|---|---|
| Tl | 0.72 | 0.42 | ** |
| LMA | 0.83 | 0.59 | ** |
| Chl a | 0.75 | 0.60 | ** |
| Chl b | 0.75 | 0.67 | нз |
| Chl (a + b) | 0.74 | 0.58 | *** |
| Car | 0.76 | 0.61 | ** |
| Chl a/A | 0.65 | 0.46 | **(Сh) |
| Chl b/A | 0.72 | 0.54 | нз |
| Chl (a + b)/A | 0.67 | 0.45 | **(Сh) |
| Car/A | 0.67 | 0.47 | *(Сh) |
| Chl/Car | 0.33 | 0.4 | нз |
| Chl a/b | 0.39 | 0.43 | нз |
Примечание. (Ch) – различия значимы только при наличии в анализе лесного вечнозеленого вида Chimaphila umbellata. Значимость различий между степными и лесными видами по непараметрическому парному U-тесту Манна-Уитни (U): *P < 0.05, **P < 0.01, ***P < 0.001, нз – различие не значимо. Tl – толщина листа, LMA – удельная поверхностная плотность листа, Chl – хлорофилл, Car – каротиноиды.
Уровень варьирования листовых параметров и содержания пигментов зависел также от условий местообитания. Внутривидовая пластичность плотности листа (LMA) в лесу была в 1.5 раза выше, чем в степи. Это было связано с наличием вечнозеленых видов в лесном сообществе, имевших высокие значения LMA (табл. 1). В то же время, в степи были выше пределы варьирования внутри вида по таким параметрам, как содержание хлорофилла b, содержание каротиноидов и соотношений Сhl a/b и Сhl/Сar.
Зависимость от погодных факторов
Проведен анализ связи изученных параметров с погодными условиями в течение сезона, такими как среднесуточные значения температуры воздуха, относительная влажность, ФАР, количество диффузной, прямой и суммарной солнечной радиации. Показано, что у степных растений количество диффузной радиации за предшествующие дню сбора 10 дней (D10) влияло на показатели пигментного комплекса листьев: содержание хлорофиллов в единице массы (Chl (a + b), r = 0.99, Р < 0.001) и площади листа (Chl (a + b)/A, r = 0.94, Р < 0.05), каротиноидов в массе (Car, r = 0.90, Р < 0.05) и площади (Car/A, r = 0.93, P < 0.05), соотношение форм пигментов (Chl/Car, r = 0.98, P < 0.01 и Chl a/b, r = –0.92, P < 0.05). Влияние других показателей погоды на пигментный комплекс степных растений обнаружено не было. У лесных растений изменения изученных параметров пигментного комплекса растений не были связаны с погодными условиями.
ОБСУЖДЕНИЕ
Известно, что растения, произрастающие в разном климате, имеют особенности пигментного комплекса [8–12, 20]. Наши исследования показали, что растения разных типов растительности (лес, степь) в одном климатическом районе, также существенно различаются по содержанию пигментов (рис. 2, табл. 1). Различия в содержании пигментов в единице массы и в отношениях форм пигментов свидетельствуют о том, что основным фактором, влияющим на растения в разных типах растительности, был уровень инсоляции. По нашим данным, в среднем, под пологом леса уровень освещения составлял 10–20% от освещения в степном сообществе вследствие затенения листовым пологом древесного яруса. В связи с этим, в травяно-кустарничковом ярусе доминировали растения, фотосинтетический аппарат которых адаптирован к условиям затенения. В степном сообществе, напротив, пигментный комплекс растений приспособлен к высокой инсоляции.
В наших исследованиях лесные растения имели меньшую толщину и плотность листа и при этом большее содержание хлорофиллов и каротиноидов в единице массы листа по сравнению со степными видами (табл. 2, рис. 2). Обнаруженные особенности лесных растений полностью соответствуют представлениям об адаптации листьев растений к затенению [21]. Так, для средиземноморских кустарников было показано, что содержание каротиноидов и хлорофиллов в расчете на единицу массы листа было больше в условиях затенения из-за более низкой LMA растений и не зависело от сезона года [4]. Такие же закономерности были обнаружены при сравнении большого набора видов степных и лесных растений из разных климатических зон [8, 20]. Таким образом, выявленные различия между степными и лесными растениями в параметрах листьев и содержании фотосинтетических пигментов демонстрируют механизмы адаптации растений к условиям произрастания.
Содержание пигментов в единице площади листа характеризует способность листовой поверхности поглощать солнечную энергию. Несмотря на низкую концентрацию хлорофиллов в единице массы листа у степных растений, благодаря вдвое большим значениям толщины и плотности листа, было сходным с лесными растениями содержание хлорофиллов в единице площади листа – 3–4 мг/дм2 которое, в целом, мало изменялось в течение вегетационного сезона (рис. 2). Учитывая, что оба сообщества находились в одном климатическом районе с одинаковым уровнем общей инсоляции, мы можем предположить, что таким образом растения отвечают на максимально возможную в данном районе интенсивность освещения. Лесные растения также подвержены действию высокой инсоляции в лесу вследствие попадания солнечных бликов максимальной для данной широты интенсивности в период колебаний интенсивности радиации, который составляет 1–10 мин [22]. Солнечные пятна имеют большое значение для растений подлеска, связанное с эффективностью пост-иллюминационной ассимиляции СО2 [23]. Они могут существенно улучшать углеродный баланс и рост растений в нижних ярусах лесного сообщества. Ранее, при исследовании кустарника Caragana bungei Ledeb., обитающего в контрастных условиях освещения в Монголии – на открытом месте и под пологом лиственничного леса, также было показано, что лесные и степные растения не различались по содержанию хлорофиллов в единице площади листа [24]. Ту же закономерность демонстрировали растения типичных и лесных саванн, произрастающие в условиях разного освещения [25]. Мы предполагаем, что содержание хлорофиллов в единице площади листа растений зависит от общего радиационного режима данной местности и, возможно, связано с географической широтой.
В отличие от хлорофиллов, содержание каротиноидов в единице площади листа, одной из функций которых является защита хлорофиллов от фотоокисления, может зависеть от суммарной интенсивности света, падающей на лист, а не от максимальной интенсивности света. В связи с тем, что под пологом леса суммарное освещение в несколько раз меньше, чем на открытых степных участках, содержание каротиноидов в единице площади листа у лесных растений меньше (рис. 2).
В растениях постоянно происходит распад и синтез молекул хлорофиллов и каротиноидов, что делает возможной акклимацию пигментного комплекса к текущим условиям. Обнаруженные нами различия между степными и лесными растениями по общему содержанию хлорофиллов и каротиноидов в единице массы листа сохранялись на протяжении всего периода измерений и не имели существенной сезонной динамики (рис. 2). Однако другие показатели пигментного аппарата проявляли сезонные колебания. При этом растения изученных сообществ различались по амплитуде сезонных изменений. В степном сообществе, в отличие от лесного, была обнаружена более высокая изменчивость параметров пигментного комплекса в течение сезона (рис. 2, 3). Ранее также было показано, что фенотипическая пластичность листовых параметров у светолюбивых видов была выше, чем у теневыносливых растений [21].
Наиболее сильные сезонные изменения происходили в содержании хлорофилла b и каротиноидов в единице площади и в соотношении форм пигментов. Поскольку хлорофилл b и каротиноиды входят в состав светособирающих комплексов пигментных систем [25–28], можно сделать вывод, что у степных растений в большей степени, чем у лесных, в течение сезона изменяется структура и функционирование фотосинтетических единиц. Если в раннелетний и позднелетний периоды отношения Chl a/b и Chl/Car в степи и в лесу были одинаковыми (рис. 2), то при наступлении периода активной вегетации (с конца июня до начала августа) у степных растений снижалась доля антенного хлорофилла b, а доля защитных пигментов – каротиноидов – увеличивалась. Вероятно, у растений открытых степных сообществ регуляция структуры и функции светособирающих комплексов в фотосинтетических единицах необходима для настройки фотосинтетического аппарата к более сильным колебаниям освещения. Известно, что в течение сезона, в зависимости от погодных условий, изменяется как общая интенсивность солнечного света, так и его состав – количество прямого и диффузного солнечного света (рис. 1). Кроме того, известно, что в рассеянной радиации выше доля синих лучей, чем в прямой [22, 29]. Проведенный нами корреляционный анализ показал, что у степных растений содержание и соотношение пигментов зависело от количества диффузного света. При увеличении количества диффузной радиации в начале и в конце сезона уменьшалась доля каротиноидов и увеличивалась доля Chl b. Известно, что Chl b более эффективен при улавливании коротковолнового света в диапазоне 425–475 нм и больше подходит для поглощения диффузного солнечного излучения [29], тогда как одной из функций каротиноидов является фотопротекция хлорофиллов от избытка энергии, которая поступает преимущественно в виде прямого солнечного света [6, 12, 29]. В отличие от степных растений, в лесу растения травяно-кустарничкового яруса постоянно находятся в условиях сильного затенения и не испытывают сильных сезонных изменений в освещении. В связи с этим, лесные растения, приспособленные к недостатку освещения, имеют более стабильные показатели пигментного комплекса в течение сезона.
По большинству изученных параметров, межвидовое варьирование внутри каждого сообщества было больше, чем внутривидовые изменения в течение сезона, за исключением содержания хлорофилла b и отношений Chl a/b и Chl/Сar у степных растений (табл. 3, рис. 3). Этот факт может свидетельствовать о высокой видоспецифичности содержания фотосинтетических пигментов в единице площади и массы листа. При этом мы обнаружили более высокие межвидовые различия в структурных параметрах листьев и содержании хлорофиллов и каротиноидов у лесных растений по сравнению со степными (рис. 2). Сравнение межвидовой вариабельности измеренных параметров показало, что в лесу уровень варьирования по этим показателям был в 1.2–2 раза выше (табл. 3). Основной причиной высокого межвидового варьирования содержания пигментов у лесных растений являлось разнообразие структурно-функциональных типов листьев, а именно 30% лесных видов обладали толстыми долгоживущими зимнезелеными листьями, тогда как летнезеленые лесные растения имели тонкие листья. Например, у вечнозеленого кустарничка Chimaphila umbellata были наиболее толстые и плотные листья и высокие значения содержания хлорофиллов и каротиноидов в единице площади листа. Исключение этого вида из статистического анализа снижало уровень вариабельности содержания пигментов в единице площади у лесных видов, который в этом случае был сравним с варьированием в степном сообществе (табл. 3). Тем не менее, несмотря на высокий уровень межвидового варьирования в лесном сообществе, различия между лесными и степными видами по содержанию пигментов оставались значимыми в течение всего вегетационного сезона.
ЗАКЛЮЧЕНИЕ
Таким образом, анализ сезонных изменений выявил стабильность показателей пигментного комплекса растений в течение периода активной вегетации района исследований – с середины июня до начала августа – как на уровне видов, так и на уровне сообществ. При этом степные и лесные растения существенно различались по содержанию хлорофиллов и каротиноидов в единице массы листа и соотношению форм пигментов. Большая концентрация пигментов в единице массы листа и большая доля хлорофилла b у лесных растений являлись признаками адаптации к условиям затенения. Несмотря на это, большая толщина и плотность листьев степных растений приводила к таким же значениям содержания фотосинтетических пигментов в единице площади листа, как у лесных растений. Поскольку содержание хлорофилла в единице площади листовой поверхности характеризует потенциальную способность листа к перехвату солнечной энергии, то этот показатель зависит от общего радиационного режима данной местности и, возможно, связан с географической широтой. Качественный состав солнечного света также может оказывать влияние на формирование пигментного комплекса растений, в частности на структуру светособирающего комплекса. Об этом свидетельствует связь изменения соотношения форм пигментов Chl a/b и Chl/Car у степных растений в течение сезона с количеством диффузной радиации. Лесные растения характеризовались стабильностью этих показателей в связи с более стабильными условиями освещения под пологом леса. Если для степных растений была характерна повышенная внутривидовая вариабельность в течение сезона по соотношению пигментов и других показателей пигментного комплекса, то у лесных растений сильнее варьировал структурный показатель листа – LMA. В целом, внутривидовые изменения в течение сезона были наиболее выражены у степных растений, в то время как в лесном сообществе более сильным было межвидовое варьирование параметров пигментного комплекса, связанное с наличием видов с толстыми зимнезелеными листьями. Таким образом, полученные нами данные свидетельствуют о разных способах настройки пигментного комплекса степных и лесных растений к климатическим и погодным условиям. В целом, содержание хлорофиллов в единице площади листа характеризует адаптацию растений к климатическим условиям данного географического района, тогда как концентрация пигментов в единице массы листа демонстрирует приспособление к локальным условиям освещения (лес, степь), а изменения соотношения пигментов светособирающего комплекса – акклимацию фотосинтетического аппарата к меняющимся условиям вегетационного сезона.
Работа выполнена в рамках бюджетной темы Ботанического сада Уральского отделения Российской академии наук, поддержанной Российским федеральным бюджетом.
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Список литературы
Young A.J., Phillip D., Savill J. Carotenoids in higher plant photosynthesis // Handbook of Photosynthesis / Ed. Pessaraki M. New York, USA: Marcel Dekker Inc., 1997. P. 575.
Esteban R., Barrutia O., Artetxe U., Fernandez-Marin B., Hernandez A., Garcia-Plazaola J.I. Internal and external factors affecting photosynthetic pigment composition in plants: a meta-analytical approach // New Phytol. 2015. V. 206. P. 268. https://doi.org/10.1111/nph.13186
Antal T.K., Kovalenko I.B., Rubin A.B., Tyystjärvi E. Photosynthesis-related quantities for education and modeling // Photosynth. Res. 2013. V. 117. P. 1. https://doi.org/10.1007/s11120-013-9945-8
Zunzunegui M., Diaz-Barradas M.C., Jauregui J., Rodriguez H., Alvarez-Cansino L. Season-dependent and independent responses of Mediterranean scrub to light conditions // Plant Physiol. Biochem. 2016. V. 102. P. 80. https://doi.org/10.1016/j.plaphy.2016.02.004
Lambers H., Chapin F.S. III, Pons T.L. Plant physiological ecology. New York: Springer, 2008. 540. p.
Demmig-Adams B., Gilmore A.M., Adams W.W. III. In vivo function of carotenoids in higher plants // FASEB J. 1996. V. 10. P. 403.
Bjorkman O. Responses to different quantum flux densities // Encyclopedia of Plant Physiology, Vol. 12A Physiological Plant Ecology I. Responses to the physical environment / Eds. Lange O.L., Nobel P.S., Osmond C.B., Ziegler H. Berlin: Springer-Verlag, 1981. P. 57.
Слемнев Н.Н., Шереметьев С.Н., Маслова Т.Г., Цоож Ш., Алтанцоож А. Разнообразие фотосинтетического аппарата растений Монголии: анализ биологических, экологических и эволюционных рядов // Ботанический журнал. 2012. Т. 97. С. 1377.
Иванов Л.А., Иванова Л.А., Ронжина Д.А., Юдина П.К. Изменение содержания хлорофиллов и каротиноидов в листьях степных растений вдоль широтного градиента на Южном Урале // Физиология растений. 2013. Т. 60. С. 856.
Иванов Л.А., Ронжина Д.А., Иванова Л.А. Изменение листовых параметров как показатель смены функциональных типов степных растений вдоль градиента аридности // Физиология растений. 2008. Т. 55. С. 332.
Дымова О.В., Головко Т.К. Фотосинтетические пигменты в растениях природной флоры таежной зоны европейского северо-востока России // Физиология растений. 2019. Т.66. С. 198.
Golovko T., Dymova O., Yatsco Y., Tabalenkova G. Photosynthetic pigment apparatus in northern plants // Handbook of Plant and Crop Stress, Third Edition / Ed. Pessarakli M. CRC Press. 2016. P. 391. https://doi.org/10.1201/b10329-19
Garcia-Plazaola J., Becerril J.M. Seasonal changes in photosynthetic pigments and antioxidants in beech (Fagus sylvatica) in a Mediterranean climate: implications for tree decline diagnosis // Aust. J. Plant Physiol. 2001. V. 28. P. 225. https://doi.org/10.1071/PP00119
Куликов П.В., Золотарева Н.В., Подгаевская Е.Н. Эндемичные растения Урала во флоре Свердловской области. Екатеринбург: Гощицкий, 2013. 612 с.
Золотарева Н.В., Подгаевская Е.Н. Современное состояние горных степей Свердловской области // Экология. 2012. № 5. С. 331.
Тооминг Х.Г. Солнечная радиация и формирование урожая. Ленинград: Гидрометеоиздат, 1977. 200 с.
Турчин Ф.М. Азотное питание растений и применение азотных удобрений. Москва: Колос, 1972. 336 с.
Wellburn A.R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution // J. Plant Physiology. 1994. V. 144. P. 307. https://doi.org/10.1016/S0176-1617(11)81192-2
Valladares F., Martinez-Ferri E., Balaguer L., Perez-Corona E., Manrique E. Low leaf-level response to light and nutrients in Mediterranean evergreen oaks: a conservative resource-use strategy // New Phytol. 2000. V. 148. P. 79. https://doi.org/10.1046/j.1469-8137.2000.00737.x
Maslova T.G., Popova I.A. Adaptive properties of the plant pigment systems // Photosynthetica. 1993. V. 29. P. 195.
Valladares F., Niinemets Ü. Shade tolerance, a key plant feature of complex nature and consequence // Annual Review of Ecology, Evolution, and Systematics. 2008. V. 39. P. 237. https://doi.org/10.1146/annurev.ecolsys.39.110707.173506
Цельникер Ю.Л. Физиологические основы теневыносливости древесных растений. Москва: Наука, 1978. 214 с.
Kono M., Terashima I. Long-term and short-term responses of the photosynthetic electron transport to fluctuating light // Journal of Photochemistry and Photobiology B: Biology. 2014. V. 137. P. 89. https://doi.org/10.1016/j.jphotobiol.2014.02.016
Иванов Л.А., Ивановa Л.А., Мигалина С.В., Юдина П.К., Дробышев Ю.И., Цэрэнханд Г., Цоож Ш., Гунин П.Д. Адаптация фотосинтетической функции пустынно-степного кустарника Caragana bungei Ledeb. к условиям лиственничного леса горных склонов Хангая в Монголии // Аридные экосистемы. 2016. Т. 22. С. 63.
Rossatto D.R., de Araújo P.E., da Silva B.H.P., Franco A.C. Photosynthetic responses of understory savanna plants: Implications for plant persistence in savannas under tree encroachment // Flora. 2018. V. 240. P. 34. https://doi.org/10.1016/j.flora.2017.12.009
Lichtenthaler H.K., Ač A., Marek M.V., Kalina J., Urban O. Differences in pigment composition, photosynthetic rates and chlorophyll fluorescence images of sun and shade leaves of four tree species // Plant Physiol. Biochem. 2007. V. 45. P. 577. https://doi.org/10.1016/j.plaphy.2007.04.006
Hikosaka K., Terashima I. A model of the acclimation of photosynthesis in the leaves of C3 plants to sun and shade with respect to nitrogen use // Plant, Cell Environ. 1995. V. 18. P. 605. https://doi.org/10.1111/j.1365-3040.1995.tb00562.x
Evans J.R. Acclimation by the thylakoid membranes to growth irradiance and the partitioning of nitrogen between soluble and thylakoid proteins // Aust. J. Plant Physiol. 1988. V. 15 P. 93. https://doi.org/10.1071/PP9880093
Kume A., Akitsu T., Nasahara K.N. Why is chlorophyll b only used in light-harvesting systems? // J. Plant Research. 2018. V. 131. P. 961. https://doi.org/10.1007/s10265-018-1052-7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


