Физиология растений, 2020, T. 67, № 3, стр. 289-297
Особенности состава и содержания жирных кислот суммарных липидов перикарпия Malus orientalis Uglitzk.
Т. В. Иванова a, *, А. С. Воронков a, Т. Х. Кумахова b, В. Д. Цыдендамбаев a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
Москва, Россия
* E-mail: itv_2006@mail.ru
Поступила в редакцию 29.08.2019
После доработки 11.11.2019
Принята к публикации 13.11.2019
Аннотация
В настоящей работе исследован состав и содержание жирных кислот (ЖК) суммарных липидов тканей перикарпия яблони восточной (Malus orientalis Uglitzk.), произрастающей в условиях гор Северного Кавказа. Установлено, что для наружной (эпидерма и гиподерма) и паренхимной частей перикарпия характерен достаточно низкий индекс ненасыщенности (ИН) ЖК – 0.902 и 1.115, соответственно. Это обусловлено относительно небольшим содержанием в перикарпии полиненасыщенных ЖК (34% в наружной части и 45% в паренхиме от суммы всех ЖК) и высоким уровнем насыщенных ЖК с очень длинной цепью (ЖКОДЦ) (15% в наружной части). Особенно контрастными выглядят данные показатели в сравнении с изученной нами ранее яблоней домашней (Malus domestica Borkh.), произрастающей на той же самой территории, для которой M. orientalis является исходным видом. Сумма диеновых и триеновых ЖК у M. domestica достигает 59 и 76% в наружной и паренхимной частях соответственно, а сумма всех ЖКОДЦ в наружной части перикарпия не превышает 1.7%. Столь существенные различия в ЖК-составе липидов родственных представителей Malus связаны с последствиями селекции яблони домашней. С одной стороны, из-за специфики состава ЖК липидов M. orientalis характеризуется сравнительно низким ИН, поэтому менее адаптирована к температурному стрессу и засухе, что скорректировано искусственным отбором при выведении сортов M. domestica. С другой – в липидах яблони восточной наблюдается высокое количество ЖКОДЦ, которое, вероятно, препятствует разрастанию перикарпия, регулируя пролиферацию клеток, но при этом способствует большей устойчивости к грибным болезням – свойству, утерянному в ходе селекционных работ у яблони домашней.
ВВЕДЕНИЕ
Яблоня является важнейшей плодовой культурой, возделываемой не только в нашей стране, но и во всем мире. В настоящее время выделяют шесть истинных видов яблони: Malus asiatica, M. caspiriensis, M. chitralensis, M. sieversii, M. sylvestris и M. orientalis, а также группу культурных сортов вида M. domestica Borkh. Благодаря высокой экологической пластичности, различные сорта яблони домашней адаптированы к произрастанию в самых разнообразных экосистемах, в том числе и горных [1].
В условиях высотной поясности так же благополучно произрастает и другой вид яблони – восточная (Malus orientalis).
Яблоня восточная (Malus orientalis Uglitzk.) – входит в состав видов Европейской группы рода Яблоня (Malus Mill.) подсемейства Яблоневые (Maloideae) семейства (Rosaceae) [2, 3]. Это дерево средней величины (8–9 м) c широкой и шатровидной кроной, которое цветет в апреле–мае, цветки 2.5–4.5 см в диаметре. Плод – яблоко, шаровидной, почти округлой формы, 20–30 мм в диаметре с остающимися чашелистиками. При созревании плода эндокарпий становится хрящеватым, а наружные ткани плодолистиков – мясистыми и совершенно сливаются с тканями гипантия. На поперечном срезе перикарпия четко выражены наружная зона (эпидерма и гиподерма) и паренхима, граничащая с плотной хрящевидной тканью, окружающей гнезда завязи. Основная сочная часть плода (яблоко) образована за счет суккулентизации тканей гипантия [4, 5]. Созревание плодов позднее, зимнее.
Яблоня восточная относится к ирано-кавказскому ареалу произрастания яблонь. На территории России растет на Северном Кавказе (Дагестан, Ингушетия, Кабардино-Балкария и др.) и в Крыму в лиственных, особенно широколиственных лесах, среди кустарников, на лесных опушках и по берегам рек. В аридных условиях (например, Дагестан) имеет небольшой рост и своеобразный облик.
Ранее нами было показано, что изменение состава жирных кислот (ЖК) липидов имеет большое значение в адаптации Maloideae (Rosaceae) к произрастанию в условиях высотной поясности [1, 6]. Известно, что значения показателей индекса ненасыщенности (ИН) и количества жирных кислот с очень длинной цепью (ЖКОДЦ) характеризуют физиологические функции мембраны, отображают степень проницаемости и поддержание селективного транспорта. Данные критические параметры связаны с поддержанием жизнедеятельности клетки и восприятием ею стрессовых сигналов при адаптации растений к комплексному воздействию окружающей среды. Целью нашего исследования было изучение особенностей состава ЖК липидов перикарпия M. orientalis, необходимое для расширения представления о значении состава ЖК в адаптации Malus к комбинированному стрессу в условиях высотной поясности.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. В качестве объекта исследования были использованы плоды яблони восточной (M. orientalis), произрастающие на высоте 700 м над уровнем моря (лесогорная экологическая зона) в центральной части предгорий Северного Кавказа, в частности в Кабардино-Балкарской республике. Образцы для исследований (зрелые плоды на стадии съемной зрелости) были собраны в 3-кратной повторности из средней части кроны трех модельных деревьев.
Определение состава ЖК суммарных липидов. Наружная и паренхимная части перикарпия M. orientalis были зафиксированы по отдельности в кипящем изопропаноле (поверхностные воска предварительно смыты хлороформом), содержавшем 0.001% ионола (m/V), как антиоксидант. В качестве внутреннего стандарта в пробу вносили маргариновую кислоту (С17:0), которая не содержалась в исследуемом объекте. Экстракцию суммарных липидов, получение метиловых эфиров ЖК (МЭЖК) путем переэтерификации проб в среде безводного метанола с участием ацетилхлорида проводили, как описано ранее [7]. МЭЖК анализировали методом ГЖХ-МС на приборе Agilent 7890A GC (“Agilent Technologies, Inc.”, США), используя 60-метровую капиллярную колонку с внутренним диаметром 0.25 мм (DB-23, Ser. № US8897617H; “Agilent Technologies, Inc.”, США), которая включала привитую (50% цианопропил)-метилполисилоксановую полярную жидкую фазу с толщиной слоя 0.25 мкм. Условия разделения МЭЖК: давление газа-носителя (гелия) в инжекторе – 191 кПа; рабочее давление газа в колонке – 245 кПа; расход газа – 1 мл/мин; линейная скорость газа-носителя в колонке – 18 см/с; объем раствора образца – 1 мкл (10 мкг МЭЖК); делитель потока – 1 : 5, температура испарителя – 260°С. Программа градиента повышения температуры колонки: от 130 до 170°С со скоростью 6.5°С/мин, от 170 до 215°С со скоростью 2.75°С/мин, выдержка при 215°С в течение 25 мин, от 215 до 240°С со скоростью 5°С/мин и выдержка при 240°С в течение 50 мин. Рабочая температура МС-детектора (5975C MSD) – 240°С. Для МС-идентификации индивидуальных видов МЭЖК в ходе их ГЖХ-фракционирования использовали расширенный пакет встроенных рабочих программ MSD ChemStation G1701EA E.02.00.493 с библиотекой спектров NIST, при этом степень соответствия между массовым спектром образца и массовым спектром в базе данных составляла 98–99%. Для оценки уровня ненасыщенности ЖК в липидах околоплодника рассчитывали ИН [8]. Абсолютное содержание липидов выражали в мкмолях этерифицированных ЖК в расчете на 1 г сырой и сухой массы [9].
Морфометрическое исследование наружной части перикарпия. Микрофотографии для морфометрии получали в проходящем свете на микроскопе AxioImager D1 (“Carl Zeiss”, Германия) с помощью камеры AxioCam MRc (“Carl Zeiss”, Германия). Срезы изготавливали из 3–4 секций тканей, взятых с противолежащих сторон экватора плода на одинаковом расстоянии от долей чашечки и плодоножки с помощью микротома с вибрирующим лезвием Microm HM 650V (“Thermo Scientific”, Германия), толщина срезов 30–50 мкм. Данные изображения обрабатывали в программе ZEN lite 2012. Толщину кутикулы измеряли с помощью инструмента “Line”, площадь клеток – “Contour”. Для вычислений использовали не менее 50 микрофотографий.
Все опыты были выполнены в трех биологических и трех аналитических повторностях. Приведены средние значения измерений и их стандартные отклонения. Достоверность различий между средними значениями оценена по t-критерию Стьюдента при P ≤ 0.05. Количественные данные обрабатывали с помощью однофакторного дисперсионного анализа, достоверно различающиеся между собой величины обозначены разными буквами.
РЕЗУЛЬТАТЫ
Относительное и абсолютное содержание ЖК суммарных липидов
Липиды наружной части перикарпия M. orientalis представлены 15 видами индивидуальных С14–24 ЖК. Главными были пальмитиновая (С16:0), стеариновая (С18:0), олеиновая (С18:1Δ9), линолевая (С18:2Δ9,12), а также α-линоленовая (С18:3Δ9,12,15) и арахиновая (С20:0) кислоты (табл. 1). Необходимо отметить достаточно высокое содержание ЖКОДЦ [10, 11], среди которых доминируют арахиновая, бегеновая (С22:0) и лигноцериновая (С24:0).
Таблица 1.
Состав ЖК суммарных липидов перикарпия Malus orientalis (% от суммы всех ЖК)
| ЖК | Наружная часть | Паренхима1 |
|---|---|---|
| C14:0 | 1.6b ± 0.09 | 1.2 a ± 0.15 |
| C15:0 | 0.4a ± 0.05 | 1.2b ± 0.13 |
| C16:0 | 19.5a ± 1.69 | 28.1b ± 3.35 |
| С16:1Δ9 | 0.4a ± 0.06 | 1.1b ± 0.06 |
| С16:2Δ7,10 | –2 | 0.4 ± 0.05 |
| C18:0 | 15.2b ± 1.80 | 5.0 a ± 0.49 |
| С18:1Δ7 | – | 0.8 ± 0.13 |
| С18:1Δ9 | 13.7a ± 1.31 | 12.0 a ± 1.35 |
| С18:1Δ11 | 0.3a ± 0.04 | 1.1b ± 0.05 |
| С18:2Δ9,12 | 24.3a ± 2.67 | 37.5b ± 3.25 |
| C19:0 | 0.2a ± 0.03 | 0.2 a ± 0.02 |
| C18:3Δ9,12,15 | 8.8b ± 0.79 | 6.9 a ± 0.80 |
| C20:0 | 7.8b ± 0.93 | 2.8a ± 0.38 |
| С20:2Δ11,14 | 0.4 ± 0.03 | – |
| C21:0 | 0.5b ± 0.04 | 0.1a ± 0.06 |
| C22:0 | 5.0b ± 0.53 | 1.3a ± 0.08 |
| C24:0 | 1.9b ± 0.22 | 0.1a ± 0.02 |
| ИН | 0.902 a | 1.115b |
| ∑ЖКОДЦ | 15.6b | 4.3a |
В паренхиме перикарпия яблони восточной идентифицировано 18 видов С14–24 ЖК, главными из которых были пальмитиновая, олеиновая, линолевая и α-линоленовая кислоты. Стеариновой кислоты и ЖКОДЦ в паренхиме содержалось в ~3–3.5 раза меньше, чем в липидах наружной части перикарпия M. orientalis (табл. 1). Также следует обратить внимание на то, что относительное количество таких кислот, как пальмитиновая и линолевая, относящихся к главным [12], в паренхиме в ~1.5 раза превышало их количество в наружной части.
Значение ИН наглядно отражало наблюдаемые различия в относительном содержании ЖК суммарных липидов в наружной части и в паренхиме яблони восточной (табл. 1). Уровень ненасыщенности ЖК липидов паренхимы был на ~20% выше, чем у наружной части. Это происходило за счет идентифицированных в липидах паренхимной части 7,10‑гексадекадиеновой (С16:2Δ7,10) и цис-7-октадеценовой (С18:1Δ7) кислот, которые не найдены в наружной части перикарпия M. orientalis, а также, из-за более высокого (относительно наружной части) содержания отдельных минорных моноеновых ЖК (табл. 1).
В расчете на сырую массу абсолютное содержание суммарных липидов в наружной части перикарпия M. orientalis более чем в два раза превышало этот показатель в паренхиме (5.56 и 2.53 мкмоль/г сырого веса соответственно). Однако при пересчете на сухую массу столь заметного различия отмечено не было: абсолютное содержание липидов в наружной части перикарпия яблони восточной – 19.70 мкмоль/г сухого веса, а в паренхиме – 17.21 мкмоль/г сухого веса. Данный факт можно объяснить тем, что количество сухого вещества у M. orientalis в наружной части перикарпия больше, чем в паренхиме (28.2 и 14.7% соответственно).
Морфометрические параметры наружной части перикарпия
В ходе исследования были измерены толщина кутикулы и площади клеток эпидермы и гиподермы наружной части перикарпия яблони восточной. Так, толщина кутикулярного слоя, покрывающего весь плод, составляла 18.96 ± 2.76 мкм. Площадь клеток покровной ткани эпидермы перикарпия равнялась 31.4 ± 9.44 мкм, а площадь подлежащих клеток гиподермы была равной 82.60 ± 21.33 мкм. Площади клеток наружной части перикарпия M. orientalis достоверно не отличались от таковых у M. domestica [1].
ОБСУЖДЕНИЕ
Согласно молекулярно-генетическим исследованиям M. orientalis сыграла важную роль в формировании генома группы сортов яблони домашней в результате ее распространения по “Шелковому пути” из Среднеазиатского региона в Европейский [13]. По данным А.М. Скибинской [14] яблоня восточная является важнейшим родоначальником большинства европейских опушенных сортов яблони, в частности яблони домашней позднезимнего сорта Ренет Симиренко, состав ЖК суммарных липидов которой был детально описан нами ранее [1]. Опираясь на эти данные, мы провели сравнительный анализ состава ЖК липидов M. orientalis и результата ее “одомашнивания” – M. domestica (позднезимний сорт Ренет Симиренко).
Из рисунка 1 видно, что наружная часть и паренхима перикарпия M. orientalis содержат на 20% больше насыщенных ЖК, по сравнению с яблоней домашней. Это обусловлено почти в 2 раза бóльшим содержанием стеариновой кислоты (табл. 1, [1]), а так же многократным увеличением суммы ЖКОДЦ (рис. 2).
Соотношение содержания насыщенных и ненасыщенных кислот лежит в основе регулирования точки фазы перехода состояния биологических мембран. Содержание большого количества ненасыщенных ЖК, а в особенности полиненасыщенных, в составе мембраны определяет ее повышенную текучесть. Следовательно, чем выше значение ИН (табл. 1, [1]), тем более устойчива клетка к воздействию низких температур [15–17]. На примере риса было показано, что разные по устойчивости к холоду генотипы по-разному реагируют на холодовой стресс, изменяя состав ЖК липидов [18]. Так, количество линоленовой кислоты увеличивается после подобного воздействия у холодоустойчивых генотипов при падении уровня пальмитиновой, и противоположным образом данные изменения происходят у теплолюбивых генотипов. Таким образом, становится понятным, что в результате селекционных работ яблоня домашняя (сорт Ренет Симиренко) приобрела бóльшую потенциальную устойчивость к низкотемпературному стрессу (за счет высокого уровня ИН, обусловленного содержанием в перикарпии диеновых ЖК в количестве 45–60% от суммы всех кислот) по сравнению с исходным видом – M. orientalis (рис. 1). Вероятно, данный признак способствовал повсеместному распространению яблони домашней, в отличие от яблони восточной, которая в нашей стране встречается в основном на Кавказе – одном из наиболее теплых регионов.
Рис. 1.
Содержание (в % от общей суммы ЖК) насыщенных (1), моноеновых (2), диеновых (3) и триеновых (4) ЖК липидов в наружной части (а, в) и паренхиме (б, г) перикарпиев Malus orientalis (а, б) и M. domestica (в, г).
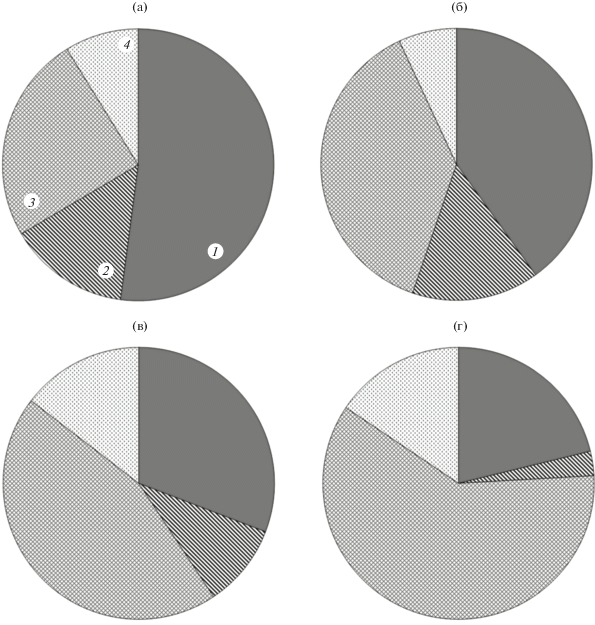
В тех условиях, где были собраны объекты исследования, наблюдается большая амплитуда суточных температур. Следовательно, плоды Malus могут подвергаться не только охлаждению ночью, но и перегреву днем. Известно, что тепловой стресс приводит к снижению доли триеновых ЖК и постоянному увеличению уровня С16:0 и диеновых, в частности, С18:2 кислот [19]. Из полученных данных видно, что содержание триеновых кислот у M. orientalis (9% в наружной части и 7% в паренхиме, рис. 1а, 1б) ниже, чем у M. domestica (14 и 16%, соответственно, рис. 1в, 1г) во всех тканях перикарпия. В дополнение, в наружной части перикарпия яблони домашней было в 2.5 раза больше С18:2Δ9,12 (табл. 1, [1]). Таким образом, у близкородственных представителей Malus мы наблюдаем, разные стратегии адаптации к тепловым воздействиям, приводящим к изменениям в составе липидов наружной части их перикарпиев (рис. 2). Наши данные свидетельствуют о том, что, вероятнее всего, у M. orientalis при тепловом стрессе будет происходить снижение количества триеновых ЖК во всем перикарпии, в то время как домашняя яблоня при подобном роде воздействия будет накапливать С18-диеновые ЖК в наружной части перикарпия (табл. 1, [1]).
Эта особенность перикарпия M. domestica может обуславливать и ее возможную засухоустойчивость. Известно, что обезвоживание тканей приводит к повреждению клеточных мембран, а, следовательно, поддержание их целостности и стабильности является жизненно важным для адаптации к засухе. На модельном объекте Arabidopsis thaliana [20], который можно отнести к засухоустойчивым, показано, что обезвоживание листьев приводит к увеличению доли полиненасыщенных ЖК. И, напротив, у малоустойчивых к засухе Salvia officinalis [21] и Carthamus tinctorius [22] при обезвоживании снижается количество С18:2Δ9,12 и С18:3Δ9,12,15 кислот. Таким образом, так как у M. orientalis кутикула на 60% толще, чем у M. domestica [1], то именно данная особенность покровной ткани в большей степени препятствует потерям влаги с поверхности плода.
Рис. 2.
Качественные изменения ЖК-состава липидов наружной части (а, б) и паренхимы (в, г) перикарпия Malus orientalis (а, в) и M. domestica (б, г). I – C12–C19 жирные кислоты: 1 – лауриновая (C12:0); 2 – тридекановая (C13:0); 3 – миристиновая (C14:0); 4 – пентадециловая (C15:0); 5 – пальмитиновая (C16:0); 6 – 7-гексадеценовая (С16:1Δ7); 7 – пальмитолеиновая (С16:1Δ9); 8 – 7,10-гексадекадиеновая (С16:2Δ7,10); S – внутренний стандарт – маргариновая (C17:0); 9 – 10-гептадеценовая (С17:1Δ10); 10 – 9,12-гептадекадиеновая (С17:2Δ9,12); 11 – стеариновая (C18:0); 12 – цис-7-октадеценовая (С18:1Δ7); 13 – олеиновая (С18:1Δ9); 14 – цис-вакценовая (С18:1Δ11); 15 – линолевая (С18:2Δ9,12); 16 – нонадекановая (C19:0); 17 – α-линоленовая (C18:3Δ9,12,15). II – жирные кислоты с очень длинной цепью: 18 – арахиновая (C20:0); 19 – 10,14-эйкозадиеновая (С20:2Δ11,14); 20 – генэйкозановая (C21:0); 21 – бегеновая (C22:0); 22 – трикозановая (C23:0); 23 – лигноцериновая (C24:0).
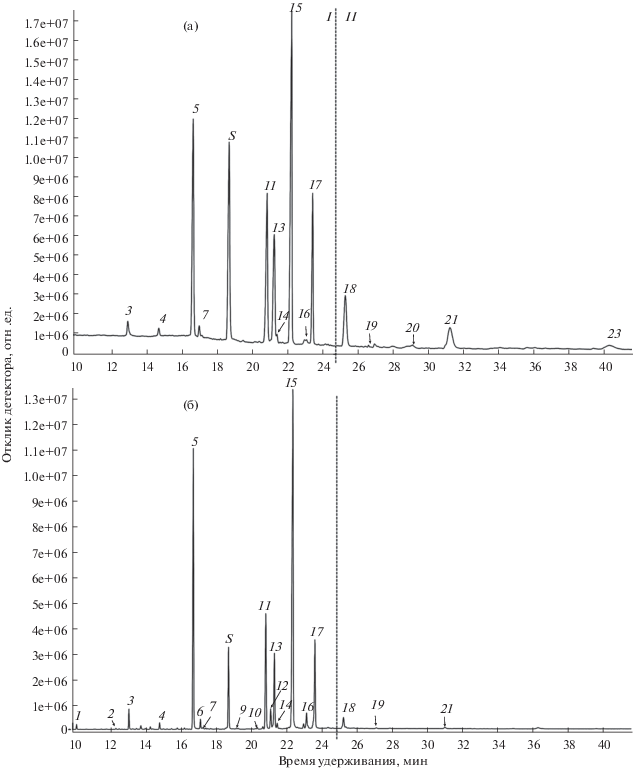
Рис. 2.
Окончание
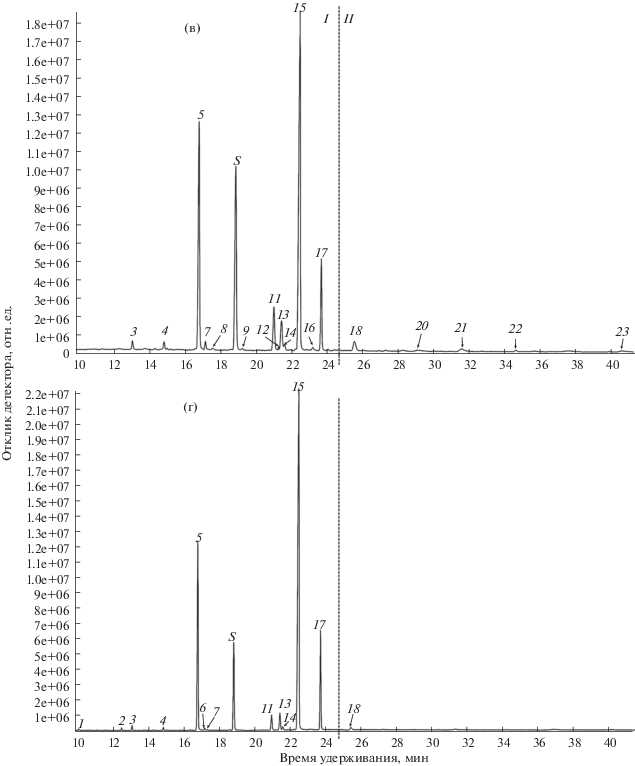
Как мы уже отмечали ранее, липиды как паренхимы, так и, особенно, наружной части перикарпия M. orientalis содержат очень большое количество ЖКОДЦ, их суммарное содержание равно 4.3 и 15.6% соответственно от общего количества ЖК (табл. 1, рис. 2a, 2в). У M. domestica в паренхиме нами ранее было обнаружено всего 0.1%, а в наружной части – 1.7% ЖКОДЦ (рис. 2б, 2г, [1]). Такое разительное отличие в содержании ЖКОДЦ (рис. 2) у культурного представителя и его дикорастущего предшественника, как мы полагаем, может быть связано с селекцией. Понятно, что все селекционные мероприятия при выведении более ценных сортов яблони домашней были направлены на получение высокопродуктивных и крупноплодных гибридных форм с улучшенными вкусовыми качествами. Известно, что ЖКОДЦ и их производные могут контролировать рост органов, ограничивая пролиферацию клеток и тем самым размеры органов растений [23]. В настоящее время ЖКОДЦ приписывают функцию регуляции дифференцировки и ограничения роста размеров клетки, путем включения в состав их мембран [24, 25]. Причем ЖКОДЦ наружных тканей могут останавливать активное деление глубжележащих таковых, подавляя биосинтез цитокининов в проводящих тканях [26], а также они участвуют в поддержании полярного транспорта ауксина при формировании тканей во время развития [27]. Исходя из этих данных, можно предположить, что большое количество ЖКОДЦ может ограничивать рост плодов. Поэтому вероятно, что при селекции представителей с наиболее крупными и сочными плодами за счет разрастания гипантия, сопутствующим отбору признаком было уменьшение количества ЖКОДЦ (рис. 2). Таким образом, в результате искусственного отбора плод M. domestica утратил изначально высокое содержание ЖКОДЦ, характерное для M. orientalis.
Однако уменьшение содержания ЖКОДЦ в тканях (особенно наружных) перикарпия M. domestica может быть связано и с негативными для культуры последствиями одомашнивания. Нами было отмечено, что M. domestica значительно подвержена микозам [28, 29]. В настоящее время в литературе существует точка зрения, что именно ЖКОДЦ принадлежит важная роль в устойчивости растений к различным заболеваниям, путем передачи сигналов, отвечающих за гибель клеток, при проникновении патогенов [30]. Вероятно, именно высокое содержание ЖКОДЦ в наружной части перикарпия M. orientalis обеспечивает ее меньшую восприимчивость к микозам плодов, в особенности к парше.
Таким образом, были обнаружены значительные отличия в составе ЖК липидов перикарпиев родственных видов M. orientalis и M. domestica (сорт Ренет Симиренко). Мы связываем эти отличия с селекционным процессом. В результате селекции M. domestica получила такие особенности липидного состава, которые обеспечивают ее бóльшую холодо- и засухоустойчивость, однако потеряла резистентность к грибным болезням по сравнению с M. orientalis.
Т.В. Иванова и А.С. Воронков внесли одинаковый вклад в эту работу.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Воронков А.С., Иванова Т.В., Кузнецова Э.И., Кумахова Т.Х. Aдаптивные возможности плода Malus domestica Borkh. (Rosaceae) в условиях высотной поясности // Физиология растений. 2019. Т. 66. С. 441. https://doi.org/10.1134/S0015330319060150
Юзепчук С.В. Род Malus // Флора СССР / Под ред. Юзепчук С.В. Москва-Ленинград: Акад. наук СССР, 1939. Т. 9. С. 359.
Деревья и кустарники СССР // Москва: Акад. наук СССР, 1954. 841 с.
Левина Р.Е. Морфология и экология плодов // Ленинград: Наука, 1987. 160 с.
Кумахова Т.Х. Некоторые особенности анатомии плодов Malus domestica (Rosaceae) в зависимости от высоты культивирования в горах // Бот. журнал. 2003. Т. 88. С. 75.
Иванова Т.В., Воронков А.С., Кузнецова Э.И., Кумахова Т.Х., Жиров В.К., Цыдендамбаев В.Д. Жирные кислоты липидов перикарпия Сydonia oblonga Mill. и Mespilus germanica L. вовлекаются в адаптацию растений к условиям высотной поясности // Доклады Академии наук. 2019. Т. 486. С. 620. https://doi.org/10.31857/S0869-56524865620-625
Цыдендамбаев В.Д., Иванова Т.В., Халилова Л.А. Куркова Е.Б., Мясоедов Н.А., Балнокин Ю.В. Жирнокислотный состав липидов вегетативных органов галофита Suaeda altissima при разном уровне засоления // Физиология растений. 2013. Т. 60. С. 700. https://doi.org/10.7868/S001533031305014X
Lyons J.M., Weaton T.A., Pratt H.K. Relationship between the physical nature of mitochondrial membranes and chilling sensitivity in plants // Plant Physiol. 1964. V. 39. P. 262.
Иванова Т.В., Майорова О.В., Орлова Ю.В., Кузнецова Э.И., Халилова Л.А., Мясоедов Н.А., Бално-кин Ю.В., Цыдендамбаев В.Д. Ультраструктура и жирнокислотный состав липидов клеток вегетативных органов Chenopodium album L. в условиях солевого стресса // Физиология растений. 2016. Т. 63. С. 783. https://doi.org/10.7868/S0015330316060051
Иванова Т.В., Мясоедов Н.А., Пчёлкин В.П., Цыдендамбаев В.Д., Верещагин А.Г. Повышенное содержание жирных кислот с очень длинной цепью в липидах вегетативных органов галофитов // Физиология растений. 2009. Т. 56. С. 871.
Жуков А.В. Жирные кислоты с очень длинной цепью в составе мембранных липидов растений // Физиология растений. 2018. Т. 65. С. 418. https://doi.org/10.1134/S0015330318050184
Hitchcock C., Nichols B.W. Plant Lipid Biochemistry. New York: Academic, 1971. 387 p.
Cornille A., Gladieux P., Smulders M.J.M., Roldan-Ruiz I., Laurens F., Le Cam B., Nersesyan A., Clavel J., Olonova M., Feugey L., Gabrielyan I., Zhang X., Tenaillon M.I., Giraud T. New insight into the history of domesticated apple: secondary contribution of the European wild apple to the genome of cultivated varieties // PLoS Genet. 2012. V. 8: e1002703. https://doi.org/10.1371/journal.pgen.1002703
Скибинская А.М. Филогенетический метод анализа сортов яблони // Труды расширенной сессии научного совета Алтайской плодово-ягодной опытной станции. Барнаул. 1955. С. 163.
Hayward S.A.L., Murray P.A., Andrew Y. Gracey A.Y., Cossins A.R. Beyond the lipid hypothesis: mechanisms underlying phenotypic plasticity in inducible cold tolerance // Molecular aspects of the stress response: chaperones, membranes and networks / Eds. Csermely P., Vigh L. New York: Springer, 2007, P. 132.
Mironov K.S., Sidorov R.A., Trofimova M.S., Bedbenov V.S., Tsydendambaev V.D., Allakhverdiev S.I., Los D.A. Light-dependent cold-induced fatty acid unsaturation, changes in membrane fluidity, and alterations in gene expression in Synechocystis // Biochimica et Biophysica Acta. 2012. V. 1817. P. 1352. https://doi.org/10.1016/j.bbabio.2011.12.011
Barrero-Sicilia C., Susana Silvestre S., Haslam R.P, Michaelson L.V. Lipid remodelling: Unravelling the response to cold stress in Arabidopsis and its extremophile relative Eutrema salsugineum // Plant Science. 2017. V. 263. P. 194. https://doi.org/10.1016/j.plantsci.2017.07.017
Cruz R.P., Golombieski J.I., Bazana M.T., Cabreira C., Silveira T.F., Silva L.P. Alterations in fatty acid composition due to cold exposure at the vegetative stage in rice // Braz. J. Plant Physiol. 2010. V. 22. P. 199. https://doi.org/10.1590/S1677-04202010000300007
Falcone D.L., Ogas J.P., Somerville C.R. Regulation of membrane fatty acid composition by temperature in mutants of Arabidopsis with alterations in membrane lipid composition // BMC Plant Biology. 2004. V. 4. P. 17. https://doi.org/10.1186/1471-2229-4-17
Gigon A.S, Matos A.-R., Laffray D., Zuily-Fodil Ya., Pham-Thi A.-T. Effect of drought stress on lipid metabolism in the leaves of Arabidopsis thaliana (Ecotype Columbia) // Ann. Bot. 2004. V. 94. P. 345. https://doi.org/10.1093/aob/mch150
Bettaieb I., Zakhama N., Aidi Wannes W., Kchouk M.E., Marzouk B. Water deficit effects on Salvia officinalis fatty acids and essential oils composition // Sci. Hort. 2009. V. 120. P. 271. https://doi.org/10.1016/j.scienta.2008.10.016
Hamrouni I., Salah H.B., Marzouk B. Effects of water-deficit on lipids of safflower aerial parts // Phytochemistry. 2001. V. 58. P. 277. https://doi.org/10.1016/S0031-9422(01)00210-2
Shang B., Xu Ch., Zhang X., Cao H., Xin W., Hu Y. Very-long-chain fatty acids restrict regeneration capacity by confining pericycle competence for callus formation in Arabidopsis // PNAS. 2016. V. 113. P. 5101. https://doi.org/10.1073/pnas.1522466113
Bach L., Faure J.-D. Role of very-long-chain fatty acids in plant development, when chain length does matter // C. R. Biol. 2010. V. 333. P. 361. https://doi.org/10.1016/j.crvi.2010.01.014
Bach L., Gissot L., Marion J., Tellier F., Moreau P., Satiat-Jeunemaitre B., Palauqui J.-C., Napier J. A., Faure J.-D. Very-long-chain fatty acids are required for cell plate formation during cytokinesis in Arabidopsis thaliana // J. Cell Sci. 2011. V. 124. P. 3223. https://doi.org/10.1242/jcs.074575
Nobusawa T., Okushima Y., Nagata N., Kojima M., Sakakibara H., Umeda M. Synthesis of very-long-chain fatty acids in the epidermis controls plant organ growth by restricting cell proliferation // PLoS Biol. 2013. V. 11: e1001531. https://doi.org/10.1371/journal.pbio.1001531
Roudier F., Gissot L., Beaudoin F., Haslam R., Michaelson L., Marion J., Molino D., Lima A., Bach L., Morin H., Tellier F., Palauqui J.-C., Bellec Y., Renne C., Miquel M. et al. Very-long-chain fatty acids are involved in polar auxin transport and developmental patterning in Arabidopsis // Plant Cell. 2010. V. 22. P. 364. https://doi.org/10.1105/tpc.109.071209
Kumachova T.Kh., Beloshapkina O.O., Voronkov A.S. The Maloideae (Rosaceae) structural and functional features determining passive immunity to mycosis // Asian Journal of Research in Botany. 2019. V. 2. P. 1.
Кумахова Т.Х., Белошапкина О.О., Воронков А.С., Рябченко А.С. Морфофункциональная характеристика листьев и плодов Maloideae Werber. (Rosaceae Juss.): б. Роль поверхностных тканей в формировании устойчивости к грибным болезням // Труды по прикладной ботанике, генетике и селекции. 2019. Т. 180. С. 95. https://doi.org/10.30901/2227-8834-2019-2-95-101
Raffaele S., Leger A., Roby D. Very long chain fatty acid and lipid signaling in the response of plants to pathogens // Plant Signaling Behav. 2009. V. 4. P. 94. https://doi.org/10.4161/psb.4.2.7580
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


