Физиология растений, 2020, T. 67, № 3, стр. 246-258
Светокультура растениеводства защищенного грунта: фотосинтез, фотоморфогенез и перспективы применения светодиодов
А. О. Закурин a, *, А. В. Щенникова a, А. М. Камионская a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
* E-mail: arturus@inbox.ru
Поступила в редакцию 05.07.2019
После доработки 05.09.2019
Принята к публикации 17.10.2019
Аннотация
Пластичность морфологии растений позволяет им эффективно приспосабливаться к условиям окружающей среды. Энергию для развития и ответа на стрессы растения получают за счет фотосинтеза, поэтому они должны эффективно улавливать и усваивать световое излучение. Основным органом фотосинтеза является лист, структура которого эволюционировала для максимально эффективного использования солнечного света, а система фоторецепторов определяет реакцию на объем и качество освещения и запускает различные сигнальные пути, последствия чего сказываются на особенностях роста, развития и морфогенеза растений. Многочисленные исследования сфокусированы на ответе различных видов растений на монохромные и мультиспектральные виды излучений, а также количество и продолжительность освещения. Развитие светодиодных технологий позволяет совершенствовать производство сельскохозяйственной продукции в условиях защищенного грунта. Важным преимуществом светодиодов является возможность динамического управления характеристиками света для оптимизации морфогенеза растений в процессе культивирования с целью повышения урожайности и качества продукции, а также снижения производственных энергозатрат.
ВВЕДЕНИЕ
Свет является одним из самых важных факторов роста и развития растений, при этом степень и качество его влияния зависят от длительности, периодичности, интенсивности и спектральных характеристик освещения [1]. Растения не просто регистрируют изменения характеристик светового потока, принимая световые сигналы, но адаптивно реагируют на них, запуская различные сигнальные пути [2].
Принимая во внимание сложную систему ответа растений на многокомпонентный свет, запускающую жизненно важные процессы онтогенеза, реакции на стрессы и адаптации, выращивание растений в защищенном грунте требует особого внимания к параметрам освещения. Во-первых, необходимо уметь предсказывать требуемые условия освещения для оптимального развития каждого отдельного вида растений, во-вторых, необходимо иметь инструменты для создания таких условий.
Появление узкоспектральных монохромных светодиодов (Light-emitting diodes, LED) сделало возможным получение точных спектральных характеристик освещения и стимулировало многочисленные исследования влияния характеристик света на различные аспекты роста и развития растений [3]. Сегодня использование LED в качестве источника основного или дополнительного освещения постепенно революционизирует светокультуру растениеводства защищенного грунта – одну из самых сложных отраслей современного сельского хозяйства [3]. Светодиоды способны эффективно заменять лампы накаливания для контроля фотозависимого ответа в растениях, а также являются конкурентной альтернативой флуоресцентным лампам и дуговым натриевым трубчатым лампам высокого давления (ДНАТ) [3].
Настоящий обзор сфокусирован на роли света и его характеристик в онтогенезе растений, включая возможность использования узкоспектральных излучений для направленной регуляции морфологии, биохимии и ответа на биотический стресс выращиваемых культур. Кроме того, в обзоре обсуждаются перспективы применения светодиодов для повышения эффективности производства сельскохозяйственной продукции в защищенном грунте.
ФОТОСИНТЕТИЧЕСКИ АКТИВНАЯ РАДИАЦИЯ
Один из самых главных процессов, поддерживающих жизнь на земле – естественный фотосинтез под действием солнечной радиации, от 26 до 64% которой, в зависимости от соотношения прямого и рассеянного излучения, составляет видимый спектр (ФАР) [4]. Зеленые части растений преобразуют ФАР, обеспечивая так необходимые нам кислород, пищу и топливо. Поэтому событие преобразования радиально-симметричного стеблеподобного листа в плоскую структуру с увеличенной площадью поглощения света признается одним из ключевых новшеств земной эволюции [5]. Современный лист является сложной оптической системой, энергетически эффективно утилизирующей ФАР [6]. Видимый свет представлен фиолетовым (ФС, ~380–440 нм), синим (СС, ~440–485 нм), голубым (ГС, ~485–500 нм), зеленым (ЗС, ~500–565 нм), желтым (ЖС, ~565–590 нм), оранжевым (ОС, ~590–625 нм), красным (КС, ~625–700 нм) и дальним красным (ДКС, ~700–750 нм) [1]. В литературе можно встретить и более упрощенное деление, например, на ультрафиолет (УФ, 320–400 нм), СС (400–500 нм), ЗС (500–600 нм), КС (600–700 нм) и ДКС (700–800 нм) [7]. Усвоение энергии ФАР начинается с первичного поглощения квантов света антенными пигмент-белковыми комплексами, после чего энергия возбуждения передается к реакционным центрам фотосистем [6, 8]. Световые сигналы принимаются фоторецепторами, с помощью которых и происходит светозависимая регуляция архитектуры растения (от высоты побега и площади листа до цветения) [1, 9].
На сегодняшний день науке известен целый ряд фоторецепторов, специфичных к определенным длинам волн. К волнам КС (~650–670 нм), ДКС (~705–740 нм) и, в меньшей степени, СС (~400–500 нм) чувствительны фитохромы PhyA–E [1, 10, 11]. Фитохромы участвуют в регуляции множества физиологических процессов, протекающих в растении, от прорастания семени до цветения и плодоношения, а также в ответе растения не только на освещение, но и на абиотические стрессы (температура, засоление, засуха, УФ радиация), включая адаптацию к окислительному стрессу. Это связано, прежде всего, с влиянием фитохромов на биосинтез низкомолекулярных антиоксидантов и фотосинтетических пигментов, а также на уровень экспрессии некоторых генов клеточной сигнализации [10–12]. Под воздействием КС фитохром переходит в физиологически активную форму, обратный переход осуществляется при ДКС, при этом обе изоформы стабильны и максимально абсорбируют в области 705–740 и 650–670 нм соответственно [10, 11]. Повышение содержания активной формы фитохромов и/или процента PhyB по отношению к общему их количеству приводит к возрастанию стрессоустойчивости растения и также является необходимым для формирования устьиц, поддержания уровня содержания хлорофиллов в зрелых листьях и структурной целостности хлоропластов в процессе старения [10].
Сигнал излучения СС (~440–485 нм) и длинноволнового ультрафиолетового (УФ) спектра UV-A (315–400 нм) принимается криптохромами CRY1–3 и фототропинами PHOT1–2, которые регулируют, в том числе, процессы, связанные с водным и газовым обменом [1, 2, 10, 11]. Криптохромы в своем составе имеют PHR-домен, высоко гомологичный фотолиазам (участвуют в светозависимой репарации ДНК) и осуществляющий фотосенсорную функцию посредством связывания с хромоформами (птерином и флавином) [7, 11]. Кроме СС, криптохромы принимают и ЗС, при этом волны З/ЖС (~570 нм) ускоряют реверсию СС-активированных криптохромов в неактивное состояние [7]. Данные фоторецепторы активируют экспрессию всех ядерных генов фотосинтетического аппарата, контролируя циркадные ритмы, индукцию цветения и другие функции растений [7, 11]. Фототропины представляют собой протеинкиназы, которые активируются светом и участвуют в регуляции фототропизма побега, корня и листьев, перемещение хлоропластов в ответ на световые и температурные сигналы и регуляцию движений устьиц, а также могут выступать в роли термосенсоров [11].
Фоторецепторами ключевого компонента радиационной среды – средневолнового UV-B (280–315 нм), который выходит за пределы ФАР и используется растениями в качестве сигнала для адаптации к солнечной радиации, являются Е3-убиквитин-лигазы ZEITLUPE, FLAVIN-BINDING KELCH REPEATF-BOX 1 и LOVKELCHPROTEIN 2 (ZTL, FKF1 и LKP2), а также UVRESISTANCELOCUS 8 (UVR8) [1, 2, 11]. ZTL контролирует циркадные ритмы, FKF1 – переход к цветению, а LKP1 участвует в обоих процессах [11]. Данные белки представляют собой комбинацию фоторецептора и F-box белка, активируются под действием СС и опосредуют убиквитинирование и протеасомную деградацию своих субстратов [1, 2, 11]. Белок UVR8 способен связываться с промоторами генов транскрипционных активаторов фотоморфогенеза [11]. UVR8 и CRYs независимо друг от друга могут обеспечивать рост и выживание растений под солнечным УФ, при этом отсутствие активности обоих видов фоторецепторов летально при UV-B, а в отсутствие CRYs восприятие UV-A сигнала берет на себя UVR8 [10, 11].
Интересно, что активные формы фоторецепторов способны тем или иным образом взаимодействовать с основными игроками крупных регуляторных модулей: активатором фотоморфогенеза HY5 (ELONGATED HYPOCOTYL 5), системными интеграторами PIFs (PHYTOCHROMEINTERACTING FACTORS) и СОР1 (CONSTITUTIVE PHOTOMORPHOGENIC 1, субстратный рецептор E3-убиквитин-лигазы CUL4), от которых зависит переключение многих генетических программ, включая фотоморфогенез, циркадные ритмы и другие процессы развития растения [11].
Фотосинтез представляет собой квантовый фотохимический процесс, в котором примерно на 8–10 фотонов (квантов) поглощенного света (безотносительно к длине волны) фиксируется один углерод и выделяется одна молекула кислорода. ФАР измеряется в квантовых единицах плотности фотосинтетически активного потока фотонов (мкмоль/(м2 с)), отражая интенсивность лучистой световой энергии, излучаемой источником света на единицу площади поверхности в единицу времени [9]. Заметим здесь, что многие исследователи для определения интенсивности освещения до сих пор используют другие фотометрические единицы (люмены, люксы и др.), которые основаны на реакции на свет человеческого глаза, более чувствительного к зеленому свету, чем к красному или синему.
Реакции фотосинтеза происходят в хлоропластах, где расположены фотосистемы I и II, содержащие ряд антенных пигментов (хлорофиллы – основные листовые пигменты первичного фотосинтеза, каротиноиды), чья задача – поглощение и передача энергии света в реакционные центры фотосистем (РЦ) [9]. Интенсивность солнечного излучения наиболее велика в области 500 нм, то есть в зеленой части спектра, где хлорофиллы поглощают минимально. При этом они интенсивно абсорбируют свет в красной и синей частях спектра, каротиноиды же – строго в синей области [9]. Считается, что в РЦ фотосистем I и II абсорбируются только фотоны, энергия которых находится в пределах интервала, где минимальный уровень – энергия, необходимая для высвобождения одного электрона, а максимальный уровень определяет границу, выше которой происходит рассеивание энергии (диссипация). Несмотря на наивысший поток энергии солнечного излучения в части спектра около 500 нм, наибольшее количество усвоенных квантов приходится на область ФАР ДКС (680–700 нм) [13, 14]. Интересно, однако, что максимальная эффективность фотосистемы достигается в инфракрасном диапазоне (~1100 нм), где абсорбируется еще больше фотонов, чем при 680 нм [14]. Тем не менее, расчетная эффективность преобразования поглощенной энергии солнечного излучения в химическую энергию имеет наивысшее значение именно в области спектра 680–720 нм, и определенный природой в процессе эволюции волновой диапазон 680–700 нм для реакционных центров фотосистем I и II является оптимальным для максимального использования солнечного спектра [13–15].
На рис. 1 представлена кривая относительной квантовой эффективности фотосинтеза (ОКЭФ) или усваиваемого растением потока фотонов (yield photon flux (YPF)), которая показывает, что волны в диапазоне 400–500 нм на 25–35% менее эффективны относительно КС при расчете фотосинтеза единичного листа [9].
Рис. 1.
Кривая относительной квантовой эффективности фотосинтеза (при низком освещении 16–150 мкмоль/(м2 с)). На основе данных Eichhorn Bilodeau с соавт. [9] и https://www.photonics.com/Articles/The_McCree_Curve_Demystified/ p1/vo150/i1013/a63340
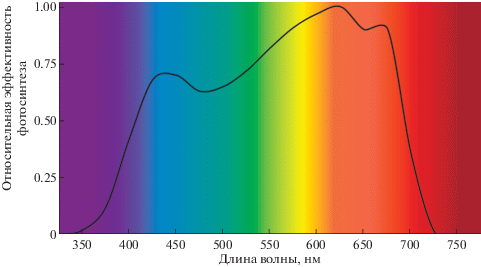
Не все абсорбируемые синие фотоны используются в фотосинтезе, что ограничивает влияние СС на ОКЭФ. Частично это происходит из-за поглощения около 20% фотонов нефотосинтетическими пигментами с последующим рассеиванием энергии в виде тепла или флуоресценции [9]. Кроме того, часть фотонов СС поглощается каротиноидами, а эффективность передачи энергии возбуждения от каротиноидов к хлорофиллам значительно меньше (35–90%), чем при передаче от хлорофилла к хлорофиллу (до 100%) [16]. Такая разница обусловлена тем, что функция антенн для каротиноидов не первостепенна. Эти пигменты выполняют, прежде всего, светозащитную роль, предотвращая фотоокислительное повреждение с помощью тушения возбужденного синглетного и триплетного состояния хлорофилла в центрах световых реакций, а также гашением возбужденного синглетного кислорода [9, 17].
Кривая ОКЭФ была построена еще в 1970-е годы на основе краткосрочных измерений, проведенных на одиночных листьях в условиях низкого освещения [9]. С тех пор проведено множество исследований эффективности фотосинтеза на протяжении всего жизненного цикла растений и выявлено, что гораздо больше, чем качество света на параметры роста растений влияет его количество [9]. Между точкой компенсации и точкой насыщения света происходит увеличение ФАР. Так как в световой точке компенсации фотосинтетическая активность растения равна его дыхательной активности по СО2-обмену, она является основой для выбора интенсивности света при выращивании конкретной культуры. При световом насыщении скорость фотосинтеза достигает своего максимума, после которого еще большее увеличение светового потока уже не оказывает эффекта или отрицательно влияет на фотосинтез. К примеру, точки компенсации для мангольда, листовой капусты и шпината составляют 25, 13 и 73 мкмоль/(м2 с) соответственно, а световое насыщение для капусты и мангольда наступает в диапазоне от 884 до 978 мкмоль/(м2 с) и для шпината – 1238 мкмоль/(м2 с) [18]. Данные параметры зависят от генотипа, однако в любом случае повышение уровня фотосинтеза приводит к росту биомассы по мере достижения световой точки насыщения. Избыток же освещения является стрессом для растения, не меньшим, чем нехватка минерального питания, засуха, экстремальные температуры и т.д. Следствием могут являться дисбаланс между поглощением и переработкой световой энергии и нарушение процессов развития [19]. В стремлении защититься от фотоповреждений и адаптироваться к повышенной освещенности растение начинает накапливать фотозащитные пигменты (флавоноиды, антоцианы, каротиноиды, беталаины и др.), которые поглощают излучение УФ и ФАР [5, 19].
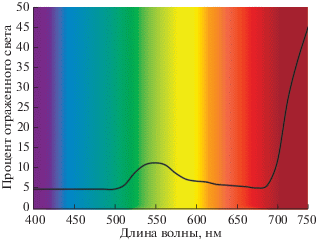
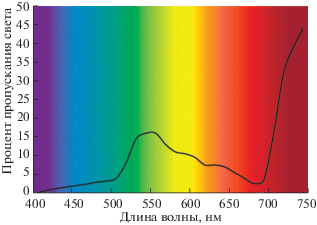
Выяснилось, что для абсорбции ФАР также имеют значение анатомия листьев, включая проводимость устьиц и мезофилла, градиент концентрации CO2, а также расположение основных фотосинтезирующих органов по отношению к источнику света (расстояние, угол освещения, ориентация листа, ярус) [20–22]. Излучение, направленное под острым углом к листьям, повышает отражение световых волн и снижает эффективность фотосинтеза до 50% [21]. Рассеянный (диффузный) свет также уменьшает фотосинтез на 15% по сравнению с направленным освещением [21]. Растительный полог в фитоценозах настолько развит, что до поверхности земли (при нормальном развитии растительного покрова) доходит от 2% (смешанный лес) до 19% ФАР (посевы подсолнечника), а 6–12% ФАР отражается от поверхности насаждений. Зеленые листья минимально поглощают в зеленой области спектра, частично отражая зеленые волны (рис. 2), частично пропуская их и делая доступными для поглощения листьями внутри полога (рис. 3) [20]. Эта особенность с учетом максимального солнечного излучения в зеленой области спектра позволяет растениям увеличить поглощение ФАР, эффективно управлять фотосинтезом во всех хлоропластах в пределах листа (включая повышение скорости переноса электронов), а также относительно равномерно распределять солнечную радиацию по всей кроне, не забывая нижние ярусы [20].
Понимание количественных и спектральных особенностей фотосинтеза лежит в основе разработки системы освещения для выращивания в защищенном грунте любой растительной культуры. Однако большое количество степеней свободы в открытых биологических системах приводит к необходимости рассмотрения всех возможных альтернатив, что является трудоемкой задачей [23–25].
СВЕТОДИОДЫ ДЛЯ СВЕТОКУЛЬТУРЫ
Контроль роста и развития растений
Как уже говорилось выше, фоторецепторы способны модулировать ответ растений на параметры освещения. Белок COP1, считающийся ключевым переключателем фотоморфогенеза, регулирует стабильность в ответ на свет различных факторов транскрипции, взаимодействуя с ними. Среди них bZIP-белки HY5, HYH (HY5 HOMOLOG), CONSTANS (CO/BBX1), COL3/BBX4, STO/BBX24 (SALT TOLERANCE) и bHLH-белок HFR1 (LONG HYPOCOTYL IN FAR-RED 1) [26]. Взаимодействие же COP1 с фоторецепторами URV8, CRY1 и CRY2 подавляет активность данного белка [26]. Активируемые светом фоторецепторы увеличивают аффинность к COP1 для вытеснения взаимодействующих с COP1 транскрипционных факторов, способствуя их накоплению и индукции фотоморфогенного развития растений [26].
Поэтому, чтобы получить желаемый физиологический эффект при выращивании растений, освещение должно иметь соответствующие параметры – от интенсивности и продолжительности до применения определенного спектра волн. Это возможно организовать с помощью монохромных и мультихромных LED [9, 27], для которых принципиальная возможность использования в светокультуре была продемонстрирована сравнительным анализом параметров роста и накопления метаболитов растениями, выращиваемыми при нормальном уровне освещения с помощью LED (КС и СС) и ДНАТ [28].
КС, имеющий самую высокую ОКЭФ, обычно вызывает прибавку сухой массы, разрастание корневой системы, удлинение стеблей, увеличение площади листового аппарата, а также контролирует продолжительность и качество цветения во многих видах растений [9]. В 90-е годы XX века эксперименты по исследованию влияния на растения регулируемого спектра (с использованием красных светодиодов (660 нм) и синих флуоресцентных ламп) продемонстрировали, что некоторые растения могут успешно проходить жизненный цикл при исключительно КС, однако небольшой добавочный процент СС оказывал позитивное влияние на рост и развитие [27, 29]. Оказалось, что доля СС способна усилить эффективность фотосинтеза, опосредуя развитие хлорофиллов и хлоропластов, а также может регулировать высоту растения, синтез антоцианов и ответ на биотический стресс [9].
Современные исследования показали, что для каждой культуры характерно свое оптимальное соотношение КС и СС, которое дополнительно варьируется в зависимости от целевого эффекта [30]. Например, высота растений перца максимальна при 100% КС, однако при 95% КС и 5% СС эти же растения способны дать большее число цветков и плодов, при пропорции 91/9% – увеличенное содержание общего хлорофилла и антиоксидантов, а при 83/17% – максимум каротиноидов [30]. Каротиноиды сильно абсорбируют в СС с максимумом при длине волны 448 нм, что объясняет повышение уровня биосинтеза этих важных вторичных метаболитов в ответ на добавление СС [30]. Использование же отдельно КС или СС ограничивает динамические перестройки архитектуры хлоропластов и снижает содержание хлорофилла в сравнении с контрольными растениями, выращенными при белом свете [31].
Сегодня уже общепринято, что в светокультуре защищенного грунта для стимуляции роста растений и повышенного содержания пигментов и антиоксидантов в плодах овощных культур КС необходимо определенным образом комбинировать с СС [30]. В то время как КС в большей мере влияет на функции хлоропластов, рост стебля и черешков листьев, а также развитие репродуктивной системы растения [32], СС воздействует на рост растения в целом, разрастание листьев, фотоморфогенез, открытие устьиц, фотосинтез и накопление пигментов [33–35]. Важно, что доля СС необходима также для предотвращения последствий синдрома избегания тени (shade-avoidance syndrome, SAS), характерного для красного участка спектра, при котором за счет активации биосинтеза и транспорта ауксина, опосредующих элонгацию клеток, удлиняются стебель и листовые черешки [10, 11, 36–38]. Как показано для Arabidopsis, при низком соотношении КС/ДКС фитохром PhyB непосредственно взаимодействует с PIFs (включая PIF3, 4, 5 и 7) и позитивно регулирует SAS-ответ, запуская транскрипцию рост-стимулирующих генов. Основные гены ответа (98 – с положительной регуляцией, и 112 – с отрицательной) включают множество прямых мишеней PIF3, 4 и 5, и AUXINRESPONSEFACTOR6 (ARF6). Активируется также экспрессия генов, кодирующих белки – негативные регуляторы SAS-ответа LONGHYPOCOTYLINFAR-RED1/SLENDERINCANOPYSHADE1 (HFR1/SICS1), PHYTOCHROMERAPIDLYREGULATED1 (PAR1), PAR2 и PIF3-LIKE1 (PIL1), которые ингибируют транскрипционную активацию генов-мишеней PIF4 и PIF5 [38]. В SAS-ответе участвуют и упомянутые ранее важные компоненты свет-опосредованного сигнального пути HY5, B-Box и COP1 [38]. Сравнительные исследования ответа на SAS на кукурузе позволили предположить, что данный сигнальный путь является высоко консервативным для видов растений, чувствительных к тени [38]. Поэтому добавление СС должно угнетать SAS-ответ самых разных агрокультур. Однако следует учитывать, что увеличение доли СС свыше 20% способно чрезмерно подавлять деление и растяжение клеток, уменьшая площадь листа ниже нормы, как следствие, снижая емкость фотосинтеза и биомассу растений [39, 40].
Исследование влияния КС и СС на состояние собранного урожая при хранении на примере брокколи показало, что КС замедляет синтез этилена и снижение концентрации аскорбатов в кочане и, как следствие, физиологическое старение и пожелтение, при этом заметного эффекта от добавления СС не выявлено [41].
ЗС/ЖС (~500–600 нм) и ДКС (~700–750 нм) нечасто рассматриваются как необходимые составляющие светокультуры из-за более низкой, в сравнении с КС и СС, абсорбции этих волн хлорофиллами, однако положительно воздействуют на растения.
В отличие от фотонов КС и СС, активно поглощаемых в верхних клеточных слоях листа, фотоны ЗС проникают глубже и в лист, и в листовой полог, что увеличивает общий объем фотосинтеза растения, индуцируя фиксацию СО2 нижними и внутренними частями листового полога [20, 21, 42, 43]. Относительная квантовая эффективность поглощения ЗС может быть сопоставима с таковой КС и быть выше, чем СС [9].
Интересно, что ЗС также может влиять на качество урожая при хранении. Так, слабоинтенсивное облучение ЗС брокколи, содержащейся в хранилище, повышает содержание хлорофилла и аскорбиновой кислоты в кочане. При использовании ЗС совместно с ЖС, КС и СС происходит задержка старения брокколи и существенное увеличение сроков ее хранения [44]. Применение же только желтых LED (590 нм) значительно увеличивает антиоксидантный потенциал и слегка ускоряет дозревание яблок, томатов и перцев при хранении [45].
Поскольку волны ДК части спектра определяют синдром избегания тени растением, можно регулировать соотношение КС/ДКС и, следовательно, количество активной формы фитохрома для контроля биомассы растений [10, 11]. Досвечивание ДКС при использовании КС/СС или мультиспектрального белого света повышает эффективность фотосинтетической активности более коротких волн, стимулируя рост растений, разрастание листьев и увеличение сухой массы на единицу площади листа [46, 47].
Таким образом, при комбинаторном применении в светокультуре LED с разными длинами световых волн очевиден синергетический эффект.
Растения воспринимают не только ФАР, но и УФ, и хотя UV-B излучение составляет < 0.5% от общей солнечной радиации на поверхности Земли, его высокая энергия вызывает повреждения нуклеиновых кислот, белков и липидов [48]. В ответ на UV-B запускается сигнальный путь, опосредованный UVR8 и способствующий адаптации растения. Данный путь высоко консервативен у видов как высших, так и низших растений [49]. Его наличие, у последних, в том числе, у зеленой водоросли Chlamydomonas reinhardtii, свидетельствует о ранней эволюции UVR8-сигналинга у фотосинтезирующих растений [50]. Защитные механизмы стимулируются с помощью синтеза и накопления в вакуоли эпидермальных клеток различных УФ-поглощающих соединений, например, флавоноидов, включая антоцианы. Так, в ответ на UV-B активируется экспрессия гена фенилаланин-аммиак-лиазы (PAL), ключевого фермента фенилпропаноидного пути в растениях, что было продемонстрировано на клеточной культуре моркови [48]. Антоцианы обладают кардиопротекторными, антисклеротическими и противоопухолевыми свойствами [51], поэтому использование UV-B светодиодного досвечивания в светокультуре может способствовать контролю/регуляции содержания антоцианов в урожае. Однако следует помнить также, что повышенные уровни UV-B облучения приводят к торможению роста и развития растения, включая изменения на репродуктивной стадии (уменьшенные размеры цветковых органов, сниженная жизнеспособность пыльцы, изменения биохимического состава семян и пр.) [52].
При изучении влияния светодиодов на рост и развитие растений в основном используют неизменные в течение дня и даже в течение всего цикла выращивания спектральные характеристики света. Однако интенсивно оптимизировать светокультуру способна динамичная регуляция спектра освещения в эти периоды. Так, непродолжительное освещение ДКС в конце фотопериода или перед его началом способно существенно повлиять на рост и морфологию некоторых видов сельскохозяйственных растений [53–55]. Один из эффектов такого кратковременного воздействия – увеличение биомассы, связанное с гормональными перестройками, которые незамедлительно изменяют циркадный ритм, устьичную проводимость и дыхание растений [56, 57].
Становится понятным, что единого рецепта освещения для всех видов растений и каждой стадии их онтогенеза не существует, хотя имеются некие общие закономерности. Например, то, что вегетативный рост большинства культур можно стимулировать различными комбинациями красных и синих светодиодов [30]. Или же то, что, несмотря на видоспецифичность ответа на спектральные характеристики освещения, а также на другие условия (температура, состав питания и пр.), рост и развитие растений стабильно обеспечивается мультиспектральным освещением ФАР.
По мере роста растение вынуждено находить энергетический баланс между разрастанием листа (для увеличения количества поглощенного света), вытягиванием и репродуктивным развитием растения. В светокультуре защищенного грунта, поэтому, должен подбираться оптимальный спектр освещения для каждой стадии развития таким образом, чтобы избежать морфофизиологических нарушений [58].
В современном производстве растительной продукции все чаще используют дополняющие светодиоды, излучающие вне пиков поглощения хлорофилла. При сложностях с подбором оптимального спектра применяют светодиодные осветители белого света: комбинацию светодиодов с различными пиками излучения или же светодиоды СС с люминофорным покрытием, которое поглощает часть фотонов СС и переизлучает свет с большей длиной волн, формируя широкий спектр белого света [57, 59].
Контроль цветения
Инициация цветения растений зависит от генотипа и опосредована автономным, температурным, гормональным и фотопериодическим сигнальными путями [60]. Переход к репродуктивной стадии развития запускает фактор транскрипции FLOWERINGLOCUST (FT), синтез и накопление которого в апикальной меристеме побега регулируется, в том числе, фотопериодом через фактор транскрипции CO [60–62]. Показано, что криптохромы СRY связывают убиквитин-лигазный комплекс СОР1-SPA1, способствуя его удалению из клеточного ядра, и инициируют цветение, поскольку именно СОР1 вызывает убиквитинирование и деградацию CO [11]. Другой фоторецептор, FKF1, участвует в деградации репрессоров генов CO, что также стимулирует цветение [11]. Фотопериод-зависимые виды зацветают в ответ на критическую длительность непрерываемой темноты [63]. Различают три типа таких растений – нейтральные, короткого дня (или, скорее, длинной ночи) и длинного дня (короткой ночи) [60, 63]. Увеличение продолжительности дня за счет искусственного освещения может вызывать цветение растений короткой ночи и подавлять его у растений длинной ночи. Аналогичный и даже больший эффект можно получить с помощью кратковременных ночных включений КС – так называемых ночных прерываний периода темноты [63], что приводит к наращиванию активной формы фитохромов и, как следствие, возрастанию уровня содержания антиоксидантов (каротиноидов и флавоноидов) и устойчивости фотосинтетического аппарата растения к УФ радиации и высокоинтенсивному освещению. Помимо регуляции цветения, подобное воздействие приводит к увеличению размера плодов у томата [64], а также к отсутствию или уменьшению размера корнеплодов у короткодневных сортов редиса [65].
Основными регуляторами цветения фотопериод-зависимых видов считаются фитохромы, которые, как упоминалось выше, поглощают свет в К и ДК области спектра [9, 13]. Интересно, что действие фитохромов зависит от класса покрытосеменных: у двудольных фитохром PhyB подавляет цветение, а у злаков активирует его совместно с PhyC [11]. Таким образом, не только длительность фотопериода, но и спектр освещения активно используются в цветочной промышленности для контролируемой стимуляции или подавления цветения фотопериод-зависимых декоративных культур, в зависимости от календаря рыночного спроса. Ранее для этого часто использовали лампы накаливания, излучающие большое количество фотонов в ДК части спектра, и флуоресцентные лампы, которые оказывают меньшее влияние на зацветание, однако дольше служат [66]. Сегодня предпочтение отдается светодиодам, результативность которых обеспечивается подбором индивидуальных узкоспектральных характеристик для точного контроля фоторегуляции и энергоэффективности светокультуры декоративных растений разных видов [66]. Например, использование комбинации КС и ДКС замедляет зацветание растений короткого дня и ускоряет цветение растений короткой ночи [67–69]. Подобно ДКС действуют светодиоды белого света (как холодного, так и теплого) [69]. Ночные прерывания или удлинение фотопериода с использованием ЗС угнетают цветение растений короткого дня [70, 71].
Третьим параметром, определяющим переход к репродуктивному развитию, является суммарная дневная освещенность, т.е. суточное количество фотонов ФАР, полученных растением. Однако даже при низкой суточной освещенности некоторые виды декоративных растений длинного дня зацветают, если дополнить системы освещения из красных и белых светодиодов ночными прерываниями ДКС [72].
Контроль морфофизиологии растений
Недостаток определенных длин волн может вызывать у растений физиологические нарушения, которые не наблюдаются при культивировании в условиях широкого спектра ФАР. Например, с отсутствием в спектре УФ и ДКС связывают излишнее разрастание клеток на поверхности листьев [73–75]. Такие наросты нарушают не только физиологию растения, но и его эстетические показатели, что особенно важно в случае декоративных культур. Применение УФ предотвращает развитие наростов у восприимчивых сортов томата (Solanum lycopersicum) и декоративного батата (Ipomoea batatas) [74, 75]. В условиях дефицита УФ, уменьшить наросты помогают ДКС и СС, что показано на примере томата и фасоли (Vigna unguiculata) [25, 73, 76, 77]. Освещение исключительно КС, с одной стороны, может приводить к излишнему удлинению побегов, дефициту хлорофилла и снижению уровня фотосинтеза [27, 29, 78], а с другой стороны, – к увеличению биомассы в сравнении с полихромным освещением [77, 79, 80].
Контроль ответа на биотический стресс
Освещение растений светодиодами специфичных спектров излучения, а также их интенсивность и продолжительность способны регулировать сопротивляемость растений фитопатогенам. Это связано с индукцией светом сигнальных путей, запускающих накопление вторичных метаболитов, например, флавоноидов, ассоциированных с иммунным ответом растений на биотические стрессы [81, 82]. Увеличение количества вторичных метаболитов перспективно также в контексте повышения диетической ценности растительной продукции [83].
Освещение красными и синими светодиодами способно подавлять споруляцию и размножение некоторых грибов, например, серой гнили Botrytis cinerea на листьях растений или (в случае применения в конце или до начала фотопериода) церкоспороза Pseudocercospora fuligenea [84, 85]. КС может увеличивать устойчивость к мучнистой росе Podosphaera pannosa (у розы), Sphaerotheca fuliginea (у огурца) и Peronospora belbahrii (у базилика) [84, 86]. Более того, предпосевная обработка семян КС стимулирует системную устойчивость к корневым нематодам Meloidogyne javanica и Pseudomonas syringae pv. TomatoDC 3000 [86]. Применение ЗС действенно против земляничного антракноза Glomerella cinglata и пятнистости листьев Perilla, вызываемых Corynespora cassiicola [86].
Особое место в ответе на биотический стресс занимает использование УФ излучения. Оно входит в видимый спектр света для насекомых, и его отсутствие оказывает поведенческое воздействие на распространение, кормление и спаривание белокрылки, тли и некоторых других насекомых-вредителей, а также блокирует споруляцию многих грибных патогенов [87]. Так, например, УФ-светодиоды с пиком излучения в области 290–320 нм эффективно противодействуют развитию мучнистой росы Sphaerotheca aphanis на землянике и Podosphaera pannosa на розе [86].
Более того, поскольку под действием, в основном, УФ происходит фотодеградация пестицидов, уменьшение УФ излучения в светокультуре способно замедлить их разложение и обеспечить устойчивый контроль над насекомыми-вредителями [87].
Использование узкоспектральных светодиодов становится популярным также для ловли насекомых. Так, УФ, зеленые и/или желтые светодиоды усиливают привлекательность ловушек для белокрылки Trialeurodes vaporariorum, восточной плодовой мушки Bactrocera dorsalis, комарика Bradysia difformis, хрущака малого Tribolium castaneum, бататового долгоносика Euscepes postfasciatus и хлопковой совки Helicoverpa armigera [86].
СНИЖЕНИЕ ЭНЕРГОЗАТРАТ В СВЕТОКУЛЬТУРЕ
Затраты на электроэнергию в светокультуре существенно влияют на себестоимость продукции и, в конечном итоге, на ее доступность для массового потребителя.
Поскольку фотосинтез является квантовым процессом, эффективность осветителя оценивают в количестве испускаемых им квантов ФАР на единицу затраченной энергии в секунду (мкмоль/(Вт с) или мкмоль/Дж). На 2014 год, при сходных показателях эффективности лучших образцов ДНАТ и светодиодов, затраты на электричество для освещения растений светодиодами были выше, чем при использовании ДНАТ [86]. По состоянию на 2019 год, эффективность светодиодов значительно выросла: на рынке появились светодиоды с эффективностью 3.6 мкмоль/Дж, в то время как эффективность лучших на сегодня образцов ДНАТ 2.1 мкмоль/Дж. При этом стоимость светодиодов постоянно снижается. Все это, в конечном итоге, может привести к вытеснению ДНАТ (основных конкурентов светодиодов) с рынка осветителей для защищенного грунта.
С точки зрения экономии электроэнергии, необходимо учитывать также, что тепло, в большом количестве выделяемое лампами ДНАТ, можно использовать для снижения затрат на обогрев теплиц в осенне-зимний период, то есть именно в тот период, когда требуется и отопление, и большее досвечивание [86]. Стоит упомянуть и такие важные, в аспекте энергоэффективности, недостатки светодиодов, как высокие требования к стабильности тока и плохая переносимость работы при повышенных температурах, для преодоления которых требуются специализированные источники питания, оснащенные стабилизаторами тока [88].
С другой стороны, то, что светодиоды нагреваются существенно меньше ДНАТ, делает возможным их использование для освещения нижних ярусов листьев без угрозы перегрева или ожога, размещая LED внутри листового полога. Подобное освещение способно увеличить выход биомассы на 50%, что продемонстрировано на самых разных культурах (салат, томат, огурец, земляника, перец и др.) [44, 89–91]. Более того, появляется возможность предотвратить преждевременное старение нижних листьев, что происходит при освещении от единственного источника [89, 91]. Тем не менее, сведения о возможной экономии электроэнергии при освещении внутри полога противоречивы [86].
Однако показан 50% эффект снижения энергопотребления на производство единицы сухой массы растений при направленном освещении отдельных растений или даже отдельных участков растений светодиодами КС и СС [36, 37]. Используется также важное преимущество светодиодов – возможность контроля фотонного потока путем снижения его по мере необходимости для регулирования физиологических процессов в растениях или обеспечения достаточного уровня ФАР. Так, можно задать алгоритм управления током, при котором светодиоды мигают до нескольких тысяч раз в секунду, либо включаются и выключаются на короткие периоды [92]. Динамическое освещение, в котором светодиоды использовались для досвечивания и автоматически компенсировали недостаточность солнечного фотонного потока, позволило снизить энергопотребление на 20–25% по сравнению с обычным освещением [93], а также эффективно регулировать фотонный поток таким образом, чтобы избежать его снижения ниже заданного уровня [94], и давать растениям необходимое количество света вне зависимости от неблагоприятных условий окружающей среды (высокая облачность, туман и т.д.). Динамику необходимого досвечивания определяют, используя флуориметр или спектрофотометр для измерения флуоресценции хлорофилла и квантовый датчик ФАР для оценки фотонного потока [94, 95]. На основании измерений определяют не только эффективность освещения, но и возможный стресс от избыточного освещения, что также используется в управлении светокультурой [96].
Сегодня активно развивается так называемое сити-фермерство, направленное на выращивание в городах сельскохозяйственных растений на промышленных многоярусных установках защищенного грунта. Исходно на таких фермах использовали ДНАТ с водяным охлаждением [61], затем флуоресцентные лампы [96]. Сегодня наиболее выгодным источником освещения признаны LED, которые из-за низкого уровня теплового излучения не наносят вред растениям при близком расположении, которое неизбежно при компактной и плотной посадке [96]. Разнообразие в способах применения, снижение стоимости и одновременное повышение энергоэффективности и сроков службы обращает все большее внимание на светодиоды, как перспективную составляющую вертикального земледелия, способную решить вопрос минимизации себестоимости производства растительной продукции [97, 98].
ЗАКЛЮЧЕНИЕ
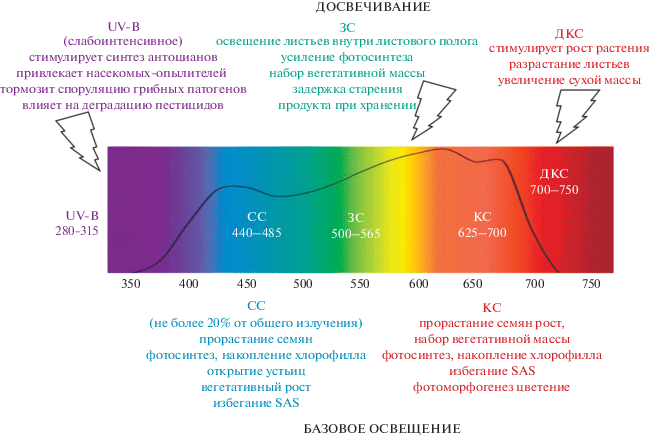
Каждая составляющая широкого спектра видимого излучения по-своему значима и необходима для успешного развития растения (рис. 4). Поэтому мы считаем, что именно белый свет должен использоваться в качестве основного источника искусственного освещения. Под белым светом мы подразумеваем освещение, включающее в себя либо весь спектр ФАР, либо спектр, формируемый диодами красного, синего и зеленого света, поскольку отказ от зеленых диодов или части зеленого спектра нецелесообразен, как заявляют некоторые исследователи или производители осветителей. Такое освещение может быть обеспечено как традиционными источниками света, так и более современными – светодиодами LED (белыми или мультиспектральными). Предпочтение отдается излучателям, экономическая эффективность которых максимальна, что является основой любого коммерческого проекта. Постоянное совершенствование светодиодов, направленное на увеличение эффективности и снижение себестоимости позволяет предположить, что в ближайшей перспективе светодиоды займут уверенное положение на рынке в качестве источников искусственного освещения для производства сельскохозяйственной продукции в защищенном грунте. Такая уверенность подкрепляется тем, что светодиоды имеют множество дополнительных опций применения, наиболее обещающими из которых, на наш взгляд, являются: (1) возможность повышения эффективности фотосинтеза за счет быстрого изменения параметров освещенности; (2) дополнительное освещение растений внутри листового полога; (3) досвечивание и ночные прерывания с использованием узкоспектральных излучений.
Рис. 4.
Схема рекомендуемых светодиодов в светокультуре: базовое освещение является обязательным, а досвечивание используется для получения конкретных желаемых результатов. При использовании в светокультуре ламп ДНАТ рекомендуется досвечивание СС, а UV-B, ЗС и ДКС по мере необходимости для получения конкретных эффектов. В случае выращивания культуры в закрытом грунте при недостатке солнечного излучения рекомендуется добавление базового освещения (КС + СС).
Множество регуляторных молекулярно-генетических путей зависит от особенностей освещения. Однако все они являются высоко консервативными для растений разных видов. Таким образом, исследование особенностей ответа растений разных видов на количество, качество и продолжительность освещения позволит в будущем разработать набор основных алгоритмов светокультуры, оптимизированных для различных групп растений, объединенных по набору определенных признаков, что приведет к повышению урожайности и качества продукции, а также к снижению ее себестоимости.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Mawphlang O.I.L., Kharshiing E.V. Photoreceptor mediated plant growth responses: implications for photoreceptor engineering toward improved performance in crops // Front. Plant Sci. 2017. V. 8. P. 1181. https://doi.org/10.3389/fpls.2017.01181
Jones M.A. Interplay of circadian rhythms and light in the regulation of photosynthesis-derived metabolism // Prog. Bot. 2017. V. 79. P. 147.
Gómez C., Izzo L.G. Increasing efficiency of crop production with LEDs // AIMS Agriculture and Food. 2018. V. 3(2). P. 135.
Trejo-Téllez L.I., Estrada-Ortiz E., Gómez-Merino F.C., Becker C., Krumbein A., Schwarz D. Flavonoid, Nitrate and Glucosinolate Concentrations in Brassica Species Are Differentially Affected by Photosynthetically Active Radiation, Phosphate and Phosphite // Front. Plant Sci. 2019. V. 10. P. 371. https://doi.org/10.3389/fpls.2019.00371
Yamaguchi T., Nukazuka A., Tsukaya H. Leaf adaxial-abaxial polarity specification and lamina outgrowth: evolution and development // Plant Cell Physiol. 2012. V. 53. P. 1180.
Olmos J.D., Kargul J. A quest for the artificial leaf // Int. J. Biochem. Cell Biol. 2015. V. 66. P. 37.
Battle M.W., Jones M.A. Cryptochromes integrate green light signals into the circadian system // Plant Cell Environ. 2019. https://doi.org/10.1111/pce.13643
Xu D.Q., Chen Y., Chen G.Y. Light-harvesting regulation from leaf to molecule with the emphasis on rapid changes in antenna size // Photosynth. Res. 2015. V. 124. P. 137.
EichhornBilodeau S., Wu B.S., Rufyikiri A.S., MacPherson S., Lefsrud M. An update on plant photobiology and implications for cannabis production // Front. Plant Sci. 2019. V. 10: 296. https://doi.org/10.3389/fpls.2019.00296
Kreslavski V.D., Los D.A., Schmitt F.J., Zharmukhamedov S.K., Kuznetsov V.V., Allakhverdiev S.I. The impact of the phytochromes on photosynthetic processes // Biochim. Biophys. Acta Bioenerg. 2018. V. 1859. P. 400.
Войцеховская О.В. Фитохромы и другие (фото)рецепторы информации у растений // Физиология растений. 2019. Т. 66. С. 163.
Carvalho R.F., Campos M.L., Azevedo R.A. The role of phytochromes in stress tolerance // Salt Stress in Plants / Eds. Ahmad P., Azooz M.M., Prasad M.N.V. New York, Heidelberg, Dordrecht, London: Springer, 2013. P. 283.
Rai N., Neugart S., Yan Y., Wang F., Siipola S.M., Lindfors A.V., Winkler J.B., Albert A., Brosche M., Lehto T., Morales L.O., Aphalo P.J. How do cryptochromes and UVR8 interact in natural and simulated sunlight? // J. Exp. Bot. 2019. pii: erz236. https://doi.org/10.1093/jxb/erz236
Milo R. What governs the reaction center excitation wavelength of photosystems I and II? // Photosynth. Res. 2009. V. 101. P. 59. https://doi.org/10.1007/s11120-009-9465-8
Marosvölgyi M.A., van Gorkom H.J. Cost and color of photosynthesis // Photosynth. Res. 2010. V. 103. P. 105.
Cope K.R., Snowden M.C., Bugbee B. Photobiological interactions of blue light and photosynthetic photon flux: effects of monochromatic and broad-spectrum light sources // Photochem. Photobiol. 2014. V. 90. P. 574.
Mozzo M., Dallosto L., Hienerwadel R., Bassi R., Croce, R. Photoprotection in the antenna complexes of photosystem II: role of individual xanthophylls in chlorophyll triplet quenching // J. Biol. Chem. 2008. V. 283. P. 6184.
Erwin J., Gesick, E. Photosynthetic responses of Swiss chard, kale, and spinach cultivars to irradiance and carbon dioxide concentration // HortScience. 2017. V. 52. P. 706.
Соловченко А.Е., Мерзляк М.Н. Экранирование видимого и УФ излучения как механизм фотозащиты у растения // Физиология растений. 2008. Т. 55. С. 803.
Terashima I., Fujita T., Inoue T., Chow W.S., Oguchi R. Green light drives leaf photosynthesis more efficiently than red light in strong white light: revisiting the enigmatic question of why leaves are green // Plant Cell Physiol. 2009. V. 50. P. 684.
Brodersen C.R., Vogelmann T.C. Do changes in light direction affect absorption profiles in leaves? // Funct. Plant Biol. 2010. V. 37. P. 403.
Du Q., Liu T., Jiao X., Song X., Zhang J., Li J. Leaf anatomical adaptations have central roles in photosynthetic acclimation to humidity // J. Exp. Bot. 2019. pii: erz238. https://doi.org/10.1093/jxb/erz238
Both A.J., Benjamin L., Franklin J., Holroyd G., Incoll L.D., Lefsrud M.G., Pitkin G. Guidelines for measuring and reporting environmental parameters for experiments in greenhouses // Plant Methods. 2015. V. 11:43. https://doi.org/10.1186/s13007-015-0083-5
Walker B.J., Busch F.A., Driever S.M., Kromdijk J., Lawson T. Survey of tools for measuring in vivo photosynthesis // Photosynthesis: Methods Mol. Biol. / Eds. Covshoff S. New York: Humana Press, 2018. V. 1770. P. 3.
Massa G.D., Kim H.H., Wheeler R.M., Mitchell C.A. Plant productivity in response to LED lighting // HortScience. 2008. V. 43. P. 1951.
Wang Q., Lin C. Photoreceptor signaling: when COP1 meets VPs // EMBO J. 2019. V. 21: e102962. https://doi.org/10.15252/embj.2019102962
Brown C.S., Schuerger A.C., Sager J.C. Growth and photomorphogenesis of pepper plants under red light-emitting diodes with supplemental blue or far-red lighting // J. Am. Soc. Hortic. Sci. 1995. V. 120. P. 808.
Аверчева О.В., Беркович Ю.А., Ерохин А.Н., Жигалова Т.В., Погосян С.И., Смолянина С.О. Особенности роста и фотосинтеза растений китайской капусты при выращивании под светодиодными светильниками // Физиология растений. 2009. Т. 56. С. 17.
Yorio N.C., Wheeler R.M., Goins G.D., Sanwo-Lewandowski M.M., Mackowiak C.L., Brown C.S., Sager J.C., Stutte G.W. Blue light requirements for crop plants used in bioregenerative life support systems // Life Support & Biosph. Sci. 1998. V. 5. P 119.
Naznin M.T., Lefsrud M., Gravel V., Azad M.O.K. Blue light added with red LEDs enhance growth characteristics, pigments content, and antioxidant capacity in lettuce, spinach, kale, basil, and sweet pepper in a controlled environment // Plants (Basel). 2019. V. 8(4). pii: E93. https://doi.org/10.3390/plants8040093
Kochetova G.V., Belyaeva O.B., Gorshkova D.S., Vlasova T.A., Bassarskaya E.M., Zhigalova T.V., Avercheva O.V. Long-term acclimation of barley photosynthetic apparatus to narrow-band red and blue light // Photosynthetica. 2018. V. 56. P. 851.
Li H., Tang C., Xu Z., Liu X., Han X. Effects of different light sources on the growth of non-heading Chinese cabbage (Brassica campestris L.) // J. Agric. Sci. 2012. V. 4. P. 262.
Lin C., Ahmad M., Cashmore A.R. Arabidopsis cryptochrome 1 is a soluble protein mediating blue light-dependent regulation of plant growth and development // Plant J.1996. V. 10. P. 893.
Assmann S.M., Shimazaki K.I. The multisensory guard cell. Stomatal responses to blue light and abscisic acid // Plant Physiol. 1999. V. 119. P. 809.
Ramalho J.C., Marques N.C., Semedo J.N., Matos M.C., Quartin V.L. Photosynthetic performance and pigment composition of leaves from two tropical species is determined by light quality // Plant Biol. 2002. V. 4. P. 112.
Wang X.Y., Xu X.M., Cui J. The importance of blue light for leaf area expansion, development of photosynthetic apparatus, and chloroplast ultrastructure of Cucumissativusgrown under weak light // Photosynthetica. 2015. V. 53. P. 213.
Snowden M.C., Cope K.R., Bugbee B. Sensitivity of seven diverse species to blue and green light: interactions with photon flux // PLoS One. 2016. V. 11: e0163121. https://doi.org/10.1371/journal.pone.0163121
Ma L., Li G. Auxin-dependent cell elongation during the shade avoidance response // Front. Plant Sci. 2019. V. 10: 914. https://doi.org/10.3389/fpls.2019.00914
Bugbee B. Toward an optimal spectral quality for plant growth and development: the importance of radiation capture //Acta Hort. 2016. V. 1134. P. 1. https://doi.org/10.17660/ActaHortic.2016.1134.1
Kaiser E., Ouzounis T., Giday H., Schipper R., Heuvelink E., Marcelis L.F.M. Adding blue to red supplemental light increases biomass and yield of greenhouse-grown tomatoes, but only to an optimum // Front. Plant Sci. 2019. V. 9: 2002. https://doi.org/10.3389/fpls.2018.02002
Ma G., Zhang L., Setiawan C.K., Yamawaki K., Asai T., Nishikawa F., Maezawa S., Sato H., Kanemitsu N., Kato M. Effect of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli // Postharvest Biol. Technol. 2014. V. 94. P. 97.
Frantz J.M., Joly R.J., Mitchell C.A. Intracanopy lighting influences radiation capture, productivity, and leaf senescence in cowpea canopies // J. Am. Soc. Hortic. Sci. 2000. V. 125. P. 694.
Lu N., Maruo T., Johkan M., Hohjo M., Tsukagoshi S., Ito Y., Ichimura T., Shinohara Y. Effects of supplemental lighting with light-emitting diodes (LEDs) on tomato yield and quality of single-truss tomato plants grown at high planting density // Environ. Control Biol. 2012. V. 50. P. 63.
Loi M., Liuzzi V.C., Fanelli F., De Leonardis S., Maria Creanza T., Ancona N., Paciolla C., Mule G. Effect of different light-emitting diode (LED) irradiation on the shelf life and phytonutrient content of broccoli (Brassica oleracea L. var. italica) // Food Chem. 2019. V. 283. P. 206.
Kokalj D., Hribar J., Cigić B., Zlatić E., Demšar L., Sinkovič L., Šircelj H., Bizjak G., Vidrih R. Influence of yellow light-emitting diodes at 590 nm on storage of apple, tomato and bell pepper fruit // Food Technol. Biotechnol. 2016. V. 54. P. 228.
Park Y., Runkle E.S. Far-red radiation promotes growth of seedlings by increasing leaf expansion and whole-plant net assimilation // Environ. Exp. Bot. 2017. V. 136. P. 41.
Zhen S., van Iersel M.W. Far-red ligh is needed for efficient photochemistry and photosynthesis // J. Plant Physiol. 2017. V. 209. P. 115.
Takeda J., Nakata R., Ueno H., Murakami A., Iseki M., Watanabe M. Possible involvement of a tetrahydrobiopterin in photoreception for UV-B-induced anthocyanin synthesis in carrot // Photochem. Photobiol. 2014. V. 90. P. 1043.
Ekhtari S., Razeghi J., Hasanpur K., Kianianmomeni A. Different regulations of cell-type transcription by UV-B in multicellular green alga Volvox carteri // Plant Signal Behav. 2019. V. 14: 1657339. https://doi.org/10.1080/15592324.2019.1657339
Tilbrook K., Dubois M., Crocco C.D., Yin R., Chappuis R., Allorent G., Schmid-Siegert E., Goldschmidt-Clermont M., Ulm R. UV-B Perception and acclimation in Chlamydomonas reinhardtii // Plant Cell. 2016. V. 28. P. 966.
Winter A.N., Bickford P.C. Anthocyanins and Their Metabolites as Therapeutic Agents for Neurodegenerative Disease // Antioxidants (Basel). 2019. V. 8. pii: E333. https://doi.org/10.3390/antiox8090333
Tripathi R., Rai K., Singh S., Agrawal M., Agrawal S.B. Role of supplemental UV-B in changing the level of ozone toxicity in two cultivars of sunflower: growth, seed yield and oil quality // Ecotoxicology. 2019. V. 28. P. 277.
Chia P.L., Kubota C. End-of-day far-red light quality and dose requirements for tomato rootstock hypocotyl elongation // HortScience. 2010. V. 45. P. 1501.
Yang Z.C., Kubota C., Chia P.L., Kacira M. Effect of end-of-day far-red light from a movable LED fixture on squash rootstock hypocotyl elongation // Sci. Hort. 2012. V. 136. P. 81.
Chinchilla S., Izzo L.G., van Santen E., Gomez C. Growth and physiological responses of lettuce grown under pre-dawn or end-of-day sole-source light-quality treatments // Horticulturae. 2018. V. 4: 8. https://doi.org/10.3390/horticulturae4020008
Goto E. Effects of light quality on growth of crop plants under artificial lighting // Environ. Control Biol. 2003. V. 41. P. 121.
Tallman G., Zeiger E. Light quality and osmoregulation in Vicia guard cells: evidence for involvement of three metabolic pathways // Plant Physiol. 1988. V. 88. P. 887.
Gómez C., Mitchell C.A. Growth responses of tomato seedlings to different spectra of supplemental lighting // HortScience. 2015. V. 50. P. 112.
Chen L., Lin C.C., Yeh C.W., Liu R.S. Light converting inorganic phosphors for white light-emitting diodes // Materials (Basel). 2010. V. 3. P. 2172.
Cho L.H., Yoon J., An G. The control of flowering time by environmental factors // Plant J. 2017. V. 90. P. 708.
Hayama R., Sarid-Krebs L., Richter R., Fernández V., Jang S., Coupland G. PSEUDO RESPONSE REGULATORs stabilize CONSTANS protein to promote flowering in response to day length // EMBO J. 2017. V. 36. P. 904.
Jones M.A. Using light to improve commercial value // Hort. Research. 2018. V. 5: 47. https://doi.org/10.1038/s41438-018-0049-7
Higuchi Y., Sumitomo K., Oda A., Shimizu H., Hisamatsu T. Day light quality affects the night-break response in the short-day plant chrysanthemum, suggesting differential phytochrome-mediated regulation of flowering // J. Plant. Physiol. 2012. V. 169. P. 1789.
Cao K., Cui L., Ye L., Zhou X., Bao E., Zhao H., Zou Z. Effects of red light night break treatment on growth and flowering of tomato plants // Front. Plant Sci. 2016. V. 7: 527. https://doi.org/10.3389/fpls.2016.00527
Зубкова Е.Н., Белова Т.А. Физиология фотопериодической чувствительности у растительных организмов при различной продолжительности светового периода // Вестник РУДН. Серия: Экология и безопасность жизнедеятельности. 2017. Т. 25. № 1. С. 50.
Meng Q.W., Runkle E.S. Controlling flowering of photoperiodic ornamental crops with light-emitting diode lamps: a coordinated grower trial // HortTechnology. 2014. V. 24. P. 702.
Craig D.S., Runkle E.S. A moderate to high red to far-red light ratio from light-emitting diodes controls flowering of short-day plants // J. Am. Soc. Hortic. Sci. 2013. V. 138. P. 167.
Craig D.S., Runkle E.S. An intermediate phytochrome photoequilibria from night interruption lighting optimally promotes flowering of several long-day plants // Environ. Exp. Bot. 2016. V. 121. P. 132.
Meng Q.W., Runkle E.S. Control of flowering using night-interruption and day-extension LED lighting // LED Lighting for Urban Agriculture / Eds. Kozai T., Fujiwara K., Runkle E.S. Singapore: Springer. 2016. P. 191.
Hamamoto H., Shimaji H., Higashide T. Budding and bolting responses of horticultural plants to night-break treatments with LEDs of various colors // J. Agric. Meteorol. 2003. V. 59. P. 103.
Hamamoto H., Yamazaki K. Reproductive response of okra and native rosella to long-day treatment with red, blue, and green light-emitting diode lights // HortScience. 2009. V. 5. P. 1494.
Kohyama F., Whitman C., Runkle E.S. Comparing flowering responses of long-day plants under incandescent and two commercial light-emitting diode lamps // HortTechnology. 2014. V. 24. P. 490.
Morrow R.C., Tibbitts T.W. Evidence for involvement of phytochrome in tumor-development on plants // Plant Physiol. 1988. V. 88. P. 1110.
Craver J.C., Miller C.T., Williams K.A., Bello N.M. Ultraviolet radiation affects intumescence development in ornamental sweetpotato (Ipomoea batatas) // HortScience. 2014. V. 49. P. 1277.
Kubota C., Eguchi T., Kroggel M. UV-B radiation dose requirement for suppressing intumescence injury on tomato plants // Sci. Hort. 2017. V. 226. P. 366.
Wollaeger H.M., Runkle E.S. Growth and acclimation of impatiens, salvia, petunia, and tomato seedlings to blue and red light // HortScience. 2015. V. 50. P. 522.
Eguchi T., Hernández R., Kubota C. Far-red and blue light synergistically mitigate intumescence injury of tomato plants grown under UV-deficit light environment // HortScience. 2016. V. 51. P. 712.
Trouwborst G., Hogewoning S.W., van Kooten O., Harbinson J., van Ieperen W. Plasticity of photosynthesis after the ‘red light syndrome’ in cucumber // Environ. Exp. Bot. 2016. V. 121. P. 75.
Ohashi-Kaneko K., Takase M., Kon N., Fujiwara K., Kurata K. Effect of light quality on growth and vegetable quality in leaf lettuce, spinach and komatsuna // Environmental Control in Biology. 2007. V. 45. P. 189.
Son K.H., Oh M.M. Leaf shape, growth, and antioxidant phenolic compounds of two lettuce cultivars grown under various combinations of blue and red light-emitting diodes // HortScience. 2013. V. 48. P. 988.
Vanninen I., Pinto D.M., Nissinen A.I., Johansen N.S., Shipp L. In the light of new greenhouse technologies: 1. Plant-mediated effects of artificial lighting on arthropods and tritrophic interactions // Ann. Appl. Biol. 2010. V. 157. P. 393.
Johansen N.S., Vanninen I., Pinto D.M., Nissinen A.I., Shipp L. In the light of new greenhouse technologies: 2. Direct effects of artificial lighting on arthropods and integrated pest management in greenhouse crops // Ann. Appl. Biol. 2011. V. 159. P. 1. https://doi.org/10.1111/j.1744-7348.2011.00483
Carvalho S.D., Folta K.M. Environmentally modified organisms – Expanding genetic potential with light // Crit. Rev. Plant Sci. 2011. V. 33. P. 486.
Hasan M.M., Bashir T., Ghosh R., Lee S.K., Bae H. An overview of LEDs’ effects on the production of bioactive compounds and crop quality // Molecules. 2017. V. 22. pii: E1420. https://doi.org/10.3390/molecules22091420
Tokuno A., Ibaraki Y., Ito S., Araki H., Yoshimura K., Osaki K. Disease suppression in greenhouse tomato by supplementary lighting with 405 nm LED // Environmental Control in Biology. 2012. V. 50. P. 19.
Gómez C., Izzo L.G. Increasing efficiency of crop production with LEDs // AIMS Agriculture and Food. 2018. V. 3(2). P. 135.
Leach H., Wise J.C., Isaacs R. Reduced ultraviolet light transmission increases insecticide longevity in protected culture raspberry production // Chemosphere. 2017. V. 189. P. 454.
Lara A., Girand M. NUD4001 and NUD4011 low cost integrated current sources for LEDS lighting applications of low and high voltage (6.0 V–120 V) // Semiconductor Components Industries. LLC. 2004. http:// o-nsemi.com. Publication Order Number: AND8156/D
Gómez C., Mitchell C.A. Supplemental lighting for greenhouse-grown tomatoes: intracanopy LED towers vs. overhead HPS lamps // Acta Hort. 2014. V. 1037. P. 855.
Choi H.G., Moon B.Y., Kang N.J. Effects of LED light on the production of strawberry during cultivation in a plastic greenhouse and in a growth chamber // Sci. Hortic. 2015. V. 189. P. 22.
Gómez C., Mitchell C.A. Physiological and productivity responses of high-wire tomato as affected by supplemental light source and distribution within the canopy // J. Am. Soc. Hortic. Sci. 2016. V. 141. P. 196.
Schwend T., Beck M., Prucker D., Peisl S., Memper H. Test of a PAR sensor-based, dynamic regulation of LED lighting in greenhouse cultivation of Helianthus annuus // Eur. J. Hortic. Sci. 2016. V. 81. P. 152.
van Iersel M.W., Gianino D. An adaptive control approach for light-emitting diode lights can reduce the energy costs of supplemental lighting in greenhouses // HortScience. 2017. V. 52. P. 72.
Carstensen A.M., Pocock T., Bankestad D., Wik T. Remote detection of light tolerance in basil through frequency and transient analysis of light induced fluorescence // Comput. Electron. Agric. 2016. V. 127. P. 289.
Al-Kodmany K. The vertical farm: a review of developments and implications for the vertical city // Buildings. 2018. V. 8: 24. https://doi.org/10.3390/buildings8020024
Kozai T. Resource use efficiency of closed plant production system with artificial light: concept, estimation and application to plant factory // Proc. Jpn. Acad. Ser. B. 2013. V. 89. P. 447.
Janda M., Navrátil O., Haisel D., Jindřichová B., Fousek J., Burketová L., Čeřovská N., Moravec T. Growth and stress response in Arabidopsis thaliana, Nicotianabenthamiana, Glycine max, Solanum tuberosum and Brassica napus cultivated under polychromatic LEDs // Plant Methods. 2015. V. 11: 31. https://doi.org/10.1186/s13007-015-0076-4
Rehman M., Ullah S., Bao Y., Wang B., Peng D., Liu L. Light-emitting diodes: whether an efficient source of light for indoor plants? // Environ. Sci. Pollut. Res. Int. 2017. V. 24. P. 24743.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений