Физиология растений, 2020, T. 67, № 4, стр. 417-427
Функциональное состояние ФС II в листьях ярового овса при снижении температуры в осенний период
В. Е. Софронова a, *, В. А. Чепалов a, О. В. Дымова b, Т. К. Головко b
a Институт биологических проблем криолитозоны Якутского научного центра
Сибирского отделения Российской академии наук
Якутск, Россия
b Институт биологии Коми научного центра Уральского отделения Российской академии наук
Сыктывкар, Россия
* E-mail: vse07_53@mail.ru
Поступила в редакцию 17.06.2019
После доработки 18.10.2019
Принята к публикации 07.11.2019
Аннотация
Исследовали динамику изменения показателей флуоресценции хлорофилла а, JIP-теста и фонда фотосинтетических пигментов в листьях ярового овса позднего срока сева в период осеннего похолодания. По мере снижения среднесуточных температур от 8 до 2°С содержание хлорофиллов уменьшалось на 40%, соотношение хлорофиллов a/b варьировало в пределах 2.2‒2.4. Суммарное содержание каротиноидов, доля β-каротина, лютеина, неоксантина и пигментов виолаксантинового цикла изменялось незначительно. Выявлено увеличение доли QB-невосстанавливающих центров в РЦ ФС II и повышение квантового выхода энергизационного qE компонента нефотохимического тушения (параметра φNPQ) в антенне ФС II. Величина показателя Fv/Fm, характеризующего фотохимическую активность комплексов ФС II, составила 0.72–0.76. При температурах около 0°C его значения снижались до 0.62. Одновременно наблюдали увеличение нерегулируемой светом тепловой диссипации (фотоингибиторного qI компонента нефотохимического тушения), что выражалось в росте значений параметров φDo, DI0/RC. Сделан вывод, что в этих условиях часть РЦ ФС II теряет фотохимическую активность с преобразованием их в диссипативные центры энергии возбуждения. Существенная часть инактивированных РЦ теряет способность к восстановлению QA обратимо, что предполагает образование фотоинактивированных форм комплексов ФС II, стабилизированных низкими температурами. Снижение среднесуточной температуры до −3°С с ночными минимальными температурами −7…−8°С в течение 3 сут приводило к гибели растений.
ВВЕДЕНИЕ
Фотосинтез является чувствительным к действию низкотемпературного стресса процессом. В процессе холодовой адаптации фотосинтетический аппарат (ФСА) злаковых растений претерпевает структурно-функциональные изменения [1‒4]. Изучение последовательности этих изменений при 4°С показало, что в первые часы содержание хлорофилла, способность к ассимиляции углерода и рост листьев озимых и яровых злаков снижаются, а нефотохимическое тушение поглощенной энергии увеличивается. Спустя 48–72 ч y озимых [3] и 4 недели у яровых [1, 5] злаков фотосинтез и скорость электронного транспорта стабилизируются на достаточно высоком уровне, фотохимическая эффективность ФС II, содержание хлорофилла восстанавливаются, рост листовой пластинки растений возобновляется [1‒3]. Изменения структуры ФСА озимых злаков проявляются в формировании хлоропластов с тилакоидной системой “светового типа” [4].
Адаптивные процессы в ФСА яровых злаковых растений при холодовом закаливании исследованы недостаточно. В естественных условиях низкие положительные температуры (ниже 4°C) резко ограничивают их адаптивные возможности, а температуры −5…−10°С в течение 8–24 ч приводят к гибели растений [5, 6, с. 7‒27]. В процессе эволюции яровые злаки не сформировали генетически детерминированный механизм устойчивости к отрицательным температурам путем внеклеточного льдообразования.
Овес посевной с яровым типом развития является второй после ячменя ведущей зернофуражной культурой, возделываемой в условиях многолетней мерзлоты [7]. Использование естественного холодного климата Якутии без возвратных потеплений в осенний период, консервирующего зеленую массу растений овса, является перспективным направлением в производстве сочных кормов [8, с. 206‒210]. В природных условиях Центральной и Северо-Восточной Якутии значительная часть дикорастущих кормовых растений в злаково-осоковых фитоценозах часто не успевают пройти весь цикл роста и развития и уходят под снег в зеленом состоянии, образуя ценный корм для многих животных. Для центральных районов Якутии, по сравнению с расположенными на той же широте регионами с более мягким климатом, характерно быстрое по темпам снижение температуры на фоне медленного уменьшения фотопериода. Яровой овес позднего посева является удобной моделью для исследования теоретических основ получения криокорма и выявления адаптивных ответов первичных процессов фотосинтеза на осеннее снижение температуры.
Цель работы ‒ исследование механизмов функциональной инактивации ФС II в листьях осенне-вегетирующих растений ярового овса в процессе холодовой адаптации на основе изучения динамики показателей флуоресценции хлорофилла а и содержания фотосинтетических пигментов.
МАТЕРИАЛЫ И МЕТОДЫ
Объект и схема проведения опытов. Овес посевной (Avena sativa L.), сорт Покровский местной селекции, выращивали на опытном участке без полива, расположенном на средней пойме р. Лена (окрестности Якутска, 62°15′ с.ш., 129°37′ в.д.). Почвы участка пойменные луговочерноземные, сформированные на легком суглинке. Эксперименты проводили в 2013 и 2017 гг.
Овес высевали в два срока (табл. 1). Схему опытов планировали таким образом, чтобы у растений позднего посева не происходило огрубления побегов до периода достижения среднесуточных низких положительных температур от 5 до 0°С (конец сентября‒начало октября). Молодые растения позднего посева проходили период закаливающих среднесуточных температур воздуха от 10 до 0°С в течение не менее 4 недель.
Таблица 1.
Сроки прохождения фенологических фаз развития А. sativa первого и второго посевов и метеорологические показатели в период проведения исследований (Центральная Якутия, 2017 г.)
| Срок взятия проб | Фазы развития | Среднесуточная температура воздуха, °C* | Cумма осадков, мм** | Фотопериод, ч |
|---|---|---|---|---|
| I срок посева (17 июня), летний период | ||||
| 17.07 | Начало выхода в трубку | 20.8 ± 3.4 | 1.0 | 18.4 |
| 01.08 | Выметывание | 19.4 ± 5.6 | 8.8 | 17.2 |
| 11.08 | Молочная спелость | 17.4 ± 1.8 | 12.6 | 16.2 |
| 21.08 | Восковая спелость | 15.4 ± 3.7 | 12.4 | 15.3 |
| 04.09 | Созревание | 11.6 ± 5.2 | 12.3 | 14.0 |
| II срок посева (20 июля), осенний период | ||||
| 11.08 | Кущение | 17.4 ± 1.8 | 12.6 | 16.2 |
| 21.08 | Начало выхода в трубку | 15.4 ± 3.7 | 12.4 | 15.3 |
| 04.09 | Трубкование | 11.6 ± 5.2 | 12.3 | 14.0 |
| 13.09 | Трубкование | 10.0 ± 5.6 | 35.5 | 13.1 |
| 18.09 | Выметывание | 5.1 ± 2.7 | 12.2 | 12.4 |
| 26.09 | Молочная спелость | 5.0 ± 3.1 | 10.7 | 11.6 |
| 02.09 | Молочная спелость | 0.2 ± 1.0 | 11.0 | 11.2 |
Температуру воздуха на участке регистрировали с помощью термографа DS 1922L iBitton (“Dallas Semiconductor”, США) с интервалом 1 ч. Освещенность регистрировали с помощью сенсора LI–190 (“LI-COR”, США) через каждые 30 мин. Поступление солнечной радиации за день определяли как среднее получасовых измерений от восхода до захода солнца и выражали как величину плотности потока фотонов (ППФ) в мкмоль/(м2 с). Средняя температура воздуха, сумма осадков за вегетационный период (июнь–сентябрь) 2013 и 2017 гг. составили 13.6 и 15.9°С, 194 и 139 мм, соответственно. Погодные условия в период проведения эксперимента были типичными для Центральной Якутии.
Измерение флуоресценции хлорофилла а. Сезонную динамику кинетических кривых световой индукции флуоресценции хлорофилла (ФХ) (OJIP-кривых) отслеживали в полевых условиях с помощью PAR FluorPen FP 100-MAX-LM (“Photon Systems Instruments”, Чехия). OJIP-кривые индуцировали синим светом (λ = 455 нм) с плотностью потока фотосинтетически активных фотонов (ППФ) 3000 мкмоль фотонов/(м2 с) в течение 3 с. Измерения проводили при температуре окружающей среды после 30 мин темновой адаптации. Каждая кривая получена путем усреднения как минимум 5 измерений. Полученные кривые анализировали с использованием параметров JIP-теста (табл. 2) [9–11].
Таблица 2.
Параметры флуоресценции хлорофилла [9‒11]
| Параметр | Определение |
|---|---|
| F0 или (O) | Минимальный уровень, зарегистрированный при 50 мкс, когда РЦ ФС II открыты |
| Fm или (P) | Максимальный уровень, когда все РЦ ФС II закрыты |
| $F_{{\text{m}}}^{'}$ | Максимальный уровень в адаптированных к свету образцах, когда все РЦ ФС II закрыты, акцепторы ФС II частично редуцированы |
| Fs | Стационарный уровень на свету |
| Ft | Уровень в момент времени t |
| FJ | Интенсивность при 2 мс |
| FI | Интенсивность при 30 мс |
| Fv | Fv = Fm – F0 (вариабельная флуоресценция в адаптированных к темноте растениях) |
| VJ | VJ = (FJ − F0)/(Fm – F0), относительная амплитуда O‒J фазы |
| φPo | φPo = (Fm – F0)/Fm, максимальный фотохимический квантовый выход ФС II |
| φPSII | φPSII = ($F_{{\text{m}}}^{'}$ − Fs)/$F_{{\text{m}}}^{'}$, параметр Genty, эффективный квантовый выход фотохимической реакции в ФС II на свету |
| φNPQ | φNPQ = Fs/$F_{{\text{m}}}^{'}$ – Fs/Fm, квантовый выход регулируемого светом нефотохимического тушения (ΔpH- и зеаксантин-зависимого) |
| ψ0 | ψ0 = 1 − VJ, вероятность транспорта электронов за пределы ${\text{Q}}_{{\text{A}}}^{ - }$ (при t = 0), т.е. эффективность, с которой экситон, захваченный РЦ, восстанавливает акцепторы после QA |
| φEo | φEo = (1 − F0/Fm)ψ0, квантовый выход электронного транспорта от ${\text{Q}}_{{\text{A}}}^{ - }$ далее в цепь транспорта электронов (при t = 0); |
| ET0/RC | ET0/RC = M0(1/VJ)ψ0, максимальный поток электронов, перенесенных от QA к QB в расчете на один активный РЦ ФС II |
| φDo | φDo = 1 – φPo = (F0/Fm), квантовый выход конститутивных потерь (тепловой диссипации при t = 0) |
| М0 | М0 = 4(F300μs – F50μs)/(Fm – F0), начальный наклон переменной флуоресценции |
| ABS/RC | ABS/RC = М0(1/VJ)(1/φPo), поток энергии, поглощаемой одним активным РЦ ФС II, пропорциональный видимому размеру антенны активных РЦ ФС II, способных восстанавливать QA |
| TR0/RC | TR0/RC = M0(1/VJ), поток энергии возбуждения, улавливаемой одним активным РЦ после темновой адаптации при t = 0 |
| DI0/RC | DI0/RC = (ABS/RC) – (TR0/RC), количество энергии, рассеиваемой одним РЦ в виде тепла, флуоресценции или переноса к другой фотосистеме, при t = 0 |
| PIABS | PIABS = RC/ABS × φPo(1 − φPo) × ψ0(1 − ψ0), индекс производительности, показатель функциональной активности ФС II, отнесенный к поглощаемой энергии |
Максимальный фотохимический квантовый выход ФС II, φPo = (Fm – F0)/Fm, определяли с помощью флуориметра РАМ-2500 (“Walz”, Германия). Минимальную флуоресценцию (F0) возбуждали в адаптированных к темноте в течение 30 мин образцах с помощью зондирующих импульсов света (ППФ 0.1 мкмоль фотонов/(м2 с), λ = 630 нм, длительность импульса 1 мкс, частота модуляции 200 Гц). Максимальный выход флуоресценции (Fm) индуцировали в адаптированных к темноте образцах зондирующими импульсами света, наложенными на мощную насыщающую вспышку света с частотой 100 кГц. Насыщающая вспышка характеризовалась ППФ 6000 мкмоль фотонов/(м2 с) с максимумом эмиссии при 630 нм и длительностью 400 мс. Эти параметры ФХ (φPo,Fm,F0) также независимо определяли при регистрации OJIP-кривых.
Для определения квантовых выходов фотохимического тушения на свету φPSII = ($F_{{\text{m}}}^{'}$ – Fs)/$F_{{\text{m}}}^{'}$ (параметр Genty) и регулируемого светом энергизационного qE компонента нефотохимического тушения φNPQ = Fs/$F_{{\text{m}}}^{'}$ – Fs/Fm [12] в первой половине солнечного дня (11.00–13.00) неотделенный лист овса адаптировали к темноте в течение 30 мин и предварительно определяли Fm и F0. Затем образцы последовательно освещали в течение 10 мин актиничным светом при ППФ 5, 28, 65, 112, 190, 250 и 305, 460 мкмоль фотонов/(м2 с). В конце каждого 10-минутного цикла, достаточного для перехода фотосинтеза в стационарную фазу, измеряли параметры Fs (технически измерение аналогично F0) и $F_{{\text{m}}}^{'}$ (технически измерение аналогично F0). Скорость фотосинтетического электронного транспорта рассчитывали по формуле:
Анализ пигментов. Фотосинтетические пигменты из свежего растительного материала экстрагировали 100% ацетоном при 8–10°C на слабом свету. Гомогенат центрифугировали 20 мин при 8000 g при температуре 4°C. Содержание хлорофиллов (a + b) и суммы каротиноидов в супернатанте определяли спектрофотометрически с использованием спектрофотометра Agilent 8453E (“Agilent Technologies Deutschland GmbH”, Германия) путем регистрации оптической плотности при длинах волн 662, 644 и 470 нм [13]. Сухую массу растительного материала определяли высушиванием параллельных проб (50 мг, 3‒4 повторности) до постоянного веса в сушильном шкафу при 100°С и основной погрешности стабилизации температуры ±2°С.
Для анализа состава каротиноидов фиксированные в жидком азоте пробы листьев высушивали на лиофилизаторе (“VirТis”, США). Лиофилизаты хранили при −80°С и использовали для анализа пигментов методом ВЭЖХ. Разделение индивидуальных каротиноидов проводили с помощью ВЭЖХ с обращенной фазой (“Knauer”, Германия) в соответствии с модифицированным методом [14] после экстрагирования лиофилизатов элюентом А (ацетонитрил : метанол : вода в объемном соотношении 75 : 12 : 4). Для построения градуировочных кривых использовали стандарты чистых веществ (пигментов) (“Sigma” и “Fluka”, США).
Полученные данные обрабатывали методом ANOVA, описательной статистики с уровнем значимости 0.05. Статистическую значимость различий между независимыми выборками оценивали с помощью критерия Фишера и теста Дункана. В таблицах и на рисунках представлены средние арифметические величины и их стандартные отклонения. Определение биохимических показателей проводили в 3–4 биологических и двух аналитических повторностях.
РЕЗУЛЬТАТЫ
У растений летнего срока посева содержание каротиноидов тесно коррелировало с содержанием хлорофиллов (рис. 1а). Количество зеленых и желтых пигментов возрастало от фазы трубкования (середина июля) к выметыванию метелки (начало августа) на 39 и 55%, соответственно (табл. 1, рис. 1а). До фазы восковой спелости содержание пигментов практически не изменялось. Во время созревания семян в конце августа‒начале сентября отмечали уменьшение хлорофиллов и каротиноидов. У осенне-вегетирующих растений ярового овса позднего срока сева снижение среднесуточной температуры от 8 до 1°С и укорочение фотопериода приводили к постепенному уменьшению содержания хлорофиллов (a + b) на 40% относительно начала третьей декады августа (табл. 1, рис. 1б). Соотношение хлорофиллов a/b у растений обоих сроков посева варьировало в пределах 2.2–2.4 вплоть до снижения среднесуточной температуры до 1–3°С. В дни выпадения осадков с преобладанием облачных дней данное соотношение былo 2.2, в сухие солнечные дни повышалось до 2.4. Осеннее снижение температуры и прохождение этапов онтогенеза не оказывали влияния на этот показатель.
Рис. 1.
Динамика содержания суммы хлорофиллов (1) и каротиноидов (2) в листьях Avena sativa первого (а) и второго (б) сроков посева в 2017 г. Разные латинские буквенные символы обозначают достоверность изменений параметра (значимость различий показателей по группам) (тест Дункана, α = 0.05).
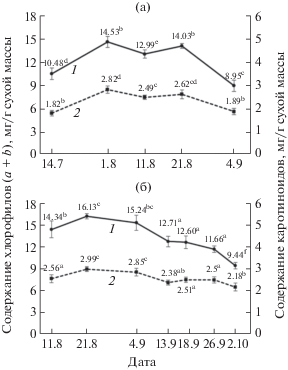
В аналогичных фазах роста и развития осенне-вегетирующие растения при низких положительных температурах 2.4–5.1°С не отличались от летне-вегетирующих по содержанию каротиноидов (рис. 1б). Заметное их снижение (на 13%) у растений позднего посева отмечено при околонулевых температурах. Долевое содержание индивидуальных каротиноидов практически не зависело от осеннего снижения температур и освещенности (табл. 3). Схожую картину наблюдали у озимых ржи и пшеницы, культивируемых при 5°С и умеренной освещенности [2].
Таблица 3.
Относительное содержание каротиноидов (% от суммы каротиноидов) в листьях Avena sativa позднего посева при осеннем снижении температуры и ФАР
| Среднесуточная температура, °С* | Средняя ФАР за световой день, мкмоль/(м2 с) |
Долевое содержание, % | |||||
|---|---|---|---|---|---|---|---|
| β-каротин | лютеин | зеаксантин | антераксантин | виолаксантин | неоксантин | ||
| 12.0 ± 2.7 | 591 | 26.9 ± 0.9a | 34.9 ± 1.4a | 3.6 ± 0.3a | 3.0 ± 0.1a | 22.6 ± 1.1a | 9.0 ± 0.4a |
| 6.8 ± 3.8 | 380 | 26.3 ± 1.1a | 34.4 ± 2.7a | 4.8 ± 0.7b | 3.7 ± 0.3a | 20.6 ± 1.4a | 10.2 ± 0.8a |
| 1.6 ± 2.5 | 342 | 29.9 ± 1.4b | 35.2 ± 2.1a | 5.0 ± 0.2b | 4.5 ± 0.2b | 16.6 ± 1.8b | 8.8 ± 0.8b |
Для отслеживания изменений в ФС II ярового овса в течение осеннего снижения температуры проводили измерения OJIP-кривых (рис. 2). На кривой, измеренной в конце августа (рис. 2а, кривая 1), отчетливо видны три основные фазы роста выхода ФХ, характеризующие последовательное светоиндуцированное восстановление акцепторной стороны ФС II (фаза OJ), пула пластохинонов (JI), и всей фотосинтетической ЭТЦ цепи, включая ФС I (IP) [9, 11]. По мере сезонного снижения среднесуточной температуры наблюдали снижение относительной амплитуды OP в кривой роста ФХ (рис. 2а), соответствующей параметру φPo (Fv/Fm). При 5°С падение амплитуды ОР (нормированной на значения F0), отражающей фотохимическую активность ФС II, составило 10% (рис. 2б), при околонулевых температурах ‒ 50%. Начальный выход ФХ (О), соответствующий величине F0, достоверно возрастал при околонулевых и отрицательных температурах (рис. 2а, кривые 3, 4), несмотря на уменьшение содержания хлорофилла в листьях (рис. 1б). Обнаруженные нами закономерности изменения величин F0, Fm, φPo подтверждаются независимыми измерениями, проведенными с помощью PAM-флуориметрии (табл. 4).
Рис. 2.
Индукционные кривые флуоресценции хлорофилла (OJIP), измеренные на листьях Avena sativa: (а) – оригинальные кривые, (б) – кривые, нормированные на F0; (в) – кривые, нормированные на амплитуду фазы OJ (2 мс); (г) – кривые, нормированные на амплитуду OP. Кривые 1, 2, 3, 4 соответствуют измерениям, проведенным при среднесуточных температурах произрастания растений 15.4 ± 3.7, 5.1 ± 2.7, 0.2 ± 0.4 и −2.5 ± 3.8°С (замерзшие растения) соответственно. Каждая кривая получена путем усреднения как минимум 5 измерений.
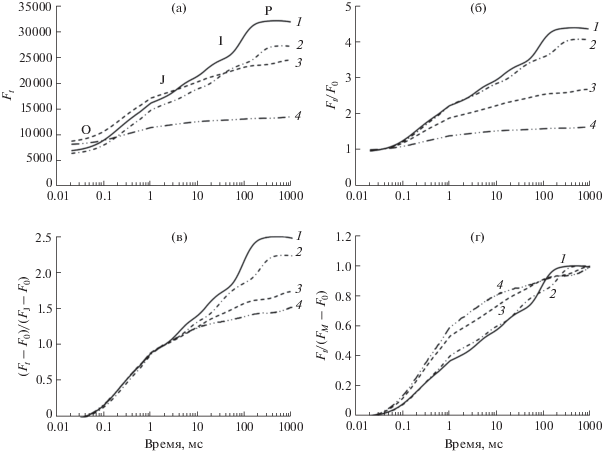
Таблица 4.
Влияние сезонного снижения температуры на показатели флуоресценции хлорофилла в листьях Avena sativa
| Средняя дневная температура, °С | ETR, мкмоль электронов/(м2 с) | φPo* | φNPQ** | F0, отн. %* | Fm, отн. %* |
|---|---|---|---|---|---|
| 17.1 ± 2.9 | 104 ± 3 | 0.786 ± 0.005a | 0.338 ± 0.029a | 100.0 ± 3.2a | 100.0 ± 5.0a |
| 7.9 ± 3.9 | 65 ± 2 | 0.757 ± 0.034b | 0.420 ± 0.032b | 100.9 ± 2.7a | 92.4 ± 8.3b |
| 3.5 ± 3.6 | 21 ± 1 | 0.740 ± 0.038b | 0.676 ± 0.034c | 101.8 ± 4.8a | 88.4 ± 13.5c |
| 0.2 ± 0.5 | 14 ± 2 | 0.621 ± 0.043c | 0.550 ± 0.034d | 120.1 ± 6.1b | 67.8 ± 4.1d |
Примечание. Разные надстрочные буквенные символы обозначают достоверность изменений параметра (тест Дункана, P < 0.05). Все измерения проводили в полевых условиях на неотделенных листьях овса в фазе выметывания с разными сроками посева: * ‒ за час до восхода солнца, ** ‒ значения при ППФ 460 мкмоль/(м2 с). Значения F0, Fm при 17.1°С приняты равными 100%.
Относительный вклад фазы JP в амплитуду OP характеризует вероятность переноса электрона с ${\text{Q}}_{{\text{A}}}^{ - }$ на акцепторы после QA. Для оценки относительной величины JP, кривые OJIP нормировали на амплитуду OJ (рис. 2в). Амплитуда JP была максимальной при 15–16°С, затем сначала медленно снижалась в диапазоне 5–14°С, затем быстро снизилась при температурах ниже 2–3°С.
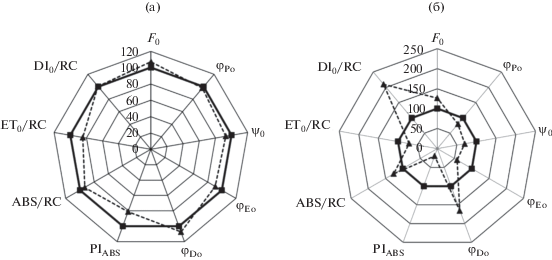
В таблице 5 и на рис. 3 приведены данные о сезонных изменениях параметров ФХ из OJIP кривых. При среднесуточных температурах около 5°С в конце второй декады сентября выявлено начало снижения параметров PIABS, φEo, ET0/RC, ψ0, φDo. Выраженное изменение значений этих параметров, а также ABS/RC, DI0/RC, F0 относительно 15°С наблюдали в период, когда происходил переход ночных и дневных температур через ноль (рис. 3б).
Таблица 5.
Влияние сезонного снижения температуры и ФАР на параметры JIP-теста в листьях Avena sativa
| Среднесуточная температура, °С |
Ночная температура, °С | Средняя ППФ, мкмоль/(м2 с) за световой день |
φPo | ψ0 | ABS/RC | φDo | DI0/RC |
|---|---|---|---|---|---|---|---|
| 15.4 ± 3.7 | 11.2 ± 1.3 | 630 | 0.771 ± 0.008a | 0.598 ± 0.033a | 2.638 ± 0.175a | 0.230 ± 0.008a | 0.605 ± 0.079a |
| 5.1 ± 2.7 | 3.9 ± 2.2 | 460 | 0.753 ± 0.020b | 0.554 ± 0.023b | 2.454 ± 0.202a | 0.247 ± 0.020b | 0.609 ± 0.100a |
| 0.2 ± 0.4 | 0.1 ± 0.2 | 190 | 0.621 ± 0.060c | 0.420 ± 0.064c | 3.326 ± 0.209b | 0.380 ± 0.060 c | 1.268 ± 0.279c |
Рис. 3.
Влияние сезонного снижения среднесуточной температуры на параметры JIP теста в листьях Avena sativa: (а) ‒ 5.1°С; (б) ‒ 0.2°С. Значения параметров при 15.4°С приняты равными 100%. Пунктирные линии показывают изменения их значений при 5.1 и 0.2°С.
Для оценки влияния снижения температуры на регулируемые светом фотохимические и фотозащитные процессы определяли квантовый выход qE компонента нефотохимического тушения (φNPQ), скорость электронного транспорта (ETR) у одновозрастных растений разных сроков сева (табл. 4). Величины этих параметров определяли при интенсивности актиничного света 460 мкмоль фотонов/(м2 с), что соответствует средней освещенности в 12‒16 ч дня во второй половине сентября в солнечные дни. В сентябре по мере снижения дневных температур до 3.5°С, а ночных до околонулевых со слабыми заморозками величина φNPQ возросла более чем в 1.5 раза, достигнув максимальных значений 0.68. При понижении среднесуточных температур до околонулевых величина этого показателя составила 0.55. Уменьшение ETR на 37% отмечено при падении средних дневных температур от 17 до 8°C. При дальнейшем снижении дневной температуры до 3.5°С и ниже величина ETR достигала наименьших значений, около 14 мкмоль электронов/(м2 с), что составило около 15% от величин, наблюдаемых при 17°C. Снижение среднесуточной температуры до −3°С с ночными минимальными температурами −7…−8°С в течение 3 сут приводило к гибели растений.
ОБСУЖДЕНИЕ
Заметное уменьшение содержания фотосинтетических пигментов в листьях летне-вегетирующих растений овса в засушливый период июля мы связываем с адаптацией ФСА к высокой инсоляции и недостатку влаги. Плотность потока ФАР в дневные часы в июле доходила до 1200–1500 мкмоль/(м2 с) при сумме осадков 1 мм за декаду (табл. 1). Содержание фотосинтетических пигментов повышалось во время интенсивного роста молодых листьев и достигало максимума к выметыванию метелки (табл. 1, рис. 1а). Флаговый лист овса остается функционально активным вплоть до наступления фазы восковой спелости [15]. Это способствует сохранению фонда хлорофиллов и каротиноидов (рис. 1а) на фоне умеренных осадков в течение августа (табл. 1).
Листья осенне-вегетирующих растений в период, когда среднесуточные температуры составляли 11–15°С, регулярно выпадали осадки и преобладала облачная погода, характеризовались более высоким накоплением фотосинтетических пигментов, чем листья летне-вегетирующих растений в той же фазе роста и развития (рис. 1б). Постепенное снижение содержания хлорофиллов выявлено в период с 14 сентября по 2 октября при действии среднесуточных закаливающих температур от 10°С до околонулевых температур (табл. 1, рис. 1б). Наблюдаемое в этот же период уменьшение Fm (табл. 4) может быть обусловлено инактивацией части РЦ ФС II [16]. Одновременное уменьшение хлорофиллов (a + b) и Fm свидетельствует о сокращении числа фотосинтетических единиц (ФСЕ). При 1–3°C у ярового овса также умеренно усиливаются процессы ПОЛ, образования активных форм кислорода (АФК), приводящие к фотодеструкции хлорофилла [17]. По нашему мнению, уменьшение числа ФСЕ носит адаптивный характер, так как оно способствует быстрому достижению донорно-акцепторного баланса (фотостаза) между абсорбированной ФСА световой энергией и потребляемой метаболическими акцепторами энергией при низких температурах [18].
В отличие от хлорофиллов (a + b), сумма каротиноидов в листьях осенне-вегетирующих растений практически не изменялась, пока среднесуточная температура не падала до низких положительных величин 1–2°С (рис. 1б). Консервативность стехиометрии пигментов в пигмент-белковых комплексах (ПБК) ФСА подразумевает синхронное изменение каротиноидов и хлорофиллов, участвующих в фотосинтезе, что мы наблюдали у летних растений, за исключением фазы старения (рис. 1а). Несинхронный характер спада содержания хлорофиллов и каротиноидов у молодых осенне-вегетирующих растений (рис. 1б) предполагает увеличение доли каротиноидов, не участвующих в фотосинтезе. Возможными сайтами их локализации могут быть оболочка хлоропластов, а также пластоглобулы в строме хлоропластов [19].
Пул каротиноидов, участвующий в фотосинтезе, играет ключевую роль в светосборе, регуляции распределения абсорбированной антенными ПБК солнечной энергии, предотвращении образования АФК в ЭТЦ, а также в поддержании структурной целостности ПБК. Важная роль принадлежит зеаксантину, который вносит вклад в тушение избыточно поглощенной энергии через регулируемый светом механизм qE, предотвращающий избыточное образование синглетного кислорода (1О2) [20]. Обычно в кинетике индукции и затухания NPQ выделяют три компонента: быстрый энергизационный qE, связанный с ΔрН-зависимым ростом тепловой диссипации энергии возбуждения в антенне и модулируемый степенью деэпоксидации виолаксантина в зеаксантин; промежуточный qT, обусловленный перераспределением ССК II между ФС II и ФС I (переход состояний); и самый медленный фотоингибиторный qI, отражающий конститутивную тепловую диссипацию энергии как в РЦ, так и в антенне ФС II. Характерное время развития и релаксации для регулируемых светом qE и qT составляет секунды и минуты [21, c. 70], тогда как изменения для qI компонента в природных условиях наблюдают в длительном временном интервале: от нескольких часов до 4−5 сут [22, 23].
Функционирование qE механизма мы отслеживали через измерение значений φNPQ. (табл. 4) [12]. По мере сезонного снижения температуры величина φNPQ возрастала, в то время как эффективный квантовый выход фотохимического тушения на свету (φPSII) и, следовательно, скорость электронного транспорта в ФС II (ETR) снижались. Очевидно, что тушение избыточно поглощенной энергии в ССК ФСА по qE механизму приобретает важное значение в период закаливания растений для поддержания высоких значений параметра φPo (Fv/Fm) при 3–8°С (табл. 4), т.е. придания устойчивости к фотоингибированию.
На снижение значений ETR помимо тушения по qE механизму могли также повлиять изменения гетерогенности РЦ ФС II при воздействии низких температур. В ФС II различают два типа гетерогенности: гетерогенность акцепторной стороны и гетерогенность светособирающего антенного комплекса [9, 21, с. 130–161].
Параметр ψ0 = 1 – Vj отражает относительный вклад фазы JP в амплитуду OP (табл. 2, 5) и характеризует вероятность переноса электрона с ${\text{Q}}_{{\text{A}}}^{ - }$ на акцепторы после QA. На рис. 2в кривые нормированы на амплитуду OJ (АOJ), чтобы выявить соотношения между фазами JP и OP. Отношение АJР/АOP (ψ0) снижалось примерно на 8%, в последующем на 30% при снижении среднесуточной температуры до 5°С и околонулевых, что свидетельствует об увеличении доли QB-невосстанавливающих центров ФС II, которые не способны восстанавливать QB и ПХ пул [9, 11]. В этих центрах окисление ${\text{Q}}_{{\text{A}}}^{ - }$ происходит путем обратной реакции с компонентами донорной стороны ФС II, РЦ быстрее переходят в закрытое состояние, а скорость реокисления ${\text{Q}}_{{\text{A}}}^{ - }$ снижается. Стабилизация QА в восстановленном состоянии при 5°С сопровождается ростом диссипации избыточной световой энергии в РЦ [24]. Рост доли QB-невосстанавливающих центров приводил к снижению параметра ET0/RC, означающего поток электронов, перенесенных от QA на QВ [25], а также вероятности (ψEо) и квантового выхода электронного транспорта (φEo) за пределы ${\text{Q}}_{{\text{A}}}^{ - }$, индекса производительности ФС II (PIABS), отражающего снижение функциональной активности ФС II (рис. 3).
Из рис. 2г видно, что относительная скорость роста фазы О–J при температурах около нуля (кривая 3) была выше, чем при 5 и 15°С. В этих условиях часть активных QB-восстанавливающих РЦ трансформировалась в QB-невосстанавливающие (рис. 2в), в которых зависимость начального подъема ФХ (OJ) от времени имеет вид экспоненты [21, с. 135‒138]. Снижение экситонной связанности отдельных комплексов ФС II также может привести к более быстрому росту фазы O–J [26]. Кроме того, нельзя было полностью исключить возможность изменения гетерогенности ССК ФС II. Быстрый рост фазы O–J, увеличение значений F0 (рис. 2г, табл. 4) могут наблюдаться не только при увеличении доли QA- и QB-невосстанавливающих центров [21, с. 135–138; 27], но и при необратимом отделении ССК II от корового комплекса ФС II с образованием комплексов c малым размером антенны [16, 21, с. 131]. Однако, по нашим данным, различия величин соотношения хлорофиллов а/b между летними и осенними растениями, произрастающими при температурах около нуля не значимы. Учитывая, что 90% от общего содержания хлорофилла b входит в состав CCК II [28], мы предполагаем, что предпочтительное необратимое сокращение ССК II по отношению к коровому комплексу ФС II в листьях овса в процессе холодового закаливания отсутствует. Для сравнения отметим, что у сосны обыкновенной, у которой доказано функционирование этого механизма при гипотермии [22], соотношение хлорофиллов а/b к концу сентября увеличивается на 35%, а к декабрю на 50% [23].
Амплитуда OP в ОJIP кривых соответствует максимальной переменной флуоресценции (Fv) и отражает фотохимическую активность ФС II. При околонулевых температурах значение Fv снижалось примерно на 50% (рис. 2б), а тесно связанного с ней параметра φPo –на 20% (рис. 3б), что обусловлено сокращением РЦ ФС II, способных к восстановлению QА. При этом возрастала независимая от функционирования ВКЦ диссипация поглощенной энергии в тепло, что проявлялось в увеличении значений параметров DI0/RC, φDo (табл. 5, рис. 3б). Отметим, что эти параметры отражают конститутивное (не регулируемое светом фотоингибиторное тушение qI) как в ССК II, так и в РЦ [11, 26, 29]. По нашим данным, в листьях овса отсутствует конститутивное накопление зеаксантина (табл. 3), ответственного за рост DI0/RC, φDo в антенных ПБК. Поэтому одновременное увеличение ABS/RC, отражающего относительный размер антенны, отнесенный к доле фотохимически активных РЦ, и DI0/RC, φDo (рис. 3б) мы связываем в основном с увеличением доли “спящих центров” [9, 11]. Такие РЦ могут абсорбировать и улавливать энергию так же, как и активные РЦ, но не могут переводить ее в энергию разделенных зарядов, поэтому поглощенная энергия испускается в тепло. Увеличение DI0/RC также может быть связано с энергетическим разобщением между отдельными ФСЕ [26].
У стрессированных околонулевыми температурами растений овса параметр Fv/Fm восстанавливался от 0.61–0.62 до 0.73–0.75 при 10–12°С в темноте в основном за счет увеличения Fm при переносе растений в лабораторные условия (данные не представлены). Следовательно, часть РЦ ФС II в растениях овса при околонулевых температурах обратимо теряет способность к восстановлению QA и в природных условиях наблюдается только в случае фотоинактивации при низких температурах на начальном этапе фотоингибирования [22]. Предположительно, этот феномен связан с образованием промежуточной формы комплексов ФС II. При повышении температуры в темноте часть этих комплексов восстанавливают фотохимическую активность без синтеза белка D1 de novo, остальная часть превращается в комплексы с необратимо ингибированными РЦ, в которых превращение предшественника D1 в активный зрелый белок ингибировано [30].
В отличие от параметра Fm рост F0 (O) (табл. 4, рис. 2а), несмотря на снижение содержания хлорофилла (рис. 1б), при околонулевых температурах было в основном необратимым при выдержке растений в темноте при 10–12°С. Судя по нашим данным, необратимое увеличение F0 может быть вызвано необратимой инактивацией РЦ. В то же время обратимое увеличение F0 обусловлено частично обратимой инактивацией РЦ ФС II.
Холодовое закаливание ярового овса в условиях Центральной Якутии ограничено коротким осенним периодом продолжительностью около 4 недель. В отличие от озимых злаков овес теряет до 40% хлорофиллов. Достоверное снижение суммы каротиноидов у осенне-вегетирующих растений выявлено лишь при околонулевых температурах и составилo около 13%. Долевое содержание индивидуальных каротиноидов в темное время суток не зависит от осеннего снижения положительных температур и ФАР. Конститутивное накопление зеаксантина при низких положительных температурах не обнаружено. Начало снижения суммы хлорофиллов (a + b), рост доли QB-невосстанавливающих центров и регулируемого светом qE тушения избыточной энергии в ССК II отмечаются уже в начале второй половины сентября при среднесуточных и ночных температурах 5–6 и 1–3°С, соответственно. Начальные изменения в РЦ и ССК II приводят к снижению функциональной эффективности ФС II (параметра PIABS). По мере сезонного снижения температуры постепенно нарастали тушение по qE механизму в ССК II, а также фотоингибиторный qI компонент в РЦ ФС II. Выраженное снижение φPo, отражающего рост доли QA-невосстанавливающих центров, выявлено при околонулевых температурах в конце сентября. Наблюдаемое при этом увеличение значений параметров F0, φDo, ABS/RC, DI0/RC обусловлено инактивацией части РЦ ФС II и преобразованием их в диссипативные центры энергии возбуждения. Часть РЦ ФС II теряет способность к восстановлению QA обратимо, что предполагает образование фотоинактивированных форм комплексов ФС II, стабилизированных низкими температурами. При этом необратимое фотоингибирование комплексов ФС II обусловлено необратимой инактивацией РЦ ФС II.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета на выполнение государственных заданий Института биологических проблем криолитозоны Якутского научного центра Сибирского отделения Российской академии наук (№ АААА-А17-117020110054-6) и Института биологии Коми научного центра Уральского отделения Российской академии наук (№ АААА-А17-117033010038-7).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Hurry V.M., Huner N.P.A. Low growth temperature affects a differential inhibition of photosynthesis in spring and winter wheat // Plant Physiol. 1991. V. 96. P. 491. https://doi.org/10.1104/pp.96.2.491
Gray G.R., Savitch L.V., Ivanov A.G., Huner N.P.A. Photosystem II excitation pressure and development of resistance to photoinhibition. II. Adjustment of photosynthetic capacity in winter wheat and winter rye // Plant Physiol. 1996. V. 110. P. 61. https://doi.org/10.1104/ pp.110.1.61
Венжик Ю.В., Титов А.Ф., Таланова В.В., Фролова С.А., Таланов А.В., Назаркина Е.А. Влияние пониженной температуры на устойчивость и функциональную активность фотосинтетического аппарата растений пшеницы // Известия РАН. Серия биологическая. 2011. № 2. С. 171.
Венжик Ю.В., Титов А.Ф., Таланова В.В., Мирославов Е.А., Котеева Н.К. Структурно-функциональная реорганизация фотосинтетического аппарата растений пшеницы при холодовой адаптации // Цитология. 2012. Т. 54. С. 916.
Rizza F., Pagani D., Stanca A.M., Cattivelli L. Use of chlorophyll fluorescence to evaluate the cold acclimation and freezing tolerance of winter and spring oats // Plant Breed. 2008. V. 120. P. 389. https://doi.org/10.1046/j.1439-0523.2001.00635.x
Дроздов С.Н., Курец В.К., Титов А.Ф. Терморезистентность активно вегетирующих растений. Ленинград: Наука, 1984. 168 с.
Петрова Л.В. Oценка сортообразцов овса посевного (Avena sativa L.) методом многомерного ранжирования в Центральной Якутии // Земледелие. 2017. № 5. С. 42.
Петров К.А. Криорезистентность растений: эколого-физиологические и биохимические аспекты. Новосибирск: Издательство СО РАН, 2016. 276 с.
Strasser R.J., Tsimilli-Michael M., Srivastava A. Analysis of chlorophyll a fluorescence transient // Chlorophyll fluorescence: a signature of photosynthesis // Advances in Photosynthesis and Respiration. V. 19 / Eds. Papageorgiou G. Govindjee C. Dordrecht, The Netherlands: Springer, 2004. P. 321. https://doi.org/10.1007/978-1-4020-3218-9_12
Schreiber U. Pulse-amplitude-modulation (PAM) fluorometry and saturation pulse method: an overview // Chlorophyll a Fluorescence: a Signature of Photosynthesis. Advances in Photosynthesis and Respiration. V. 19 / Eds. Papageorgiou G.C., Govindjee. Dordrecht, The Netherlands: Springer, 2004. P. 279.
Гольцев В.Н., Каладжи Х.М., Паунов М., Баба В., Хорачек Т., Мойски Я., Коцел Х., Аллахвердиев С.И. Использование переменной флуоресценции хлорофилла для оценки физиологического состояния фотосинтетического аппарата растений // Физиология растений. 2016. Т. 63. С. 881. https://doi.org/10.7868/S0015330316050055
Klughammer Chr., Schreiber U. Complementary PS II quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the Saturation Pulse method // PAM Application Notes. 2008. V. 1. P. 27.
Lichtenthaler H.K. Chlorophylls and carotenoids pigments of photosynthetic biomembranes // Methods in Enzymology. V. 148 / Eds. Colowick S.P., Kaplan N.O. New York, USA: Academic Press, 1987. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Gilmore A.M., Yamamoto H.Y. Resolution of lutein and zeaxanthin using a non-endcapped, lightly carbon loaded C18 high performance liquid chromatographic column // J. Chromatogr. 1991. V. 35. P. 67. https://doi.org/10.1016/S0021-9673(01)95762-0
Мыхлык А.И., Дуктова Н.А. Oценка фотосинтетической деятельности сортов овса посевного в зависимости от уровня азотного питания // Вестник Белорусской сельскохозяйственной академии. 2015. Вып. 3. С. 130.
Yamane Y., Kashino Y., Koike H., Satoh K. Increases in the fluorescence F0 level and reversible inhibition of Photosystem II reaction center by high-temperature treatments in higher plants // Photosynth. Res. 1997. V. 52. P. 57. https://doi.org/10.1023/A:1005884717655
Liu W., Yu K., He T., Li F., Zhang D., Liu J. The low temperature induced physiological responses of Avena nuda L., a cold-tolerant plant species // The Scientific World Journal. 2013. https://doi.org/10.1155/2013/658793
Ensminger I., Busch F., Huner N.P.A. Photostasis and cold acclimation: sensing low temperature through photosynthesis // Physiol. Plant. 2006. V. 126. P. 28. https://doi.org/10.1111/j.1399-3054.2006.00627.x
Климов С.В. Адаптация растений к низким температурам // Успехи современной биологии. 2001. Т. 121. С. 3.
Jahns P., Holzwarth A.R. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem II // Biochim. Biophys. Acta. 2012. V. 1817. P. 182. https://doi.org/10.1016/ j.bbabio.2011.04.012
Корнеев Д.Ю. Информационные возможности метода индукции флуоресценции хлорофилла. Киев: Альтерпрес, 2002. 188 с.
Verhoeven A. Sustained energy dissipation in winter evergreens // New Phytol. 2014. V. 201. P. 57. https://doi.org/10.1111/nph.12466
Софронова В.Е., Антал Т.К., Дымова О.В., Головко Т.К. Cезонные изменения первичных процессов фотосинтеза при низкотемпературной адаптации хвои Pinus sylvestris в Центральной Якутии // Физиология растений. 2018. Т. 65. С. 331. https://doi.org/10.1134/ S0015330318050160
Sane P.V., Ivanov A.G., Hurry V., Huner N.P.A., Oquist G. Changes in the redox potential of primary and secondary electron-accepting quinones in photosystem II confer increased resistance to photoinhibition in low-temperature-acclimated Arabidopsis // Plant Physiol. 2003. V. 132. P. 2144. https://doi.org/10.1104/pp.103.022939
Stirbet A., Govindjee. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem II: basics and applications of the OJIP fluorescence transient // J. Photochem. Photobiol. B: Biol. 2011. V. 104. P. 236.https://doi.org/10.1016/j.jphotobiol.2010.12.010
Force L., Critchley C., Van Rensen J.J.S. New fluorescence parameters for monitoring photosynthesis in plants // Photosynth. Res. 2003. V. 78. P. 17. https://doi.org/10.1023/A:1026012116709
Mathur S., Mehta P., Jajoo A., Bharti S. Analysis of elevated temperature induced inhibition of Photosystem II using Chl a fluorescence induction kinetics in wheat leaves (Triticum aestivum) // Plant Biology. 2011. V. 13. P. 1. https://doi.org/10.1111/j.1438-8677.2009.00319.x
Tang Y., Wen X., Lu C. Differential changes in degradation of chlorophyll–protein complexes of photosystem I and photosystem II during flag leaf senescence of rice // Plant Physiol. Biochem. 2005. V. 43. P. 193. https://doi.org/10.1016/j.plaphy.2004.12.009
Van Heerden P.D.R., Swanepoel J.W., Kruger G.H.J. Modulation of photosynthesis by drought in two desert scrub species exhibiting C3-mode CO2 assimilation // Environ. Exp. Bot. 2007. V. 61. P. 124. https://doi.org/10.1016/j.envexpbot.2007.05.005
Mohanty P., Allakhverdiev S.I., Murata N. Application of low temperatures during photoinhibition allows characterization of individual steps in photodamage and the repair of photosystem II // Photosynth. Res. 2007. V. 94. P. 217. https://doi.org/10.1007/s11120-007-9184-y
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


