Физиология растений, 2020, T. 67, № 4, стр. 408-416
Функциональное взаимодействие АФК и оксида азота при индуцировании теплоустойчивости проростков пшеницы донором сероводорода
Ю. В. Карпец a, Ю. Е. Колупаев a, *, А. А. Луговая a, Н. В. Швиденко a, М. А. Шкляревский a, Т. О. Ястреб a
a Харьковский национальный аграрный университет им. В.В. Докучаева
Харьков, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 20.08.2019
После доработки 02.10.2019
Принята к публикации 02.10.2019
Аннотация
Изучали участие активных форм кислорода (АФК) и оксида азота (NO), а также генерирующих их ферментативных систем в развитии теплоустойчивости проростков пшеницы, индуцируемой донором сероводорода (H2S) гидросульфидом натрия (NaHS). 24-часовая обработка проростков NaHS в концентрациях диапазона 0.1–1 мМ повышала их выживание после 10-минутного повреждающего прогрева в водяном термостате при 45°С. В течение первых 4 ч после начала обработки донором сероводорода в корнях повышалось содержание пероксида водорода и оксида азота, а также активность нитратредуктазы (НР). При этом повышение содержания NO значительно угнеталось ингибитором НР вольфраматом натрия, но не ингибитором NO-синтазы L-NAME (NG-nitro-L-arginine methyl ester). Скавенджер пероксида водорода диметилтиомочевина (ДМТМ) и ингибитор НАДФ·H-оксидазы имидазол устраняли эффект повышения активности НР и содержания NO в корнях. В то же время скавенджер NO PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) и ингибиторы ферментов синтеза оксида азота слабо влияли на увеличение содержания пероксида водорода, вызываемое обработкой корней донором H2S. Повышение теплоустойчивости проростков, индуцируемое действием гидросульфида натрия, нивелировалось как антагонистами АФК (ДМТМ и имидазолом), так и антагонистами NO (PTIO и вольфраматом). Сделано заключение, что эффект повышения теплоустойчивости проростков пшеницы экзогенным сероводородом опосредован усилением генерации АФК, последующей активацией НР и увеличением зависимого от этого фермента содержания оксида азота.
ВВЕДЕНИЕ
По современным представлениям, сероводород (H2S) является одной из ключевых регуляторных молекул-газотрансмиттеров у растений и животных [1]. Получены сведения о его участии в реализации физиологических эффектов фитогормонов, регуляции ростовых процессов, передаче стрессовых сигналов и адаптации растений к неблагоприятным факторам [2–4]. Обнаружено повышение эндогенного содержания H2S у растений при действии стрессоров различной природы: обезвоживания [5], засоления [6], экстремальных температур [7], ионов тяжелых металлов и других токсикантов [8, 9]. В ряде работ показаны эффекты индуцирования устойчивости растений к стрессорам действием доноров сероводорода [7, 10, 11].
Однако представления о механизмах сигнальных эффектов сероводорода сформировались далеко не полностью [1, 4]. Установлено, что одним из прямых биохимических механизмов действия сероводорода является сульфгидратация (персульфидирование) белков [12]. Также сигнальные эффекты сероводорода связаны с его функциональным взаимодействием с другими посредниками, в частности, с активными формами кислорода (АФК). Например, показано, что повышение донором H2S устойчивости растений ячменя к действию УФ-B сопровождалось увеличением содержания пероксида водорода в листьях [13]. Эти эффекты нивелировались скавенджером H2O2 диметилтиомочевиной (ДМТМ) и ингибитором НАДФ·H-оксидазы дифенилениодониумом. Индуцирование теплоустойчивости колеоптилей пшеницы обработкой NaHS сопровождалось усилением генерации супероксидного анион-радикала и пероксида водорода и также устранялось ДМТМ и ингибитором НАДФ·H-оксидазы имидазолом [14].
Еще одним сигнальным посредником, с которым тесно связан сероводород, является оксид азота (NO) [15]. Показано, что эти газотрансмиттеры могут действовать на одни и те же белковые мишени, вызывая эффекты персульфидирования либо нитрозилирования [4]. В то же время NO и H2S оказывают влияние и на внутриклеточное содержание друг друга. Предполагается, что в зависимости от природы стресс-фактора и регулируемых процессов, NO в сигнальных цепях может быть расположен как выше, так и ниже сероводорода [4].
В экспериментах с растениями люцерны установлено снятие положительного влияния донора сероводорода NaHS на солеустойчивость и экспрессию генов антиоксидантных ферментов скавенджером оксида азота PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) [16]. Обработка проростков гороха гидросульфидом натрия повышала их устойчивость к токсическому действию мышьяка, при этом отмечалось увеличение содержания оксида азота [10]. Под влиянием донора сероводорода NaHS у растений томата уменьшались последствия окислительного стресса, вызываемого действием 100 мМ нитрата [17]. При этом донор H2S повышал эндогенное содержание NO в корнях, которое ассоциировалось с повышением активности нитратредуктазы (НР), но не фермента, подобного NO-синтазе животных [17].
В целом же сведений о роли оксида азота в трансдукции сигналов сероводорода, индуцирующих развитие устойчивости растений к стрессорам, пока недостаточно. В частности, открытым остается вопрос об участии NO в H2S-индуцируемом развитии устойчивости растений к тепловому стрессу. Как уже отмечалось, влияние сероводорода на теплоустойчивость растений опосредовано АФК [14]. Известно, что между АФК и NO существуют очень тесные функциональные связи [18], в том числе в процессах индуцирования теплоустойчивости растений [19]. Однако функциональное взаимодействие между пероксидом водорода и оксидом азота как возможными посредниками в реализации протекторных эффектов сероводорода при тепловом стрессе почти не изучено.
В связи с этим целью работы явилось установление последовательности вклада пероксида водорода и оксида азота как сигнальных посредников в индуцирование теплоустойчивости проростков пшеницы донором сероводорода NaHS. Также задачей работы было выяснение возможной роли НР в образовании NO под действием экзогенного сероводорода.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования были 4-суточные этиолированные проростки пшеницы (Triticum aestivum L.) сорта Досконала, выращенные при температуре 18–20°С на очищенной водопроводной воде. В среду инкубации корней добавляли донор H2S гидросульфид натрия (0.025–2 мМ) и выдерживали проростки в течение 24 ч. Оптимальная экспозиция была выбрана в предварительных опытах. При исследовании эффектов скавенджера NO PTIO (0.1 мМ), ингибиторов НР вольфрамата натрия (2 мМ) и NO-синтазы L-NAME (от NG-nitro-L-arginine methyl ester, 2 мМ), антиоксиданта ДМТМ (0.15 мМ) и ингибитора НАДФ · H-оксидазы имидазола (0.01 мМ) инкубация корней в растворах этих соединений составляла 26 ч. При оценке совместного действия донора сероводорода и указанных антагонистов NO и АФК последние добавляли в среду инкубации проростков за 2 ч до внесения в нее NaHS. Концентрации исследуемых соединений, максимально модифицирующие эффекты донора сероводорода, но не оказывающие видимого токсического действия на проростки, выбирали на основании предварительных опытов.
Для определения теплоустойчивости проростков их подвергали повреждающему прогреву в водяном ультратермостате при температуре 45.0 ± 0.1°С в течение 10 мин. После этого проростки всех вариантов переносили на очищенную водопроводную воду. Через 3 суток после воздействия повреждающего прогрева оценивали относительное количество выживших проростков [19].
Содержание пероксида водорода и оксида азота определяли в корнях, поскольку они более чувствительны к воздействиям экзогенных соединений [19]. Для определения содержания пероксида водорода корни на холоде гомогенизировали в 5% трихлоруксусной кислоте. Пробы центрифугировали при 8000 g в течение 10 мин при температуре не более 4°С на центрифуге MPW 350R (“MPW MedInstruments”, Польша) и в супернатанте определяли концентрацию H2O2 с помощью ферротиоцианатного метода [20].
Содержание NO в корнях проростков анализировали с использованием реактива Грисса [21] с авторскими модификациями [19]. Активность НР (КФ 1.7.1.1) определяли in vitro по количеству накопленного продукта реакции нитрита [22] в соответствии с прописью, приведенной нами ранее [23]. Активность фермента выражали в нмоль нитрата/(г сырой массы мин).
Опыты проводили в 4-кратной биологической повторности и каждый независимо воспроизводили 3 раза. На рисунках приведены средние величины и их стандартные ошибки. Достоверность различий определяли по t-критерию Стьюдента. Кроме специально оговоренных случаев, обсуждаются эффекты, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ
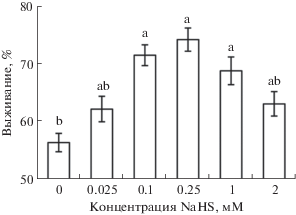
Инкубация проростков пшеницы на растворах донора сероводорода NaHS в концентрациях 0.1, 0.25 и 1 мМ заметно повышала их выживание после повреждающего прогрева (рис. 1). При использовании концентраций 0.025 и 2 мМ достоверного повышения теплоустойчивости проростков не наблюдали. В последующих экспериментах использовали NaHS в концентрации 0.25 мМ, влияние которой на теплоустойчивость проростков было наиболее существенным.
Рис. 1.
Концентрационная зависимость влияния донора сероводорода NaHS на выживание (%) проростков пшеницы после повреждающего прогрева (10 мин при 45°С). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
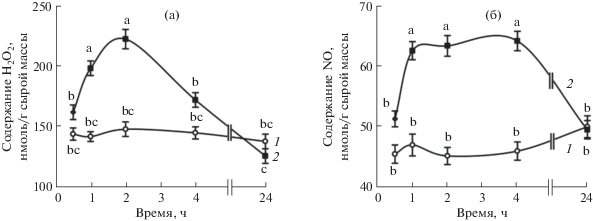
Через 1 ч после начала обработки донором сероводорода в корнях проростков отмечали достоверное повышение содержания пероксида водорода (рис. 2а). Максимальные значения, которые превышали контроль в 1.5 раза, проявлялись через 2 ч после начала обработки, затем содержание пероксида водорода постепенно снижалось, к 24 ч достигая величин контроля. Повышение содержания оксида азота в корнях под влиянием донора H2S также было транзиторным (рис. 2б). Выраженный эффект наблюдали через 1–4 ч после начала обработки, а к 24 ч экспозиции содержание NO в корнях проростков опытного варианта не отличалось от контроля.
Рис. 2.
Динамика содержания пероксида водорода (а) и оксида азота (б) в корнях проростков пшеницы при обработке 0.25 мМ NaHS. 1 – контроль; 2 – NaHS (0.25 мМ). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
Обработка проростков скавенджером пероксида водорода ДМТМ несколько снижала его содержание в корнях (рис. 3а). При этом в присутствии ДМТМ не проявлялось повышение содержания H2O2, вызываемое действием донора сероводорода. Также индуцируемый обработкой корней NaHS эффект увеличения количества H2O2 полностью устранялся действием имидазола – ингибитора НАДФ · H-оксидазы, что указывает на роль этого фермента в H2S-индуцируемом усилении генерации АФК.
Рис. 3.
Содержание пероксида водорода (а) и оксида азота (б) в корнях проростков пшеницы при действии NaHS и антагонистов АФК или NO. (а): 1 – контроль; 2 – NaHS (0.25 мМ); 3 – ДМТМ (0.15 мМ); 4 – NaHS (0.25 мМ) + ДМТМ (0.15 мМ); 5 – имидазол (0.01 мМ); 6 – NaHS (0.25 мМ) + имидазол (0.01 мМ); (б) 1 – контроль; 2 – NaHS (0.25 мМ); 3 – Na2WO4 (2 мМ); 4 – NaHS (0.25 мМ) + Na2WO4 (2 мМ); 5 – L-NAME (2 мМ); 6 – NaHS (0.25 мМ) + L-NAME (2 мМ). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05. Анализы проводили через 2 ч после начала обработки проростков NaHS и/или 4 ч после воздействия антагонистов АФК или NO.
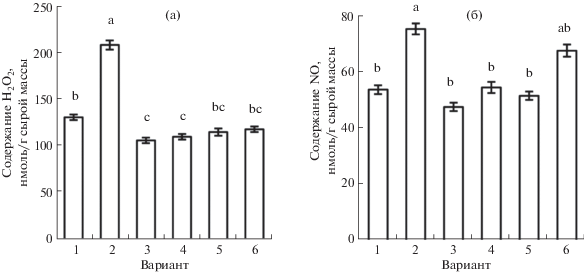
При обработке ингибитором НР вольфраматом натрия проявлялась тенденция к уменьшению содержания оксида азота в корнях, эффект был достоверным при P ≤ 0.1 (рис. 3б). Ингибитор NO-синтазы L-NAME практически не влиял на регистрируемое количество оксида азота. Повышение содержания NO, происходящее в корнях проростков пшеницы под влиянием донора H2S, заметно угнеталось ингибитором НР вольфраматом натрия (рис. 3б). В то же время ингибитор NO-синтазы не оказывал достоверного при P ≤ 0.05 влияния на проявление этого эффекта. Эти результаты позволяют предполагать ведущую роль НР в усилении образования оксида азота, вызываемого действием донора сероводорода.
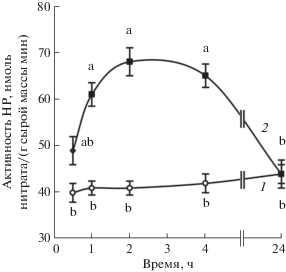
Непосредственное определение активности НР в корнях проростков показало ее транзиторное увеличение под влиянием донора сероводорода (рис. 4). Достоверный эффект повышения активности фермента наблюдали через 1–4 ч после начала обработки корней NaHS, а через 24 ч она не отличалась от величин контроля.
Рис. 4.
Динамика активности НР в корнях проростков пшеницы при обработке донором сероводорода NaHS. 1 – контроль; 2 – NaHS (0.25 мМ). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
Для выяснения причинно-следственных связей между изменениями содержания пероксида водорода и оксида азота в корнях проростков пшеницы при действии донора H2S оценивали влияние скавенджера оксида азота PTIO и ингибиторов НР (вольфрамата натрия) и NO-синтазы (L-NAME) на количество H2O2. Антагонисты оксида азота сами по себе достоверно не влияли на содержание пероксида водорода в корнях проростков пшеницы (рис. 5). При этом обработка PTIO незначительно уменьшала эффект повышения содержания пероксида водорода в корнях, вызываемый действием гидросульфида натрия. Под влиянием ингибитора НР вольфрамата натрия также отмечалось некоторое снижение содержания пероксида водорода в варианте с обработкой донором сероводорода, но этот эффект не был достоверным при P ≤ 0.05. В присутствии L-NAME содержание пероксида водорода в корнях проростков, обработанных донором сероводорода, почти не отличалось от величин, которые наблюдались без воздействия этого ингибитора. Таким образом, в целом различные антагонисты NO не устраняли эффект увеличения содержания пероксида водорода в корнях, вызываемый донором сероводорода.
Рис. 5.
Влияние донора сероводорода NaHS в сочетании с антагонистами NO на содержание пероксида водорода в корнях проростков пшеницы. 1 – контроль; 2 – NaHS (0.25 мМ); 3 – PTIO (0.1 мМ); 4 – NaHS (0.25 мМ) + PTIO (0.1 мМ); 5 – Na2WO4 (2 мМ); 6 – NaHS (0.25 мМ) + Na2WO4 (2 мМ) ; 7 – L-NAME (2 мМ); 8 – NaHS (0.25 мМ) + L-NAME, 2 мМ. Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05. Анализы проводили через 2 ч после начала обработки проростков NaHS и/или 4 ч после воздействия антагонистов NO.
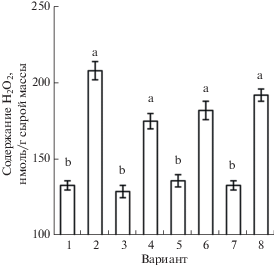
В следующей серии экспериментов изучали влияние антиоксиданта ДМТМ и ингибитора НАДФ · H-оксидазы имидазола на активность НР и содержание NO в корнях проростков, подвергнутых действию донора H2S. Обработка проростков антиоксидантом ДМТМ сама по себе практически не влияла на активность НР и содержание NO в корнях проростков пшеницы. Однако при этом она нивелировала вызываемые донором сероводорода эффекты повышения активности НР и содержания оксида азота в корнях проростков (рис. 6). Под влиянием имидазола активность НР и содержание оксида азота существенно не изменялись, но при этом обработка корней проростков ингибитором НАДФ · H-оксидазы полностью подавляла как повышение активности НР, так и увеличение содержания NO в варианте с воздействием донора сероводорода (рис. 6). Эти результаты указывают на роль предварительного накопления пероксида водорода в проявлении зависимого от НР увеличения содержания NO при действии на проростки донора сероводорода.
Рис. 6.
Активность НР (а) и содержание NO (б) в корнях проростков пшеницы при комбинированном действии донора сероводорода NaHS и антагонистов АФК. 1 – контроль; 2 – NaHS (0.25 мМ); 3 – ДМТМ (0.15 мМ); 4 – NaHS (0.25 мМ) + ДМТМ (0.15 мМ); 5 – имидазол (0.01 мМ); 6 – NaHS (0.25 мМ) + имидазол (0.01 мМ). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05. Анализы проводили через 2 ч после начала обработки проростков NaHS и/или 4 ч после воздействия антагонистов АФК.
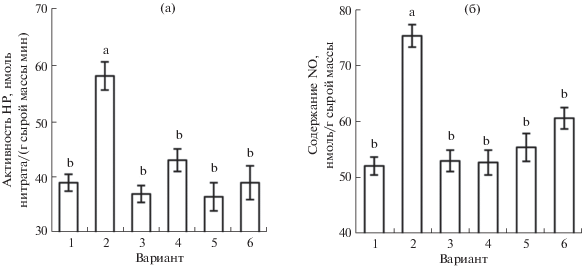
Для выяснения участия пероксида водорода и оксида азота в процессах индуцирования теплоустойчивости проростков пшеницы экзогенным сероводородом исследовали влияние антагонистов АФК и NO на проявление протекторного действия NaHS. Обработка ДМТМ несколько повышала выживание проростков пшеницы после теплового стресса (рис. 7). При этом под действием ДМТМ заметно уменьшалось положительное влияние донора сероводорода на теплоустойчивость проростков. Положительный эффект NaHS полностью устранялся и действием на проростки ингибитора НАДФ · H-оксидазы имидазола, который сам по себе не влиял на их теплоустойчивость (рис. 7). Такие результаты указывают на роль АФК, генерируемых с участием НАДФ · H-оксидазы, в реализации стресс-протекторного действия донора сероводорода на проростки пшеницы.
Рис. 7.
Выживание проростков пшеницы (%) после повреждающего прогрева (10 мин при 45°С) при действии донора сероводорода NaHS и антагонистов АФК или NO. 1 – контроль; 2 – NaHS (0.25 мМ); 3 – ДМТМ (0.15 мМ); 4 – NaHS (0.25 мМ) + ДМТМ (0.15 мМ); 5 – имидазол (0.01 мМ); 6 – NaHS (0.25 мМ) + имидазол (0.01 мМ); 7 – PTIO (0.1 мМ); 8 – NaHS (0.25 мМ) + PTIO (0.1 мМ); 9 – Na2WO4 (2 мМ); 10 – NaHS (0.25 мМ) + Na2WO4 (2 мМ); 11 – L-NAME (2 мМ); 12 – NaHS (0.25 мМ) + L-NAME (2 мМ). Одинаковыми латинскими буквами отмечены значения, различия между которыми не достоверны при P ≤ 0.05.
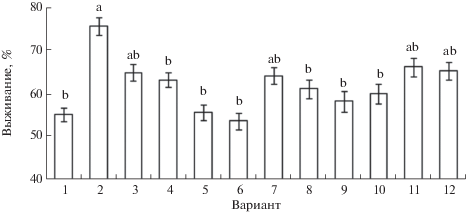
Обработка проростков скавенджером NO PTIO и ингибитором NO-синтазы L-NAME сама по себе вызывала некоторое повышение их теплоустойчивости, хотя оно не было достоверным при P ≤ 0.05 (рис. 7). Вольфрамат натрия в отсутствие донора сероводорода существенно не влиял на резистентность проростков пшеницы. В то же время как скавенджер NO PTIO, так и ингибитор НР вольфрамат заметно уменьшали положительное влияние донора сероводорода на теплоустойчивость проростков пшеницы (рис. 7). Тенденция к подобному эффекту проявлялась и в варианте с комбинированным действием донора H2S с L-NAME, однако он не был значимым при P ≤ 0.05.
ОБСУЖДЕНИЕ
Полученные результаты показали, что вызываемому обработкой донором сероводорода повышению теплоустойчивости проростков пшеницы (рис. 1) предшествовало транзиторное увеличение содержания пероксида водорода в корнях (рис. 2а). Увеличение количества H2O2, индуцируемое донором сероводорода, устранялось действием ингибитора НАДФ · H-оксидазы имидазола (рис. 3а). Также ингибитор этого фермента нивелировал эффект повышения теплоустойчивости проростков, вызываемый донором H2S (рис. 7). Это свидетельствует о роли НАДФ · H-оксидазы в образовании АФК, участвующих в сигнальных процессах при реализации стресс-протекторного действия экзогенного H2S. С использованием другого ингибитора этого фермента дифенилениодониума показано его участие как генератора АФК при индуцировании сероводородом устойчивости растений ячменя к действию УФ-B [13].
Наряду с увеличением содержания пероксида водорода под влиянием донора H2S в корнях проростков пшеницы транзиторно увеличивалось содержание NO (рис. 2б). Эффект повышения количества оксида азота в клетках растений под влиянием экзогенного сероводорода зарегистрирован и в ряде других исследований. Как отмечалось, в проростках гороха донор сероводорода NaHS, смягчая токсическое действие мышьяка, вызывал повышение содержания NO [10]. Похожий эффект обнаружен и при исследовании влияния донора сероводорода на солеустойчивость томата. Его протекторное действие сопровождалось увеличением содержания оксида азота в корнях [24].
Наши результаты позволяют предполагать, что ферментативным источником образования NO, стимулируемого H2S, является НР. На это указывает транзиторное увеличение ее активности в корнях, которое совпадало по времени с повышением в них содержания NO (рис. 2б, 4). Эффект повышения количества NO в корнях, обработанных донором сероводорода, устранялся ингибитором НР вольфраматом, но не ингибитором NO-синтазы L-NAME (рис. 3б). Повышение активности НР под действием экзогенного сероводорода показано и на ряде других объектов. Так, обработка корней кукурузы NaHS повышала активность НР и предотвращала ее снижение при токсическом действии свинца [25]. В корнях гороха повышение содержания NO, вызываемое обработкой донором сероводорода, также сопровождалось увеличением активности НР [10]. В нашей работе впервые показана роль НР как источника NO в развитии теплоустойчивости проростков пшеницы, индуцируемом донором сероводорода. Ингибитор НР вольфрамат, как и скавенджер NO PTIO, устранял положительное влияние обработки NaHS на теплоустойчивость проростков (рис. 7). В то же время ингибитор NO-синтазы L-NAME лишь незначительно уменьшал проявление защитного действия донора сероводорода.
Как известно, представления о механизмах синтеза оксида азота у растений являются предметом дискуссии [26]. Основными путями считаются нитрат/нитрит-зависимый и L-аргинин-зависимый. Если роль НР в восстановлении нитрата и нитрита до оксида азота считается установленной, то вопрос о природе фермента(-ов), обеспечивающего(-их) синтез NO в результате превращений L-аргинина, остается открытым [26]. В нашем случае обсуждение возможной роли фермента, подобного NO-синтазе животных, в реализации физиологических эффектов сероводорода выходит за рамки экспериментального материала, поскольку его ингибитор L-NAME почти не влиял на проявление эффектов донора H2S на содержание NO в корнях и развитие теплоустойчивости проростков пшеницы (рис. 3б, 7).
Оксид азота и пероксид водорода как сигнальные посредники находятся в тесной функциональной связи. Наши результаты указывают на то, что они оба принимают участие в реализации физиологического действия сероводорода, индуцирующего развитие теплоустойчивости проростков пшеницы. Динамика повышения содержания оксида азота и пероксида водорода в корнях при обработке их донором сероводорода была похожей: основные эффекты проявлялись через 1–4 ч после начала воздействия донора H2S, что не позволяет ответить на вопрос о последовательности расположения этих посредников в сигнальной цепи. В то же время снятие эффекта увеличения содержания оксида азота антиоксидантом ДМТМ и ингибитором НАДФ·H-оксидазы имидазолом, а также отсутствие выраженного влияния скавенджера оксида азота PTIO и ингибиторов ферментов его синтеза на количество H2O2 в корнях (рис. 5, 6б), указывают на первичность увеличения содержания пероксида водорода по отношению к изменению пула NO. Примечательно, что повышение активности НР, вызываемое донором сероводорода, также устранялось действием скавенджера пероксида водорода ДМТМ и ингибитора НАДФ·H-оксидазы имидазола (рис. 6а). Следует отметить, что в литературе имеются данные о повышении активности НР под влиянием пероксида водорода [18].
Предполагаемое нами развитие сигнальных событий не может исключать и других вариантов взаимодействия сероводорода, пероксида водорода и оксида азота как сигнальных посредников. Например, в экспериментах с проростками кукурузы показано, что индуцируемое донором оксида азота нитропруссидом натрия развитие теплоустойчивости сопровождалось повышением активности L-цистеиндесульфгидразы и содержания H2S [27]. Сероводород как посредник в реализации сигнала NO рассматривается и при индуцировании солеустойчивости томатов [24]. С другой стороны, положительное влияние донора сероводорода на солеустойчивость растений люцерны [16] и проростков ячменя [28] устранялось скавенджером NO PTIO. Наконец, имеются данные о том, что индуцирование теплоустойчивости проростков кукурузы экзогенным пероксидом водорода происходит при посредничестве оксида азота и сероводорода [29]. Приведенные примеры наводят на мысль о том, что проявления тех или иных сигнальных и/или стресс-протекторных эффектов экзогенных соединений во многом зависят от особенностей конкретных экспериментальных моделей. В их рамках обычно изучаются фрагменты сложных сигнальных сетей, в разных частях которых могут функционировать одни и те же посредники [4].
Процессы индуцирования теплоустойчивости растительных объектов действием доноров сероводорода включают в себя функциональное взаимодействие не только АФК и оксида азота, но и других посредников, среди которых обязательным, по-видимому, является кальций. Так, в нашей предыдущей работе было показано угнетение влияния сероводорода на теплоустойчивость клеток колеоптилей пшеницы, генерацию АФК и активность антиоксидантных ферментов различными антагонистами кальция [14]. Значение кальция в реализации стресс-протекторного действия сероводорода показано и на других объектах [8].
В целом, результаты, полученные в настоящей работе, позволяют заключить, что индуцирование теплоустойчивости проростков пшеницы донором сероводорода происходит при посредничестве АФК, генерируемых с участием НАДФ · H-оксидазы, и оксида азота, образующегося преимущественно под действием НР. При этом активация НР, вероятно, происходит с участием АФК, находящихся в сигнальной цепи выше NO. По-видимому, сигнальный каскад, индуцируемый сероводородом, активирует комплекс физиологических реакций, обусловливающих повышение теплоустойчивости. Среди них, вероятно, особое значение имеет повышение активности и усиление экспрессии генов антиоксидантных ферментов [10, 13, 26]. Также имеются данные о повышении у растений под влиянием экзогенного сероводорода содержания полифункциональных низкомолекулярных протекторов – пролина, сахарозы, бетаина и флавоноидных соединений [11, 13, 30]. Изучение механизмов активации сероводородом защитных реакций растений создает теоретические предпосылки для использования доноров H2S в составе стресс-протекторных препаратов для растениеводства.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Hancock J.T. Hydrogen sulfide and environmental stresses // Environ. Exp. Bot. 2019. V. 161. P. 50.
Tian B., Zhang Y., Jin Z., Liu Z., Pei Y. Role of hydrogen sulfide in the methyl jasmonate response to cadmium stress in foxtail millet. Front. Biosci. (Landmark Ed.). 2017. V. 22. P. 530.
Ziogas V., Molassiotis A., Fotopoulos V., Tanou G. Hydrogen sulfide: A potent tool in postharvest fruit biology and possible mechanism of action // Front. Plant Sci. 2018. V. 9: 1375. https://doi.org/10.3389/fpls.2018.01375
Corpas F.J., González-Gordo S., Canas A., Palma J.M. Nitric oxide (NO) and hydrogen sulfide (H2S) in plants: Which is first? // J. Exp. Bot. 2019. V. 70. P. 4391.https://doi.org/10.1093/jxb/erz031
Jin Z.P., Shen J.J., Qiao Z.J., Yang G.D., Wang R., Pei Y.X. Hydrogen sulfide improves drought resistance in Arabidopsis thaliana // Biochem. Biophys. Res. Commun. 2011. V. 414. P. 481.
Lai D.W., Mao Y., Zhou H., Li F., Wu M., Zhang J., He Z., Cui W., Xie Y. Endogenous hydrogen sulfide enhances salt tolerance by coupling the reestablishment of redox homeostasis and preventing salt-induced K+ loss in seedlings of Medicago sativa // Plant Sci. 2014. V. 225. P. 117.
Lisjak M., Teklic T., Wilson I.D., Whiteman M., Hancock J.T. Hydrogen sulfide: environmental factor or signalling molecule? // Plant Cell Environ. 2013. V. 36. P. 1607.
Fang H.H., Pei Y.X., Tian B.H., Zhang L.P., Qiao Z.J., Liu Z.Q. Ca2+ participates in H2S induced Cr6+ tolerance in Setaria italica // Chin. J. Cell. Biol. 2014. V. 36. P. 758.
Shi H., Ye T., Chan Z. Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass (Cynodon dactylon (L). Pers.) // Plant Physiol. Biochem. 2014. V. 74. P. 99.
Singh V.P., Singh S., Kumar J., Prasad S.M. Hydrogen sulfide alleviates toxic effects of arsenate in pea seedlings through up-regulation of the ascorbate-glutathione cycle: Possible involvement of nitric oxide // J. Plant Physiol. 2015. V. 181. P. 20.
Колупаев Ю.Е., Горелова Е.И., Ястреб Т.О., Рябчун Н.И., Кириченко В.В. Стресс-протекторные реакции проростков пшеницы и ржи при индуцировании устойчивости к низким температурам донором сероводорода // Физиология растений. 2019. Т. 66. С. 277.
Aroca A., Gotor C., Luis C. Romero hydrogen sulfide signaling in plants: emerging roles of protein persulfidation // Front. Plant Sci. 2018. V. 9: 1369. https://doi.org/10.3389/fpls.2018.01369
Li Q., Wang Z., Zhao Y., Zhang X., Zhang S., Bo L., Wang Y., Ding Y., An L. Putrescine protects hulless barley from damage due to UV-B stress via H2S- and H2O2-mediated signaling pathways // Plant Cell Rep. 2016. V. 35. P. 1155.
Колупаев Ю.Е., Фирсова Е.Н., Ястреб Т.О., Луговая А.А. Участие ионов кальция и активных форм кислорода в индуцировании антиоксидантных ферментов и теплоустойчивости растительных клеток донором сероводорода // Прикл. биохимия и микробиол. 2017. Т. 53. С. 502.
Parankusam S., Adimulam S.S., Bhatnagar-Mathur P., Sharma K.K. Nitric oxide (NO) in plant heat stress tolerance: Current knowledge and perspectives // Front. Plant Sci. 2017. V. 8: 1582. https://doi.org/10.3389/fpls.2017.01582
Wang Y., Li L., Cui W., Xu S., Shen W., Wang R. Hydrogen sulfide enhances alfalfa (Medicago sativa) tolerance against salinity during seed germination by nitric oxide pathway // Plant Soil. 2012. V. 351. P. 107.
Liang Y., Zheng P., Li S., Li K., Xu H. Nitrate reductase-dependent NO production is involved in H2S-induced nitrate stress tolerance in tomato via activation of antioxidant enzymes // Sci. Horticult. 2018. V. 229. P. 207.
Kolupaev Yu.E., Karpets Yu.V., Dmitriev A.P. Signal mediators in plants in response to abiotic stress: calcium, reactive oxygen and nitrogen species // Cytol. Genet. 2015. V. 49. P. 338.
Карпец Ю.В., Колупаев Ю.Е., Вайнер А.А. Функциональное взаимодействие оксида азота и пероксида водорода при формировании индуцированной теплоустойчивости проростков пшеницы // Физиология растений. 2015. Т. 62. С. 72.
Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica // Plant Physiol. 1976. V. 57. P. 308.
Zhou B., Guo Z., Xing J., Huang B. Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis // J. Exp. Bot. 2005. V. 56. P. 3223.
Галеева Е.И., Трифонова Т.В., Пономарева А.А., Викторова Л.В., Минибаева Ф.В. Нитратредуктаза листьев Triticum aestivum: регуляция активности и возможная роль в образовании оксида азота // Биохимия. 2012. Т. 77. С. 512.
Карпец Ю.В., Колупаев Ю.Е., Луговая А.А., Швиденко Н.В., Ястреб Т.О. Влияние нитрата и L-аргинина на содержание оксида азота, активность антиоксидантных ферментов в корнях проростков пшеницы и их теплоустойчивость // Физиология растений. 2018. Т. 65. С. 472.
da-Silva C.J., Mollica Dé.C.F., Vicente M.H., Peres Lá.E.P., Modolo L.V. NO, hydrogen sulfide does not come first during tomato response to high salinity // Nitric Oxide. 2018. V. 76. P. 164.
Zanganeh R., Jamei R., Rahman F. Role of salicylic acid and hydrogen sulfide in promoting lead stress tolerance and regulating free amino acid composition in Zea mays L. // Acta Physiol. Plant. 2019. V. 41: 94. https://doi.org/10.1007/s11738-019-2892-z
Мамаева А.С., Фоменков А.А., Носов А.В., Мошков И.Е., Мур Л.А.Дж., Холл М.А., Новикова Г.В. Регуляторная роль оксида азота у растений // Физиология растений. 2015. Т. 62. С. 459.
Li Z.G., Yang S.Z., Long W.B., Yang G.X., Shen Z.Z. Hydrogen sulphide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize (Zea mays L.) seedlings // Plant Cell Environ. 2013. V. 36. P. 1564.
Chen J., Wang W.H., Wu F.H., He E.M., Liu X., Shangguan Z.P., Zheng H.L. Hydrogen sulfide enhances salt tolerance through nitric oxide-mediated maintenance of ion homeostasis in barley seedling roots // Sci. Rep. 2015. V. 5: 12516. https://doi.org/10.1038/srep12516
Li Z.G., Luo L.J., Sun Y.F. Signal crosstalk between nitric oxide and hydrogen sulfide may be involved in hydrogen peroxide induced thermotolerance in maize seedlings // Физиология растений. 2015. Т. 62. С. 542.
Li Z.G., Zhu L.P. Hydrogen sulfide donor sodium hydrosulfide-induced accumulation of betaine is involved in the acquisition of heat tolerance in maize seedlings // Braz. J. Bot. 2015. V. 391. P. 31.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


