Физиология растений, 2020, T. 67, № 4, стр. 400-407
Поглощение нафталина листьями и его взаимодействие с хлорофилл-белковыми комплексами растений гороха
М. С. Христин a, *, А. В. Ланкин b, В. Д. Креславский a, c
a Институт фундаментальных проблем биологии РАН, Федеральный исследовательский центр, Пущинский научный центр биологических исследований Российской академии наук
Московская обл., Пущино, Россия
b Институт физико-химических и биологических проблем почвоведения РАН, Федеральный исследовательский центр, Пущинский научный центр биологических исследований Российской академии наук
Московская обл., Пущино, Россия
c Институт физиологии растений им. К.А. Тимирязева РАН, Федеральное государственное бюджетное
учреждение науки, Российской академии наук
Москва, Россия
* E-mail: khristin_@rambler.ru
Поступила в редакцию 27.12.2018
После доработки 09.12.2019
Принята к публикации 13.01.2020
Аннотация
Исследовали ингибирование фотосинтеза парообразным нафталином (Наф), проникновение его в тилакоиды и взаимодействие с хлорофилл-белковыми комплексами (ХБК). Установлено, что парообразный Наф сорбируется на поверхности листьев гороха, проникает в лист, связывается с тилакоидами и ингибирует фотосинтез. Адсорбированный Наф отмывается от поверхности листьев кратковременной (1 мин) инкубацией в гексане. В тилакоидах, выделенных из таких листьев, обнаруживали флуоресценцию с максимумами 325 нм и 335нм, соответствующими Наф. ПААГ электрофорезом хлорофилл-белковых комплексов (ХБК) в неденатурирующих условиях не удалось обнаружить флуоресценцию Наф в какой-либо зеленой зоне из-за тушения компонентами, поглощающими свет на длине волны 266 нм. Однако при освещении комплексов в гелях ультрафиолетовым светом (УФС) наблюдали более интенсивное выцветание Хл в опыте с добавкой Наф по сравнению с контролем без Наф. Кроме того, обнаружен перенос энергии возбуждения от Наф на Хл в комплексе тримера LHCII после вымывания из ПААГ низкомолекулярных тушителей флуоресценции. Таким образом, парообразный Наф накапливается на поверхности листьев и частично проникает в них, связываясь с тилакоидами и ХБК. Предполагается, что Наф, взаимодействуя с тримером LHCII, может участвовать в переносе энергии на Хл, стимулировать фотодеструкцию Хл и таким образом ингибировать фотосинтез.
ВВЕДЕНИЕ
Полиароматические углеводороды (ПАУ), такие как нафталин (Наф) и его производные, загрязняют атмосферу при cжигании каменного угля и бытового мусора, пиролизе дизельного топлива, бензина [1], листьев табака [2]. ПАУ осаждаются на листьях растений, частично поглощаются и метаболизируются растениями [3]. Фотосинтез наиболее чувствителен к действию физических и химических стрессоров, в частности ПАУ. При этом последние ингибируют фотосинтетический аппарат (ФА) растений, прежде всего фотосистему II [4–6]. Ингибирование фотосинтеза наблюдается также в опытах с отделенными листьями, инкубированными в воде с добавкой Наф [7], при внесении ПАУ в почву [8]. Однако механизмы такого эффекта ПАУ на ФА во многом не изучены и их исследование по-прежнему актуально. В частности, недостаточно исследованным вопросом в литературе до сих пор остается механизм ингибирования ФА при проникновении ПАУ из атмосферы в листья.
ПАУ могут загрязнять окружающую среду в форме аэрозольных частиц с очень большим диапазоном размеров – от 0.03 до 44 мкм [9]. Такие частицы адсорбируются на поверхности листа при взаимодействии с восковым слоем эпидермиса [10]. Однако малоизученным остается путь проникновения ПАУ с поверхности листьев в тилакоиды и хлорофилл-белковые комплексы (ХБК). До сих пор отсутствуют прямые экспериментальные доказательства локализации ПАУ в ХБК. За доказательство их проникновения в тилакоиды и связывания с ХБК принимается факт ингибирования активности ФС II [7]. Однако, как известно, ингибирование ФС II происходит при воздействии не только ПАУ, но и других стрессовых факторов различной природы. Возможно косвенное действие стрессоров типа ПАУ и других химических соединений на ФС II. Поэтому ингибирование фотосинтетической активности не может быть единственным фактом, позволяющим делать вывод о проникновении Наф в листья, хлоропласты и ХБК. Кроме того, адсорбированные ПАУ на поверхности листьев могут десорбироваться при участии конвертируемого потока воздуха и паров воды обратно в атмосферу, а также модифицироваться в химические производные под воздействием солнечного света и взаимодействовать с ароматическими фенольными веществами, секретируемыми листьями.
Эффект ингибирования синтеза хлорофилла и фотосинтеза нафталином, добавленным в питательную среду при выращивании растений [12, 13], нам представляется косвенным и недостаточным доказательством проникновения ПАУ в хлоропласты и ХБК ФС II. Наф содержит два бензольных кольца и обладает растворимостью в воде [14], поэтому может легче, чем другие ПАУ проникать через водную среду клетки в хлоропласты. Его модифицированные окисленные производные диффундируют в водной среде еще более эффективно. Пока отсутствуют прямые доказательства взаимодействия Наф с ХБК. Таким доказательством могут быть результаты экспериментов с использованием радиоактивно-меченого Наф, либо масс-хроматографического и НРLC анализа ХБК, выделенных из растений, находящихся в атмосфере с Наф. Однако результаты такого анализа в литературе нам не известны. Альтернативным методом может быть выявление максимумов 325 нм и 335 нм в спектре флуоресценции поверхности листьев, либо в гексановых экстрактах тилакоидов. Использование гексана для удаления с поверхности листьев адсорбированного Наф, с последующим выделением из таких листьев хлоропластов, тилакоидов и ХБК, по нашему предположению, позволяет обнаружить следовые количества Наф в этих препаратах, причем без применения хромато-масс-спектрометрии. Исследование флуоресценции Наф на длине волны возбуждения 266 нм может иметь, кроме того, практическое применение в разработке дистанционных методов определения ПАУ в окружающей среде на основе эксимерных лазеров с излучением света на длине волны 266 нм [15].
Целью работы являлось флуоресцентное определение Наф на поверхности листьев растений, инкубированных в атмосфере с парами Наф, в выделенных из них тилакоидах и ХБК, а также исследование взаимодействия Наф с ХБК, разделенными нативным электрофорезом в ПААГ.
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание и инкубация растений в парах Наф. Исследования проводились на растениях гороха (Pisum sativum L. сорт Московский 559). Растения выращивали в течение двух недель в теплице при средней интенсивности света около 400 мкмоль квантов м–2 с–1 и температуре 20–25°С, световой режим 12ч/12ч (март–апрель). Для опытов отбирали растения максимально близкие по размерам, числу ярусов, количеству листьев и пересаживали в три группы (в каждой по три) вегетационных сосудов. Сосуды одного из вариантов помещали под стеклянный колпак, туда же помещали открытую пластиковую пробирку с порошком Наф (250 мг). В другом варианте растения гороха также помещали под колпак, но без Наф. В третьем варианте растения не были накрыты колпаком. В каждом сосуде было 8–10 растений. Все варианты были сверху накрыты марлей для более равномерного освещения. Растения инкубировали в течение 24 ч. Затем полностью сформированные пары листьев второго и третьего ярусов отделяли и использовали для дальнейших анализов. В ряде опытов одинаковые по размеру сегменты листа из контрольного и опытного вариантов кратковременно инкубировали при перемешивании в спектрофотометрической кварцевой кювете с водой, после чего их вынимали из кюветы и регистрировали спектр флуоресценции. Для удаления части Наф, адсорбированного на поверхности листа, последний инкубировали в гексане 1–2 секунды.
Измерения активности ФС II в листьях флуоресцентным методом. Оценку фотосинтетической активности ФС II проводили путем измерения методом быстрой флуоресценции Хл а (JIP-test) после инкубации растений гороха на свету в течение 24 ч как в атмосфере Наф, так и без него. Адаптационный темновой период перед измерением составлял 15 мин. Индукционные кривые быстрой флуоресценции, OJIP (возрастание выхода флуоресценции Хл а от минимальной до максимальной интенсивности) переходы записывали с помощью флуориметра [7]. Определяли максимальный квантовый выход флуоресценции, равный Fv/Fm, где Fm – максимальная амплитуда флуоресценции, Fv – фотоиндуцированные изменения флуоресценции Хл, равные Fm – F0, где F0 – начальная по времени флуоресценция [16] и эффективность использования энергии возбуждения в ФС II, которая равна Fv/F0.
Выделение целых хлоропластов, тилакоидов и экстракция ХБК. Для выделения хлоропластов из опытных растений листья инкубировали в гексане 1–2 секунды, чтобы отмыть Наф. Затем листья растирали в охлажденной ступке с добавлением среды (50 мМ Mes-NaOH, рН 6.5, 5 мМ MgCl2, 100 мМ NaCl, 400 мМ сахарозы) и фильтровали через слой капронового полотна. Крупные частицы осаждали центрифугированием в течение 3 мин при 300 g, хлоропласты – 15 мин при 500 g. Целые хлоропласты ресуспендировали 10 мМ Mes-NaOH, рН 6.5 с 10 мМ NaCI в течение 40 мин на ледяной бане и осаждали 10 мин при 500 g, тилакоиды 20 мин – при 10 000 g. ХБК экстрагировали из тилакоидов на ледяной бане 20 мин при перемешивании 0.2% раствором β-додецилмальтозида (ДМ) (соотношение ДМ/хлорофилл = 20/1, вес/вес) в среде 50 мМ-MES-NaOH, рН 6.5 с добавкой 0.4 М сахарозы. Остаток несолюбилизированных мембран осаждали при 15 000 g (20 мин). К супернатанту добавляли Наф (5 мкМ в этаноле), затем сахарозу до 2 М и наносили на поверхность ПААГ. Электрофорез экстрактов тилакоидов в 7% ПААГ проводили в цилиндрических стеклянных трубках с дерифатом-160 в электродном буфере [17]. Для изучения возможного связывания Наф с разделенными зелеными полосами гели инкубировали в водном растворе Наф (30 мг/л) в темноте в течение 3 часов. Свободный Наф отмывали от гелей водой с добавкой 5% ДМСО. Участки гелей с зелеными зонами вырезали, помещали в кварцевую кювету и записывали спектры флуоресценции Наф, либо хлорофилла при длине волны возбуждения 266 нм. Так как максимумы флуоресценции Наф и спектра поглощения хлорофилла в области 300–400 нм перекрываются, можно было ожидать перенос энергии между Наф и Хл в ХБК согласно теории Фёрстера [18].
Измерение флуоресценции Наф. Наф на поверхности контрольных (инкубированных в атмосфере под стеклянным колпаком без Наф) и опытных листьев (то же, но с Наф) растений, выделенных из них тилакоидах, а также в участках ПААГ, содержащих ХБК, определяли по интенсивности полос флуоресценции при 325 нм и 335 нм на длине волны возбуждения 266 нм (в максимуме полосы поглощения Наф). Для регистрации использовали спектрофлуориметр (“Hitachi-850”, Япония).
Облучение УФС гелей с разделенными ХБК. Гели после электрофореза освещали в течение 10 мин УФС, используя облучатель ртутно-кварцевый настольный ОКН-11 (“МЭЛЗ”, СССР) со спектром, близким к линейчатому, который состоит главным образом из линий 577; 546; 435.8; 404.7; 365.6; 312.9; 296.7; 280.4; 265.2 и 253.7 нм. Сравнивали интенсивность выцветания хлорофиллов в участках гелей до и после облучения ХБК, с добавлением и без Наф в ДМ-экстракты тилакоидов.
Статистический анализ. Эксперименты включали не менее трех биологических и не менее 8 аналитических повторностей. В таблице приведены средние арифметические значения из полученных величин и их стандартные ошибки (±SE). Достоверность различий между вариантами описывали по t критерию Стьюдента при 5% уровне значимости. На графиках (рис. 1–4) приведены типичные кривые из не менее трех повторностей.
Рис. 1.
Флуоресценция Наф сорбированного на поверхности листа гороха, инкубированного 24 часа под стеклянным колпаком в контроле (1), с парами Наф до (2) и после (3) отмывки Наф с поверхности листа гексаном. 4 – флуоресценция водного раствора Наф (4.68 мкМ л–1). Длина волны возбуждения – 266 нм. Кривые 1 и 3 изображены в реальном масштабе, кривая 2 – в масштабе, уменьшенном в 5 раз. Показаны типичные кривые из трех биологических повторностей.
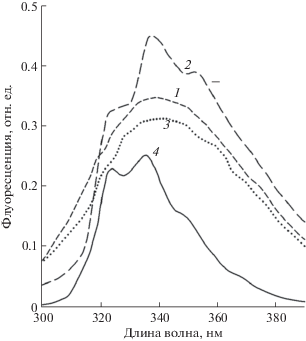
Рис. 2.
Спектр флуоресценции Наф (0.1 мкМ/л) в гексане (2) и флуоресценция Наф в гексановом экстракте тилакоидов, выделенных из листьев гороха, предварительно выдержанных в парах Наф и кратковременно (1–2 с) отмытых гексаном от адсорбированного Наф (1). Показаны типичные кривые из 5 биологических повторностей.
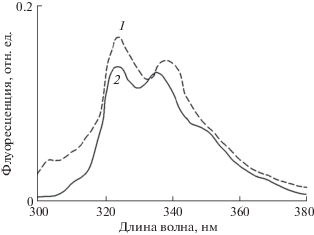
Рис. 3.
Электрофореграммы ХБК, разделенных без добавления (1, 2), с добавлением (3, 4) раствора Наф перед электрофорезом, после (2, 4) 10 минут освещения УФ зеленых зон в геле. Инкубация геля после электрофореза ХБК в парах Наф (5), х – зона тримера LHС II, в которой обнаружен перенос энергии с Наф на Хл.

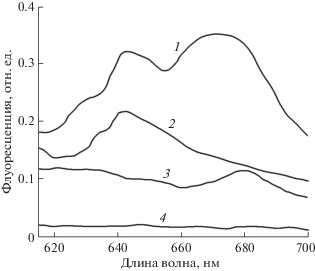
Рис. 4.
Флуоресценция в участках ПАГ после нативного электрофореза ДМ экстракта тилакоидов и инкубация геля в парах Наф при длине волны возбуждения 266 нм (рис. 3, гель 5). Показаны типичные кривые из трех биологических повторностей. 1 – тример LHС II, обозначено крестом на рис. 3, гель 5; 2 – мономер ФС II, третья зона сверху; 3 – свободные пигменты, шестая зона сверху; 4 – свободный участок геля.
РЕЗУЛЬТАТЫ
Инкубация растений в атмосфере с парами Наф в течение суток не приводила к изменению визуально заметного внешнего вида и зеленой окраски листьев по сравнению с контрольными вариантами опытов (растения, не накрытые стеклянным колпаком – контроль 1 и растения под колпаком – контроль 2). Однако за это время уже наблюдалось изменение фотосинтетической активности опытных растений (табл. 1): максимальный квантовый выход (Fv/Fm) флуоресценции Хл а и отношение Fv/F0 достоверно были меньше в опыте с парообразным Наф по сравнению с растениями контрольных вариантов. У растений, находящихся под колпаком без паров Наф, за то же время активность практически не изменилась по сравнению с растениями, не накрытыми колпаком. Этот результат показал, что закрытое пространство под колпаком не оказывает негативный эффект на фотосинтетическую активность при инкубации растений в течение суток. В воздухе же, взятом пипеткой (200 мкл) из-под колпака с Наф и перемешанном с 1 мл дистиллированной воды, наблюдались максимумы флуоресценции Наф 325 нм и 335 нм, которые соответствовали флуоресценции раствора Наф в воде (рис. 1, кривая 4). В спектре флуоресценции целого листа гороха, взятого из-под колпака с парами Наф и промытого в дистиллированной воде, также регистрируются оба максимума, принадлежащие Наф (рис. 1, кривая 2). Интенсивность этих максимумов возрастала в течение 24 ч инкубации растений в парах Наф. Чтобы отмыть такие листья от Наф, адсорбированного на поверхности листьев и затем выделить из них тилакоиды, необходима многократная промывка листа водой или однократная промывка гексаном.
Таблица 1.
Влияние паров нафталина на флуоресцентные параметры, отражающие активность фотосистемы II (Fv/Fm и Fv/F0) листьев гороха. Растения выдерживали 24 ч в обычных условиях (Контроль 1) или под стеклянным колпаком без (Контроль 2) и с добавленным нафталином (Опыт), n = 6.
| Параметры/Варианты | Контроль 1 | Контроль 2 | Опыт |
|---|---|---|---|
| Fv/Fm | 0.804 ± 0.015 | 0.794 ± 0.011 | 0.745 ± 0.012* |
| Fv/F0 | 5.1 ± 0.01 | 4.9 ± 0.02 | 3.9 ± 0.03* |
Такая подготовка листьев растений, находящихся в парах Наф, исключает проникновение адсорбированного Наф на поверхности листьев в тилакоиды при гомогенизации листьев в гомогенизаторе, последующем отжиме тканей и осаждении хлоропластов центрифугированием. В тилакоидах из полученных такой подготовкой хлоропластов содержится только та часть Наф, которая проникла через клеточные и тилакоидные мембраны в ХБК.
Спектр флуоресценции поверхности листа из сосуда с Наф (рис. 1, кривая 2), как видно, имеет сходство со спектром водного раствора Наф (к 1 мл дистиллированной воды добавлено при перемешивании 200 мкл воздуха, взятого из пробирки с сухим Наф, что примерно соответствует 1.5 мкМ Наф в 1 л воды) (рис. 1, кривая 4), в то время как в спектре флуоресценции поверхности контрольного листа гороха (рис. 1, кривая 1) относительная амплитуда была на порядок меньше и без характерных пиков. Кратковременная обработка гексаном листьев растений, инкубированных в атмосфере с Наф, приводила к исчезновению на их поверхности флуоресценции с максимумами при 325 нм и 335 нм, т.е. Наф отмывался с поверхности листьев (рис. 1, кривая 3). Однако та часть Наф, которая проникла внутрь листа в тилакоиды и была коньюгирована с ХБК при инкубации растений в парах Наф за короткое время обработки гексаном, не была экстрагирована гексаном за короткое время промывки листьев. В пользу этого вывода свидетельствует отсутствие в гексановой отмывке следов хлорофилла, что подтверждает отсутствие его проникновения в тилакоиды, когда обрабатывались целые листья.
После отмывки Наф, адсорбированного на поверхности листьев, целесообразным было получить из них тилакоиды, экстрагировать Наф с помощью гексана и спектрофлуориметрически определить его. С помощью лабораторного встряхивателя препараты тилакоидов с гексаном (1/1, v/v) перемешивали 3–4 минуты и выдерживали до полного разделения смеси на две фазы. В верхней (гексановой фазе) измеряли спектр флуоресценции при длине волны возбуждения 266 нм. В спектре флуоресценции гексанового экстракта тилакоидов, выделенных из листьев после отмывки с их поверхности Наф, выявлена полоса с максимумом при 325 нм, которая соответствует полосе раствора Наф в воде с таким же максимумом, и полоса в области 335–345 нм, которая несколько смещена в красную область спектра по сравнению с полосой 335 нм нафталина в воде (рис. 2). Такое смещение может быть связано, например, с экстракцией из тилакоидов компонентов, обладающей флуоресценцией, близкой к 335 нм.
В следующих опытах мы попытались изучить связывание Наф с ХБК, экстрагированными из тилакоидов с помощью ДМ. Тилакоиды для этих опытов выделяли из растений, выдержанных под стеклянным колпаком без паров Наф. К экстракту тилакоидов добавляли Наф из расчета 1/20 (w/w) хлорофилл/Наф и проводили нативный электрофорез. Флуоресценция Наф не была обнаружена не только в зеленых зонах, но и в нижней части гелей, где находятся низкомолекулярные компоненты, такие как пигменты. Объяснить этот результат можно тушением флуоресценции с максимумами при 325 нм и 335 нм УФС поглощающими веществами, используемыми для полимеризации гелей, такими как не полностью израсходованный ТЕМЕД, а также белками и липидами в составе ХБК. В пользу этого предположения свидетельствует полное тушение флуоресценции акриламидом, если Наф был добавлен к растворам для полимеризации ПААГ. Последующее вымывание из гелей веществ, поглощающих УФС, приводило к восстановлению флуоресценции. Это наблюдение позволило предположить, что Наф может находиться в комплексе с ХБК и при этом не флуоресцировать. Чтобы проверить эту возможность, гели освещали УФС и наблюдали выцветание зелёных зон. Сравнение интенсивностей выцветания Хл в зелёных зонах в опыте и в контроле позволяет подтвердить присутствие Наф в ХБК. Доказательство наличия Наф в ХБК свидетельствует в пользу гипотезы о механизме фотоинактивации ФС II при прямом действии ПАУ на ФА [16]. Гели, содержащие зеленые зоны ХБК после электрофореза ДМ-экстрактов из тилакоидов без добавления Наф (рис. 3, гель 2) и гели с разделенными ХБК в присутствии Наф (рис. 3, гель 4), освещали УФС в течение 20 минут и сравнивали интенсивности выцветания зеленых зон ХБК. Было обнаружено более интенсивное фотовыцветание хлорофилла в зеленых зонах в опыте с добавкой Наф в препараты экстракта тилакоидов перед электрофорезом (рис. 3, гель 4) по сравнению с опытом без добавления Наф (рис. 3, гель 2). Такой эффект, хотя и косвенно, может свидетельствовать о присутствии Наф в ХБК.
В следующих экспериментах мы попытались моделировать взаимодействие Наф с ХБК в гелях после разделения в них экстрактов тилакоидов и инкубации гелей в парах Наф. Для этого гели с ХБК многократно отмывали от низкомолекулярных компонентов в дистиллированной воде. При этом зеленые зоны оставались в гелях. Затем их помещали в пары с Наф на 2–3 часа в темноте, зоны вырезали и записывали спектр флуоресценции. Во всех зеленых зонах (рис. 3, гель 5) наблюдалась флуоресценция Наф. Она также обнаруживалась в участках гелей, свободных от ХБК. Чтобы обнаружить специфичное связывание Наф с белками, липидами и пигментами, ХБК измеряли флуоресценцию хлорофиллов при возбуждении светом 266 нм, который поглощается Наф. Оказалось, что во всех зеленых зонах в ПААГ обнаруживалась флуоресценция Наф (данные не представлены).
На рис. 4 представлены спектры флуоресценции Хл зеленых зон, одна из которых наиболее интенсивно флуоресцирует и соответствует тримеру LHCII (рис. 3, гель 5, зона LHCII обозначена крестиком). В контрольном опыте (измерение флуоресценции Хл при возбуждении на длине волны 266 нм в зоне тримера LHCII в геле, отмытом от низкомолекулярных веществ без инкубации в парах Наф) флуоресценция хлорофилла не была обнаружена.
ОБСУЖДЕНИЕ
Как известно, растения могут быть использованы как для фиторемедиации почв и для очистки воздуха, загрязненных ПАУ [19], так и для оценки токсичности ПАУ в окружающей среде [16]. Однако представлено мало данных о том, как ПАУ, в частности Наф, проникают внутрь листьев, ингибируя фотосинтез. Представленные результаты дают основание предположить наличие адсорбции паров Наф на поверхности листьев. В пользу такого вывода свидетельствует отсутствие флуоресценции на поверхности листьев, если перед измерением их кратковременно обрабатывать гексаном.
Возможно, определенная часть парообразного Наф в закрытом пространстве под колпаком проникает в лист, минуя адсорбцию в кутикулярном слое. Существует кутикулярный механизм поглощения СО2 и, возможно, Наф и других парообразных ПАУ. При реализации этого механизма поглощения нельзя исключить ингибирование нафталином замыкающих клеток устьиц, что само по себе ингибирует фотосинтез из-за дефицита СО2. Интересной оказалась неодинаковая по интенсивности флуоресценция Наф на адаксиальной и абаксиальной сторонах листа. Так, она была на 30–35% выше (данные в пересчете на площадь листа) с адаксиальной его стороны по сравнению с абаксиальной. Эти различия можно объяснить большим числом устьиц на адаксиальной стороне листа. Эффект снижения фотохимической активности ФС II при воздействии паров Наф на растения гороха аналогичен его эффекту на активность ФС II в опытах с отделенными от растений листьями гороха, инкубированными в воде с Наф [7, 16, 20], но отличен по результату от опытов с исследованием воздействия ПАУ, поступающих аэральным путем на хвою деревьев сосны [21]. Хотя ПАУ накапливались внутри хвои, снижения фотохимической активности ФС II обнаружено не было. Вероятно, в опытах с листьями Наф, растворенный в воде и частично испаряющийся в атмосферу, адсорбируется на поверхности листьев, находясь на поверхности воды в закрытом сверху стеклянном стакане. Листья подвергаются действию Наф, растворенного в воде, а также находящегося в воздушном пространстве, так как Наф испаряется из водного раствора и накапливается в закрытом пространстве под крышкой стакана.
В нашей работе конечной целью было установление факта проникновения Наф из атмосферы в ХБК ФС II с тем, чтобы изучить возможность его участия в фотоповреждении Хл и ингибировании фотосинтеза. Кроме адсорбции на поверхности листа, наблюдали также и обратный процесс – десорбцию Наф из листа в воду и воздух. При закрытых устьицах (выдерживание растений под колпаком в темноте) выделение Наф значительно ингибировалось по сравнению с открытыми устьицами на свету (данные не представлены). Кратковременная обработка листьев гексаном приводила к быстрому закрыванию устьиц, а также к смыву Наф, сорбированного в кутикулярном слое. Вероятно, Наф, проникший в лист с помощью различных механизмов, в дальнейшем может транспортироваться в межклеточном пространстве.
Механизм ингибирования ФС II парообразным Наф остается до конца не выясненным. В литературе отсутствуют данные, подтверждающие проникновение Наф в тилакоиды и ХБК. В наших опытах с ДМ-экстрактом тилакоидов, инкубированным с Наф и разделенным на отдельные зеленые зоны, каждая из которых представлена отдельным ХБК, не была обнаружена флуоресценция Наф. Однако при облучении ультрафиолетом зеленых зон было обнаружено ускорение выцветания Хл в опыте с добавлением Наф к смеси ХБК перед их электрофорезом. Этот результат свидетельствует о модификации ХБК в результате взаимодействия с ними Наф и УФ. Результаты исследования переноса энергии от Наф к Хл в разделенных на отдельные фракции ХБК показали возможность переноса энергии от Наф к Хл в тримере LHII. В других зонах ХБК этот эффект не был обнаружен, что может свидетельствовать о специфичности взаимодействия молекул Наф с молекулами Хл а в ХБК. Перенос энергии возбуждения при поглощении УФ ароматическими аминокислотами на Хл был обнаружен в препаратах антенных комплексов CP47 и СР43, что, по предположению авторов работы [22], может свидетельствовать об использовании энергии УФ в фотосинтезе. Результатом взаимодействия Хл с ароматическими веществами при поглощении длинноволнового света Хл в присутствии кислорода является образование синглетного кислорода и ОН радикалов. Такой эффект действия радикалов реализуется при фототрансформации канцерогенного бензо(а)пирена лизированными клетками микроводоросли Selenastrum capricornutum [23].
Учитывая данные, полученные в экспериментах по разделению ХБК электрофорезом в ПААГ в присутствии Наф, можно предположить, что флуоресценция Наф на поверхности листьев может тушиться ароматическими летучими веществами, выделяемыми в атмосферу из листьев. Такой эффект мы наблюдали при смешивании воздуха, отобранного из пробирки с кристаллическим Наф, с воздухом из-под стеклянного колпака с растениями без парообразного Наф. Водорастворимые производные Наф, которые, вероятно, образуются в тилакоидах при окислительных фотохимических реакциях, становятся более проницаемыми для мембраны и к тому же являются переносчиками, детекторами и генераторами синглетного кислорода в биологических средах [24–27].
Таким образом, можно заключить, что Наф и другие ПАУ адсорбируются на поверхности листа растений, затем частично проникают в лист, включаются в мембраны и ХБК, взаимодействуют с белками, и, поглощая УФ, передают энергию возбуждения на Хл, а также стимулируют фотодеструкцию Хл и ингибируют фотосинтез.
Работа поддержана грантом Российского фонда фундаментальных исследований № 18-34-00951 мол_а.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Li C.T., Mi H.H., Li W.C., Wang V.F. PAH emission from the industrial boilers // J. Hazard. Mater. 1999. V. 69. P. 1.
Schmeltz I., Tosk J. Formation and determination of naphtalenes in cigarette smoke // Anal. Chem. 1976. V. 48(4). P. 645.
Bruken J.G., Schnoor J.L. Predictive relationships for uptake of organic contaminants by hybrid poplar trees // Environ. Sci. Technol. 1998. V. 32. P. 3379.
Marwood C., Solomon K.R., Grinberg B.M. Chlorophyll fluorescence as a bioindicator of effects on growth in aquatic macrophytes from mixtures of polycyclic aromatic hydrocarbons // SETAC. 2001. V. 20. P. 890.
Kumerova M., Zezulka S., Krulova J., Triska J. Evaluation of fluoranthene phytotoxicity in pea plants by Hill reaction and chlorophyll fluorescence // Chemosphere. 2006. V. 65. P. 489.
Kumerova M., Zezulka S., Krolova J., Triska J. Photoinduced toxicity of fluoranthene on primary processes of photosynthesis in lichens // Lichenologist. 2007. V. 39. P. 91.
Lankin A.V., Kreslavski V.D., Khudyakova A.Vu., Zharmukhamedov S., Allakhverdiev S.I. Effect of naphthalene on photosystem 2 photochemical activity of pea plants // Biochemistry (Moscow). 2014. V. 79. P. 1493.
Jajoo A., Mekala N., Tomar R.S., Grieco M.,Tikkanen M., Aro E.M. Inhibitity effects of polycyclic aromatic hydrocarbons (PAHs) on photosynthetic performance are not related to their aromaticity // J. Photochem. Photobiol. B: Biol. 2014. V. 137. P. 151.
Wedding J.B., Carlson R.,W., Stukel J.J., Bazzaz F.A. Aerosol deposition on plant leaves // Environ. Sci. Technol. 1975. V. 9. P. 151.
Bakker M. I., Vorenhout M., SiJm D.T.M., Kolloffel C. Dry deposition of atmospheric polycyclic aromatic hydrocarbons in three Plantago species // Environ. Toxicol. Chem. 1999. V. 18. P. 2289.
Балахнина Т.И., Кособрюхов А.А., Иванов А.А., Креславский В.Д. Влияние кадмия на СО2 газообмен, переменную флуоресценцию хлорофилла и уровень антиоксидантных ферментов в листьях Pisum sativum // Физиология растений. 2005. Т. 52. С. 21.
Tomar R.S., Jajoo A.A. Quik investigation of the detrimental effects of environmental pollutans polycyclic hydrocarbon fluoranthrene on the photosynthetic efficiency wheat (Triticum aestivum) // Ecotoxicology. 2013. V. 22. P. 1313.
Shen Y., Li J., Gu R., Yue C., Zhan X., Xing B. Phenanthrene-triggered chlorosis is caused by elevated chlorophyll degradation and leaf moisture // Environ. Pollut. 2017. V. 220. P. 1311.
Perlman R.S., Yalkowsky S.H., Banerjee S. Water solubilities of polynuclear aromatic and heteroaromatic compounds // J. Phys. Chem. 1984. V. 13. P. 555.
Федотов Ю.В., Белов М.Л., Матросова О. А., Городничев В.А. Исследование спектров флуоресценции нефтяных загрязнений и природных образований при возбуждении на длине волны 266 нм // Известия высших учебных заведений. Физика. 2012. Т. 55. С. 105.
Kreslavski V.D., Brestic M., Zharmukhamedov S.K., Lubimov V.Yu., Lankin A.V., Jajoo A., Allakhverdiev S.I. Mechanisms of inhibitory effects of polycyclic aromatic hydrocarbons in the photosynthetic primary processes in pea leaves and thylakoid preparations // Plant. Biol. 2017. V. 19. P. 683.
Peter G.F., Thornberg J.P. Biochimical composition and organization of higher plant Photosystem II light-harvesting pigment-proteins // J. Biol. Chem. 1991. V. 266. P. 16745.
Wu P., Brand L. Resonance energy transfer: methods and applications // Analytical Biochemistry. 1994. V. 218. P. 1.
Simonich S., Hites R.A. 1994. Importance of vegetation in removing polycyclic aromatic hydrocarbons from the atmosphere // Nature. 1994. V. 370. P. 49.
Kreslavski V.D., Lankin A.V., Vasilyeva G.K., Luybimov V.Yu., Semenova G.N., Schmitt F.-J., Friedrich T., Allakhverdiev S.I. Effects of polyaromatic hydrocarbons on photosystem II activity in pea leaves // Plant Physiol. Biochem. 2014. V. 81. P. 135.
Сергейчик С.А., Гвардиян В.Н., Сергейчик А.А., Мышковец Е.Н., Ходасевич Э.В. Влияние атмосферных загрязнителей на фотосинтез древесных растений // Бот. журнал. 1989. V. 74(18). С. 736.
Qu Y.G., Qin X.C., Wang W.F., Li. L.B., Kuang T.V. Energy transfer of aromatic acid in Photosystem 2 core antenna complexes CP43 and CP47 // Photosynthetica. 2007. V. 45. N. 2. P. 266.
Luo L., Lai X. Chen B., Lin L., Fang L., Tam N.F., Luan T. Chlorophyll catalyse the phototransformation of carcinogenic benzo-a-pyrene in water // Sci. Rep. 2015. V. 5. P. 12776. https://doi.org/10.1038/srep12776
Pierlot C., Hajjam S., Barthelemy C., Aubry J-M. Water-soluble naphthalene derivatives as singlet oxygen (1O2) carriers for biological media // J. Photochem. Photobiol. B: Biol. 1996. V. 36. P. 31.
Pierlot C., Briviba K., Aubry J-M., Sies H. Naphtalene endoperoxides as generators of singlet oxygen in biological media // Method. Enzymol. 2000. V. 319. P. 3.
Muller K. and Ziereis K. Naphthalenes as water-soluble singlet oxygen carriers and detectors: Hydrophobic and kinetic properties // Arch. Pharm. (Weinheim). 1992. V. 325. P. 219.
Liu H., Weisman D., Ye Y.B., Cui B., Huang Y.H., Colon-Carmona A., Wang Z.H. An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in Arabidopsis thaliana // Plant Sci. 2009. V. 176. P. 357.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


