Физиология растений, 2020, T. 67, № 4, стр. 389-399
Влияние синтетических аналогов ауксинов – 2,4-Д и α-НУК – на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris L.
С. В. Томилова a, b, *, М. Т. Ханды a, Д. В. Кочкин a, b, Б. А. Галишев c, А. Г. Клюшин b, А. М. Носов a, b
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
b Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К. А. Тимирязева Российской академии наук
Москва, Россия
c Федеральное государственное автономное образовательное учреждение высшего образования
“Уральский федеральный университет имени первого Президента России Б. Н. Ельцина”
Екатеринбург, Россия
* E-mail: lanatomilova@yandex.ru
Поступила в редакцию 05.11.2019
После доработки 20.12.2019
Принята к публикации 23.12.2019
Аннотация
Изучено влияние синтетических аналогов ауксинов – 2,4-дихлорфеноксиуксусной (2,4-Д) и α‑нафтилуксусной (α-НУК) кислот – на ростовые характеристики и накопление стероидных гликозидов в суспензионной культуре клеток якорцев стелющихся Tribulus terrestris L. Установлено, что замена в среде выращивания 2,4-Д на α-НУК приводила к повышению в культивируемых клетках как уровня содержания стероидных гликозидов (до 6 раз), так и к увеличению их структурного разнообразия (девять идентифицированных олигофуростанозидов на среде с α-НУК по сравнению с пятью на среде с 2,4-Д). Положительное влияние α-НУК на биосинтетические характеристики суспензионной культуры клеток якорцев сопровождалось изменением морфологии клеток (цитодифференцировкой), их агрегированности и постепенным снижением (в течение 3–4 циклов выращивания) жизнеспособности культуры, вплоть до ее гибели. Одновременное присутствие двух синтетических аналогов ауксинов (α-НУК и 2,4-Д) в среде выращивания также приводило к увеличению содержания в клетках T. terrestris стероидных гликозидов, но в меньшей степени (до 3 раз), однако при этом культура имела относительно стабильный рост и высокую жизнеспособность. Сделан вывод об альтернативном влиянии двух аналогов ауксинов на рост клеток высших растений in vitro и биосинтез веществ специализированного обмена: 2,4-Д способствует пролиферации клеток, тогда как α-НУК вызывает цитодифференцировку и активирует образование вторичных соединений. Этот вывод подтверждается данными по изучению культур клеток других видов лекарственных растений, накапливающих иные группы вторичных метаболитов. Например, в экспериментах с культурой клеток женьшеня Panax ginseng C.A.Mey замена в среде выращивания 2,4-Д на α-НУК приводила к увеличению уровня содержания и разнообразия тритерпеновых гликозидов (гинзенозидов) с одновременным увеличением агрегированности клеток и снижением жизнеспособности культуры. В свою очередь, при сопоставлении образования стероидных гликозидов в культуре клеток якорцев стелющихся с длительно (более 40 лет) выращиваемой культурой клеток диоскореи дельтовидной Dioscorea deltoidea Wall. было показано, что в обеих культурах происходило накопление только способствующих пролиферации клеток фуростаноловых (но не спиростаноловых) гликозидов. При этом в культуре клеток диоскореи высокий уровень содержания олигофуростанозидов (до 12% к сухой массе клеток) наблюдался на среде с 2,4-Д. Таким образом, результаты изучения образования фуростаноловых гликозидов в культивируемых клетках высших растений свидетельствуют о многофакторной системе регулирования вторичного метаболизма в клетках in vitro. Разные синтетические аналоги ауксинов могут оказывать альтернативное влияние на ростовые и биосинтетические процессы. В то же время, длительное выращивание культуры приводит к автоселекции клеток со способствующими пролиферации свойствами – в частности, к высокому содержанию фуростаноловых гликозидов.
ВВЕДЕНИЕ
Культуру клеток высших растений рассматривают как экспериментально созданную уникальную биологическую систему. Она дает широкие возможности для изучения разнообразных физиологических процессов, которые происходят на клеточном уровне. Помимо фундаментальной значимости, культуры клеток могут иметь практическое применение в биотехнологии как источник экологически чистого растительного сырья, содержащего ценные биологически активные вещества – вторичные метаболиты. Есть много сведений о том, что для клеток растений in vitro характерен целый набор специфических особенностей, вследствие которых многие физиологические процессы в них, в частности, вторичный метаболизм, имеют существенные отличия по сравнению с интактными растениями. Это обусловлено уникальными свойствами клеток, живущих вне организма – их дедифференцированным состоянием, постоянной пролиферацией и популяционными механизмами развития системы [1].
Специфика культуры клеток высших растений как биологической системы позволяет использовать ее для исследования механизмов клеточного регулирования вторичного метаболизма. К настоящему времени исследованы многие факторы, влияющие на этот процесс – прежде всего сигналы, которые в клетках интактных растений могут запускать вторичный метаболизм. К подобным сигналам можно отнести элиситоры, стрессовые воздействия, изменение состава и содержания регуляторов роста [1]. Есть сведения, что существенную роль в процессах образования вторичных метаболитов в клетках растений in vitro играет качественный и количественный состав, а также соотношение фитогормонов (прежде всего ауксинов и цитокининов или их синтетических аналогов) в среде культивирования [1, 2]. Однако в зависимости от вида культуры клеток и типа образуемых соединений влияние этих факторов на процесс вторичного метаболизма может быть различным, а общие закономерности к настоящему времени неизвестны.
В наших предыдущих работах с культурами клеток женьшеня показано, что мощным фактором, влияющим на образование вторичных метаболитов, является состав и количество ауксинов (или их синтетических аналогов) в среде выращивания. Для культуры клеток женьшеня Panax ginseng C.A.Mey замена 2,4-Д на α-НУК привела к существенному увеличению содержания в клетках тритерпеновых гликозидов (гинзенозидов) [2]. В то же время, для длительно выращиваемой (более 40 лет) культуры клеток диоскореи Dioscorea deltoidea Wall. интенсивное образование фуростаноловых гликозидов (до 12% к сухой массе клеток) обеспечивает использование только 2,4-Д [1]. В связи с этим принципиально важно исследование закономерностей влияния качественного и количественного состава ауксинов или их синтетических аналогов на образование конкретных типов вторичных метаболитов в различных культурах клеток.
Якорцы стелющиеся Tribulus terrestris L. (Zygophyllaceae R.Br.) синтезируют широкий спектр стероидных гликозидов, которые обладают высокой биологической активностью (сердечно-сосудистой, цитотоксической, противомикробной) и используются при лечении различных заболеваний [3–5]. Рядом исследователей получены культуры клеток T. terrestris и изучены их свойства, в том числе образование вторичных метаболитов [6, 7]. Ранее нами были получены каллусная и суспензионная культуры клеток якорцев стелющихся, определены их ростовые параметры и показано наличие в клетках in vitro двух фуростаноловых гликозидов. В суспензионных культурах клеток исследовано влияние тяжелых металлов (ионов меди) на состав и содержание стероидных гликозидов [8, 9].
Цель работы – изучение влияния состава синтетических аналогов ауксинов 2,4-Д и α-НУК в среде выращивания на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использована суспензионная культура клеток якорцев стелющихся Tribulus terrestris L. (штамм Tter 8 коллекционный №81 во Всероссийской коллекции культур клеток высших растений (ВККК ВР)), которая была получена М.Т. Ханды с коллегами в Институте физиологии растений им. К.А.Тимирязева РАН в 2014 г. из каллусной культуры клеток, индуцированной из семян растения T. terrestris американской популяции (“Forever Seeds Company”, США) [8].
Для культивирования использовали среду Мурасиге и Скуга (MS), приготовленную по прописи [10] с добавлением гидролизата казеина (0.5 г/л), инозитола (0.1 г/л) и 3% сахарозы (“Merck”, Германия). Для экспериментов среды дополняли разными сочетаниями регуляторов роста: 2,4-Д, БАП, и α-НУК (“Merck”, Германия). Диапазон используемых концентраций регуляторов роста в средах составил от 0.5 до 2.0 мг/л. Культивирование проводили в колбах объемом 250 мл (33–35 мл суспензии в колбе) на ротационном шейкере (100 об/мин) в темноте при 26°С. Цикл выращивания суспензионной культуры клеток T. terrestris составлял 14 дней. Для пересева применяли соотношение инокулюм : свежая среда равное 1 : 10.
Для характеристики суспензионных культур клеток использовали жизнеспособность клеток и содержание сырой и сухой биомассы в 1 л среды. Жизнеспособность культур клеток определяли с помощью окрашивания клеток прижизненным красителем феносафранином (0.1% раствор) (“Merck”, Германия) путем подсчета живых (неокрашенных) и мертвых (окрашенных) культивируемых единиц под микроскопом. Для определения сырой и сухой биомассы фиксированный объем суспензии (не менее 30 мл в трех биологических повторностях) фильтровали под вакуумом через бумажный фильтр с помощью воронки Бюхнера. Биомассу высушивали методом сублимационного обезвоживания [11].
Микрофотографии суспензионных культур клеток сделаны с помощью цифровой камеры Levenhuk D2L 0.3 Мпикс (США).
Для качественного анализа стероидных гликозидов в исследуемых вариантах культуры клеток использовали ТСХ в силикагеле и ультраэффективную жидкостную хроматографию с масс-спектрометрическим детектированием при ионизации электрораспылением (УЭЖХ ЭР МС).
Общую экстракцию стероидной фракции проводили из лиофилизированной биомассы 70% этанолом (соотношение биомасса : растворитель – 1 : 40 (масса : объем)) на ультразвуке 3 раза по 30 мин при комнатной температуре (УЗ-ванна “Сапфир”, Россия). Объединенный экстракт упаривали досуха под вакуумом при 55°С и растворяли в воде. Полученный раствор наносили на патрон для твердофазной экстракции Supelclean ENVI-18 (“Supelco”, США). Затем патрон последовательно промывали водой и 70% этанолом. Спиртовую фракцию упаривали досуха под вакуумом при 55°С и использовали для химического анализа.
Для анализа методом ТСХ очищенную фракцию стероидных гликозидов растворяли в 70% этаноле (0.5–1 мл) и 30 мкл экстракта наносили на хроматографическую пластинку Kieselgel 60 (“Merck”, Германия). В качестве образца сравнения использовали 1% раствор препарата дельтостима, который представляет собой очищенную смесь фуростаноловых гликозидов (протодиосцин, 25(S)-протодиосцин, дельтозид и 25(S)-дельтозид) из биомассы суспензионной культуры клеток Dioscorea deltoidea Wall. [1]. Раствор дельтостима на хроматограмму наносили в объеме 10 мкл. Для разделения фуростаноловых гликозидов использовали систему растворителей хлороформ : метанол : вода (65 : 35 : 10, по объему). Проявление хроматограммы проводили 1% раствором реактива Эрлиха (п‑диметиламинобензальдегид, “Merck”, Германия) в смеси концентрированная соляная кислота : этанол – 34 : 66, по объему) с последующим прогреванием пластинки при 100°С в течение 5 мин. Фуростаноловые гликозиды обнаруживались в виде розово-красных пятен.
Для качественного анализа стероидных гликозидов методом УЭЖХ ЭР МС пробу растворяли в смеси ацетонитрил : вода (50:50, по объему) и фильтровали через нейлоновый фильтр с порами 0.2 мкм (“Acrodisc”, Германия). УЭЖХ ЭР МС проводили на хроматографе Waters Aсquity UPLC (“Waters”, США). Пробу в объеме 0.5–1 мкл наносили на колонку ACQUITY UPLC BEH Phenyl (50 × 2.1 мм, 1.7 мкм, “Waters”, Ирландия). Температура колонки составляла 40°С, объемная скорость потока подвижной фазы – 0.4 мл/мин. В качестве подвижной фазы использовали 0.1% (по объему) раствор муравьиной кислоты в воде и 0.1%-ный (по объему) раствор муравьиной кислоты в ацетонитриле. Хроматографическое разделение проводили в режиме градиентного элюирования. В процессе анализа состав подвижной фазы менялся следующим образом (ацетонитрил, % по объему): 0–7 мин – 19%, 7–17 мин – 19 → 35%, 17–23 мин – 35 → 45%, 23–27 мин – 45 → 55%, 27–33 мин – 55 → 65%, 33–33.5 мин – 65 → 95%, 33.5–35 мин – 95%, 35–35.5 мин – 95 → 19%, 35.5–37 – 19%. Анализ осуществляли в режиме детектирования положительных ионов (диапазон m/z 100–1500). Параметры источника ионизации: температура источника ионизации – 120°С, температура десольвации – 250°С, напряжение на капилляре – 3.0 кВ, напряжение на конусе ввода пробы – 30 В, скорость подачи азота (десольвационный газ) 600 л/ч. Обработку полученных результатов производили с помощью программы MassLynx (“Waters”, США).
Для количественного анализа применяли спектрофотометрический метод, разработанный нами ранее [9]. 0.4 мл спиртового экстракта отбирали в пробирки Эппендорф. К экстракту добавляли 1.0 мл реактива Эрлиха (1% раствор п-диметиламинобензальдегида в смеси концентрированная соляная кислота : этанол – 34:66, по объему). Пробирки закрывали и помещали в термостат при 50 ± 1°С на 2 ч. После охлаждения пробирок проводили измерение оптической плотности на спектрофотометре “Униплан” (ЗАО “Пикон”, Россия) при 520 нм. Концентрацию фуростаноловых гликозидов вычисляли по калибровочному графику, построенному по препарату “Дельтостим” (смесь фуростаноловых гликозидов, выделенных из биомассы культуры клеток Dioscorea deltoidea).
Определение ростовых и физиологических характеристик (содержание сырой и сухой биомассы, жизнеспособность клеток) проводили в трех биологических повторностях. Количественное содержание фуростаноловых гликозидов определяли в индивидуальном экстракте без учета биологических и аналитических повторностей. На графиках представлены средние значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Для выращивания суспензионной культуры клеток T. terrestris использовали питательные среды с разным составом фитогормонов (α-НУК (1–2 мг/л) – БАП (0.5–2 мг/л)), контрольная среда содержала 2,4-Д (2 мг/л) – БАП (1 мг/л). В результате проведенных экспериментов было показано, что в течение первого цикла культивирования у большинства вариантов не наблюдалось достоверно значимых изменений в накоплении сырой и сухой биомассы по сравнению с контролем (рис. 1). Стоит отметить, что у варианта с 1 мг/л α-НУК и 0.5 мг/л БАП наблюдали более высокий прирост биомассы по сравнению с контролем и другими вариантами.
Рис. 1.
Содержание сырой (а), сухой (б) биомассы и жизнеспособность клеток (в) на 7 и 14 сутки культивирования суспензионной культуры T. terrestris на средах с различным составом регуляторов роста: 1 – 2 мг/л 2,4-Д и 1 мг/л БАП (контроль); 2 – 1 мг/л α-НУК и 0.5 мг/л БАП; 3 – 1 мг/л α-НУК и 1 мг/л БАП; 4 – 1 мг/л α-НУК и 2 мг/л БАП; 5 – 2 мг/л α-НУК и 2 мг/л БАП; 6 – 2 мг/л α-НУК и 1 мг/л БАП.
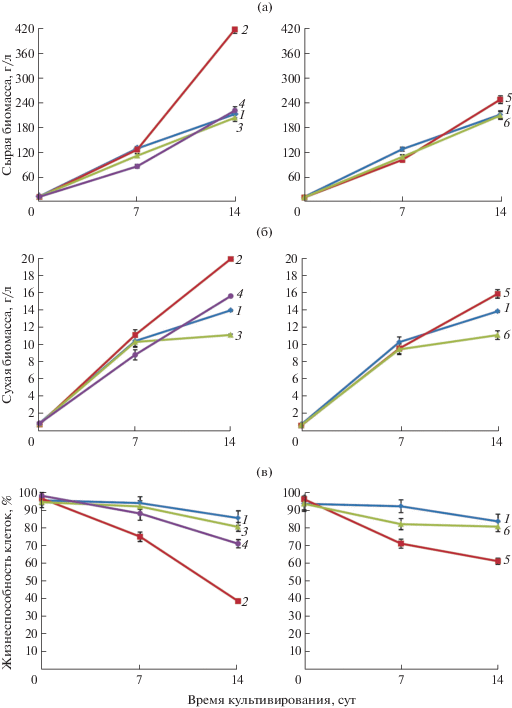
Несмотря на то, что в первом цикле выращивания замена 2,4-Д на α-НУК практически не влияла на ростовые характеристики суспензионной культуры T. terrestris, во всех экспериментальных вариантах (среды с α-НУК) отмечено снижение жизнеспособности клеток. Наиболее значительное падение этого показателя (менее 40% жизнеспособных клеток к концу периода культивирования) наблюдали для варианта с 1 мг/л α-НУК и 0.5 мг/л БАП (рис. 1).
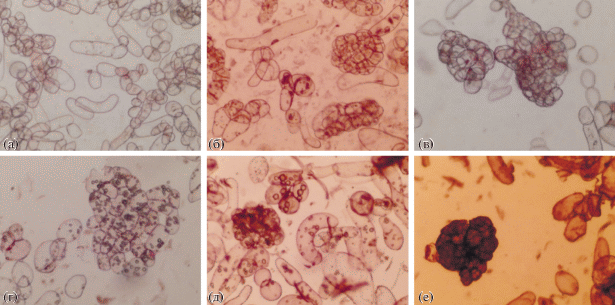
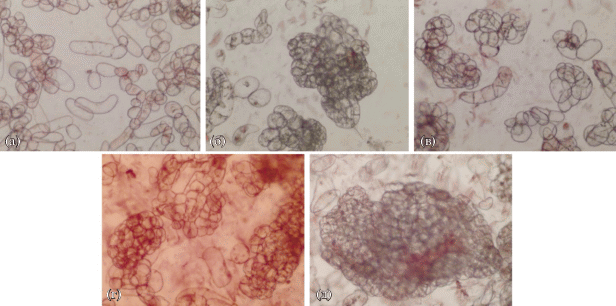
Для дальнейшего изучения ростовых характеристик в течение трех последовательных циклов культивирования использовали два варианта сред: 2 мг/л α-НУК – 1 мг/л БАП, 1 мг/л α-НУК – 1 мг/л 2,4-Д – 1 мг/л БАП. У суспензионной культуры клеток T. terrestris, которую выращивали на среде с 2 мг/л α-НУК и 1 мг/л БАП, наблюдали значительное изменение ростовых характеристик в течение трех последовательных циклов культивирования (рис. 2). Стоит отметить, что в третьем цикле выращивания рост культуры практически прекращался и происходило сильное падение жизнеспособности клеток (ниже 50%). К тому же выращивание культуры клеток с α-НУК в качестве ауксина, видимо, приводило к увеличению длительности цикла культивирования, т. к. на втором цикле выращивания максимум накопления сырой и сухой биомассы был отмечен только на 21 сутки. В течение трех циклов выращивания наблюдали образование крупных, плотных агрегатов и увеличение количества аномальных клеток (рис. 3).
Рис. 2.
Кривые роста по накоплению сырой (а), сухой (б) биомассы и жизнеспособность клеток (в) трех циклов выращивания суспензионной культуры T. terrestris на среде с 2 мг/л α-НУК и 1 мг/л БАП: 1 – контроль (среда с 2 мг/л 2,4-Д и 1 мг/л БАП); 2 – 1 цикл; 3 – 2 цикл; 4 – 3 цикл.
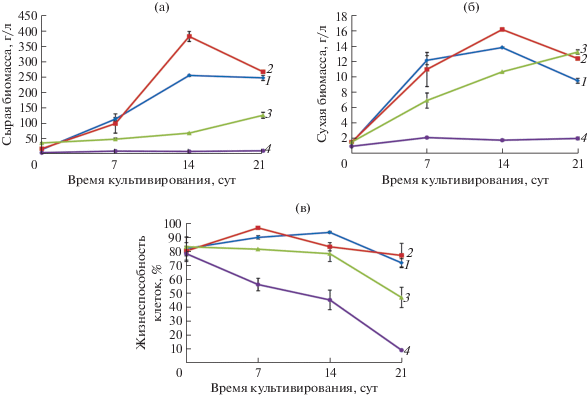
Рис. 3.
Микрофотографии суспензионной культуры клеток T. terrestris в различных циклах выращивания на среде с 2 мг/л α-НУК и 1 мг/л БАП: (а) – контроль, 14 сут (среда с 2 мг/л 2,4-Д и 1 мг/л БАП); (б) – 1 цикл, 7 сут; (в) –1 цикл, 14 сут; (г) – 2 цикл, 7 сут; (д) – 2 цикл, 14 сут; (е) – 3 цикл, 14 сут.
Для суспензионной культуры клеток T. terrestris, которую выращивали на среде с одновременным присутствием как 2,4-Д (1 мг/л), так и α‑НУК (1 мг/л), значимого снижения накопления сырой и сухой биомассы в течение трех циклов культивирования достоверно не отмечено, что, видимо, связано с наличием, помимо α-НУК, в питательной среде и 2,4-Д (рис. 4). В этом варианте также наблюдали повышение агрегированности культуры клеток (рис. 5), но при этом клетки сохраняли высокую жизнеспособность (80–90%) и стабильный рост на протяжении всех трех циклов выращивания.
Рис. 4.
Кривые роста по накоплению сырой (а), сухой (б) биомассы и жизнеспособность клеток (в) трех циклов выращивания суспензионной культуры T. terrestris на среде с 1 мг/л 2,4-Д, 1 мг/л α-НУК и 1 мг/л БАП: 1 – контроль (среда с 2 мг/л 2,4-Д и 1 мг/л БАП); 2 – 1 цикл; 3 – 2 цикл; 4 – 3 цикл.
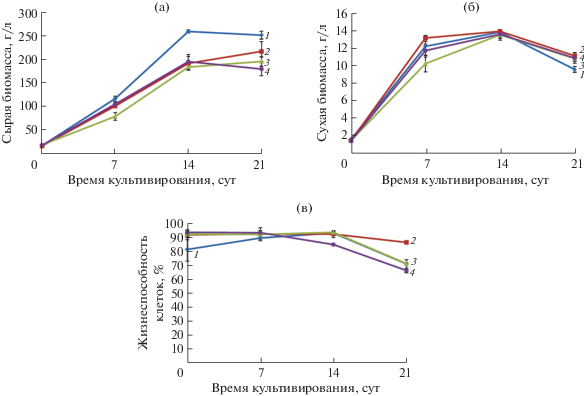
Рис. 5.
Микрофотографии суспензионной культуры клеток T. terrestris в разных циклах выращивания на среде с 1 мг/л 2,4-Д, 1 мг/л α-НУК и 1 мг/л БАП: (а) – контроль, 14 сут (среда с 2 мг/л 2,4-Д и 1 мг/л БАП); (б) – 1 цикл, 7 сут; (в) – 1 цикл, 14 сут; (г) – 2 цикл, 14 сут; (д) – 3 цикл, 14 сут.
Качественный фитохимический анализ стероидных гликозидов методом ТСХ (специфическая розовая окраска пятен с реактивом Эрлиха) показал наличие фуростаноловых гликозидов (ФГ) во всех образцах биомассы суспензионной культуры T. terrestris. В экстракте из биомассы культуры клеток, выращенной в присутствии только α-НУК в качестве ауксина, обнаруживалось от 2 до 7 (в разных образцах) соответствующих ФГ пятен розово-красного цвета. В контрольном варианте (среда с 2 мг/л 2,4-Д и 1 мг/л БАП) обнаруживались только два соответствующих слабоокрашенных пятна этих соединений. На ТСХ хроматограммах экстрактов из биомассы культуры клеток, выращенной на средах с одновременным присутствием 2,4-Д и α-НУК, также выявлялись только два пятна фуростаноловых гликозидов.
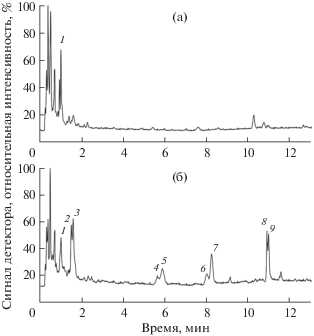
Для структурной идентификации обнаруженных соединений был проведен УЭЖХ ЭР МС анализ очищенных экстрактов. УЭЖХ ЭР МС хроматограммы (записанные в режиме полного ионного тока при регистрации положительных ионов) экстрактов из биомассы контрольного варианта культуры (2 мг/л 2,4-Д и 1 мг/л БАП, 14 сутки выращивания), а также культуры, выращенной на среде с α-НУК (2 мг/л α-НУК и 1 мг/л БАП, 2 цикл, 14 сутки выращивания) представлены на рисунке 6.
Рис. 6.
УЭЖХ ЭР МС хроматограммы (записаны в режиме полного ионного тока при регистрации положительных ионов) экстрактов из биомассы суспензионной культуры клеток T. terrestris: а – контрольный вариант (2 мг/л 2,4-Д и 1 мг/л БАП, 14 сут выращивания); б – культура клеток, выращенная на среде с α‑НУК в качестве ауксина (2 мг/л α-НУК и 1 мг/л БАП, 2 цикл, 14 сут выращивания). Номера 1–9 – пики идентифицированных гликозидов (табл. 1).
Структурную идентификацию соединений проводили на основании расшифровки результатов масс-спектрометрии (фрагментации протонированных молекул гликозидов в источнике ионизации), анализа относительного хроматографического поведения соединений и сопоставления этих результатов с данными литературы [12, 13]. Результаты идентификации представлены в таблице 1. Обнаруженные соединения обозначены номерами 1–9 в соответствии с порядком увеличения их гидрофобности (времени удерживания на обращенной фазе хроматографической колонки).
Таблица 1.
Результаты УЭЖХ ЭР МС анализа (регистрация положительных ионов) экстрактов из биомассы суспензионной культуры клеток T. terrestris
| Номер пика | tR, мин* | Масс-спектры, m/z** | Результаты идентификации | ||
|---|---|---|---|---|---|
| [M–H2O + H]+ | [M + Na]+ | Осколочные ионы | |||
| 1 | 1.03 | 1241.6 | 1281.6 | 1079.5, 917.5, 755.4, 593.4, 431.3 | Пентагексозил-гидрокси-диосгенин (фуростаноловая форма) |
| 2 | 1.52 | 1243.6 | 1283.6 | 1081.6, 919.5, 757.4, 595.4, 433.3 | Пентандрозид F |
| 3 | 1.61 | 1243.6 | 1283.6 | 1081.6, 919.5, 757.4, 595.4, 433.3 | 25(R)-пентандрозид F |
| 4 | 5.63 | 1227.6 | 1267.6 | 1065.6, 903.5, 741.4, 579.4, 561.4, 417.3 | Гексозил-25(S)-террестрозин H |
| 5 | 5.88 | 1227.6 | 1267.6 | 1065.6, 903.5, 741.4, 579.4, 561.4, 417.3 | Гексозил-25(R)-террестрозин H |
| 6 | 7.99 | 1049.5 | 1089.5 | 903.5, 887.5, 741.4, 725.4, 579.4, 417.3 | 25(S)-прототеррестрозин B |
| 7 | 8.22 | 1049.5 | 1089.5 | 903.5, 887.5, 741.4, 725.4, 579.4, 417.3 | 25(R)-прототеррестрозин B |
| 8 | 10.88 | 1313.6 | 1353.6 | 1181.6, 1167.6, 1049.6, 1035.5, 1019.6, 903.5, 887.5, 873.5, 741.4, 579.4, 417.3 | Террестринин B |
| 9 | 10.95 | 1313.6 | 1353.6 | 1181.6, 1167.6, 1049.6, 1035.5, 1019.6, 903.5, 887.5, 873.5, 741.4, 579.4, 417.3 | 25(R)-террестринин B |
Результаты масс-спектрометрии (наличие характеристических осколочных ионов) свидетельствуют о том, что обнаруженные соединения являются производными трех разных агликонов [3, 12, 13]: соединение 1 – производное гидрокси-диосгенина (характеристический ион – m/z 431), соединения 2–3 – производные гитогенина/неогитогенина (характеристический ион – m/z 433), соединения 4–9 – производные тигогенина/неотигогенина (характеристический ион – m/z 417). Сравнение хроматографического поведения обнаруженных гликозидов с данными литературы подтверждает справедливость этих выводов. Элюирование стероидных гликозидов на обращенной фазе, прежде всего, зависит от структуры агликона [12, 14], при этом (вне зависимости от структуры углеводных цепей) производные, содержащие гидроксильные группы в циклической части молекулы (производные гидрокси-диосгенина и гитогенина/неогитогенина) вымываются с колонки раньше, чем незамещенные соединения (производные тигогенина/неотигогенина).
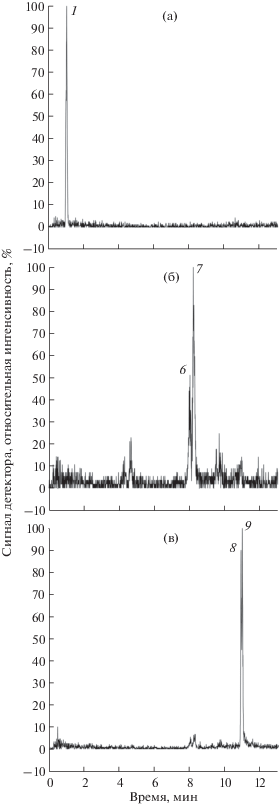
Наибольшее структурное разнообразие стероидных гликозидов (в общей сложности 9 соединений) было обнаружено в экстракте из биомассы культуры клеток T. terrestris, выращенной на среде с α-НУК. При этом в биомассе контрольного варианта культуры было выявлено только 5 гликозидов (соединения 1, 6–9). Стоит отметить, что интенсивность сигналов стероидных гликозидов на хроматограмме экстракта из биомассы контрольного варианта достаточно низкая. В связи с этим, хроматографические пики некоторых гликозидов (соединения 6–9) на данной хроматограмме удалось обнаружить только после фильтрации полного ионного тока по сигналам ионов с конкретными значениями m/z (рис. 7).
Рис. 7.
Результаты фильтрации сигнала полного ионного тока хроматограммы контрольного варианта суспензионной культуры клеток T. terrestris для ионов с m/z 1079.5 (а), 1049.5 (б) и 887.5 (в). Номера 1, 6–9 – пики идентифицированных гликозидов (табл. 1).
Таким образом, с помощью УЭЖХ ЭР МС анализа в биомассе суспензионной культуры клеток T. terrestris были идентифицированы 9 фуростаноловых гликозидов с тремя различными агликонами. Важно, что все обнаруженные гликозиды имеют фуростаноловую структуру. Ранее при изучении культур клеток диоскореи дельтовидной было высказано предположение, что отличительной чертой культивируемых in vitro клеток растений-продуцентов стероидных гликозидов (по сравнению с интактными растениями) является накопление именно гидрофильных и нетоксичных фуростаноловых форм этих соединений [1]. Полученные в ходе настоящего исследования результаты о структурном разнообразии стероидных гликозидов в культуре клеток T. terrestris подтверждают это предположение и свидетельствуют об общем характере данной закономерности.
Количественное содержание стероидных гликозидов в суспензионной культуре клеток T. terrestris определяли спектрофотометрическим методом для вариантов 2 мг/л α-НУК – 1 мг/л БАП и 1 мг/л 2,4-Д – 1 мг/л α-НУК – 1 мг/л БАП. Анализ осуществляли в течение трех циклов культивирования (для первого цикла на 7 и 14 сутки выращивания, для второго и третьего циклов на 14 сутки выращивания). Результаты представлены в таблице 2.
Таблица 2.
Количественное содержание фуростаноловых гликозидов (ФГ) в биомассе суспензионной культуры клеток T. terrestris, выращенной на средах с различным составом регуляторов роста
| Комбинация фитогормонов | Период культивирования | Содержание ФГ, мг/г сухой массы |
|---|---|---|
| Контроль: 2 мг/л 2,4-Д, 1 мг/л БАП | 14 сут | 1.02 |
| 2 мг/л α-НУК, 1 мг/л БАП | 1 цикл, 7 сут | 3.41 |
| 1 цикл, 14 сут | 6.79 | |
| 2 цикл, 14 сут | 1.59 | |
| 3 цикл, 14 сут | 1.31 | |
| 1 мг/л 2,4-Д, 1 мг/л α-НУК, 1 мг/л БАП | 1 цикл, 7 сут | 0.99 |
| 1 цикл, 14 сут | 1.75 | |
| 2 цикл, 14 сут | 2.88 | |
| 3 цикл, 14 сут | 1.93 |
На питательных средах, в которых присутствовал только α-НУК, увеличение содержания ФГ в 3.3 раза наблюдали уже на 7 сутки первого цикла выращивания по сравнению с контролем (3.4 и 1.0 мг/г сухой массы соответственно). Максимальное повышение концентрации в 6.6 раза зафиксировано на 14 сутки первого цикла выращивания (6.8 мг/г сухой массы). В дальнейшем содержание ФГ снижалось, что, по-видимому, связано с ухудшением роста и падением жизнеспособности культуры клеток, но было в 1.3–1.6 раза выше, чем в контроле.
Для варианта суспензионной культуры клеток T. terrestris, выращенной на комбинации из двух ауксинов 2,4-Д и α-НУК, на 7 сутки первого цикла выращивания увеличение содержания ФГ не происходило, на 14 сутки оно повышалось в 1.7 раза по сравнению с контролем (1.8 и 1.0 мг/г сухой массы соответственно). Максимальное увеличение концентрации ФГ в 2.8 раза отмечено на 14 сутки второго цикла выращивания (2.9 мг/г сухой массы). В дальнейшем показатель немного снижался, но был примерно в 2 раза больше, чем в контрольной культуре клеток, выращиваемой на среде с 2,4-Д.
ОБСУЖДЕНИЕ
На основании полученных результатов можно заключить, что изменение в среде выращивания культуры клеток якорцев стелющихся состава синтетических аналогов ауксинов, а именно замена 2,4-Д на α-НУК, может стимулировать образование в клетках in vitro стероидных гликозидов. Важно отметить ряд особенностей влияния подобной замены.
1. Замена 2,4-Д на α-НУК влияет не только на увеличение уровня содержания соединений (повышение до 6 раз), но и на их качественный состав (девять идентифицированных олигофуростанозидов на среде с α-НУК по сравнению с пятью на среде с 2,4-Д).
2. Повышение качественного и количественного содержания стероидных гликозидов сопровождается изменением морфологии клеток, изменением их агрегированности и постепенным снижением жизнеспособности культуры вплоть до ее гибели.
Установленные закономерности практически идентичны показанным ранее при аналогичной замене 2,4-Д на α-НУК для культуры клеток женьшеня P. ginseng [2], но для другого класса соединений. В случае с культурой клеток женьшеня расширялся качественный состав и повышалось количественное содержание не стероидных, а тритерпеновых гликозидов (гинзенозидов). Можно предположить, что α-НУК может выступать в роли сигнальной молекулы, которая способна приводить к быстрой стимуляции синтеза вторичных метаболитов в клетке (подобно стрессовому воздействию или элиситации) и параллельно вызывать дифференцировку клеток (многие вторичные метаболиты синтезируются в специализированных структурах растения). Для этих процессов, вероятно, важна не химическая структура метаболитов (тритерпеновые или стероидные гликозиды), а их функциональная значимость (например, участие в ответе на стресс, антиоксидантная активность и др.). Можно также предположить, что первичной реакцией на замену “ауксиновых” регуляторов роста может быть изменение физиологического статуса клетки (ее дифференцировка, взаимодействие с другими клетками – агрегированность), что индуцирует образование вторичных метаболитов. Однако подобные предположения требуют корректной экспериментальной проверки.
Стоит отметить, что наличие в среде только α‑НУК в качестве ауксина вызывало быструю активацию и повышение синтеза стероидных гликозидов, но приводило к существенному увеличению агрегированности культуры и, впоследствии, к ее гибели. Возможно, подобной реакцией объясняется динамика повышения содержания стероидных гликозидов в трех последовательных циклах культивирования: максимальный уровень в первом цикле и последующий спад во втором и третьем, в которых культура постепенно теряла жизнеспособность. Использование сочетания из двух синтетических аналогов ауксинов (α-НУК и 2,4-Д) не вызывало быстрой активации синтеза стероидных гликозидов, хотя приводило к постепенному увеличению их содержания в биомассе, при этом культура клеток характеризовалась относительно стабильным ростом и высокой жизнеспособностью, которая лишь незначительно снижалась к третьему циклу выращивания. Можно говорить о противоположном влиянии этих двух аналогов ауксинов на процессы пролиферации и дифференцировки клеток in vitro, что вполне согласуется с данными литературы [15].
Наконец, сопоставление образования стероидных гликозидов в культурах клеток диоскореи дельтовидной [1] и якорцах стелющихся позволяет обнаружить как сходства, так и различия образования вторичных метаболитов одного структурного класса в разных культурах. Обе культуры синтезируют только способствующие пролиферации клеток фуростаноловые, но не спиростаноловые гликозиды, тогда как для интактных растений характерно присутствие обеих форм этих соединений [3, 16]. Это подтверждает сделанные ранее предположения [16] о накоплении в клетках in vitro вторичных метаболитов, способствующих пролиферации клеток. Однако в культуре клеток D. deltoidea активному образованию фуростаноловых гликозидов способствует 2,4-Д, тогда как для T. terrestris – α-НУК. Вероятно, это можно объяснить тем, что культура клеток диоскореи дельтовидной – давно сформировавшаяся биологическая система (ее возраст – более 40 лет), в процессе образования которой постепенно отобрались активно делящиеся клетки, содержащие соединения, способствующие пролиферации (фуростаноловые гликозиды). Реализуется ли данная закономерность в культуре клеток якорцев, покажут дальнейшие исследования.
Работа выполнена при поддержке гранта Российского научного фонда № 19-14-00387.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Nosov A.M., Popova E.V., Kochkin D.V. Isoprenoid Production via Plant Cell Cultures: Biosynthesis, Accumulation and Scaling-Up to Bioreactors // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Ed. by K.Y. Paek, H.N. Murthy, J.J. Zhong. Dordrecht: Springer, 2014. P. 563.
Смоленская И.Н., Решетняк О.В., Смирнова Ю.Н., Черняк Н.Д., Глоба Е.Б., Носов А.М., Носов А.В. Противоположное влияние синтетических ауксинов – 2,4-дихлорфеноксиуксусной и 1-нафтилуксусной кислот на рост культуры клеток женьшеня настоящего и синтез гинзенозидов // Физиология растений. 2007. Т. 54. С. 243.
Kostova I., Dinchev D. Saponins in Tribulus terrestris – chemistry and bioactivity // Phytochemistry Reviews. 2005. V. 4. P. 111.
Angelova S., Gospodinova Z., Krasteva M., Antov G., Lozanov V., Markov T., Bozhanov S., Georgieva E., Mitev V. Antitumor activity of Bulgarian herb Tribulus terrestris L. on human breast cancer cells // J. BioSci. Biotechnol. 2013. V. 2. P. 25.
Al-Bayati F. A., Al-Mola H. F. Antibacterial and antifungal activities of different parts of Tribulus terrestris L. growing in Iraq // J. Zhejiang Univ. Sci. B. 2008. V. 9. P. 154.
Erhun W. O., Sofowora A. Callus induction and detection of metabolites in Tribulus terrestris L. // J. Plant Physiol. 1986. V. 123. P. 181.
Nikam T. D., Ebrahimi M. A., Patil V. A. Embryogenic callus culture of Tribulus terrestris L. a potential source of harmaline, harmine and diosgenin // Plant Biotechnol. Rep. 2009. V. 3. P. 243.
Ханды М.Т., Кочкин Д.В., Томилова С.В., Галишев Б.А., Суханова Е.С., Клюшин А.Г., Иванов И.М., Носов А.М. Получение и характеристика каллусных и суспензионных культур клеток якорцев стелющихся Tribulus terrestris L. – продуцента стероидных гликозидов // Биотехнология. 2016. Т. 32. С. 21.
Томилова С.В., Кочкин Д.В., Галишев Б.А., Носов А.М. Влияние повышенных концентраций ионов меди на ростовые характеристики и синтез стероидных гликозидов в суспензионной культуре клеток Tribulus terrestris L. // Биотехнология. 2019. Т. 35. С. 42.
Murashige T., Skoog F. A revised medium for rapid growth and bio-assays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. P. 473.
Носов А.М. Методы оценки и характеристики роста культур клеток высших растений // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. Москва: Бином. Лаборатория знаний, 2012. С. 386.
Zheng W., Wang F., Zhao Y., Sun X., Kang L., Fan Z., Qiao L., Yan R., Liu S., Ma B. Rapid Characterization of Constituents in Tribulus terrestris from Different Habitats by UHPLC/Q-TOF MS // J. Am. Soc. Mass Spectrom. 2017. V. 28. P. 2302.
Mulinacci N., Vignolini P., la Marca G., Pieraccini G., Innocenti M., Vincieri F.F. Food supplements of Tribulus terrestris L.: An HPLC-ESI-MS method for an estimation of the saponin content // Chromatographia. 2003. V. 57. P. 581.
Hamed A.I., Janda B., Mahalel U.A., Stochmal A., Oleszek W. Profiles of steroidal saponins from the aerial parts of Tribulus pentandrus, T. megistopterus subsp. pterocarpus and T. parvispinus by LC-ESI-MS/MS // Phytochem. Anal. 2012. V. 23. P. 613.
Campanoni P., Nick P. Auxin-Dependent Cell Division and Cell Elongation. 1-Naphthaleneacetic Acid and 2,4-Dichlorophenoxyacetic Acid Activate Different Pathways // Plant Physiol. 2005. V. 137. P. 939.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. P. 609.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


