Физиология растений, 2020, T. 67, № 4, стр. 378-388
Действие эффекторов Са2+-сигнальной системы и олигосахарина OSRG на ИУК-индуцируемое формирование адвентивных корней на эксплантах гипокотилей гречихи
И. А. Ларская a, *, О. В. Горшков a, О. И. Трофимова a, Т. А. Горшкова a
a Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр
“Казанский научный центр Российской академии наук”
Казань, Россия
* E-mail: pzl@mail.ru
Поступила в редакцию 20.11.2019
После доработки 25.12.2019
Принята к публикации 13.01.2020
Аннотация
Взаимодействие различных сигнальных путей при развитии корневой системы исследовали на примере влияния эффекторов Ca2+-сигналинга и стимулирующего ризогенез олигосахарина (OSRG) на ИУК-индуцируемое формирование адвентивных корней. Определение чувствительности стадий корнеобразования к ИУК, Са2+ и олигосахарину на культивируемых эксплантах гипокотилей гречихи (Fagopyrum esculentum Moench) показало, что действие Са2+, как и OSRG относится к ранним стадиям процесса формирования корней и предшествует действию гормона. Ауксин может быть внесен в среду с задержкой, но не позднее, чем через час после начала культивирования эксплантов, а Са2+ должен находиться в среде с самого начала культивирования. Количество ИУК-индуцированных адвентивных корней на сегментах гипокотилей гречихи уменьшалось при действии блокаторов Са2+-каналов (верапамил, дилтиазем), соединений, влияющих на высвобождение Са2+ из внутриклеточных хранилищ (рутениевый красный, неомицин), а также антагонистов кальмодулина (хлорпромазин, флуфеназин). С использованием блокатора кальциевых каналов (дилтиазем) показано, что эффект олигосахарина не зависел от функционирования потенциал-зависимых каналов плазмалеммы. Анализ данных профилирования транскриптома культивируемых эксплантов выявил в анализируемых образцах экспрессию 149 генов (TGR > 5), имеющих отношение к Са2+-сигналингу. Профиль экспрессии этих генов существенно менялся в ходе ИУК-индуцированного корнеобразования, при этом внесение OSRG оказывало эффект на экспрессию лишь некоторых из них.
ВВЕДЕНИЕ
Адвентивные корни – это корни, имеющие постэмбриональное происхождение и формирующиеся на поверхности стеблей, листьев, гипокотилей [1]. Их образование регулируется большим количеством экзогенных и эндогенных факторов, среди которых главенствующее место отводится ауксину – основному индуктору и ключевому элементу, объединяющему различные сигнальные пути, вовлеченные в процесс формирования корней [1]. Показано его взаимодействие практически со всеми фитогормонами, которое может носить либо синергический, либо антагонистический характер в зависимости от стадии развития корня [2]. Известно, что ауксин способствует адвентивному корнеобразованию через NO-опосредуемый путь с MAPK-каскадами в качестве нисходящего сигнала [3]. В роли сигнальных молекул в ауксин-индуцированном адвентивном корнеобразовании также функционируют Н2О2 и цГМФ [4].
Другим универсальным сигналом является Ca2+, который служит в качестве основного вторичного мессенджера во многих клеточных процессах [5]. Повышение концентрации цитозольного Ca2+ наблюдается в течение нескольких минут после применения ауксина, показывая, что ауксин является мощным индуктором кальциевого сигнала [6]. В свою очередь, кратковременное изменение концентрации Са2+ в цитоплазме вовлечено как в процесс выхода ауксина из клеток через релокализацию PIN-белков [7], так и в приток ауксина, опосредованный AUX-переносчиками [8]. Ингибиторы транспорта ауксина способны блокировать также и передвижение Ca2+ [9], а хелаторы кальция и блокаторы кальциевых каналов подавляют ауксин-зависимую элонгацию сегментов эпикотилей гороха [10]. Несмотря на то, что не показано прямого взаимодействия между двумя эффекторами, имеющиеся данные указывают на существование сложной системы прямых и обратных связей между Ca2+ и ауксиновой сигнализацией.
С применением ингибиторного анализа на побегах тополя, проростках огурца и маша, было показано, что вещества, влияющие на внутриклеточное содержание Са2+ или передачу кальциевого сигнала, вызывают снижение ИУК-индуцируемого формирования адвентивных корней [4, 11, 12]. При осуществлении этого процесса Са2+ находится во взаимосвязи с NO-, цГМФ- и МАР-киназной системами [3, 4]. Очевидно, что приведенный перечень регуляторов процесса корнеобразования далеко не полный, поскольку из-за вовлеченности как ИУК, так и Са2+ в большое количество процессов необходимы дополнительные участники, обладающие более «точечным ударом» и позволяющие обеспечить точность передачи сигнала.
Начиная с 80-х годов, появились данные о новых регуляторных молекулах – олигосахаринах – фрагментах клеточной стенки, обладающих биологической активностью [13, 14]. Разрыхление клеточной стенки (в том числе, при действии ауксина), связанное с ростом, развитием и образованием новых органов, включает ряд гидролитических процессов, что способствует высвобождению из полимеров клеточной стенки растворимых фрагментов – олигосахаридов, которые могут обладать значительным морфогенным потенциалом [13, 14]. Различные олигосахарины в основном оказывают ингибирующий эффект на процессы, индуцируемые ауксином, такие как удлинение сегментов стеблей гороха [15] или формирование адвентивных корней [13]. Механизм регуляции олигосахаринами морфогенных реакций растительного организма все еще непонятен. Вместе с тем показано, что одной из первых реакций на некоторые олигосахариды (олигогалактурониды) служит повышение уровня цитозольного Са2+ [16].
В нашей лаборатории получена фракция олигосахаридов, которая обладает способностью увеличивать количество ИУК-индуцируемых корней на различных модельных системах (OSRG – oligosaccharin that stimulates rhizogenesis) [17]. Учитывая тесную связь между передачей ауксинового сигнала и Са2+-сигнализацией, а также между эффектом ауксинов и олигосахаринами, и доказанную взаимосвязь этих соединений с процессами роста и развития [17, 18], целью настоящего исследования явилось изучение взаимодействия между этими эффекторами в процессе формирования адвентивных корней на эксплантах гипокотилей гречихи.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследований служили сегменты гипокотилей гречихи. Для их получения семена гречихи (Fagopyrum esculentum Moench) стерилизовали 10 мин в 2% растворе гипохлорита натрия, а затем проращивали в течение 4 суток на 1/2 нормы агаризованной среды Мурасиге-Скуга (MS/2) [19]. Из средней части гипокотиля вырезали сегменты длиной 1 см, которые разделяли вдоль на две части, помещали срезом вниз в чашки Петри с жидкой средой MS/2 и культивировали в течение 5 суток в темноте при 25°C. Среда MS/2 содержала 2% сахарозы, для агаризованной среды вносили 0.8% агара. Все работы по выращиванию гипокотилей, приготовлению и культивированию эксплантов выполняли стерильно.
Экстракцию олигосахарина OSRG из проростков гороха (Pisum sativum L.) и последующую очистку выполняли согласно разработанной ранее методике [14], в основе которой лежит поэтапная очистка экстрагированных буфером соединений с использованием последовательных стадий хроматографии, включающих катионную, анионообменную хроматографию и гель-фильтрацию. Условия подбирались с учетом высокой гидрофильности нейтральных олигосахаридов и отсутствия у них зарядов, а также с целью обеспечить удаление примесей, обладающих биологической активностью (белки, фенолы) и сохранить олигосахариды в процессе извлечения их из растительной ткани. Детальное описание методики приведено в недавней работе [20]. В процессе очистки тестировали активность различных фракций на разработанной ранее тест-системе – сегментах гипокотилей гречихи, на которых с помощью ИУК было индуцировано образование адвентивных корней [14]. Подсчет корней (длиной не менее 2 мм) проводили визуально на пятые сутки инкубации. Отобранная углеводная фракция, стимулирующая ризогенез, была обозначена как OSRG (oligosaccharin that stimulates rhizogenesis). Моносахаридный анализ OSRG выявил остатки галактозы, арабинозы, глюкозы и рамнозы (соответственно, 37, 29, 23 и 9 мол.%); судя по спектру поглощения, фракция не содержала неуглеводных примесей [20].
Используемые эффективные концентрации экзогенного Са2+, ИУК, а также других исследуемых ингибиторов и эффекторов были выбраны, основываясь на результатах предварительных экспериментов. Во всех экспериментах применяли 3 мМ Са2+, что соответствует его концентрации в среде Мурасиге-Скуга [19], 3 мкМ ИУК и 5 мкг/мл OSRG. Концентрации остальных эффекторов: дилтиазем – 12.5 мкМ, верапамил – 25 мкМ, неомицин – 12.5 мкМ, рутениевый красный – 2.5 мкМ, хлорпромазин – 25 мкМ, флуфеназин – 50 мкМ (“Sigma-Aldrich”, USA). При изучении действия эффекторов Са2+-сигнальной системы они вносились одновременно с ИУК в начале культивирования эксплантов на весь его период. При анализе эффектов различных комбинаций ИУК, олигосахарина (OSRG) и дилтиазема на формирование корней сопоставлялось действие: (а) каждого из этих эффекторов по отдельности в течение всего периода культивирования, (б) возможных комбинаций этих эффекторов (ИУК + OSRG или ИУК + дилтиазем, или OSRG + дилтиазем, или ИУК + OSRG + дилтиазем) в течение всего периода культивирования, (в) предобработки в течение одного часа одними эффекторами с последующим переносом в среду с другими (с OSRG на ИУК; с OSRG + дилтиазем на ИУК; с OSRG на ИУК + дилтиазем). Каждый эксперимент был выполнен в трех повторностях. Для каждого варианта использовали не менее 10 эксплантов. Статистическую обработку данных проводили с использованием программы Microsoft Office Excel 2010. В табл. 1 и на рис. 2, 3 приведены средние значения и их стандартные ошибки.
Для анализа экспрессии генов, активных в ходе индукции корнеобразования под действием олигосахарина OSRG, были использованы транскриптомы сегментов гипокотилей гречихи, культивируемых на среде с добавлением ИУК (IAA) или ИУК+олигосахарин (IAA + OS) в течение 6 и 24 часов [20]. Соответствующие варианты были обозначены как: IAA (6 h), IAA + OS (6 h), IAA (24 h) и IAA + OS (24 h). Экстракцию тотальной РНК проводили из 10 эксплантов каждого образца путем комбинированного метода лизиса растительных тканей с использованием аналога реагента TRIzol (“Евроген”, Россия) и RNeasy Plant Mini Kit (“Qiagen”, Германия). Для максимального удаления ингибиторов (полифенолы, полисахариды) последующих ферментативных реакций, в ходе экстракции РНК был использован набор Plant RNA Isolation Aid (“Ambion”, США). Подготовку библиотек кДНК и последующее секвенирование проводили с использованием TruSeq Sample Prep Kit v3 (“Illumina”, США) и Illumina HiSeq2500. Оценку качества секвенирования и очистку прочтений от адаптеров и контаминаций рРНК в библиотеках ридов, полученных в виде файлов fastq, проводили с использованием программ FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/) и bbtools (https:// jgi.doe.gov/data-and-tools/bbtools/). Расчет дифференциально-экспрессируемых генов (ДЭГ) осуществляли с помощью пакета R “DEseq2” [21]. Значения экспрессии представлены в виде нормализованных TGR (total gene reads). В качестве порога для дифференциально-экспрессируемых генов считали значения FC (fold change) ≥ |2| при P ≤ 0.05. Volcano plot, отображающий дифференциальную экспрессию между образцами, построен с использованием пакета R “Enhanced Volcano” [22].
РЕЗУЛЬТАТЫ
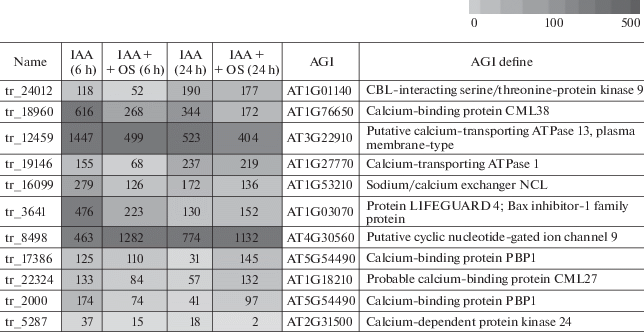
Формирование адвентивных корней в зависимости от времени и порядка внесения ИУК и Са2+ в среду культивирования
Одним из подходов для изучения характера взаимодействия разных физиологически активных соединений служит анализ изменений эффекта в зависимости от времени и порядка их добавления к растительным объектам. Такой подход, например, позволил выявить, что олигосахарин OSRG эффективен только на ранних стадиях индукции ауксином образования адвентивных корней [17]. Чтобы исследовать появление корней на эксплантах гречихи в зависимости от времени и порядка внесения в среду культивирования ИУК и Са2+, экспланты сначала помещали в среду с обоими эффекторами, а затем, по истечении указанного промежутка времени (диапазон от 30 минут до 48 часов), переносили на среду, содержащую либо ИУК, либо Са2+, где они оставались до конца культивирования (рис. 1, варианты I, II). Или, наоборот, экспланты сначала инкубировали в среде, содержащей один из эффекторов (ИУК или Са2+), используя те же временные интервалы, а затем переносили в среду, содержащую оба эффектора (рис. 1, варианты III, IV). Для сравнения в качестве контрольного варианта использовали экспланты, культивируемые во время всего эксперимента в присутствии ИУК и Са2+; количество корней, формируемое в таких условиях, составляло 12.0 ± 0.8 корней на эксплант.
Рис. 1.
Схема эксперимента по установлению периодов культивирования в средах с различными комбинациями ИУК и Са2+, требуемых для формирования корней на эксплантах гипокотилей гречихи.
При переносе из среды, содержащей и Са2+, и ИУК в среду, содержащую только Са2+ или только ИУК, экспланты необходимо было выдержать на среде с обоими эффекторами не менее 24 часов, чтобы достичь такого же количества корней, которое наблюдалось в контрольном варианте (табл. 1, колонки I, II). По истечении этого периода времени удаление одного из эффекторов из среды культивирования уже не оказывало влияния на их количество.
Таблица 1.
Количество корней, образующихся на сегментах гипокотилей гречихи, в зависимости от различных комбинаций ИУК и Са2+ в среде культивирования.
| Время культивирования в первой среде, ч | Количество корней, формируемых на эксплантах, шт./эксплант |
|||
|---|---|---|---|---|
| I | II | III | IV | |
| ИУК + Са2+ → Са2+ | ИУК + Са2+ → ИУК | Са2+ → ИУК + Са2+ | ИУК → ИУК + Са2+ |
|
| 0.5 | – | 3.0 ± 0.4 | 11.4 ± 1.4 | 6.0 ± 0.3 |
| 1 | 4.3 ± 0.3 | 3.0 ± 0.3 | 11.9 ± 1.5 | – |
| 2 | 3.5 ± 0.8 | – | 11.0 ± 1.6 | – |
| 3 | 3.3 ± 0.3 | 2.0 ± 0.1 | 9.7 ± 0.7 | 4.0 ± 0.2 |
| 5 | 2.5 ± 0.5 | 4.5 ± 0.5 | 8.5 ± 1.6 | 2.0 ± 0.1 |
| 12 | 2.0 ± 0.4 | 8.0 ± 0.3 | 6.0 ± 0.9 | 2.5 ± 0.2 |
| 24 | 12.7 ± 1.1 | 12.0 ± 1.2 | 4.3 ± 0.5 | 2.0 ± 0.1 |
| 48 | 12.3 ± 1.3 | – | 3.7 ± 0.9 | – |
При обратной постановке эксперимента, когда экспланты переносили из среды, содержащей либо только ИУК, либо только Са2+, в среду, содержащую оба эффектора, количество корней сильно зависело от того, какой эффектор присутствовал на первой стадии эксперимента (табл. 1, колонки III, IV). Так, инкубация в среде с кальцием, но без гормона в течение 1–2 часов не оказывала негативного воздействия на количество корней, и при последующем переносе на среду, содержащую и Са2+, и ИУК, экспланты формировали то же количество корней, как и в контрольном варианте (табл. 1, колонка III). Более длительное культивирование в среде с Са2+, но в отсутствии гормона имело негативный эффект, и чем позже осуществлялся перенос на среду с обоими эффекторами, тем меньше было количество корней. При добавлении гормона через 48 ч после начала культивирования его эффект отсутствовал полностью, и количество корней на эксплантах было таким же, как при их культивировании в среде без гормона в течение всего исследуемого периода, и составляло 3–4 корня на эксплант.
Если при инкубации в среде с Са2+, но без ИУК допускался, по крайней мере, 1–2 часовой лаг-период до внесения гормона, без негативного влияния на количество корней (табл. 1, колонка III), то инкубация в среде без Са2+ даже в течение 30 минут отрицательно сказывалась на количестве корней, несмотря на присутствие гормона в среде культивирования (табл. 1, колонка IV).
Действие эффекторов Са2+-сигнальной системы на формирование адвентивных корней
Для дальнейшей характеристики роли Са2+ в процессе формирования адвентивных корней было исследовано действие ингибиторов Са2+ каналов и антагонистов кальмодулина – ключевого Са2+-сенсорного белка.
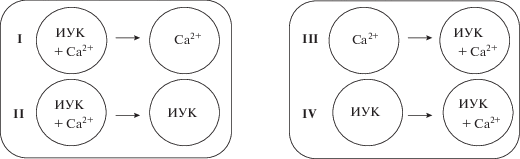
Обработка эксплантов блокаторами кальциевых каналов, подавляющих либо вход ионов кальция извне – верапамилом (25 мкМ) и дилтиаземом (12.5 мкМ), либо выход Са2+ из внутриклеточных хранилищ – неомицином (12.5 мкМ) и рутениевым красным (2.5 мкМ), приводила к снижению количества корней на эксплантах (рис. 2). Антагонисты кальмодулина – хлорпромазин и флуфеназин – в концентрациях 25 мкМ и 50 мкМ, соответственно, также оказывали ингибирующий эффект на процесс формирования корней (рис. 2).
Рис. 2.
Действие эффекторов Са2+-сигнальной системы на ИУК-индуцированное формирование адвентивных корней на сегментах гипокотилей гречихи. Ингибиторы вносились одновременно с ИУК в начале культивирования эксплантов на весь период инкубации. 1 – ИУК (3 мкМ); 2 – дилтиазем (12.5 мкМ); 3 – верапамил (25 мкМ); 4 – неомицин (12.5 мкМ); 5 – рутениевый красный (2.5 мкМ); 6 – хлорпромазин (25 мкМ); 7 – флуфеназин (50 мкМ).
Действие дилтиазема и олигосахарина (OSRG) на формирование адвентивных корней
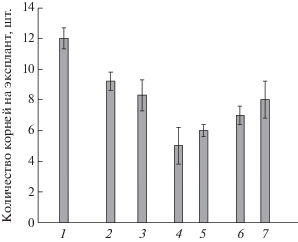
Для изучения сопряженности в эффектах олигосахарина и экзогенного кальция на ИУК-индуцируемое образование адвентивных корней сопоставлено действие на этот процесс различных комбинаций ИУК, олигосахарина и блокатора кальциевых каналов дилтиазема (рис. 3). Обнаружено, что если ИУК повышала количество корней (12.0 ± 0.8 корней на эксплант), по сравнению с безгормональным вариантом (3.4 ± 0.5 корней на эксплант), то культивирование эксплантов в среде без гормона только с OSRG или только с дилтиаземом, не оказывало эффекта, и количество корней в этих вариантах не превышало 3-4 корней на эксплант (рис. 3). При одновременном добавлении ИУК и OSRG в среду культивирования количество корней увеличивалось до 16.2 ± 0.8 корней на эксплант, что примерно на 30% выше количества корней, индуцируемых одним гормоном (рис. 3). Обработка эксплантов дилтиаземом вместе с ИУК приводила к снижению количества корней приблизительно на 25% (9.1 ± 0.4 корней на эксплант). Культивирование эксплантов в среде с добавлением одновременно и OSRG, и дилтиазема, но без гормона давало количество корней, сопоставимое с безгормональным вариантом. При одновременном внесении в среду культивирования всех трех эффекторов (ИУК, OSRG и дилтиазем) количество корней было сопоставимо с действием одной ИУК (рис. 3).
Рис. 3.
Действие ИУК, олигосахарина и дилтиазема на формирование корней на эксплантах гипокотилей гречихи. Концентрации: ИУК – 3 мкМ, олигосахарин (OSRG) – 5 мкг/мл, дилтиазем – 12.5 мкМ. (а) – Действие одного эффектора: 1 – ИУК; 2 – OSRG; 3 – дилтиазем; (б) – действие различных комбинаций эффекторов: 4 – ИУК + OSRG; 5 – ИУК + дилтиазем; 6 – OSRG + дилтиазем; 7 – ИУК + OSRG + дилтиазем; (в) – предобработка одними эффекторами с последующим переносом в среду с другими. Время предобработки – 1 час: 8 – с OSRG на ИУК; 9 – с OSRG + + дилтиазем на ИУК; 10 – с OSRG на ИУК + дилтиазем.
Предобработка эксплантов OSRG в течение часа с последующим переносом в среду, содержащую ИУК, вызывала дополнительное увеличение количества корней по сравнению с тем, что было получено при инкубации как с одним гормоном, так и при одновременном добавлении OSRG и ИУК в среду культивирования (рис. 3). Такой же эффект наблюдался и в том случае, если вместе с OSRG вносили дилтиазем. Однако предобработка эксплантов OSRG не имела эффекта, если экспланты потом переносили в среду, содержащую ИУК и дилтиазем.
Анализ экспрессии генов, имеющих отношение к Са2+-сигналингу
С целью выявления возможных механизмов участия Са2+ в ИУК-индуцируемом процессе образования адвентивных корней при стимулирующем действии OSRG, мы охарактеризовали изменения в экспрессии генов, имеющих отношение к Са2+-сигналингу при добавлении OSRG. Для этого были проанализированы и сопоставлены опубликованные ранее полные транскриптомы сегментов гипокотилей гречихи, культивируемых на среде MS/2 с 3 мМ Са2+ в присутствии только ИУК или ИУК + OSRG [20].
Учитывая, что и OSRG, и Са2+ вовлечены в ранние этапы развития ризогенной программы, были выбраны две временные точки, отражающие начальные стадии процесса корнеобразования: первая (6 часов от начала культивирования), на которой не происходит значительных морфологических изменений, охватывает различные процессы, связанные с преодолением последствий нарезания эксплантатов, спецификацией клеток-основателей и антиклинальными/периклинальными делениями. Второй этап (24 ч от начала культивирования), который в основном включает деление клеток и рост зачатка корня внутри родительской ткани, заканчивается формированием куполообразного примордия.
Среди генов, имеющих достоверный уровень экспрессии (TGR > 5) хотя бы в одном из анализируемых образцов, было выявлено 149 генов, кодирующих белки, которые либо участвуют в транспортировке Са2+ (Са2+-АТФазы, Na+/Ca2+-обменники, Са2+-каналы), либо относятся к белкам-сенсорам (Са2+/кальмодулин-протеинкиназы, Са2+-связывающие белки и пр.), либо являются другими Са2+-регулируемыми белками (факторы транскрипции, аннексины). Идентификационные номера этих генов обозначены прямоугольными рамками на рисунке 4, где представлено попарное сравнение экспрессии в исследуемых образцах всех 24929 генов, для которых выявлена соответствующая мРНК (normalized TGR > 5).
Рис. 4.
Анализ различий в экспрессии генов (в виде volcano plot [Blighe]) между гипокотилями гречихи, культивируемыми на Са2+-содержащей среде в течение 6 и 24 часов в присутствии только ИУК или ИУК + OSRG. Приведены попарные сравнения, иллюстрирующие действие OSRG (а, б), или времени культивирования эксплантов (в, г). Примечание: представлены гены, для которых различия достоверны (|fold change| ≥ 2, P ≤ 0.05). По горизонтальной оси указана величина N-кратных различий уровня экспрессии, по вертикальной оси – достигаемый уровень значимости установленных различий экспрессии. Вертикальная и горизонтальная линии на графике соответствуют используемым порогам достоверности: 2-кратное изменение экспрессии при значении P ≤ 0.05. В рамках обозначены гены, имеющие отношение к Са2+-сигналингу, достоверно экспрессируемые в рамках используемых порогов.
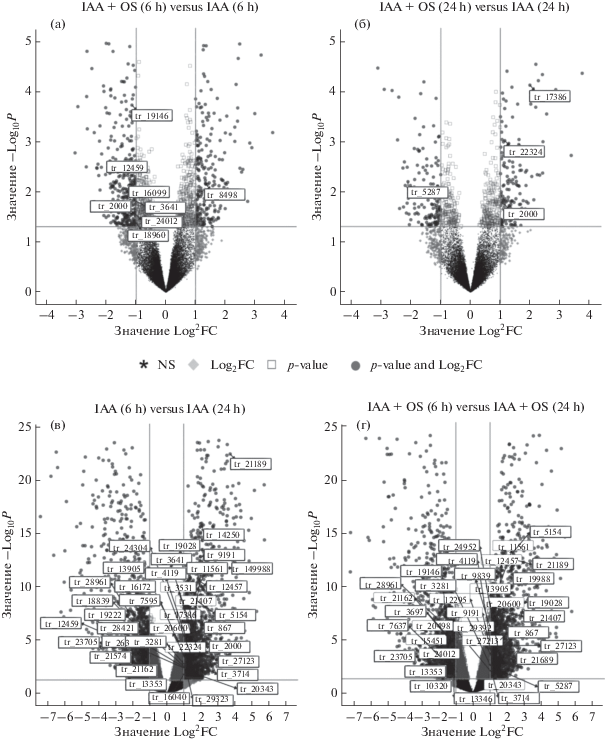
При добавлении OSRG в среду культивирования подавляющее большинство генов, имеющих отношение к Са2+-сигналингу, не изменяли существенно уровень экспрессии (рис. 4а, б). Внесение OSRG оказывало, в целом, существенно меньший эффект на транскриптомный профиль, чем, например, время инкубирования эксплантов, соответствующее определенным стадиям развития процесса (рис. 4в). Среди генов, экспрессия которых в отсутствии OSRG существенно различалась на двух проанализированных стадиях (рис. 4в), отмечены несколько генов кальмодулинов (tr_21189, tr_867, tr_12457, tr_19028) и кальмодулин-связывающих белков (tr_5154, tr_21407, tr_9191), содержание мРНК которых снижалось на более поздней стадии. В перечне генов, повышавших экспрессию со временем культивирования, наиболее заметны гены, гомологи которых аннотированы как кодирующие белки кальциевых каналов эндоплазматического ретикулума (например, tr_16172, tr_18839, tr_28421) (рис. 4в).
При сравнении образцов, обработанных только ИУК или ИУК + OSRG, дифференциальная экспрессия (|log2FC| ≥ 1, P ≤ 0.05) была выявлена для 11 генов (рис. 4а, б), перечисленных в таблице 2. Так, повышение экспрессии при наличии в среде OSRG отмечалось для гена, кодирующего ионный канал, относящийся к семейству каналов, регулируемых циклическими нуклеотидами (семейство GNGC) (tr_8498 гомолог AT4G30560), а снижение – для генов Na+/Са2+-обменника (tr_16099 гомолог AT1G53210), двух Са2+-транспортирующих АТФаз (tr_19146 гомолог AT1G27770 и tr_12459 гомолог AT3G22910), и белка LIFEGUARD 4, относящегося к семейству BAX inhibitor 1 (tr_3641 гомолог AT1G03070). Экспрессия двух генов (tr_17386 и tr_2000), гомологом которых является AT5G54490, кодирующих кальций-связывающий белок PBP1 (PID-BINDING PROTEIN 1), повышалась на 24 час культивирования эксплантов. Среди дифференциально экспрессирующихся в ответ на OSRG генов отмечены также два кальций-связывающих белка, относящихся к семейству кальмодулинов (tr_18960 гомолог AT1G76650 и tr_22324 гомолог AT1G18210), и две Са2+/Кам-зависимые протеинкиназы (tr_24012 гомолог AT1G01140 и tr_5287 гомолог AT2G31500) с пониженной экспрессией в эксплантах при обработке OSRG.
ОБСУЖДЕНИЕ
Кальций является непременным ингредиентом сред, используемых для культивирования клеток и тканей, необходимым элементом для осуществления морфогенетических процессов. Характеристика эффективности формирования адвентивных корней на эксплантах гипокотилей гречихи в зависимости от времени и порядка внесения в среду культивирования ИУК и Са2+ показала, что если для внесения ИУК существует временной интервал в 1–2 часа, когда отсутствие гормона не сказывается негативно на количестве корней, то для Са2+ такой лаг-период отсутствует, и ион должен находиться в среде с самого начала культивирования (табл. 1). Даже 30-минутное отсутствие Са2+ вызывало снижение количества корней вдвое, несмотря на экзогенно добавленный ауксин. Вероятно, повышение внутриклеточной концентрации кальция за счет его высвобождения из внутриклеточных хранилищ, вызываемое ауксином [12], в отсутствии экзогенно добавленного Са2+ не является достаточным условием для запуска процесса образования адвентивных корней на сегментах гипокотилей гречихи (табл. 1, колонка VI). Некоторые исследователи [11, 23] считают, что экзогенный кальций играет важную роль преимущественно на более позднем этапе, а именно в процессе удлинения корня. Однако во всех предыдущих работах кальций вносили только в двух или даже одной временной точке. Длительная динамика с более узкими временными интервалами при переносе эксплантов из среды без кальция в среду, содержащую ион и наоборот (табл. 1), дали нам возможность выделить более узкие диапазоны по чувствительности эксплантов к Са2+ и ИУК, что позволило сделать заключение, что эффект Са2+ связан, в первую очередь, с ранними этапами формирования корней.
Чтобы осознать роль экзогенного и эндогенного пулов кальция в качестве вторичного мессенджера в процессе формирования корней, было исследовано действие веществ, влияющих на уровень внутриклеточного Са2+ и его связывание с кальций-сенсорными белками (рис. 2). Снижение количества корней при применении дилтиазема и верапамила – органических блокаторов потенциал-зависимых Ca2+ каналов в плазмалемме [24] – на 23% и 31%, соответственно, указывает на то, что приток Ca2+ из внеклеточного пространства является частью, но при этом не единичным путем передачи сигнала в исследуемом нами процессе. Значительное снижение количества корней под действием неомицина и рутениевого красного, на 58% и 50%, соответственно, показывает участие в процессе корнеобразования кальция, высвобождаемого из внутриклеточных хранилищ. Первый ингибитор нарушает освобождение Са2+ из вакуолей через инозитольный путь, препятствуя связыванию фосфолипазы С с фосфатидилинозитол-4,5-бифосфатом, и подавляет тем самым образование вторичного мессенджера – инозитол-1,4,5–трифосфата [12]. Второй блокирует цАДФР/рианодин–чувствительные Са2+-каналы вакуолей [25], также препятствуя выходу кальция в цитоплазму. Таким образом, формирование адвентивных корней на эксплантах гипокотилей гречихи проходит при участии как внешнего, так и внутреннего пулов кальция. Более значительный эффект ингибиторов, действующих на выход кальция из внутриклеточных хранилищ, возможно, связан с их более низкой специфичностью, поскольку показано, что эти ингибиторы могут оказывать влияние и на другие Са2+ каналы, например, в ЭПР и на плазмалемме [24].
Повышение концентрации кальция в клетке воспринимается различными белками-сенсорами (например, кальмодулины и кальмодулин-подобные белки), которые, связывая Са2+, инициируют сигнальные каскады для регуляции многих клеточных процессов. Антагонисты кальмодулина фенотиазинового ряда – флуфеназин и хлорпромазин, для которых характерно сильное взаимодействие с кальмодулином, приводящее к подавлению его способности активировать ферменты [24], ингибировали количество корней, формирующихся на эксплантах гипокотилей гречихи (рис. 2). Подобный эффект антагонистов кальмодулина наблюдался у лишенных корней проростков бархатцев [26] и гипокотилей подсолнечника [27]. Считается, что мишенью антагонистов кальмодулина могут выступать активно делящиеся клетки, где эти ингибиторы оказывают влияние на митоз и цитокинез, приводя, таким образом, к ингибированию индукции адвентивных корней [27].
Ранее нами было показано, что в процесс формирования корней вовлечен элиситор углеводной природы – олигосахарин OSRG, который стимулирует ИУК-индуцируемый процесс корнеобразования, причем наибольший стимулирующий эффект достигался при добавлении его в начальный период культивирования эксплантов на 1–2 часа до добавления гормона. Внесение OSR-G после гормона не оказывало стимулирующего эффекта [17]. Учитывая данные, полученные в предыдущей работе и в настоящем исследовании, можно заключить, что для получения максимального ответа на эффекторы Са2+ должен присутствовать весь период культивирования, для ИУК необходим временной интервал от 2 до 24 часов, а для OSRG достаточно 2-часовой обработки. Таким образом и Са2+, и OSRG вовлечены в ранние этапы процесса формирования корней. Для обоих эффекторов задержка с внесением ИУК на 2–3 часа не является критичной, однако они не оказывают влияния на процесс корнеобразования при полном отсутствии гормона в среде культивирования (табл. 1, [17]).
Известно, что как ИУК [6], так и олигогалактуронидные фрагменты клеточной стенки [18] вызывают повышение уровня внутриклеточного кальция через активацию каналов, локализованных на плазмалемме. Поскольку выделенный нами олигосахарин OSRG задействован в начальных стадиях процесса корнеобразования [17], а вход Са2+ в клетку является самым ранним сигналом в ответ на любые воздействия, и оба эффектора вовлечены в ИУК-индуцируемый сигнальный путь, возникло предположение, что такой ранний ответ эксплантов на OSRG, полученный в наших исследованиях, мог быть опосредован активацией Са2+ каналов плазмалеммы. Однако применение блокатора кальциевых каналов – дилтиазема оказывало ингибирующее действие только на эффект, вызываемый ИУК, снижая на 25% количество корней, индуцируемое гормоном (рис. 3), а OSRG снимал негативное влияние ингибитора при одновременном внесении всех трех эффекторов. Предобработка эксплантов OSRG всегда вызывает значительную стимуляцию количества корней, даже если олигосахарин вносится вместе с дилтиаземом, свидетельствуя, что блокировка Са2+ каналов, локализованных на плазматической мембране, по крайней мере, тех, которые блокируются дилтиаземом, не влияет на начальные этапы процесса корнеобразования, запускаемые OSRG. Однако на более позднем этапе, очевидно, возникает необходимость активации Са2+-каналов плазмалеммы в процессе формирования адвентивных корней, индуцируемом ИУК, поскольку при переносе эксплантов из среды, содержащей OSRG, в среду, содержащую ИУК и дилтиазем, количество корней снижалось почти вдвое (рис. 3). Таким образом, можно предположить, что потенциал-зависимые каналы плазмалеммы участвуют в ИУК-индуцируемом процессе адвентивного корнеобразования на эксплантах гипокотилей гречихи, однако эффект OSRG, предшествующий действию ИУК, вероятно, не опосредуется через регуляцию этих каналов.
Транскриптомный анализ выявил эффект OSR-G на экспрессию некоторых генов, имеющих отношение к Са2+-сигнализации, который, как по числу дифференциально экспрессирующихся генов, так и по функциональному разнообразию кодируемых белков, был в большей степени выражен на ранних стадиях культивирования эксплантов (табл. 2). Если через 6 час культивирования изменялся уровень мРНК генов белков, имеющих отношение как к транспорту Са2+ (Na+/Ca2+-обменник, Ca2+-ATФазы, каналы, регулируемые циклическими нуклеотидами, белок, относящейся к семейству BAX inhibitor 1), так и различные Са2+-сенсорные белки (Са2+/кальмодулин-зависимые протеинкиназы, кальмодулин-связывающие белки), то через 24 час культивирования OSRG оказывал влияние только на экспрессию генов Са2+-сенсорных белков. С помощью ингибиторного анализа мы показали, что эффект OSRG, вероятно, не реализуется через поступление внешнего кальция через потенциал-зависимые каналы плазмалеммы, однако то, что на 6 час культивирования OSRG оказывает влияние на экспрессию ряда генов транспортеров кальция, отличающихся и по локализации, и по направлению передвижения кальция, говорит о том, что нельзя полностью исключить возможность его участия в изменении внутриклеточного содержания кальция.
OSRG оказывает влияние на экспрессию нескольких Са2+-зависимых протеинкиназ, одна из которых относится к классу протеинкиназ, способных образовывать комплекс с кальциневрин В-подобным белком (tr_24012 гомолог AT1G01140). Этот способ сложной и динамической регуляции Са2+-сигнальных путей показан только у наземных растений. С помощью попарных комбинаций различных кальциневринов и специфически связывающихся с ними Са2+-зависимых протеинкиназ создается разветвленная сигнальная сеть [28]. Показано, что отдельные представители этого семейства протеинкиназ регулируют архитектуру корневой системы в ответ на внешнее воздействие [29], но участие этого класса протеинкиназ в процессе формирования адвентивных корней не изучалось.
На 24 час культивирования OSRG повышал экспрессию двух генов (tr_17386 и tr_2000), гомологом которых является AT5G54490, кодирующий кальций-связывающий белок PBP1 (PID-BINDING PROTEIN 1) (табл. 2). Известно, что в ответ на изменение уровня цитозольного кальция белки РВР1 регулируют активность PID-киназы (серин/треонин протеинкиназа PINOID), которая участвует в тонкой настройке полярного транспорта ауксина во время формирования органов растений, в том числе и латеральных корней в ответ на локальные концентрации ауксина [30].
Таким образом, OSRG, как и Са2+, вовлечен в регуляцию ответов на ауксин в процессе формирования адвентивных корней и наши результаты представляют собой попытку связать две сигнальные системы: универсальную, опосредуемую Са2+, и мало изученную сигнальную систему с участием биологически активных фрагментов полисахаридов клеточной стенки. На основании полученных данных мы можем заключить, что на начальных стадиях адвентивного корнеобразования OSRG может быть задействован в создании определенных профилей колебания внутриклеточного кальция, которые являются индивидуальными при действии различных эффекторов, включая гормональный сигнал [5]. А на более позднем этапе, через повышение экспрессии генов белков PBP1, OSRG способствует усилению полярного транспорта ауксина и изменению программы развития, связанной со следующим этапом формирования корня. В целом, можно заключить, что олигосахарин OSRG может выступать в роли тонкого регулятора адвентивного корнеобразования, протекающего при участии ИУК, и опосредованного многоплановым участием Ca2+ в разнообразных клеточных процессах.
Авторы выражают благодарность старшему научному сотруднику отдела физиологии и молекулярной биологии растений КИББ ФИЦ КазНЦ РАН Мокшиной Наталье Евгеньевне за помощь в обсуждении результатов.
Финансовое обеспечение исследований осуществлялось из средств федерального бюджета в рамках темы государственного задания Казанского института биохимии и биофизики ФИЦ КазНЦ РАН и при поддержке Российского фонда фундаментальных исследований (проект № 17-04-01539).
Авторы заявляют об отсутствии конфликтов интересов. Данная статья не содержит каких-либо исследований с участием людей и животных.
Список литературы
Verstraeten I., Schotte S., Geelen D. Hypocotyl adventitious root organogenesis differs from lateral root development // Front. Plant Sci. 2014. V. 5. Article 495. https://doi.org/10.3389/fpls.2014.00495
Li K., Liang Y., Xing L., Mao L., Liu Z., Dong F., Meng Y., Han M., Zhao C., Bao L., Zhang D. Transcriptome analysis reveals multiple hormones, wounding and sugar signaling pathways mediate adventitious root formation in apple rootstock // Int. J. Mol. Sci. 2018. V. 19. Article 2201. https://doi.org/10.3390/ijms19082201
Pagnussat G. C., Lanteri M. L., Lombardo M. C. Nitric oxide mediates the indole acid induction activation of a mitogen activated protein kinase cascade involved in adventitious root development // Plant Physiol. 2004. V. 135. P. 279. https://doi.org/10.1104/pp.103.038554
Li S.W., Xue L.G. The interaction between H2O2 and NO, Ca2+, cGMP, and MAPKs during adventitious rooting in mung bean seedlings // In Vitro Cell DevBiol – Plant. 2010. V. 46. P. 142. https://doi.org/10.1007/s11627-009-9275-x
Медведев С.С. Принципы формирования и распространения кальциевого сигнала в растительной клетке // Физиология растений. 2018. Т. 65. С. 403. https://doi.org/10.1134/S0015330318060106
Shishova M., Lindberg S. Auxin induces rapid increase of Ca2+ concentration in the cytosol of wheat leaf protoplasts // J. Plant Physiol. 2004. V. 161. P. 937. https://doi.org/10.1016/j.jplph.2003.12.005
Zhang J., Vanneste S., Brewer P.B., Michniewicz M., Grones P., Kleine-Vehn J., Lofke C., Teichmann T., Bielach A., Cannoot B., Hoyerova K., Chen X., Xue H-W., Benkova E., Zazımalova E., Friml J. Inositol trisphosphate-induced Ca2+ signaling modulates auxin transport and PIN polarity // Dev. Cell. 2011. V. 20. P. 855. https://doi.org/10.1016/j.devcel.2011.05.013
Dindas J., Scherzer S., RoelfsemaM.R.G., von Meyer K., Müller H.M., Al-Rasheid K.A.S., Palme K., Dietrich P., Becker D., Bennett M.J., Hedrich R. AUX1-mediated root hair auxin influx governs SCF TIR1/AFB-type Ca2+ signaling // Nat. Commun. 2018. V. 9. P. 1174. https://doi.org/10.1038/s41467-018-03582-5
Lee J.S., Mulkey T.J., Evans M.L. Inhibition of polar calcium movement and gravitropism in roots treated with auxin-transport inhibitors // Planta. 1984. V. 160. P. 536. https://doi.org/10.1007/BF00411142
Reddy A.S.N., Koshiba T., Theologis A., Poovaiah B.W. The effect of calcium antagonists on auxin-induced elongation and on the expression of two auxin-regulated genes in pea epicotyls // Plant Cell Physiol. 1988. V. 29. P. 1165. https://doi.org/10.1093/oxfordjournals.pcp.a077618
Bellamine J., Penel C., Greppin H., Gaspar T. Confirmation of the role of auxin and calcium in the late phases of adventitious root formation // Plant Growth Regul. 1998. V. 26. P. 191. https://doi.org/10.1023/A:1006182801823
Lanteri M.L., Pagnussat G.C., Lamattina L. Calcium and calcium-dependent protein kinases are involved in nitric oxide and auxin-induced adventitious root formation in cucumber // J. Exp. Bot. 2006. V. 57. P. 1341. https://doi.org/10.1093/jxb/erj109
Bellincampi D., Salvi G., De Lorenzo G., Cervone F., Marfa V., Eberhard S., Darvill A., Albersheim P. Oligogalacturonides inhibit the formation of roots on tobacco explants // Plant J. 1993. V. 4. P. 207. https://doi.org/10.1046/j.1365-313X.1993.04010207.x
Zabotina O.A., Gurjanov O.P., Ibragimova N.N., Ayupova D.A., LozovayaV.V. Rhizogenesis in buckwheat thin-cell-layer explants: effect of plant oligosaccharides // Plant Sci. 1998. V. 135. P. 195. https://doi.org/10.1016/S0168-9452(98)00022-3
Auxtova-Samajova O., Liskova D., Kakoniova D., Kubackova M., Karacsonyi S., Bilisics L. Inhibition of auxin stimulated short-term elongation growth of pea stem segments by galactoglucomannan-derived oligosaccharides // J. Plant Physiol. 1996. V. 147. P. 611. https://doi.org/10.1016/S0176-1617(96)80054-X
Navazio L., Moscatiello R., Bellincampi D., Baldan B., Meggio F., Brini M., Bowler C., Mariani P. The role of calcium in oligogalacturonide-activated signaling in soybean cells // Planta. 2002. V. 215. P. 596. https://doi.org/10.1007/s00425-002-0776-7
Ларская И.А., Барышева Т.С., Заботин А.И., Горшкова Т.А. Характер участия олигосахарина OSRG в ИУК-индуцируемом формировании адвентивных корней // Физиология растений. 2015. Т. 62. С. 186. https://doi.org/10.7868/S0015330315020128
Vanneste S., Friml J. Calcium: the missing link in auxin action // Plants. 2013. V. 2. P. 650. https://doi.org/10.3390/plants2040650
Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture // Physiol. Plant. 1962. V. 15. P. 473. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Larskaya I., Gorshkov O., Mokshina N., Trofimova O., Mikshina P., Klepikova A., Gogoleva N., Gorshkova N. Stimulation of adventitious root formation by the oligosaccharin OSRG at the transcriptome level // Plant Signaling Behav. 2019. e1703503. https://doi.org/10.1080/15592324.2019.1703503
Love M.I., Huber W., Anders S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2 // Genome Biology. 2014. V. 15. P. 550. https://doi.org/10.1186/s13059-014-0550-8
Blighe K., Rana S., Lewis M. Enhanced Volcano: Publication-ready volcano plots with enhanced colouring and labeling; https://github.com/kevinblighe
Capitani F., Altamura M.M. Exogenous calcium enhances the formation of vegetative buds, flowers and roots in tobacco pith explants cultured in the absence of exogenous hormones // Plant Cell, Tissue Organ Cult. 2004. V. 77. P. 1. https://doi.org/10.1023/B:TICU.0000016608.08095.0f
De Vriese K., Costa A., Beeckman T., Vanneste S. Pharmacological strategies for manipulating plant Ca2+signalling // Int. J. Mol. Sci. 2018. V. 19. P. 1506. https://doi.org/10.3390/ijms19051506
Navazio L., Mariani P., Sanders D. Mobilization of Ca2+ by cyclic ADP-ribose from theendoplasmic reticulum of cauliflower florets // Plant Physiol. 2001. V. 125. P. 2129. https://doi.org/10.1104/pp.125.4.2129
Liao W.-B., Zhang M.-L., Huang G.-B., Yu H.-X. Ca2+ and CaM are involved in NO- and H2O2-induced adventitious root development in marigold // J. Plant Growth Regul. 2012. V. 31. P. 253. https://doi.org/10.1007/s00344-011-9235-7
Kalra G., Bhatia S.C. Auxin – calcium interaction in adventitious root formation in the hypocotyl explants of sunflower (Helianthus annuus L.) // J. Plant Biochem. Biotechnol. 1998. V. 7. P. 107. https://doi.org/10.1007/BF03263045
Mao J., Manik S., Shi S., Chao J., Jin Y., Wang Q., Liu H. Mechanisms and physiological roles of the CBL-CIPK networking system in Arabidopsis thaliana // Genes. 2016. V. 7. P. 62. https://doi.org/10.3390/genes7090062
Xuan Y.H., Kumar V., Han X., Kim S.H., Jeong J.H., Kim C.M., Gao Y., Han C.-D. CBL-INTERACTING PROTEIN KINASE 9 regulates ammonium-dependent root growth downstream of IDD10 in rice (Oryza sativa) // Annals of Botany. 2019. mcy242. https://doi.org/10.1093/aob/mcy242
Benjamins R., Quint A., Weijers D., Hooykaas P.J.J., Offringa R. The PINOID protein kinase regulates organ development in Arabidopsis by enhancing polar auxin transport // Development. 2001. V. 128. P. 4057.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений