Физиология растений, 2020, T. 67, № 5, стр. 475-481
4-хлорфеноксиуксусная кислота как регулятор онтогенеза партенокарпических плодов томата
В. В. Карягин a, О. Н. Прудникова a, В. Ю. Ракитин a, *
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: rakit@ippras.ru
Поступила в редакцию 20.11.2019
После доработки 05.12.2019
Принята к публикации 05.12.2019
Аннотация
Изучали влияние синтетического ауксина 4-хлорфеноксиуксусной кислоты (4-ХФУ) на онтогенез плода томата. Опыление цветков томата Solanum lycopersicum L. сорта “Сливовидный” вызывало образование в завязях ауксина индолил-3-уксусной кислоты (ИУК), под влиянием которой происходило развитие плода. Обработка кастрированных цветков 4-ХФУ также индуцировала синтез ИУК в завязях, что приводило к образованию партенокарпических плодов, достигавших полной зрелости на 6 суток раньше, и их масса была на 17% больше, чем у семенных плодов. Содержание абсцизовой кислоты, выделение этилена, а также интенсивность дыхания были выше в партенокарпических, чем в семенных плодах в течение практически всего периода развития, но изменялись сходным образом в обоих вариантах. Удаление из растущих плодов формирующихся семян – основных источников ауксина – приводило к полной остановке роста плода, который восстанавливался до нормального уровня при замене семязачатков источником экзогенного ауксина: ИУК или 4-ХФУ. Полученные данные позволяют сделать вывод об участии синтетического ауксина не только в инициировании роста партенокарпического плода через стимуляцию синтеза эндогенной ИУК, но и демонстрируют возможность независимой от ИУК регуляции развития плода на всех стадиях вплоть до созревания.
ВВЕДЕНИЕ
Фитогормоны регулируют развитие плода на всех этапах онтогенеза, а ключевым гормоном в этом процессе является ИУК [1, 2]. Опыление цветков и последующее оплодотворение вызывают повышение содержания ауксина в завязи, что является сигналом начала роста и развития плода. Неблагоприятные факторы (высокие и низкие температуры, слишком высокая или низкая влажность, недостаточная освещенность и т.д.) нарушают процесс оплодотворения, в результате индукции синтеза ИУК не происходит, что, в свою очередь, приводит к прекращению развития плода и потере урожая. Одним из способов преодоления неблагоприятных для завязывания плодов условий является обработка цветков синтетическими ауксинами, в частности, хлорзамещенными феноксиуксусными кислотами, например, 4-хлорфеноксиуксусной (4-ХФУ). Образовавшиеся в результате такой обработки партенокарпические плоды характеризуются ускоренным развитием и созреванием в сравнении с семенными плодами [3, 4].
Вопрос о механизме действия синтетических ауксинов на процессы роста и развития плода остается открытым. Возможны, по крайней мере, три пути действия синтетических ауксинов на плодообразование: 1) стимуляция синтеза эндогенного ауксина – ИУК, 2) восполнение недостатка эндогенного ауксина за счет синтетического, 3) реализация обеих этих возможностей. В пользу первого пути свидетельствует то, что обработка плода синтетическими ауксинами как на стадии завязывания, так и в период роста способствует повышению уровня эндогенной ИУК, что позволяет бессемянным плодам достигать и даже превосходить массу семенных плодов [5–8].
Принято считать, что эндогенная ИУК является главным гормональным фактором развития партенокарпического плода, а экзогенные ауксины лишь индуцируют аккумуляцию ИУК в завязи [5]. Тем не менее, возможность замены эндогенной ИУК синтетическим ауксином при регуляции онтогенеза плода остается далеко не изученной. Данная работа была проведена для проверки такой возможности. С этой целью в течение всего периода развития плода (от завязывания до созревания) исследовали содержание ИУК в семенных, а ИУК и 4-ХФУ – в партенокарпических плодах и в плодах, у которых центры синтеза ИУК были заменены искусственными источниками ИУК или 4-ХФУ. Плоды из всех вариантов эксперимента сравнивали по скорости роста, периоду развития до полной зрелости, накоплению АБК, продукции этилена и интенсивности дыхания.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работу проводили на растениях томата (Solanum lycopersicum L.) сорта “Сливовидный”, выращенных в почвенной культуре в период с апреля по август при естественном освещении и температуре 18˚С ночью и 28˚С днем в оранжерее Института физиологии растений им. К.А. Тимирязева РАН.
У 8-недельных растений оставляли 2–3 средних цветка в каждой кисти, находившихся на стадии полураскрытого бутона, остальные цветки удаляли. Для получения семенных плодов цветки кастрировали, удаляя венчик и тычиночный круг, а затем вручную опыляли пыльцой, собранной накануне с этих же растений (вариант “опыление”) [9]. Для получения партенокарпических плодов цветки кастрировали, удаляя венчик, тычиночный круг и столбик, а на внешнее основание чашечки микропипеткой наносили 10 мкл водного раствора, содержавшего 1.25 мкг натриевой соли 4-ХФУ (вариант – “обработка 4-ХФУ”). Обработку и опыление проводили в один и тот же день. Возраст собранных для анализа плодов определяли от момента опыления или обработки 4-ХФУ.
На части растений у 10-дневных завязей, развившихся из опыленных цветков, удаляли верхнюю половину. У некоторых из оставшихся на растении половинок удаляли плаценту с семязачатками (рис. 1). На места срезов наносили ланолиновую пасту, содержавшую ИУК (0.5%), 4-ХФУ (0.1%) или чистый ланолин. На срез половинок, из которых не удаляли плаценты с семязачатками, наносили только ланолин.
Рис. 1.
Замена плаценты с семязачатками искусственным источником ауксина. У 10-дневных завязей, развившихся из опыленных цветков, удаляли верхнюю половину. Из оставшейся на растении половины удаляли плаценту с семязачатками. На места среза наносили ланолиновую пасту, содержавшую ИУК (0.5%), 4-ХФУ (0.1%) или чистый ланолин. У половинок плодов, из которых не удаляли плаценту с семязачатками, срез смазывали ланолином.

Измерение выделения этилена и интенсивности дыхания проводили в герметично закрывающихся сосудах объемом от 15 до 500 мл в зависимости от размера плодов. Скорость выделения этилена и интенсивность дыхания определяли газохроматографическим методом [10].
Очистку растительных образцов для последующего количественного анализа ИУК, АБК и 4-ХФУ осуществляли методом твердофазной экстракции. Плоды томата фиксировали жидким азотом и измельчали в 10-кратном объеме охлажденного (–20°С) 80% метанола, содержавшего антиоксидант – 2,6-ди-трет-бутил-4-метилфенол (10 мг/л). Гомогенат фильтровали через стеклянный фильтр GF/F (“Whatman”, Великобритания). Полученный экстракт последовательно очищали сначала на анионообменной колонке – 30х9 мм DEAE Si 100 (“Serva”, ФРГ), затем на колонке C-18 – 30 × × 6 мм Chromosorb LC-7 (“Sigma”, США). Окончательная очистка и разделение образца на фракции, содержавшие ИУК, АБК и 4-ХФУ, происходила на колонке 250 × 4 мм Sephasorb HP Ultrafine (“Pharmacia”, Швеция). Количественное определение АБК в виде метилового эфира, а ИУК и 4-ХФУ в виде пентафторбензиловых эфиров проводили на газовом хроматографе Газохром 1109 (Россия) с детектором по захвату электронов и кварцевой капиллярной колонкой 10 м × 0.53 мм HP-17 (“Hewlett-Packard”, США), с последующим подтверждением результатов анализа методом газовой хроматографии – масс-спектрометрометрии с использованием газового хроматографа НР 5890А с масс-спектрометрическим детектором НР 5970 и кварцевой колонкой 25 м х 0.32 мм НР-5 (“Hewlett-Packard”, США) [11].
На графиках представлены средние арифметические величины из трех биологических повторностей и их стандартные ошибки. Каждая биологическая повторность представляла собой усредненную пробу из 10–60 плодов, собранных с 5–15 растений.
РЕЗУЛЬТАТЫ
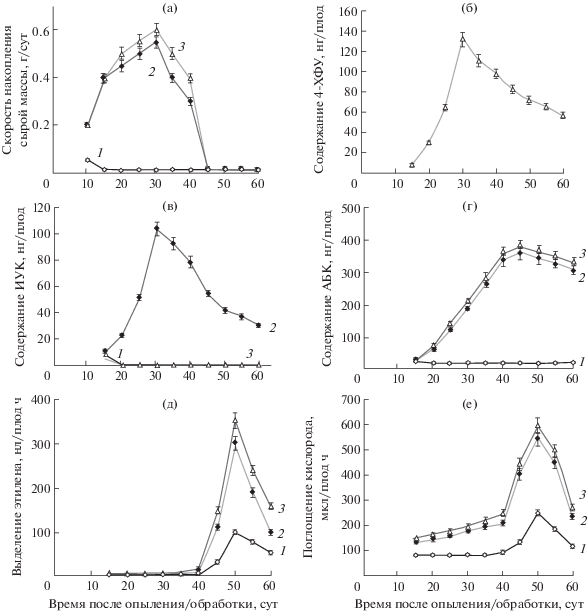
Партенокарпические плоды, образовавшиеся под влиянием 4-ХФУ, росли быстрее, чем семенные, образовавшиеся в результате опыления. Так, максимальную скорость роста у партенокарпических плодов – 1.8 г/сутки – наблюдали на 25 день после обработки 4-ХФУ, а скорость роста семенных плодов достигала максимума в 1.5 г/сутки только на 30 сутки после опыления (рис. 2а). Партенокарпические плоды достигали максимальной массы – 53 г (стадия зеленых выросших плодов) на 45 и созревали на 57 сутки после обработки 4‑ХФУ. Семенные плоды набирали максимальную массу – 45 г на 50 сутки и созревали на 63 день после опыления. Период созревания составлял 12 суток у партенокарпических плодов и 13 суток – у семенных. В течение всего периода развития партенокарпических плодов экзогенный ауксин (4‑ХФУ) присутствовал в их тканях в свободной форме.
Рис. 2.
Скорость накопления сырой массы (а), содержание 4-ХФУ (б), ИУК (в), АБК (г), скорость выделения этилена (д) и поглощения кислорода плодами томата (е). 1 – опыление; 2 – обработка 4-ХФУ. Вставки показывают скорость выделения этилена и поглощения кислорода в первые 4 дня после опыления/обработки.

Нанесенная на чашечки цветков 4-ХФУ быстро поступала в завязь, ее содержание уже через сутки составляло 1 нг/плод. Содержание 4-ХФУ достигало максимального значения (128 нг/плод) на 25 день после обработки цветков 4ХФУ, что совпадало с максимумом скорости роста (рис. 2б). Содержание эндогенной ИУК в завязях резко возрастало уже в первые дни после опыления или обработки цветков 4-ХФУ (рис. 2в). В динамике содержания ИУК наблюдали два максимума. Первый на пятые сутки, причем содержание ИУК (95 нг/плод) в завязях из обработанных 4-ХФУ цветков было в 2 раза больше, чем в завязях из опыленных цветков (43 нг/плод). Второй пик в содержании ИУК совпадал с максимумом в скорости роста плода и приходился на 25 день у партенокарпических (125 нг/плод) и на 30 день у семенных плодов (305 нг/плод).
В завязях неопыленных и необработанных 4‑ХФУ кастрированных цветков содержание ИУК оставалось на исходном, очень низком уровне (менее 1 нг/плод), цветки опадали или образовывали нерастущие, так называемые “сидячие” плоды. Содержание АБК в плодах повышалось по мере их роста, достигая максимума непосредственно перед началом созревания: на 35 сутки у партенокарпических (2.3 мкг/плод) и на 40 сутки – у семенных плодов (2.8 мкг/плод) (рис. 2г).
Обращает на себя внимание параллелизм в изменении выделения этилена и интенсивности дыхания. Исходные завязи из полураскрытых бутонов выделяли 0.02 нл С2Н4/плод ∙ ч (рис. 2д) и потребляли 2 мкл О2/плод · ч (рис. 2е). За первые сутки после опыления выделение этилена завязью увеличивалось в 11 раз, достигая величины 0.22 нл С2Н4/плод · ч, а потребление кислорода возрастало в 13.5 раза до 27 мкл О2/плод · ч. Обработка цветков 4-ХФУ за сутки увеличивала выделение этилена завязью лишь в 3.5 раза до 0.07 нл С2Н4/плод · ч и только в 2.5 раза увеличивала потребление кислорода до 5 мкл О2/плод · ч. Однако к пятым суткам эксперимента завязи цветков, обработанных 4‑ХФУ, выделяли 0.11 нл С2Н4/плод · ч и потребляли 120 мкл О2/плод · ч, т.е. в 2 раза больше, чем завязи из опыленных цветков (0.06 нл С2Н4/плод · ч и 60 мкл О2/плод · ч). Выделение этилена и поглощение кислорода плавно увеличивались по мере роста плодов. Резкое усиление выделения этилена и потребления кислорода происходило после окончания роста плодов в начале созревания. Максимальное выделение этилена и потребление кислорода происходило на стадии розовых плодов: у партенокарпических на 50 сутки и составляло 455 нл С2Н4/плод · ч и 2000 мкл О2/плод · ч, а у семенных плодов на 55 сутки и достигало 352 нл С2Н4/плод · ч и 1800 мкл О2/плод · ч.
Половинки плодов, у которых удаленные плаценты с семязачатками были заменены источниками экзогенного ауксина (ИУК или 4-ХФУ), росли так же, как и половинки, из которых не были удалены плаценты. Рост половинок плодов, лишенных естественных и не получавших искусственные источники ауксинов, был сильно заторможен. У половинок плодов с искусственными источниками 4-ХФУ и ИУК скорость накопления сырой массы достигала наибольшего значения на 30 сутки и составляла 0.5 и 0.45 г/сут, соответственно (рис. 3, 4а).
Рис. 3.
Развитие плодов томата с естественными и искусственными источниками ауксинов. 1 – интактные плоды; 2 – плоды, у которых удалена верхняя половина, но семязачатки оставлены; 3 – плоды, у которых удалена верхняя половина и плацента с семязачатками из оставшейся на растении половины, а на поверхности срезов нанесен чистый ланолин; 4 – то же, что и 3, но ланолин содержал 0.5% ИУК; 5 – то же, что и 3, но ланолин содержал 0.1% 4-ХФУ. Верхний ряд – плоды на 10 сутки, нижний ряд – на 60 сутки после опыления цветков.

Рис. 4.
Скорость накопления сырой массы (а), содержание 4-ХФУ (б), ИУК (в), АБК (г), скорость выделения этилена (д) и поглощения кислорода (е) плодами томата, в которых плаценты с семязачатками заменены искусственными источниками ауксинов (ИУК или 4-ХФУ). 1 – ланолин; 2 – ланолин + 0.5% ИУК; 3 – ланолин + 0.1% 4-ХФУ.
Скорость роста половинок плодов, лишенных плаценты с семязачатками, находилась в прямой зависимости от содержания экзогенных ауксинов, поступавших в них из ланолиновой пасты 4‑ХФУ или ИУК (рис. 4а–в). Следует отметить, что в половинках плодов, лишенных плаценты с семязачатками, 4-ХФУ не была способна индуцировать образование ИУК в течение всего периода роста (рис. 4в). Содержание АБК в половинках плодов с искусственными источниками ауксинов (ИУК или 4-ХФУ) увеличивалось вплоть до начала созревания, однако уровень ее накопления был в несколько раз меньше, чем в семенных плодах. В плодах, лишенных естественных и искусственных источников ауксинов, АБК присутствовала в следовых количествах (рис. 4г).
Характер изменения скорости выделения этилена и интенсивности дыхания был сходным у половинок плодов с искусственными источниками ИУК или 4-ХФУ и интактных плодов: постепенное повышение по мере роста плода сменялось резким подъемом при переходе к созреванию (рис. 2д, е; 4д, е).
У половинок плодов, в которых удаленные плаценты с семязачатками не были заменены искусственными источниками ауксинов, выделение этилена и поглощение кислорода оставалось на низком уровне вплоть до начала созревания, при котором наблюдалось характерное для климактерических плодов повышение выделения этилена и потребления кислорода (рис. 4д, е). Период созревания половинок плодов во всех вариантах эксперимента продолжался 15 суток и завершался к 60 суткам от момента опыления исходных завязей.
ОБСУЖДЕНИЕ
В онтогенезе плода томата можно выделить несколько этапов. Первый этап включает в себя опыление цветка и оплодотворение завязи. Образование зиготы дает старт началу роста и развития плода. Рост завязи начинается с периода клеточного деления (приблизительно, 10–14 суток), сменяющегося периодом роста растяжением образовавшихся клеток (4–7 недель). Достигнув максимальной массы, плоды вступают в стадию созревания (приблизительно, 10–14 суток) [12]. Каждый из этапов регулируется фитогормонами: деление контролируют ИУК и цитокинины, растяжение – ИУК и гиббереллины. Далее при созревании вступают в действие АБК и этилен [13, 14].
Онтогенез плода томата зависит от его способности синтезировать ИУК. Опыление и оплодотворение стимулируют закладку в завязи семязачатков, которые становятся источниками ИУК в развивающемся плоде. ИУК регулирует деление клеток завязи и последующий рост растяжением образовавшихся клеток. Возможно, ее действие, по крайней мере, частично, реализуется через регуляцию синтеза гиббереллинов и цитокининов [15], а также путем стимуляции sink-активности растущего плода [16]. Нарушение процесса опыления препятствует формированию в плоде источника ауксина, что вызывает опадение завязи или образование не растущих так называемых “сидячих” плодов. На практике это может приводить к значительной потере урожая плодов [3]. Обработка цветков синтетическими ауксинами, например 4-ХФУ, позволяет заменить опыление и получить повышенный урожай плодов в более короткие сроки. Наиболее вероятным источником ИУК в завязях, обработанных 4-ХФУ, служат плаценты с неоплодотворенными семяпочками. Следует отметить, что развитие и размер плодов томата “Северянин” с естественной (не индуцированной экзогенными ауксинами) партенокарпией напрямую зависит от таких семяпочек [17].
Завязи из обработанных 4-ХФУ цветков характеризовались повышенным уровнем ИУК в первые дни развития (рис. 2в) и более высокой скоростью роста, чем у завязей, образовавшихся в результате опыления (рис. 2а), что согласуется с результатами, полученными ранее в процессе индукции 4‑ХФУ партенокарпии у томата [18] и баклажана [5]. При последующем росте растяжением содержание ИУК было выше у семенных плодов, однако партенокарпические продолжали расти с большей скоростью (рис. 2а, в). Одновременно с увеличением содержания эндогенной ИУК в партенокарпических плодах происходило накопление экзогенного ауксина – 4-ХФУ (рис. 2б, в). Учитывая большую, чем у ИУК, химическую устойчивость в растительной ткани синтетического ауксина [19], можно предположить, что повышенная скорость роста партенокарпических плодов является результатом совместного действия синтетического и эндогенного ауксина и 4-ХФУ может, по крайней мере, отчасти, восполнить недостаток ИУК в плоде.
Для доказательства данного предположения у плодов, вступивших в стадию роста растяжением, были удалены плаценты с семенами, что привело к полной остановке роста. Восстановить рост удалось, возобновив снабжение плода ИУК или 4‑ХФУ. Нормальное развитие плода продолжалось независимо от того, ИУК или 4-ХФУ были применены. Плоды в обоих случаях достигали размера, сравнимого с таковым у интактных плодов, и созревали одновременно. Содержание АБК, выделение этилена и дыхание были практически идентичными у обоих вариантов, что позволяет предположить одинаковый механизм действия ИУК и 4-ХФУ в регуляции роста плода томата. Дополнительным доказательством является тот факт, что 4-ХФУ, как и ИУК, стимулирует синтез гиббереллинов и цитокининов [15], а также активацию ферментов, регулирующих sink-активность плодов [16].
Ускоренный рост партенокарпических плодов сопровождался повышенными уровнями содержания АБК, выделения этилена и дыхания, причем характер изменений этих показателей был такой же, как у семенных плодов. Предположительно, АБК участвует в регуляции снабжения развивающего органа ассимилятами [14] и индукции синтеза этилена в созревающих плодах [20], а также предотвращает преждевременное прорастание сформировавшихся семян в плоде [13]. Одной из важнейших функций этилена является регуляция дыхания в те моменты развития плода, когда в короткое время нужно обеспечить быстропротекающий процесс необходимым количеством энергии [21]. В условиях нормального развития плода, т.е. в отсутствие стрессовых воздействий, критическими этапами его развития являются оплодотворение (завязывание) и созревание, когда происходит переключение генетически детерминированной программы развития плода в первом случае на рост, а во втором – на его прекращение и переход к созреванию. Именно в эти периоды наблюдается увеличение образования этилена, сопровождающееся усилением дыхания (рис. 2д, е).
Полученные данные свидетельствуют о том, что в онтогенезе плода томата ауксин является лимитирующим фактором как индукции, так и последующего развития от завязывания до созревания. Любые воздействия, приводящие к уменьшению уровня ауксина в плоде, вызывают замедление или полное прекращение его роста, который возобновляется при снабжении плода ауксином. Приведенные данные позволяют сделать вывод об участии синтетического ауксина не только в инициировании роста партенокарпического плода через стимуляцию синтеза эндогенной ИУК, но также демонстрируют возможность независимой от ИУК регуляции развития плода на всех стадиях вплоть до созревания.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ruan Y.-L., Patrick J.W., Bouzayen M., Osorio S., Fernie A.R. Molecular regulation of seed and fruit set // Trends Plant Sci. 2012. V. 17. P. 1360.
Joldersma D., Lui Z. The making of virgin fruit: the molecular and genetic basis of parthenocarpy // J. Exp. Bot. 2018. V. 69. P. 955. https://doi.org/10.1093/jxb/erx446
Nandawani D., Dennery S., Balkaran S. Effect of 4‑CPA on fruit set and yield of beefsteak tomato (Solanum lycopersicum L.) on the island of St. Croix // Acta Hortic. 2014. T. 1042. C. 255. https://doi.org/10.17660/actahortic.2014.1042.31
Jasmin B.L., Kumar S., Modi S. Influence of plant growth regulators on growth and yield of greenhouse tomato (Solanum lycopersicum L.) // Int. J. Curr. Microbiol. Appl. Sci. 2018. V. 7. P. 1603. https://doi.org/10.20546/ijcmas.2018.708.183
Lee T.-H., Sugiama A., Takeno K., Ohno H., Yamaki S. Changes in content of indole-3-acetic acid and in activities of sucrose-metabolising enzymes during fruit growth in eggplant (Solanum melongena L.) // J. Plant Physiol. 1997. V. 150. P. 292.
Li X.-X., Hayata Y., Osajima Y. p-CPA Increases the endogenous IAA content of parthenocarpic muskmelon fruit // Plant Growth Regul. 2002. V. 37. P. 99.
Stem R.A., Flaishman M., Applebaum S., Ben-Arie R. Effect of synthetic auxins on fruit development of ‘bing’ cherry (Prunus arium L.) // Scientia Horticulturae. 2007. V. 114. P. 275.
Devoghalaera F., Doucen T., Guitton B., Keeling J., Payne W., Ling T.J., Ross J.J., Hallett I.C., Gunaseelan K., Dayatilaka G.A., Diak R., Breen K.C., Tustin D.S., Costes E., Chagne D. et al. A genomics approaches to understanding the role of auxin in apple (Malus x domestica) fruit size control // BMC Plant Biology. 2012. V. 12. P. 7. https://doi.org/10.1186/1471-2229-12-7
Гаранько И.Б., Штрейс Р.И., Голишевский Л.Ф., Шутов А.А., Власова Э.А. Выращивание томатов в защищенном грунте Нечерноземной зоны РСФСР. Л.: Агропромиздат, 1985. 144 с.
Ракитин В.Ю., Ракитина Т.Я. Определение выделения и содержания этилена в растениях // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Кузнецова Вл.В., Кузнецова В.В., Романова Г.А. М.: Бином. Лаборатория знаний, 2011. С. 323.
Карягин В.В., Ракитин В.Ю., Садовская В.Л. Количественное определение индолил-3-уксусной кислоты, абсцизовой кислоты и галоидфеноксикислот в одном образце растительной ткани // Молекулярно-генетические и биохимические методы в современной биологии растений / Под ред. Кузнецова Вл.В., Кузнецова В.В., Романова Г.А. М.: Бином. Лаборатория знаний, 2011. С. 316.
de Jong M., Mariani C., Vriezen W.H. The role of auxin and gibberellin in tomato fruit set // J. Exp. Bot. 2009. V. 60. P. 1523.
Srivastava A., Handa A.K. Hormonal regulation of tomato fruit development: a molecular perspective // J. Plant Growth Regul. 2005. V. 24. P. 67.
McAtee P., Karim S., Schaffer R., David K. A dynamic interplay between phytohormones is required for fruit development, maturation and ripening // Front Plant Sci. 2013. V. 4. P. 79. https://doi.org/10 3389/fpls.201300079
Mariotti L., Picciarelli P., Lombardi L., Ceccarelli N. Fruit set and early fruit growth in tomato are associated with increases in indoleacetic acid, cytokinin and bioactive gibberellin contents // J. Plant Growth Regul. 2011. V. 30. P. 405.
Lee T.-H., Sugiama A., Ofusu-Anim J., Takeno K., Ohno H., Yamaki S. Activation of sucrose-metabolising enzymes and stimulation of sucrose uptake by auxin and sucrose in eggplant (Solanum melongena L.) // J. Plant Physiol. 1997. V. 150. P. 297.
Kataoka K., Uemachi A., Yazawa S. Fruit growth and pseudoembryo development affected by uniconazole, an ingibitor of gibberellin biosynthesis, in pat-2 and auxin-induced parthenocarpic tomato fruits // Sci. Hort. 2003. V. 98. P. 9.
Sjut V., Bangerth F. Induced parthenocarpy – a way of changing the levels of endogenous hormones in tomato fruits (Lycopersicon esculentum Mill.) 2. Diffusible hormones // Plant Growth Regulation. 1984. V. 2. P. 49.
Гуськов А.В. Метаболизм ауксинов в растениях и его регуляция. Итоги науки и техники ВИНИТИ. Сер. Физиология растений. М. 1991. Т. 8. 155 с.
Zhang M., Yuan B., Leng P. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit // J. Exp. Bot. 2009. V. 60. P. 1579.
Ракитин В.Ю. Активация этиленом цианидрезистентного дыхания при созревании плодов лимона // Физиология растений. 1988. Т. 30. С. 717.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


