Физиология растений, 2020, T. 67, № 5, стр. 482-489
Участие компонентов жасмонатного сигналинга в развитии солеустойчивости Arabidopsis thaliana, индуцированной донорами H2S и NO
Т. О. Ястреб a, Ю. Е. Колупаев a, *, М. А. Шкляревский a, А. П. Дмитриев b
a Харьковский национальный аграрный университет им. В.В. Докучаева
Харьков, Украина
b Институт клеточной биологии и генетической инженерии Национальной академии наук Украины
Киев, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 07.01.2020
После доработки 12.02.2020
Принята к публикации 17.02.2020
Аннотация
Сравнивали влияние доноров сероводорода (50 мкМ гидросульфид натрия – NaHS) и оксида азота (500 мкМ нитропруссид натрия – НПН) на солеустойчивость растений арабидопсиса (Arabidopsis thaliana L.) дикого типа (Col-0) и дефектных по жасмонатному сигналингу: coi1 (мутант по гену, кодирующему белок COI1, участвующий в удалении белков-репрессоров транскрипционных факторов жасмонатного сигналинга) и jin1 (мутант, дефектный по гену, кодирующему транскрипционный фактор JIN1/MYC2). Доноры NO и H2S оказывали сходное положительное влияние на солеустойчивость растений дикого типа, что выражалось в снижении под их влиянием водного дефицита листьев, уменьшении окислительных повреждений, стабилизации проницаемости мембран и содержания хлорофилла при действии 175 мМ NaCl. Также под влиянием обработки NaHS и НПН при засолении у растений Col-0 повышалась активность супероксиддисмутазы (СОД) и каталазы (КАТ), но уменьшалось стресс-индуцированное накопление пролина. Предварительная обработка мутантов coi1 и jin1 донорами NO и H2S не предотвращала вызываемое действием NaCl усиление пероксидного окисления липидов и не способствовала уменьшению проницаемости мембран и сохранению пула хлорофиллов в стрессовых условиях. Также у обоих мутантов, обработанных NaHS или НПН, не отмечалось повышения активности СОД и КАТ при действии соли. Обработка донорами NO и H2S не оказывала влияния на величину водного дефицита и содержание пролина в листьях мутанта jin1. Однако у мутанта coi1 предшествовавшая солевому воздействию обработка NaHS или НПН уменьшала проявление водного дефицита и накопление пролина. Сделано заключение о вовлечении компонентов жасмонатного сигналинга в реализацию стресс-протекторного действия доноров сероводорода и оксида азота. Предполагается, что транскрипционный фактор JIN1/MYC2 играет более важную роль в процессах индуцирования солеустойчивости растений арабидопсиса экзогенными NO и H2S по сравнению с белком COI1.
Сероводород (H2S) и оксид азота (NO) считаются важными молекулами-газотрансмиттерами, задействованными в регуляции многих функций растительного организма, в том числе ростовых процессов, органогенеза и адаптации к действию стрессоров различной природы [1, 2]. В частности, известно, что под влиянием экзогенных оксида азота [3] и сероводорода [4] повышается солеустойчивость растений разных видов.
Газотрансмиттеры тесно связаны с сетью гормонального сигналинга. С одной стороны, они участвуют в трансдукции гормональных сигналов в генетический аппарат растительной клетки [5], с другой – изменение концентрации газотрансмиттеров может оказывать влияние на гормональный комплекс [6–8], в том числе содержание жасмонатов [7]. Так, показано, что оксид азота может участвовать в трансдукции сигнала жасмоновой кислоты при реакции растений на ранение [7]. Вызываемое жасмоновой кислотой угнетение удлинения корней и усиление их латерального роста у арабидопсиса сопровождалось повышением содержания NO в корневой системе растений дикого типа [9]. В то же время экзогенный оксид азота слабо влиял на архитектуру корней мутантов coi1, дефектных по гену, кодирующему белок COI1, который считается рецептором жасмоната и участвует в удалении белков-репрессоров транскрипционных факторов жасмонатного сигналинга. Это указывает на роль компонентов жасмонатного сигналинга и (или) самой жасмоновой кислоты в реализации физиологических эффектов оксида азота [9].
Сероводород, наряду с оксидом азота, также задействован в проявлении физиологических эффектов жасмонатов. Показано повышение содержания сероводорода у растений арабидопсиса при их обработке жасмоновой кислотой [5]. С другой стороны, молекулярно-генетическими методами получены данные, указывающие на возможность влияния сероводорода на экспрессию гена, кодирующего белок-рецептор жасмоната COI1 [10].
Следует отметить, что сероводород и оксид азота также находятся в тесном функциональном взаимодействии друг с другом. Они могут конкурировать между собой при действии на одни и те же мишени, вызывая эффекты персульфидирования или нитрозилирования тиольных групп [11]. В то же время NO и H2S оказывают влияние и на синтез друг друга [11, 12].
Транскрипционный фактор JIN1/MYC2 контролирует экспрессию генов, индуцируемых не только жасмонатом, но и абсцизовой кислотой (АБК) [13, 14]. В настоящее время этот белок рассматривается в качестве одного из узловых в стрессовом сигналинге, в том числе при формировании защитных реакций растений на засуху и засоление [13]. На основании данных, полученных методами биоинформатики, было высказано предположение об участии генов семейства MYC в трансдукции сигналов оксида азота [15]. В наших экспериментах показано отсутствие заметного влияния экзогенного NO на солеустойчивость мутантов арабиопсиса jin1, дефектных по гену, кодирующему белок JIN1/MYC2, и ее существенное повышение у растений дикого типа при обработке донором оксида азота [16]. При этом, однако, остается неясным, играет ли транскрипционный фактор JIN1/MYC2 специфическую роль в реализации эффектов NO или же “нечувствительность” растений jin1 к экзогенному NO обусловлена нарушением жасмонатного сигналинга в целом.
Таким образом, факты, изложенные выше, позволяют предположить, что различные белки жасмонатного сигналинга могут быть задействованы в проявлении физиологических эффектов NO и H2S. Для проверки рабочей гипотезы о вовлечении жасмонатного сигналинга в реализацию стресс-протекторных эффектов газотрансмиттеров сравнивали влияние их доноров на солеустойчивость растений арабидопсиса дикого типа и мутантов по компонентам жасмонатного сигналинга – coi1 и jin1.
МАТЕРИАЛЫ И МЕТОДЫ
Для экспериментов использовали 4–5-недельные растения Arabidopsis thaliana L. дикого типа (Col-0) и мутантных линий coi1 и jin1, сем-ена которых были любезно предоставлены проф. Ж.-М. Нейгаузом (Университет Нашатель, Швейцария). Растения выращивали в водной культуре на среде Хогланда с модификациями при температуре 21/16°С (день/ночь), освещении 6000 лк и фотопериоде 10 ч [17]. В таких условиях растения накапливали достаточную биомассу розетки, но еще не переходили к цветению.
Донор H2S гидросульфид натрия и донор NO НПН вносили в питательную среду и инкубировали на ней растения в течение 24 ч. После этого их переносили на питательную смесь без NaHS и НПН, но с добавлением 175 мМ NaCl. После 24‑часовой инкубации растений в присутствии хлорида натрия среду заменяли на обычную. В предварительных опытах было установлено, что такое воздействие соли не приводило к потере тургора, но вызывало усиление пероксидного окисления липидов (ПОЛ) и снижение содержания хлорофилла в листьях при дальнейшем росте растений на обычной среде.
Оптимальные концентрации гидросульфида натрия (50 мкМ) и НПН (500 мкМ), наиболее эффективно предотвращающие накопление продукта ПОЛ малонового диальдегида (МДА) и снижение содержания хлорофиллов в листьях после воздействия солевого стресса, установлены в предварительных опытах (результаты не приводятся). Специфичность стресс-протекторного действия НПН как донора оксида азота на растения арабидопсиса была показана ранее путем использования скавенджера NO PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide). В его присутствии положительное влияние НПН на солеустойчивость растений дикого типа практически не проявлялось [16].
Для всех биохимических анализов использовали развитые розеточные листья 5–6 ярусов. Все показатели за исключением содержания фотосинтетических пигментов определяли сразу после окончания стрессового воздействия.
Водный дефицит оценивали по насыщению интактных листьев водой и выражали в процентах от общего содержания воды в состоянии полного насыщения [18].
Проницаемость мембран определяли по выходу электролитов из тканей [19]. Для этого регистрировали электропроводность водных экстрактов на кондуктометре ОК 102/1 (Radelkis, Венгрия). Навески листьев в стаканчиках инкубировали в воде при комнатной температуре в течение 2 ч. Затем измеряли электропроводность экстрактов с учетом поправки на воду. Для определения полного выхода электролитов из тканей стаканчики с образцами и экстрактами выдерживали на кипящей водяной бане в течение 20 мин. После охлаждения стаканчиков до комнатной температуры объем экстрактов в них доводили до исходного и вновь определяли электропроводность. Проницаемость мембран оценивали по экзоосмосу электролитов, рассчитанному в процентах от полного выхода.
Количество продуктов ПОЛ (в основном МДА) в листьях определяли по реакции с 2-тиобарбитуровой кислотой [17] и выражали в нмоль/г сухой массы. Сухую массу растений определяли путем высушивания при температуре (103 ± 1°С) до постоянной массы.
Фотосинтетические пигменты анализировали через 2 суток после действия соли на растения. Как показали предварительные опыты, именно через такое время после стрессового воздействия наблюдалось наиболее заметное снижение содержания хлорофилла в листьях. Пигменты экстрагировали из листьев этанолом и определяли содержание спектрофотометрическим методом [20]. Их количество выражали в мг/г сухой массы.
Активность супероксиддисмутазы (СОД) и каталазы (КАТ) определяли по методикам, подробно описанным ранее [16]. Навески листьев гомогенизировали на холоде в 0.15 М K,Na-фосфатном буфере (pH 7.6), содержавшем 0.1 мМ ЭДТА и 1 мМ дитиотрейтол. Для анализа использовали супернатант после центрифугирования гомогената при 8000 g на центрифуге MPW 350R (MedInstruments, Польша) в течение 10 мин при 4°С. Активность цитозольной супероксиддисмутазы (СОД, КФ 1.15.1.1), представляющей собой преимущественно Cu/Zn-СОД [21], определяли при pH 7.6, используя метод, основанный на способности фермента конкурировать с тетразолием нитросиним за супероксидные анионы, образующиеся вследствие аэробного взаимодействия НАД·H и феназинметосульфата. Активность КАТ (КФ 1.11.1.6) анализировали при рН 7.0 по количеству разложившегося пероксида водорода за единицу времени. Активность СОД выражали в усл. ед./(мг белка × × мин), активность КАТ – в мкмоль H2O2/(мг белка × мин). Содержание белка определяли по Bradford [22].
Содержание пролина в листьях анализировали по методу Bates и соавт. [23] и выражали в мкмоль/г сухой массы.
Опыты проводили в 3-кратной биологической повторности и каждый опыт независимо воспроизводили 3 раза. На рисунках и в таблице приведены средние величины и их стандартные ошибки. Кроме специально оговоренных случаев, обсуждаются различия, достоверные при P ≤ 0.05. Достоверность различий определяли по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ
Водный дефицит листьев при солевом стрессе
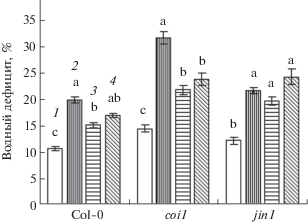
При воздействии NaCl водный дефицит тканей листьев арабидопсиса всех трех генотипов увеличивался приблизительно в два раза (рис. 1). Обработка растений дикого типа донором сероводорода NaHS перед солевым стрессом существенно уменьшала его проявление в стрессовых условиях. При действии НПН эффект снижения водного дефицита у растений Col-0 проявлялся на уровне тенденции (был достоверным при P ≤ 0.1). Заметное уменьшение водного дефицита в вариантах с предобработкой NaHS и НПН наблюдалось и у мутантов coi1. В то же время у растений генотипа jin1, обработанных перед стрессовым воздействием донорами сероводорода и оксида азота, водный дефицит не уменьшался (рис. 1).
Рис. 1.
Водный дефицит листьев арабидопсиса при действии NaCl и доноров сероводорода и оксида азота. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + + NaHS (50 мкМ); 4 – NaCl (175 мМ) + НПН (500 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05 в пределах каждого генотипа.
Пероксидное окисление липидов, проницаемость мембран и содержание фотосинтетических пигментов в листьях при солевом стрессе
Инкубация растений на среде с NaCl вызывала повышение содержания продукта ПОЛ МДА в листьях растений всех трех изучаемых генотипов (рис. 2а). Предобработка донорами сероводорода и оксида азота значительно уменьшала стресс-индуцированное накопление МДА у растений дикого типа, но практически не влияла на его содержание у обоих мутантов, дефектных по жасмонатному сигналингу.
Рис. 2.
Содержание МДА (а) и выход электролитов из листьев арабидопсиса (б) при действии NaCl и доноров сероводорода и оксида азота. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + NaHS (50 мкМ); 4 – NaCl (175 мМ) + + НПН (500 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05 в пределах каждого генотипа.

Смягчение донором сероводорода вызываемых солевым стрессом окислительных повреждений листьев растений Col-0 уменьшало и экзоосмос электролитов из тканей листьев, то есть способствовало сохранению целостности мембран (рис. 2б). Обработка растений дикого типа донором оксида азота оказывала подобный мембранопротекторный эффект на уровне тенденции (достоверно при P ≤ 0.1). В то же время предобработка мутантов coi1 и jin1 донорами H2S и NO существенно не влияла на проницаемость мембран клеток листьев при солевом стрессе (рис. 2б).
После воздействия соли у растений всех трех генотипов снижалось содержание хлорофиллов, в наибольшей степени этот эффект проявлялся у мутантов jin1 (табл. 1). Предобработка NaHS и НПН способствовала сохранению пула хлорофиллов в листьях в стрессовых условиях у растений дикого типа, но не у мутантов, дефектных по жасмонатному сигналингу. Следует отметить, что в отсутствие воздействия NaCl в течение четырех суток эксперимента содержание хлорофиллов в листьях достоверно не изменялось, не наблюдалось и достоверных отличий по этому показателю и между различными генотипами (результаты не приводятся).
Таблица 1.
Содержание фотосинтетических пигментов (мг/г сухой массы) в листьях арабидопсиса при действии NaCl и доноров сероводорода и оксида азота
| Вариант | Хлорофилл a | Хлорофилл b | Хлорофиллы a + b | Каротиноиды |
|---|---|---|---|---|
| Col-0 | ||||
| Контроль | 10.20 ± 0.18a* | 5.24 ± 0.08a | 15.44 ± 0.20a | 1.41 ± 0.03a |
| NaCl (175 мМ) | 8.14 ± 0.16b | 4.98 ± 0.10a | 13.12 ± 0.19b | 1.56 ± 0.06a |
| NaCl (175 мМ) + + NaHS (50 мкМ) | 9.89 ± 0.13a | 5.33 ± 0.11a | 15.22 ± 0.17a | 1.47 ± 0.04a |
| NaCl (175 мМ) + + НПН (500 мкМ) | 9.28 ± 0.16a | 5.16 ± 0.08a | 14.44 ± 0.18a | 1.52 ± 0.06a |
| coi1 | ||||
| Контроль | 10.46 ± 0.20a | 5.74 ± 0.10a | 16.20 ± 0.22a | 1.71 ± 0.07a |
| NaCl (175 мМ) | 8.52 ± 0.18b | 5.48 ± 0.06a | 14.00 ± 0.19b | 1.74 ± 0.08a |
| NaCl (175 мМ) + + NaHS (50 мкМ) | 8.64 ± 0.16b | 5.77 ± 0.07a | 14.41 ± 0.17b | 1.55 ± 0.05a |
| NaCl (175 мМ) + + НПН (500 мкМ) | 8.37 ± 0.19b | 5.25 ± 0.10a | 13.62 ± 0.21b | 1.55 ± 0.05a |
| jin1 | ||||
| Контроль | 10.14 ± 0.16a | 5.60 ± 0.10a | 15.74 ± 0.19a | 1.76 ± 0.07a |
| NaCl (175 мМ) | 6.90 ± 0.12b | 3.81 ± 0.13c | 10.71 ± 0.18c | 1.55 ± 0.04a |
| NaCl (175 мМ) + + NaHS (50 мкМ) | 7.24 ± 0.14b | 4.67 ± 0.09b | 11.91 ± 0.17b | 1.48 ± 0.06a |
| NaCl (175 мМ) + + НПН (500 мкМ) | 6.52 ± 0.18b | 3.71 ± 0.07c | 10.23 ± 0.19c | 1.55 ± 0.05a |
Содержание каротиноидов в листьях растений трех генотипов при умеренном стрессовом воздействии достоверно не изменялось (табл. 1). Их предобработка донорами сероводорода и оксида азота существенно не влияла на количество каротиноидов.
Активность антиоксидантных ферментов и содержание пролина в листьях
Изучаемые генотипы арабидопсиса отличались по активности СОД в отсутствие стресса. У генотипа coi1 она была выше, а у jin1 существенно ниже, чем у растений дикого типа (рис. 3а). Инкубация растений на среде с NaCl вызывала снижение активности фермента у растений всех трех изучаемых генотипов. Предобработка NaHS растений дикого типа способствовала сохранению активности СОД в листьях на уровне, близком к контролю, а предварительное воздействие НПН вызывало существенное повышение активности фермента по сравнению с контрольным вариантом (рис. 3а). В то же время предстрессовая обработка растений coi1 и jin1 донорами сероводорода и оксида азота не влияла на активность СОД в условиях действия NaCl.
Рис. 3.
Активность СОД (а) и КАТ (б) в листьях арабидопсиса при действии NaCl и доноров сероводорода и оксида азота. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + NaHS (50 мкМ); 4 – NaCl (175 мМ) + НПН (500 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05 в пределах каждого генотипа.
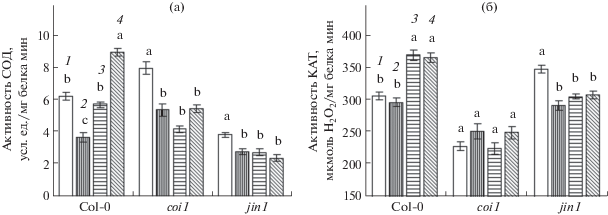
Активность КАТ в контроле у растений coi1 была существенно ниже, а у растений jin1 несколько выше по сравнению с Col-0 (рис. 3б). Солевое стрессовое воздействие не оказывало заметного влияния на активность фермента у растений дикого типа и мутантов coi1, но вызвало ее снижение у генотипа jin1. Предобработка донорами H2S и NO приводила к повышению активности КАТ у растений дикого типа при действии стрессора (рис. 3б). В то же время такие воздействия не влияли на активность фермента у мутантов coi1 и jin1.
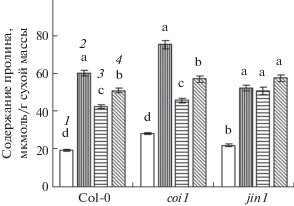
Содержание пролина в обычных условиях в листьях растений генотипа coi1 было выше по сравнению с таковым у растений дикого типа и мутантов jin1 (рис. 4). Инкубация на среде с NaCl вызывала приблизительно трехкратное увеличение содержания пролина у растений дикого типа и мутантов coi1. У растений jin1 этот эффект был немного меньшим. Предобработка растений дикого типа и мутантов coi1 донорами сероводорода и оксида азота достоверно уменьшала стресс-индуцированное накопление пролина в листьях (рис. 4). В то же время доноры H2S и NO не оказывали существенного влияния на содержание пролина при стрессовом воздействии у растений генотипа jin1.
Рис. 4.
Содержание пролина в листьях арабидопсиса при действии NaCl и доноров сероводорода и оксида азота. 1 – контроль; 2 – NaCl (175 мМ); 3 – NaCl (175 мМ) + NaHS (50 мкМ); 4 – NaCl (175 мМ) + + НПН (500 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05 в пределах каждого генотипа.
ОБСУЖДЕНИЕ
В условиях наших экспериментов предобработка донорами газотрансмиттеров – сероводорода и оксида азота – повышала устойчивость растений арабидопсиса дикого типа к действию NaCl. Это выражалось в уменьшении водного дефицита листьев (рис. 1), предотвращении окислительных повреждений, снижении стресс-индуцируемого выхода электролитов из тканей (рис. 2), а также сохранении пула хлорофилла (табл. 1). Можно полагать, что сероводород и оксид азота как сигнальные молекулы активируют протекторные системы растений, вызывая эффекты преадаптации. Одним из таких эффектов, обнаруженных в настоящей работе, является повышение под влиянием доноров H2S и особенно NO активности ключевого антиоксидантного фермента СОД (рис. 3а), выполняющего функции “первого рубежа” в защите клеток от радикальных АФК [21]. Также у растений дикого типа, обработанных NaHS и НПН, при действии NaCl повышалась активность КАТ (рис. 3б), обезвреживающей пероксид водорода и функционирующей сопряженно с СОД. Эти результаты согласуются с данными литературы об усилении функционирования антиоксидантной системы растений при действии экзогенных сероводорода и оксида азота. Так, в работе Shi и соавт. [24] под влиянием сероводорода у растений арабидопсиса дикого типа при длительном действии соли в почвенной культуре повышалась активность СОД, КАТ и глутатионредуктазы и увеличивался редокс-статус глутатиона. В целом феноменологически похожие эффекты в наших опытах проявлялись и при обработке растений Col-0 донором другого газотрансмиттера – оксида азота (рис. 3). Повышение активности СОД и КАТ, а также некоторых других антиоксидантных ферментов зарегистрировано у растений разных видов и под влиянием НПН, особенно на фоне засоления [25].
Обработка растений арабидопсиса дикого типа донорами сероводорода и оксида азота приводила к ослаблению стресс-индуцируемого накопления пролина в листьях (рис. 4). Несмотря на важность пролина как мультифункционального протектора, меньшее повышение его содержания при умеренном солевом воздействии может указывать на большую резистентность растений [26]. Иными словами, при большей резистентности “порог” активации накопления пролина стрессовым фактором может быть более высоким. Можно полагать, что у растений, преадаптированных действием доноров сероводорода и оксида азота, помимо накопления пролина, активно функционируют другие защитные механизмы, в частности, ферментативная составляющая антиоксидантной системы. Как известно, в ряде случаев между пролином и СОД возможна функциональная взаимозаменяемость как агентами, обеспечивающими защиту от свободных радикалов [27].
В нашей работе изучались лишь отдельные составляющие антиоксидантной и осмопротекторной систем растений арабидопсиса, функционирующих при солевом стрессе. Естественно, что полученные данные не раскрывают полноты влияния газотрансмиттеров на защитные системы, функционирующие при солевом стрессе. Однако, доноры сероводорода и оксида азота несомненно способствовали повышению солеустойчивости растений арабидопсиса дикого типа, что зафиксировано по таким интегральным показателям, как уровень ПОЛ, проницаемость мембран, величина водного дефицита и пул фотосинтетических пигментов. При этом сходство феноменологии протекторного действия газотрансмиттеров H2S и NO при обработке растений NaCl представляется достаточно закономерным. Имеющиеся в литературе сведения указывают, что эти молекулы находятся в сложном функциональном взаимодействии друг с другом, в том числе при индуцировании устойчивости растений к стрессорам. Так, положительное влияние донора сероводорода NaHS на солеустойчивость и экспрессию генов антиоксидантных ферментов у растений ячменя не проявлялось в присутствии скавенджера оксида азота PTIO [4]. С другой стороны, показано, что индуцируемое донором оксида азота нитропруссидом натрия развитие теплоустойчивости проростков кукурузы сопровождалось повышением содержания H2S [28].
Как уже отмечалось, H2S и NO функционально взаимодействуют не только друг с другом, но и с сетью гормонального сигналинга. Одним из “узловых” элементов такого взаимодействия может быть транскрипционный фактор JIN1/MYC2, который принимает участие не только в реализации физиологических эффектов жасмоновой кислоты, но и АБК [13]. Как показывают полученные результаты, у растений арабидопсиса jin1, дефектных по гену, кодирующему этот белок, не проявлялся эффект индуцирования солеустойчивости действием доноров оксида азота и сероводорода. Обработка этих растений НПН и NaHS, в отличие от растений дикого типа, при действии соли не способствовала снижению водного дефицита (рис. 1), не уменьшала окислительные повреждения (рис. 2) и не стабилизировала содержание хлорофиллов (табл. 1). Также у мутантов jin1, предобработанных донорами NO и H2S, не наблюдалось повышения активности антиоксидантных ферментов в стрессовых условиях (рис. 3). Кроме того, их обработка экзогенными газотрансмиттерами не влияла на уровень стресс-индуцируемого накопления пролина (рис. 4). Следует отметить, что отсутствие влияния донора оксида азота на солеустойчивость растений генотипа jin1 было показано нами ранее при использовании более сильного стрессового воздействия [16].
Результаты, полученные в настоящей работе, указывают, что в реализации протекторного действия оксида азота и сероводорода задействован не только транскрипционный фактор JIN1/MYC2, но и, вероятно, другие компоненты жасмонатного сигналинга. Так, у мутантов coi1, дефектных по рецептору жасмоновой кислоты, стресс-протекторное действие доноров NO и H2S проявлялось слабее, чем у растений дикого типа. В частности, предстрессовая обработка coi1 НПН и NaHS не уменьшала вызываемое засолением накопление продуктов ПОЛ в листьях и усиление выхода электролитов из тканей (рис. 2). Также обработка обоими донорами газотрансмиттеров не стабилизировала пул хлорофиллов при действии NaCl (табл. 1). Не наблюдалось у растений coi1 и заметного влияния доноров NO на активность СОД и КАТ при солевом стрессе (рис. 3). Таким образом, в целом растения coi1, как и мутанты jin1, слабо реагировали на действие экзогенных NO и H2S. Однако, между этими мутантами обнаруживались и некоторые отличия в проявлении ответной реакции на засоление после обработки гидросульфидом натрия и НПН. Так, у растений coi1 предварительное воздействие доноров NO и H2S уменьшало эффект стресс-индуцируемого накопления пролина (рис. 4). У этих мутантов под влиянием доноров оксида азота и сероводорода при действии NaCl несколько уменьшался водный дефицит (рис. 1). Иными словами, у мутантов coi1, в отличие от jin1, частично проявлялось стресс-протекторное действие доноров сероводорода и оксида азота. Возможно, что транскрипционный фактор JIN1/MYC2 играет более важную роль в индуцировании солеустойчивости растений арабидопсиса экзогенными NO и H2S по сравнению с белком COI1, поскольку он, по-видимому, вовлечен не только в реализацию эффектов жасмоната, но и ряд других сигнальных процессов. Как уже отмечалось, методами биоинформатики получены данные о возможной роли генов семейства MYC в передаче сигналов оксида азота [15]. Транскрипционный фактор JIN1/MYC2 задействован и в передаче сигнала АБК [13]. При этом NO и H2S могут выступать в роли посредников в реализации эффектов АБК [29], но оксид азота также способен индуцировать ее синтез [30].
С другой стороны, имеются сведения, указывающие на возможность усиления сероводородом экспрессии гена COI1, кодирующего белок-рецептор жасмоната [10]. Таким образом, вполне вероятно, что некоторые физиологические эффекты сероводорода могут реализовываться с участием жасмонатного сигнального пути. Как уже отмечалось, жасмонатный сигналинг, опосредованный белком COI1, также может принимать участие в действии оксида азота на некоторые физиологические процессы (например, формирование корневой системы) [9].
В целом, полученные результаты позволяют говорить о вовлечении компонентов жасмонатного сигналинга в реализацию протекторного действия экзогенных оксида азота и сероводорода на растения арабидопсиса при солевом стрессе.
Работа выполнена в рамках проекта “Роль сигнальных посредников и соединений с гормональной активностью в формировании адаптивных реакций растений на абиотические стрессоры”, финансируемого за счет средств государственного бюджета Украины (№ госрегистрации 0117U002427).
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Yamasaki H., Cohen M.F. Biological consilience of hydrogen sulfide and nitric oxide in plants: Gases of primordial earth linking plant, microbial and animal physiologies // Nitric Oxide. 2016. V. 55–56. P. 91.
Kolupaev Yu.E., Karpets Yu.V., Beschasniy S.P., Dmitriev A.P. Gasotransmitters and their role in adaptive reactions of plant cells // Cytol. Genet. 2019. V. 53. P. 392.
Холодова В.П., Гринин А.Л., Башмакова Е.Б., Мещеряков А.Б., Кузнецов Вл.В. Протекторный эффект оксида азота на рост растений горчицы при засолении определяет NO-зависимая аккумуляция неорганических ионов и пролина // Докл. РАН. 2011. Т. 439. С. 425.
Chen J., Wang W.H., Wu F.H., He E.M., Liu X., Shangguan Z.P., Zheng H.L. Hydrogen sulfide enhances salt tolerance through nitric oxide-mediated maintenance of ion homeostasis in barley seedling roots // Sci. Rep. 2015. V. 5: 12516. https://doi.org/10.1038/srep12516
Shan C., Wang T., Zhou Y., Wang W. Hydrogen sulfide is involved in the regulation of ascorbate and glutathione metabolism by jasmonic acid in Arabidopsis thaliana // Biol. Plant. 2018. V. 62. P. 188.
Масленникова Д.Р., Аллагулова Ч.Р., Федорова К.А., Плотников А.А., Авальбаев А.М., Шакирова Ф.М. Вклад цитокининов в реализацию рост-стимулирующего и протекторного действия оксида азота на растения пшеницы // Физиология растений. 2017. Т. 64. С. 355.
Huang X., Stettmaier K., Michel C., Hutzler P., Mueller M.J., Durner J. Nitric oxide is induced by wounding and influences jasmonic acid signaling in Arabidopsis thaliana // Planta. 2004. V. 218. P. 938.
Banerjee A., Tripathi D.K., Roychoudhury A. Hydrogen sulphide trapeze: Environmental stress amelioration and phytohormone crosstalk // Plant Physiol. Biochem. 2018. V. 132. P. 46.
Barrera-Ortiz S., Garnica-Vergara A., Esparza-Reynoso S., García-Cárdenas E., Raya-González J., Ruiz-Herrera L.F., López-Bucio J. Jasmonic acid-ethylene crosstalk via ETHYLENE INSENSITIVE 2 reprograms Arabidopsis root system architecture through nitric oxide accumulation // J. Plant Growth Regul. 2018. V. 37. P. 438.
Li H., Li M., Wei X., Zhang X., Xue R., Zhao Y., Zhao H. Transcriptome analysis of drought-responsive genes regulated by hydrogen sulfide in wheat (Triticum aestivum L.) leaves // Mol. Genet. Genomics. 2017. V. 292. P. 1091.
Corpas F.J., González-Gordo S., Canas A., Palma J.M. Nitric oxide (NO) and hydrogen sulfide (H2S) in plants: Which is first? // J. Exp. Bot. 2019. V. 70. P. 4391.
Paul S., Roychoudhury A. Regulation of physiological aspects in plants by hydrogen sulfide and nitric oxide under challenging environment // Physiol. Plant. 2019. https://doi.org/10.1111/ppl.13021
Ton J., Flors V., Mauch-Mani B. The multifaceted role of ABA in disease resistance // Trends Plant Sci. 2009. V. 14. P. 310.
Lackman P., González-Guzmán M., Tilleman S., Carqueijeiro I., Pérez A.C., Moses T., Seo M., Kanno Y., Häkkinen S.T., Montagu M.C.E.V., Thevelein J.M., Maaheimo H., Oksman-Caldentey K.M., Rodriguez P.L., Rischer H. et al. Jasmonate signaling involves the abscisic acid receptor PYL4 to regulate metabolic reprogramming in Arabidopsis and tobacco // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 5891.
Palmieri M.C., Sell S., Huang X., Scherf M., Werner T., Durner J., Lindermayr C. Nitric oxide-responsive genes and promoters in Arabidopsis thaliana: a bioinformatics approach // J. Exp. Bot. 2008. V. 59. P. 177.
Ястреб Т.О., Колупаев Ю.Е., Карпец Ю.В., Дмитриев А.П. Действие донора оксида азота на солеустойчивость растений арабидопсиса дикого типа и мутантов jin1 // Физиология растений. 2017. Т. 64. С. 142.
Ястреб Т.О., Колупаев Ю.Е., Луговая А.А., Дмитриев А.П. Содержание осмолитов и флавоноидов у растений Arabidopsis thaliana, дефектных по жасмонатному сигналингу, при солевом стрессе // Прикл. биохимия и микробиология. 2016. Т. 52. С. 223.
Гончарова Э.А. Водный статус культурных растений и его диагностика. С.-Петербург: ГНЦ РФ ВИР, 2005. 112 с.
Хохлова Л.П., Валиуллина Р.Н., Мидер Д.Р., Акберова Н.И. Термостабильность мембран и экспрессия генов низкомолекулярных белков теплового шока (мБТШ) при действии на растения повышенных температур и водного дефицита // Биологические мембраны. 2015. Т. 32. С. 59.
Шлык А.А. Определение хлорофиллов и каротиноидов в экстрактах зеленых листьев // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 154.
Alscher R.G., Erturk N., Heath L.S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants // J. Exp. Bot. 2002. V. 53. P. 1331.
Bradford M.M. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Bates L.S., Walden R.P., Tear G.D. Rapid determination of free proline for water stress studies // Plant Soil. 1973. V. 39. P. 205.
Shi H., Ye T., Han N., Bian H., Liu X., Chan Z.J. Hydrogen sulfide regulates abiotic stress tolerance and biotic stress resistance in Arabidopsis // Integr. Plant Biol. 2015. V. 57. P. 628.
Wu X., Zhu W., Zhang H., Ding H., Zhang H.J. Exogenous nitric oxide protects against salt-induced oxidative stress in the leaves from two genotypes of tomato (Lycopersicom esculentum Mill.) // Acta Physiol. Plant. 2011. V. 33. P. 1199.
Кузнецов Вл.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм, регуляция // Физиология растений. 1999. Т. 46. С. 321.
Шевякова Н.И., Бакулина Е.А., Кузнецов Вл.В. Антиоксидантная роль пролина у галофита хрустальной травки при действии засоления и параквата, инициирующих окислительный стресс // Физиология растений. 2009. Т. 56. С. 736.
Li Z.G., Yang S.Z., Long W.B., Yang G.X., Shen Z.Z. Hydrogen sulphide may be a novel downstream signal molecule in nitric oxide-induced heat tolerance of maize (Zea mays L.) seedlings // Plant Cell Environ. 2013. V. 36. P. 1564.
Scuffi D., Álvarez C., Laspina N., Gotor C., Lamattina L., García-Mata C. Hydrogen sulfide generated by L-cysteine desulfhydrase acts upstream of nitric oxide to modulate abscisic acid-dependent stomatal closure // Plant Physiol. 2014. V. 166. P. 2065.
Xing H., Tan L., An L., Zhao Z., Wang S., Zhang C. Evidence for the involvement of nitric oxide and reactive oxygen species in osmotic stress tolerance of wheat seedlings: inverse correlation between leaf abscisic acid accumulation and leaf water loss // Plant Growth Regul. 2004. V. 42. P. 61.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


