Физиология растений, 2020, T. 67, № 6, стр. 644-653
Зависимость окраски плодов перца от соотношения основных пигментов и профиля экспрессии генов биосинтеза каротиноидов и антоцианов
М. А. Филюшин a, *, Е. А. Джос a, b, А. В. Щенникова a, Е. З. Кочиева a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
Москва, Россия
b Федеральный научный центр овощеводства
Московская обл., п. ВНИИССОК, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 27.02.2020
После доработки 06.03.2020
Принята к публикации 10.03.2020
Аннотация
Проведен биохимический анализ плодов перца (Capsicum annuum L.) четырех сортов, контрастных по окраске незрелого и зрелого плодов, и определен паттерн изменения содержания хлорофиллов, каротиноидов и антоцианов в кожице и мякоти плодов в динамике их созревания. Было выявлено, что разные части перикарпа (кожица и мякоть) имеют различный состав пигментов и паттерн их накопления. В тех же тканях плодов охарактеризован профиль экспрессии структурных генов каротиноидного (PSY1, PSY2, LCYb и CCS) и антоцианового (CHS, F3'5'H, DFR, ANS и UFGT) путей. Выявлена положительная корреляция между экспрессией генов PSY1, LCYb и CCS и содержанием суммы каротиноидов в мякоти плодов, а также между экспрессией CCS и содержанием каротиноидов в кожице плодов. Для сортов перца с фиолетовой окраской незрелого плода (Сиреневый куб, Отелло) показана положительная корреляция уровня экспрессии генов CHS, F3'5'H, DFR, ANS и UFGT с содержанием антоцианов в кожице плодов. Таким образом, продемонстрировано, что окраска кожицы и мякоти плодов перца регулируется независимо и определяется соотношением основных типов пигментов и активностью генов их биосинтеза.
ВВЕДЕНИЕ
Многие растения формируют окрашенные цветки и сочные плоды для привлечения насекомых, птиц и других животных, которые являются опылителями или распространителями семян. Помимо этого, окраска плодов агрокультур влияет на их коммерческую ценность. Перец овощной (Capsicum annuum L.) – одна из основных овощных культур семейства Solanaceae [1]. Дикорастущие формы C. annuum формируют небольшие ярко-красные плоды, привлекающие птиц, но в процессе доместикации и селекции появились новые генотипы с крупными красными, желтыми, оранжевыми, коричневыми и даже белыми плодами [2].
У современных сортов перца C. annuum окраска плодов на стадии биологической зрелости, за редким исключением, может быть красной, желтой или оранжевой, тогда как пигментация незрелого плода (техническая спелость) может значительно варьировать – от светло-зеленой до фиолетовой, шоколадно-коричневой и почти черной. Такое многообразие окраски кожицы (экзокарпа) обусловлено комбинацией трех основных групп пигментов – хлорофиллов, каротиноидов и антоцианов [1, 3]. Хлорофиллы придают плодам зеленую окраску, а каротиноиды капсантин и капсорубин – красную [1, 4, 5]. Желтая и оранжевая окраска плодов обусловлена преимущественно каротиноидами виолоксантином, лютеином и β-каротином [6]. Фиолетовая окраска незрелых плодов определяется накоплением в экзокарпе антоцианидинов (производных дельфинидина) [7, 8]. Одновременное присутствие в экзокарпе больших количеств антоцианов, хлорофилла и некоторых каротиноидов приводит к визуально черным плодам [9]. Подобное разнообразие окраски плода, а также ее изменения в процессе созревания сделали перец C. annuum модельной системой для изучения молекулярно-генетических механизмов пигментации плодов [2]. Динамика изменения содержания пигментов и их качественного состава в плодах перца активно исследуется на протяжении последних 30 лет, однако, как правило, в этих исследованиях изучается либо плод целиком (перикарп), либо его мякоть (мезокарп и эндокарп) [1, 2, 10, 11].
Биосинтез каротиноидов в плодах высших растений детально охарактеризован, определены все ферменты пути и кодирующие их гены (рис. 1а) [3, 11, 12]. Исходным субстратом является фитоен, из которого в результате нескольких реакций десатурации образуется ликопин, являющийся предшественником α- и β-каротинов. В результате дальнейших ферментативных реакций происходит насыщение β-каротина атомами кислорода и образование ксантофиллов – β-криптоксантина, зеаксантина, антраксантина и виолоксантина. Специфичный для видов Capsicum фермент капсантин-капсорубинсинтаза (CCS) катализирует синтез из ксантофиллов двух красных пигментов, капсантина и капсорубина, придающих красный цвет плодам перца [4]. Мутации в гене CCS приводят к его выключению либо к снижению активности кодируемого белка, в результате чего плоды перца приобретают желтую или оранжевую окраску [1, 2, 11, 13]. При этом различные оттенки желтого и оранжевого являются следствием мутаций в других структурных генах биосинтеза каротиноидов [3].
Рис. 1.
Схема биосинтеза каротиноидов (а) и антоцианов (б) в плодах Capsicum [11, 12, 14, 15]. Рядом со стрелками указаны ферменты, катализирующие данные реакции: (а) – фитоенсинтаза (PSY), фитоендесатураза (PDS), ζ-каротиндесатураза (ZDS), β-ликопинциклаза (β-LCY), ε-ликопинциклаза (ɛ-LCY), β-каротингидроксилаза (β-CH), ɛ-каротингидроксилаза (ɛ-CH), зеаксантинэпоксидаза (ZE), виолаксантиндеэпоксидаза (VDE), капсантин-капсорубинсинтаза (CCS); (б) – фенилаланинаммониалиаза (PAL), циннамат-4-гидроксилаза (C4H), 4-кумарат-кофермент А-лигаза (4CL), халконсинтаза (CHS), халконизомераза (CHI), флавоноид-3'-гидроксилаза (F3'H), флавоноид-3',5'-гидроксилаза (F3'5'H), дигидрофлавонол-4-редуктаза (DFR), антоцианидинсинтаза (ANS), UDP-глюкозофлавоноид-3-O-глюкозилтрансфераза (UFGT).
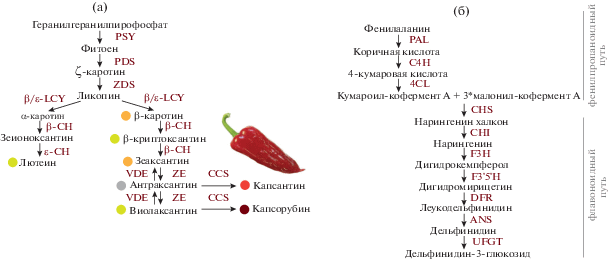
Путь биосинтеза антоцианов (флавоноидный путь) у видов Capsicum также хорошо изучен, определены все ферменты и кодирующие их гены [14, 15] (рис. 1б). Из исходного субстрата фенилаланина в результате шести ферментативных реакций образуется дигидрокемпферол и далее дигидромирицетин. Затем в результате трех последовательных ферментативных реакций образуется пигмент дельфинидин-3-глюкозид, определяющий фиолетовую окраску [14, 16]. Эти реакции опосредованы дигидрофлавонол-4-редуктазой (DFR), антоцианидинсинтазой (ANS) и UDP-глюкозофлавоноид-3-O-глюкозилтрансферазой (UFGT).
Цель работы – исследование молекулярно-генетических основ изменения окраски кожицы и мякоти плодов перца овощного (Capsicum annuum) в процессе их созревания путем сопоставления биохимических данных о содержании основных пигментов с профилями экспрессии структурных генов биосинтеза каротиноидов и антоцианов у сортов с различной моделью формирования пигментации плодов.
МАТЕРИАЛЫ И МЕТОДЫ
Плоды четырех сортов перца C. annuum на трех стадиях развития были использованы для биохимического и экспрессионного анализа (рис. 2а–г). Растения были выращены в пленочной теплице в Федеральном научном центре овощеводства (ФНЦО, Московская область), плоды каждого сорта на трех стадиях развития были собраны в один день. Стадия 1 – незрелый плод, стадия 2 – бланжевый плод (переходный этап от незрелого к зрелому плоду), стадия 3 – биологическая спелость. Выбранные сорта отличались динамикой окраски кожицы и мякоти плода по мере созревания (рис. 2а–г). Для биохимического и экспрессионного анализа с каждого плода использовали отдельные части перикарпа: кожицу (экзокарп) и продольные (от плодоножки до кончика плода) сегменты мякоти (мезокарп и эндокарп) с различных частей плода. Полученный материал растирали в жидком азоте и хранили на –80ºС.
Рис. 2.
Плоды сортов перца C. annuum на разных стадиях созревания, где стадии 1 и 2 соответствуют незрелому плоду, а стадия 3 – плоду биологической зрелости. Сорта: (а) – Желтый букет, (б) – Сибиряк, (в) – Сиреневый куб, (г) – Отелло.

Содержание хлорофиллов (a и b), каротиноидов (суммарное) и антоцианов (суммарное) в кожице и мякоти плодов определяли спектрофотометрически в хлороформ-метанольных экстрактах, содержание пигментов рассчитывали по формулам [17, 18] в двух биологических и трех технических повторах. Суммарную РНК из кожицы и мякоти плодов выделяли и очищали от примесей ДНК с использованием наборов RNeasy Plant Mini Kit и RNase free DNasy set (“Qiagen”, Германия). Препараты кДНК синтезировали с использованием набора GoScriptтм Reverse Transcription System (“Promega”, США).
Профиль экспрессии структурных генов каротиноидного (PSY1, PSY2, LCYb и CCS) и антоцианового (CHS, F3'5'H, DFR, ANS и UFGT) путей определяли методом ПЦР в реальном времени (РВ–ПЦР). Праймерные пары для РВ–ПЦР были разработаны на основе доступных в базе данных NCBI последовательностей: PSY1 (X68017), PSY2 (XM_016704726.1), LCYb (X86221), CCS (X77289), CHS (NM_001325005.1), F3’5’H (XM_016693437.1), DFR (JN885196), UFGT (NM_001324611.1) (табл. 1). Для гена ANS использовали последовательности праймеров из работы [15]. Относительный уровень экспрессии генов оценивали, нормализуя его по референсному гену Actin7 [19]. Для РВ–ПЦР использовали набор “Реакционная смесь для проведения РВ–ПЦР в присутствии SYBR GreenI и ROX” (“Синтол”, Россия) и амплификатор CFX96 Real-Time PCR Detection System (“Bio-Rad Laboratories”, США). Реакции проводили в трех технических повторностях в следующих условиях: 95°C – 5 мин; 40 циклов (95°C – 15 с, 62°C – 50 с). Статистическую обработку результатов проводили с помощью программы GraphPad Prism v. 7.02 (https://www.graphpad.com).
Таблица 1.
Последовательности праймеров для проведения РВ-ПЦР
| Ген | Последовательность праймеров |
|---|---|
| PSY1 | 5'-GTGAAGAGACAGCTGAGATCG-3' 5'-TCTCCGGAGTCATTAGCATCG-3' |
| PSY2 | 5'-AAGGAGTCGCAGAACTGAGC-3' 5'-GTCGTTCGCTTCAATCTCATCTAA-3' |
| LCYb | 5'-GGGTTGTTGTGGATCTTGCTG-3' 5'-CCATAGCCTCAAATTCATCCACC-3' |
| CCS | 5'-GCTATTGGTGGGACTTCAGG-3' 5'-CTTTCGACGATGGCCTCAGC-3' |
| CHS | 5'-CTGTGTTGATCAAGCCACCTATC-3' 5'-CTAGCATCAAGAGAAGGAGCCA-3' |
| F3’5’H | 5'-TCCAATCGTCCAACTAATGCAG-3' 5'-CCTAGCTCATTGGCACGAACA-3' |
| DFR | 5'-GCT GGA TTT ATC GGC TCT TGG-3' 5'-GTCTGCTTTCCACAGCGTTAAG-3' |
| ANS | 5'-CAAATGCCCACAACCAGAACTAGC-3' 5'-CGCACTTTGCAGTTACCCACTTTC-3' |
| UFGT | 5'-CAATGAAAGAGGCAGAGGAGGA-3' 5'-GCAGTCCAAAATGCAATCCAAGG-3' |
| Actin7 | 5'-CATTGTGCTCAGTGGTGGTTC-3' 5'-TCTGCTGGAAGGTGCTAAGTG-3' |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика содержания пигментов в плодах перца по мере созревания
В кожице и мякоти плодов перца четырех сортов, контрастных по окраске незрелого и зрелого плодов, было определено содержание трех основных групп пигментов. Наибольшее содержание хлорофиллов (а + b) было выявлено в кожице и мякоти незрелых плодов сортов Желтый букет (312.6 и 72.5 мкг/г, соответственно) и Сибиряк (147.8 и 43.5 мкг/г, соответственно), что определяло их темно-зеленую окраску, однако по мере созревания плодов содержание хлорофилла в кожице значительно снижалось (рис. 3а, б). Несмотря на желтую и красную окраску зрелых плодов, в их кожице также было детектировано небольшое количество хлорофиллов, что, по-видимому, обуславливало зеленый оттенок некоторых участков плодов. В мякоти плодов перца Желтый букет и Сибиряк наличие хлорофиллов было выявлено только на стадии 1.
Рис. 3.
Содержание (мкг/г сырой массы) хлорофилла a (а), хлорофилла b (б), суммы каротиноидов (в) и суммы антоцианов (г) в кожице (К) и мякоти (М) плодов перца в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической зрелости).

У сорта Сиреневый куб в мякоти незрелых плодов, имеющих зеленоватый оттенок, было выявлено относительно невысокое содержание хлорофиллов – 20.5 (стадия 1) и 3.2 (стадия 2) мкг/г. В зрелом плоде (стадия 3) присутствовали следовые количества хлорофилла b и только в кожице. В случае сорта Отелло минимальные количества хлорофиллов (а + b) наблюдались в незрелом плоде как в кожице (16.7 мкг/г), так и в мякоти (5.8 мкг /г). При этом, в отличие от других анализируемых сортов, суммарное содержание хлорофиллов в кожице значительно возрастало (в 3.1 раза) по мере созревания (рис. 3а, б).
Для всех образцов наблюдалась положительная динамика накопления каротиноидов в кожице и мякоти плодов по мере их созревания (рис. 3в). Максимальное количество каротиноидов было выявлено в мякоти зрелого плода (стадия 3) сортов Сибиряк (685 мкг/г) и Отелло (723 мкг/г). В кожице наибольшее количество каротиноидов содержалось в зрелых плодах сортов Сиреневый куб и Отелло (рис. 3в). Кожица зрелых плодов сортов Желтый букет и Сибиряк характеризовалась примерно одинаковым содержанием суммы каротиноидов (рис. 3в). В мякоти зрелого плода сорта Желтый букет содержание каротиноидов было минимальным в сравнении с тремя другими сортами перца (рис. 3в). Ранее уже было показано, в плодах перца с желтой и оранжевой окраской содержание каротиноидов в целом ниже, чем в плодах с красной окраской [3, 11].
Антоцианы были детектированы только в к-ожице плодов перца сортов Сиреневый куб и Отелло (рис. 3г). Максимальное содержание было выявлено в кожице незрелого плода (стадия 1) сорта Сиреневый куб (462 мкг/г). При этом содержание антоцианов в экзокарпе плодов Сиреневый куб и Отелло значительно уменьшалось по мере созревания (рис. 3г). Паттерн изменения содержания пигментов соответствовал визуально динамике изменения окраски кожицы плода в процессе развития. Наибольшее содержание пигмента соответствовало фиолетовой окраске незрелого плода, а снижение содержания антоцианов с одновременным увеличением суммы каротиноидов по мере созревания плода коррелировало с изменением окраски кожицы с фиолетовой на красную (рис. 3).
Таким образом, была определена динамика накопления пигментов в кожице и мякоти плодов исследуемых сортов перца, контрастных по окраске зрелого плода и по паттерну ее формирования. Полученные данные коррелировали с визуальной окраской плодов. Так, у сортов Желтый букет и Сибиряк в процессе созревания плода в экзокарпе снижалось содержание хлорофиллов и одновременно возрастало содержание каротиноидов, что сопровождалось изменением окраски кожицы с зеленой на желтую и красную, соответственно.
Фиолетовая окраска экзокарпа незрелого плода сорта Сиреневый куб обусловлена высоким содержанием антоцианов и присутствием следовых количеств хлорофиллов и каротиноидов. В кожице незрелого плода сорта Отелло также содержались антоцианы, но за счет наличия большего количества хлорофиллов и каротиноидов плод имел фиолетово-коричневую окраску. Данные результаты соответствовали ранее показанной зависимости фиолетовой окраски и ее оттенка от соотношения содержания антоцианов (производных дельфинидина), хлорофиллов и каротиноидов [9]. У обоих сортов по мере созревания плода количество антоцианов в кожице резко падало, а каротиноидов – возрастало до сопоставимых значений. При этом кожица плода сорта Сиреневый куб содержала лишь следовые количества хлорофиллов в отличие от Отелло, где их уровень значительно вырос. Это обуславливало наличие коричнево-окрашенных участков в плоде сорта Отелло на стадии 2, однако на кожице зрелого плода визуально не отразилось.
Полученные нами данные (по мякоти плодов) в целом согласуются с ранее предложенной моделью пигментации плода перца по мере созревания [1, 10]. При созревании плодов растений хлоропласты постепенно замещаются хромопластами, которые также могут образовываться de novo из пропластид [5, 20]. Это сопровождается замещением хлорофиллов каротиноидами – капсантином и капсорубином, которые придают плодам перца красную окраску [1, 10, 11]. Динамика изменения содержания пигментов и их качественного состава в плодах перца раньше изучалась исключительно на целом плоде без разделения его на кожицу и мякоть [1, 2, 11]. Однако наши результаты показывают, что разные части перикарпа (кожица и мякоть) имеют различный состав пигментов и паттерн их накопления.
Изменение состава и динамики накопления пигментов в плодах перца было сопоставлено с профилем экспрессии ключевых генов биосинтеза каротиноидов и антоцианов в процессе созревания плодов анализируемых сортов, контрастных по паттерну пигментации.
Профиль экспрессии генов каротиноидного пути в плодах перца по мере их созревания
В кожице и мякоти плодов исследуемых сортов перца были определены профили экспрессии четырех структурных генов каротиноидного пути – PSY1, PSY2, LCYb и CCS (рис. 4). Фитоенсинтаза, катализирующая синтез предшественника каротиноидов (фитоена), кодируется двумя генами PSY1 и PSY2, отличающимися тканеспецифичной активностью [21]. Транскрипты гена фитоенсинтазы PSY1 были обнаружены у всех сортов перца в кожице и мякоти плодов (рис. 4). Уровень экспрессии PSY1 увеличивался в процессе созревания плодов – от следовых количеств в незрелых плодах (0–0.004) до относительно высокого уровня в кожице и мякоти зрелых плодов на стадиях 2 и 3 (рис. 4), однако достоверная корреляция с увеличением содержания каротиноидов выявлена только в мякоти плодов (R2 = 0.484; p-value = 0.01) (рис. 5, табл. 2). В предыдущих исследованиях также была выявлена положительная корреляция между содержанием каротиноидов в целых плодах перца и экспрессией PSY1 [20, 22]. Такая же зависимость была показана и для плодов томата [21]. Максимальный уровень экспрессии PSY1 был выявлен в мякоти зрелого плода сорта Отелло (рис. 4).
Рис. 4.
Профиль экспрессии генов PSY1 (а), PSY2 (б), LCYb (в) и CCS (г) в кожице (К) и мякоти (М) плодов четырех сортов перца на трех стадиях развития (1 и 2 – незрелый плод, 3 – плод биологической зрелости).

Рис. 5.
Линейная регрессия экспрессии генов PSY1, PSY2, LCYb и CCS и содержания суммы каротиноидов в кожице (а) и мякоти (б) плодов анализируемых сортов перца.
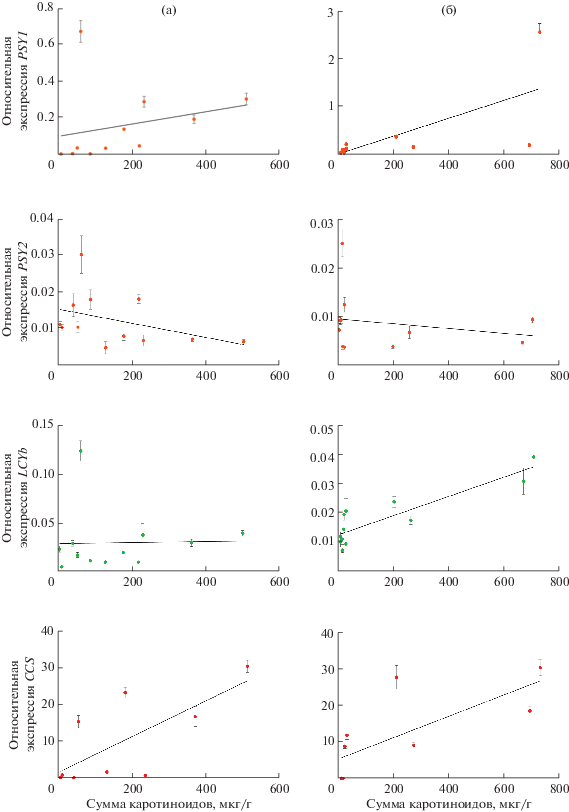
Таблица 2.
Значения коэффициентов множественной корреляции (R2) между экспрессией генов PSY1, PSY2, LCYb и CCS и содержанием суммы каротиноидов в кожице и мякоти плодов перца
| Кожица | Мякоть | |||||||
|---|---|---|---|---|---|---|---|---|
| PSY1 | PSY2 | LCYb | CCS | PSY1 | PSY2 | LCYb | CCS | |
| R2 | 0.064 | 0.166 | 0.0006 | 0.525 | 0.484 | 0.048 | 0.787 | 0.551 |
| p-value | 0.45 | 0.18 | 0.93 | 0.02 | 0.01 | 0.49 | 0.0001 | 0.02 |
Экспрессия гена PSY2 также была выявлена в кожице и мякоти всех анализируемых плодов перца, однако уровень транскрипции данного гена был значительно ниже экспрессии PSY1 (рис. 4). Максимальный уровень транскрипции выявлен в кожице плодов сорта Желтый букет (стадии 1–3) и Сибиряк (стадия 1) (рис. 4). Достоверной зависимости между экспрессией PSY2 и содержанием каротиноидов в плодах анализируемых сортов перца не выявлено (p-value > 0.18) (рис. 5, табл. 2). Полученные данные согласуются с ранее показанной низкой экспрессией PSY2 в плодах томата с одновременно высокой экспрессией в фотосинтезирующих листьях и лепестках [21]. По-видимому, наличие транскрипции PSY2 в кожице и мякоти незрелых плодов перца связано не с окраской плода, а с синтезом в хлоропластах каротиноидов, необходимых для фотозащиты/фотосинтеза [23].
Ген β-ликопинциклазы LCYb, катализирующей переход от ликопина к каротинам, экспрессировался приблизительно на одном уровне в кожице и мякоти плодов всех сортов перца на всех трех стадиях (рис. 4). Исключение составил сорт Желтый букет, в кожице плода которого на стадии 2 уровень транскрипции LCYb вырос более чем в 12 раз по сравнению со стадиями 1 и 3 (рис. 4), что предположительно приводит к ярко-желтой окраске зрелого плода на стадии 3 (рис. 2). Это может быть связано с активным преобразованием ликопина в желто-окрашенные каротиноиды (преимущественно α- и β-каротины и лютеин) [5]. Интересно, что у этого сорта в кожице плода на стадии 2 также значительно повышалась экспрессия обоих генов PSY. Невысокая сходная экспрессия гена LCYb в кожице и мякоти плодов остальных сортов на всех стадиях развития может объяснить отсутствие желтых/оранжевых оттенков в окраске зрелых плодов данных сортов. Построенные отдельно для кожицы и мякоти линейные регрессии выявили достоверную зависимость между экспрессией LCYb и содержанием каротиноидов только в мякоти плодов перца (R2 = 0.787; p‑v-alue = 0.0001) (рис. 5б, табл. 2).
Ген CCS кодирует фермент капсантин-капсорубинсинтазу, который синтезирует специфичные для видов Capsicum пигменты капсантин и капсорубин, придающие плодам насыщенный красный цвет [1, 4, 5, 20]. У анализируемых сортов перца экспрессия гена CCS была выявлена только в плодах сортов Сибиряк, Сиреневый куб и Отелло (рис. 4а, б). В кожице и мякоти незрелых плодов (стадия 1) уровень транскрипции CCS составил 0.0002–0.75, а в плодах, имеющих уже красную окраску (стадия 2 и 3), уровень экспрессии CCS был значительно выше (8.75–30.14) (рис. 4а, б). Изменение уровня экспрессии CCS в кожице и мякоти плодов перца в процессе созревания положительно коррелировало (R2 = 0.525 и 0.551; p‑value = 0.02) с накоплением каротиноидов (табл. 2).
В целом профиль экспрессии исследуемых генов биосинтеза каротиноидов у сортов перца с красной окраской зрелого плода (Сибиряк, Сиреневый куб и Отелло) был сходен. Профиль экспрессии генов PSY1, PSY2 и LCY в кожице и мякоти плодов сорта Желтый букет отличался от трех других анализируемых сортов перца, а экспрессии гена CCS не выявлено (рис. 4). Как было показано ранее, желтая и оранжевая окраска плодов перца обусловлена отсутствием экспрессии гена CCS и, следовательно, фермента капсантин-капсорубинсинтазы [1, 2, 11]. У некоторых генотипов перца с желтой окраской плодов выявлена экспрессия гена CCS, однако в кодирующей части гена были выявлены мутации, приводящие к преждевременному стоп-кодону [2, 11].
Профиль экспрессии генов антоцианового пути в плодах перца по мере их созревания
В плодах четырех анализируемых сортов перца был определен профиль экспрессии пяти структурных генов биосинтеза антоцианов – CHS, F3'5'H, DFR, ANS и UFGT (рис. 1б). Транскрипты всех анализируемых генов были выявлены только у сортов Сиреневый куб и Отелло, у которых биохимический анализ показал наличие антоцианов (рис. 3), и только в кожице плодов (рис. 6). Максимальные уровни транскрипции были выявлены в кожице незрелого плода стадии 1, тогда как в кожице плодов стадий 2 и у зрелого плода стадии 3 все пять генов экспрессировались на крайне низком уровне (0.0001–0.006) (рис. 6).
Рис. 6.
Профиль экспрессии структурных генов биосинтеза антоцианов CHS (а), F3'5'H (б), DFR (в), ANS (г) и UFGT (д) в кожице плодов перца сортов Сиреневый куб и Отелло в процессе созревания (1 и 2 – незрелый плод, 3 – плод биологической зрелости).

Сравнивая сорта Сиреневый куб и Отелло, необходимо отметить, что уровень транскрипции анализируемых генов в кожице незрелого плода стадии 1 у сорта Сиреневый куб был выше в 2–3.3 раза (рис. 6), при этом антоцианов у данного сорта было больше всего в 1.5 раза (рис. 3г). На последующих стадиях развития, в соответствии с резким падением уровня экспрессии генов, содержание антоцианов в кожице плода также резко снизилось (рис. 3г). Можно предположить, что по мере созревания плода наряду со снижением экспрессии генов биосинтеза антоцианов происходит активация транскрипции генов, кодирующих разрушающие антоцианы ферменты, как это было показано ранее для других овощных культур [8].
Уровни экспрессии всех анализируемых генов биосинтеза антоцианов высоко коррелировали с содержанием антоцианов (R2 = 0.95-0.99; p-value < < 0.001). Ранее для генов F3'5'H, DFR и UFGT уже была показана положительная связь с накоплением антоцианов в плоде [24]. В данной работе также выявлена зависимость между экспрессией генов CHS и ANS и содержанием антоцианов в кожице плодов перца.
Таким образом, у четырех сортов перца, контрастных по окраске незрелого и зрелого плодов, был определен паттерн изменения содержания основных пигментов (хлорофиллов, каротиноидов и антоцианов) в кожице и мякоти плодов в процессе созревания. Полученные данные были сопоставлены с профилем экспрессии структурных генов биосинтеза каротиноидов и антоцианов. Была выявлена положительная корреляция между экспрессией генов PSY1, LCYb и CCS и содержанием суммы каротиноидов в мякоти плодов. В кожице плодов содержание каротиноидов положительно коррелировало только с экспрессией гена и CCS. Для сортов перца с фиолетовой окраской незрелого плода (Сиреневый куб, Отелло) была показана положительная корреляция уровня экспрессии структурных генов биосинтеза антоцианов (CHS, F3'5'H, DFR, ANS и UFGT) с содержанием антоцианов в кожице плодов. Таким образом, визуально наблюдаемые изменения окраски плодов перца в процессе созревания находятся в прямой зависимости от соотношения трех основных типов пигментов и активности генов путей их биосинтеза. При этом можно предположить, что динамические паттерны пигментации кожицы и мякоти плодов перца регулируются независимо.
Работа выполнена при финансовой поддержке гранта Российского научного фонда (№ 19-16-00016) и, частично, Министерства науки и высшего образования (Филюшин М.А., определение содержания хлорофиллов в плодах перца, проведение статистического анализа).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Tian S.L., Li L., Shah S.N.M., Gong Z.H. The relationship between red fruit colour formation and key genes of capsanthin biosynthesis pathway in Capsicum a-nnuum // Biol. Plant. 2015. V. 59. P. 507. https://doi.org/10.1007/s10535-015-0529-7
Li Z., Wang S., Gui X.L., Chang X.B., Gong Z.H. A Further analysis of the relationship between yellow ripe-fruit color and the capsanthin-capsorubin synthase gene in pepper (Capsicum sp.) indicated a new mutant variant in C. annuum and a tandem repeat structure in promoter region // PLoS ONE. 2013. V. 8: e61996. https://doi.org/10.1371/journal.pone.0061996
Borovsky Y., Tadmor Y., Bar E., Meir A., Lewinsohn E., Paran I. Induced mutation in β-CAROTENE H-YDROXYLASE results in accumulation of β-carotene and conversion of red to orange color in pepper fruit // Theor. Appl. Genet. 2013. V. 126. P. 557. https://doi.org/10.1007/s00122-012-2001-9
Guzman I., Hamby S., Romero J., Bosland P.W., O’Connell M.A. Variability of carotenoid biosynthesis in orange colored Capsicum spp. // Plant Sci. 2010. V. 179. P. 49. https://doi.org/10.1016/j.plantsci.2010.04.014
Kilcrease J., Rodriguez-Uribe L., Richins R.D., Arcos J.M., Victorino J., O’Connell M.A. Correlations of carotenoid content and transcript abundances for fibrillin and carotenogenic enzymes in Capsicum annum fruit pericarp // Plant Science. 2015. V. 232. P. 57.
de Azevedo-Meleiro C.H., Rodriguez-Amaya D.B. Qualitative and quantitative differences in the carotenoid composition of yellow and red peppers determined by HPLC-DAD-MS // J Sep Sci. 2009. V. 32. P. 3652. https://doi.org/10.1002/jssc.200900311
Borovsky Y., Oren-Shamir M., Ovadia R., De Jong W., Paran I. The A locus that controls anthocyanin accumulation in pepper encodes a MYB transcription factor homologous to Anthocyanin2 of Petunia // Theor. Appl. Genet. 2004. V. 109. P. 23. https://doi.org/10.1007/s00122-004-1625-9
Liu Y., Tikunov Y., Schouten R.E., Marcelis L.F.M., Visser R.G.F., Bovy A. Anthocyanin biosynthesis and degradation mechanisms in Solanaceous vegetables: A Review // Front. Chem. 2018. V. 6. article 52. https://doi.org/10.3389/fchem.2018.00052
Lightbourn G.J., Griesbach R.J., Novotny J.A., Clevidence B.A., Rao D.D., Stommel J.R. Effects of Anthocyanin and Carotenoid Combinations on Foliage and Immature Fruit Color of Capsicum annuum L. // J. Heredity. 2008. V. 99. P. 105. https://doi.org/10.1093/jhered/esm108
Lefebvre V., Kuntz M., Camara B., Palloix A. The capsanthin-capsorubin synthase gene: a candidate gene for the y locus controlling the red fruit colour in pepper // Plant Mol. Biol. 1998. V. 36. P. 785.
Ha S.H., Kim J.B., Park J.S., Lee S.W., Cho K.J. A comparison of the carotenoid accumulation in Capsicum varieties that show different ripening colours: deletion of the capsanthin–capsorubin synthase gene is not a prerequisite for the formation of a yellow pepper // J. Exp. Bot. 2007. V. 58. P. 3135.
Lado J., Zacarías L., Rodrigo M.J. Regulation of carotenoid biosynthesis during fruit development // Stange C. (eds) Carotenoids in Nature. Subcellular Biochemistry. 2016. V. 79. Springer, Cham.
Popovsky S., Paran I. Molecular genetics of the y locus in pepper: its relation to capsanthin-capsorubin synthase and to fruit color // Theor. Appl. Genet. 2000. V. 101. P. 86. https://doi.org/10.1007/s001220051453
Naing A.H., Kim C.K. Roles of R2R3-MYB transcription factors in transcriptional regulation of anthocyanin biosynthesis in horticultural plants // Plant Mol. Biol. 2018. V. 98. P. 1. https://doi.org/10.1007/s11103-018-0771-4
Zhang Z., Li D.W., Jin J.H., Yin Y.X., Zhang H.X., Chai W.G., Gong Z.H. VIGS approach reveals the modulation of anthocyanin biosynthetic genes by CaMYB in chili pepper leaves // Front. Plant Sci. 2015. V. 6. P. 500. https://doi.org/10.3389/fpls.2015.00500
Albert N.W., Lewis D.H., Zhang H., Schwinn K.E., Jameson P.E., Davies K.M. Members of an R2R3-MYB transcription factor family in Petunia are developmentally and environmentally regulated to control complex floral and vegetative pigmentation patterning // Plant J. 2011. V. 65. P. 771. https://doi.org/10.1111/j.1365-313X.2010.04465.x
Lichtenthaler H.K. Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes // Methods Enzymol. 1987. V. 148. P. 350.
Solovchenko A.E., Chivkunova O.B., Merzlyak M.N., Reshetnikova I.V. A spectrophotometric analysis of pigments in apples // Rus. J. Plant Phys. 2001. V. 48. P. 693.
Bemer M., Karlova R., Ballester A.R., Tikunov Y.M., Bovy A.G., Wolters-Arts M., Rossetto P. de B., Angenent G.C., de Maagd R.A. The Tomato FRUITFULL Homologs TDR4/FUL1 and MBP7/FUL2 regulate ethylene-independent aspects of fruit ripening // Plant Cell. 2012. V. 24. P. 4437. https://doi.org/10.1105/tpc.112.103283
Berry H.M., Rickett D.V., Baxter C.J., Enfissi E.M.A., Fraser P.D. Carotenoid biosynthesis and sequestration in red chilli pepper fruit and its impact on colour intensity traits // J. Exp. Bot. 2019. V. 70. P. 2637. https://doi.org/10.1093/jxb/erz086
Giorio G., Stigliani A.L., D’Ambrosio C. Phytoene synthase genes in tomato (Solanum lycopersicum L.): new data on the structures, the deduced amino acid sequences and the expression patterns // FEBS J. 2007. V. 275. P. 527.
Rodriguez-Uribe L., Guzman I., Rajapakse W., Richins R.D., O’Connell M.A. Carotenoid accumulation in orange pigmented Capsicum annuum fruit, regulated at multiple levels // J. Exp. Bot. 2012. V. 63. P. 517.
Соловченко А.Е., Мерзляк М.Н. Экранирование видимого и УФ излучения как механизм фотозащиты у растений // Физиология растений. 2008. Т. 55. С. 803.
Aza-González C., Herrera-Isidrón L., Núñez-Palenius H.G., Martínez De La Vega O., Ochoa-Alejo N. Anthocyanin accumulation and expression analysis of biosynthesis-related genes during chili pepper fruit development // Biol. Plant. 2013. V. 57. P. 49. https://doi.org/10.1007/s10535-012-0265-1
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


