Физиология растений, 2020, T. 67, № 6, стр. 636-643
Влияние (+) и (–) усниновой кислоты на физиолого-биохимические и цитологические характеристики проростков Allium fistulosum
И. А. Прокопьев a, *, Г. В. Филиппова a
a Институт биологических проблем криолитозоны
Сибирского отделения Российской академии наук
Якутск, Россия
* E-mail: ilya.a.prokopiev@gmail.com
Поступила в редакцию 30.01.2020
После доработки 24.03.2020
Принята к публикации 21.04.2020
Аннотация
Проведено исследование влияния (+) и (–)-усниновой кислоты (УК) на физиолого-биохимические и цитологические характеристики проростков Allium fistulosum L. Показано, что проращивание семян в среде обоих энантиомеров УК в концентрациях 62.5–1000 мкМ приводило к снижению лабораторной всхожести, угнетению ростовых процессов, замедлению митотической активности корневых меристем и депигментации тканей. Выявлен дозозависимый рост частоты хромосомных аберраций и степени повреждения ядерной ДНК в клетках, что указывает на потенциально генотоксический и мутагенный эффект изученных энантиомеров УК. Однако (–)-УК индуцировала большее число атипичных ДНК комет, чем (+)-энантиомер, что может говорить о ее более сильном действии на фрагментацию ДНК в клетках. При действии обоих энантиомеров УК наблюдалось повышение активности ферментов антиоксидантной защиты и снижение содержания флавоноидов на фоне накопления продуктов ПОЛ в клетках проростков, что указывает на развитие окислительного стресса. В то же время, значимых различий между активностью (+) и (-)-УК на уровне физиолого-биохимических параметров проростков нами не выявлено.
ВВЕДЕНИЕ
Лишайники синтезируют ряд специфических соединений различной химической природы, объединяемые термином лишайниковые вещества. Среди этих веществ наиболее распространенной является усниновая кислота (УК), встречающаяся в лишайниках в виде двух энантиомеров, различающиеся R и S конфигурацией хирального атома С9b (рис. 1). Считается, что основной биологической функцией УК является защита фотобионта лишайника путем поглощения избыточного ультрафиолетового излучения [1]. Кроме того, известно о высокой антибактериальной активности энантиомеров УК в отношении грамположительных микроорганизмов и микобактерий, включая штаммы, устойчивые к антибиотикам [1, 2]. При этом (+)-УК обладает большей антибактериальной активностью по сравнению с (–)-УК [2].
Многие лишайниковые вещества проявляют фитотоксические свойства, выраженные в ингибировании прорастания семян и роста проростков, в то же время сведения о фитотоксичности УК носят противоречивый характер. Так, было показано, что УК оказывала ингибирующие действие на прорастание семян маша и пшеницы [3]. Однако другими авторами было показано отсутствие токсического действия УК на проростки латука и сеянцы сосны [4].
Помимо семян и проростков, УК оказывала влияние на рост и развитие уже сформировавшихся растений. При внесении в среду (+)-УК в виде натриевой соли, в концентрациях 1–40 мкМ наблюдалось замедление скорости роста, уменьшение площади листьев и биомассы побегов томата [5]. Кроме того, УК в концентрации 50 мкМ приводила к снижению скорости транспирации и патологическим изменениям в морфологии корневой системы у подсолнечника и кукурузы [6].
Цель работы – изучение влияния различных концентраций энантиомеров усниновой кислоты на физиологические и цитолого-генетические характеристики проростков Allium fistulosum, содержание фотосинтетических пигментов и флавоноидов, а также активность ферментативных антиоксидантов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили семена и проростки лука батуна – Allium fistulosum L. (сорт Апрельский, урожай 2017 г., n = 16). Выбор модельного объекта обусловлен широким использованием лука для оценки токсичности различных физических и химических факторов [7].
Стереоизомеры УК выделяли из лишайников Cladonia arbuscula и C. stellaris – (+) и (–) энантиомер, соответственно, исходя из их преимущественного содержания в талломах. Методика выделения энантиомеров УК описана в работе [8]. Идентификацию УК проводили, сопоставляя полученные ИК- и 1H-ЯМР-спектры с данными литературы [9]. Оптическую активность выделенных энантиомеров УК определяли поляриметрическим методом. Степень чистоты выделенных энантиомеров по данным тонкослойной хроматографии составляла 95–97%.
Одним из препятствий, затрудняющих исследование биологической активности УК, является ее низкая растворимость в воде [10]. УК титруется как одноосновная кислота, поэтому для получения растворимой в воде соли энантиомеры УК смешивали с эквимолярным водным раствором гидроксида калия. При необходимости избыток щелочи нейтрализовали соляной кислотой до pH 7.5. Измерение pH проводили на ионометре “Экотест-2000” (Россия). Полученные водные растворы солей (+) и (–) УК использовали для дальнейших исследований.
Для определения влияния разных концентраций калиевых солей (+) и (-) УК на физиолого-биохимические и цитологические характеристики проростков, семена A. fistulosum были разделены на 12 опытных и одну контрольную группу. В опытных группах, перед посевом семян, в чашки Петри вносили растворы энантиомеров УК в диапазоне концентраций 1000 –31.2 мкM. Контрольная группа проращивалась на дистиллированной воде. Выбор концентраций основан на данных полученных в работах [3, 11], в которых было показано, что в данном диапазоне концентраций калиевой соли усниновой кислоты наблюдались значимое снижение лабораторной всхожести семян и торможение роста проростков пшеницы, овса, кресс-салата, маша.
Семена проращивали на фильтровальной бумаге (по 50 шт. в каждой чашке, в четырех повторностях) при 16-часовом световом периоде и температуре 20–25°С. Энергию прорастания определяли на 5 день эксперимента. Лабораторную всхожесть, а также длину надземной части и корешка проростков определяли на 12 день наблюдений.
Цитологические исследования проводили на корешках проростков длиной 0.3–0.8 см (n = 10) для каждого варианта, которые фиксировали (на третий день) смесью 96% этилового спирта и ледяной уксусной кислоты в соотношении 3:1 в течение 12 ч, после чего окрашивали ацетоорсеином. Давленные препараты просматривали под световым микроскопом Axiostar plus (“Carl Zeiss”, Германия). Аберрации хромосом учитывали ана-телофазным методом. В отдельные группы выделяли мосты и фрагменты. Нарушения клеточных делений, представленные отставанием, “выбросом”, забеганием хромосом, хромосомами на экваторе, многополюсными анафазами и др. относили к группе с нетипичным расположением хромосом – прочие аномалии. Для определения активности деления клеток использовали показатель митотического индекса (МИ), который определяли отношением числа клеток, находящихся в митозе, от их общего числа выраженным в процентах [12].
Степень фрагментации ДНК в корнях проростков определяли с помощью щелочной версии метода ДНК-комет (pH > 13) [13], позволяющего количественно измерить повреждения ДНК, включая однонитевые, двунитевые разрывы и щелочелабильные сайты. Все операции по выделению изолированных ядер клеток проводили под тусклым желтым светом. С помощью острого лезвия бритвы корешки были аккуратно нарезаны в чашке Петри на льду. Кончики корешков с апикальной меристемой отсекали. Непосредственно перед микроскопированием препараты окрашивали флуоресцирующим красителем SYBR Green I (“Sigma-Aldrich”, США) (20 мкг/мл) в течение 30 мин. Анализ проводили на флуоресцентном микроскопе (“ЛабМед-2Л”, Россия), используя возбуждающий и отсекающий светофильтры на 490, 530 нм, соответственно. Полученные с микропрепаратов изображения “ДНК-комет” анализировали с использованием программного обеспечения CASP 1.2.2. В качестве показателя поврежденности ДНК использовали процентное содержание ДНК в хвосте комет (% ДНК в хвосте от общего количества ДНК в комете). Атипичные ДНК-кометы, характеризующиеся отсутствующей или практически отсутствующей головой и широким диффузным хвостом, выделяли в отдельную категорию и подсчитывали процентное содержание на каждые 100 шт. [14].
Все спектрофотометрические измерения были проведены на приборе UV-2600 (“Shimadzu”, Япония). Для исследования брали навески 0.1–0.3 г сырой ткани 12-дневных проростков и гомогенизировали их в керамической ступке в присутствии 0.1 М Na-фосфатного буфера pH = 7.4 для извлечения фементов и 96% этанол с 1% тритоном X-100 для экстракции флавоноидов и ТБК-реактивных продуктов. Гомогенат центрифугировали 10 мин при 6000 g, полученный супернатант использовали для дальнейших исследований.
Активность супероксиддисмутазы (СОД; КФ 1.15.1.1) измеряли по модифицированной методике [15]. Реакцию инициировали светом люминесцентной лампы в течение 5 мин. Активность фермента оценивали по ингибированию образования на свету окрашенного продукта восстановления нитросинего тетразолия (ε = 3.98/(мМ см), λ = = 560 нм).
Для определения активности пероксидазы (ПОК; КФ 1.11.1.7) к 0.1 мл супернатанта добавляли 0.1 мл 4.3 мМ раствора (о)-дианизидина и 0.7 мл 0.1 М Na-фосфатного буфера pH=7.4, реакцию инициировали внесением 0.1 мл 0.45 мМ пероксида водорода. Активность фермента определяли по увеличению оптической плотности при образовании окрашенного продукта окисления (о)-дианизидина в течение 1 мин (ε = 30/(мМ см), λ = 460 нм) [16].
Для определения активности каталазы (КАТ; КФ 1.11.1.6) к 0.1 мл супернатанта добавляли 0.8 мл 0.1 М Na-фосфатного буфера pH = 7.4, реакцию инициировали внесением 0.1 мл 0.45 мМ пероксида водорода. Активность фермента определяли по уменьшению оптической плотности при разложении H2O2 в течение 1 мин (ε = 39.4/(мМ см), λ = 240 нм) [17].
Для определения суммарного содержания флавоноидов в проростках к 0.2 мл супернатанта добавляли 0.8 мл лимоннокислого боратного реактива (этанольный раствор 2.5% борной и 10% лимонной кислот). Оптическую плотность растворов измеряли через 15 мин. Содержание флавоноидов определяли по накоплению окрашенного комплекса с лимоннокислым борным реактивом (ε = 4.4 /(мМ см), λ = 420 нм) [18].
Определение содержания хлорофиллов a, b и каротиноидов в проростках (без корешков) в расчете на сырую массу проводили в экстрактах с 80% ацетоном при максимумах поглощения 663, 647 и 470 нм, соответственно [19]
Интенсивность процессов перекисного окисления липидов (ПОЛ) определяли по накоплению карбонильных соединений, образующих окрашенные комплексы с тиобарбитуровой кислотой (ТБК-реактивные продукты), количество которых выражали через концентрацию комплекса малонового диальдегида-ТБК (ε = 155/(мМ см), λ = = 532 нм) [20].
Все измерения были выполнены на свежих образцах в 4 биологических и аналитических повторностях. Результаты экспериментов представлены в виде средней арифметической величины и ее стандартной ошибки. Сравнение средних значений выборок проводили методом ANOVA. Значимость отличий между средними определяли, используя критерии Ньюмена-Кейлса и Даннета для множественных сравнений при уровне P < 0.05. Расчеты проводили с помощью пакета AnalystSoft, StatPlus (программа статистического анализа, v. 2007).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведено исследование влияния различных концентраций энантиомеров (+) и (-) УК на физиологические характеристики проростков A. fistulosum. Показано, что при концентрациях (+) и (–) УК 500 и 1000 мкМ наблюдалось достоверное снижение энергии прорастания (в 1.6 и 2.7 раз) и лабораторной всхожести семян (в 1.4 и 2.6 раз) относительно контроля (табл. 1). При этом показатели длины побега и корня начинали достоверно уменьшаться уже при концентрации УК 125 мкМ. Ранее на ингибирование ростовых процессов у проростков кресс-салата и овса при действии (‒)-УК в концентрации выше 100 мкМ указывалось в работе [11], что согласуется с полученными нами данными.
Таблица 1.
Физиологические показатели проростков Allium fistulosum при действии различных концентраций энантиомеров усниновой кислоты
| Концентрация УК, мкМ | Энергия прорастания, % | Всхожесть, % | Длина побега, см | Длина корешка, см |
|---|---|---|---|---|
| Контроль | 55.3 ± 4.7 | 66.0 ± 9.2 | 3.7 ± 0.2 | 1.5 ± 0.2 |
| (+)-усниновая кислота | ||||
| 31.2 | 50.0 ± 4.0 | 62.7 ± 1.7 | 3.1 ± 0.2 | 1.2 ± 0.2 |
| 62.5 | 47.3 ± 6.4 | 58.7 ± 6.4 | 2.5 ± 0.1 | 0.8 ± 0.1 |
| 125 | 46.0 ± 2.3 | 50.7 ± 4.4 | 1.6 ± 0.1* | 0.2 ± 0.1* |
| 250 | 45.3 ± 5.8 | 54.7 ± 7.0 | 1.6 ± 0.1* | 0.4 ± 0.1* |
| 500 | 34.7 ± 6.8* | 47.3 ± 7.4* | 1.5 ± 0.1* | 0.3 ± 0.1* |
| 1000 | 22.0 ± 3.1* | 25.3 ± 4.4* | 1.0 ± 0.1* | 0.4 ± 0.1* |
| (–)-усниновая кислота | ||||
| 31.2 | 54.0 ± 3.5 | 62.0 ± 4.2 | 3.2 ± 0.2 | 1.1 ± 0.2 |
| 62.5 | 44.0 ± 5.1 | 61.8 ± 5.1 | 2.9 ± 0.1* | 0.9 ± 0.1* |
| 125 | 47.3 ± 7.9 | 59.1 ± 4.8 | 2.3 ± 0.1* | 0.5 ± 0.1* |
| 250 | 47.3 ± 4.8 | 58.0 ± 7.0 | 1.7 ± 0.1* | 0.3 ± 0.1* |
| 500 | 36.0 ± 3.1* | 40.7 ± 2.7* | 1.5 ± 0.1* | 0.3 ± 0.1* |
| 1000 | 20.7 ± 5.2* | 24.7 ± 3.5* | 1.5 ± 0.1* | 0.4 ± 0.1* |
Нами проведено исследование митотической активности корневых меристем проростков A. fistulosum при действии различных концентрации энантиомеров УК. Показано, что митотическая активность клеток начинала значимо снижаться относительно контроля при концентрации энантиомеров УК 125 мкМ. Максимальный эффект наблюдался при концентрации (+) и (–)-УК 1000 мкМ, при которой значение МИ было ниже в 1.6 и 2.2 раза, соответственно, относительно контроля (табл. 2). Ранее было показано, что (+)-УК проявляет антимитотический эффект в отношении растительных клеток A. cepa начиная с концентрации 580 мкМ [21]. Полученные нами данные указывают на то, что клетки проростков A. fistulosum были более чувствительны к действию энантиомеров УК, чем A. cepa.
Таблица 2.
Цитологические характеристики проростков Allium fistulosum при действии различных концентраций энантиомеров усниновой кислоты
| Концентрация УК, мкМ | Митотический индекс, % | Хромосомные аберрации, % | |||
|---|---|---|---|---|---|
| мосты | фрагменты | прочие аномалии | всего | ||
| Контроль | 7.9 ± 0.6 | 7.5 ± 2.3 | 1.6 ± 0.6 | 4.0 ± 1.0 | 13.1 ± 2.4 |
| (+)-усниновая кислота | |||||
| 31.2 | 8.2 ± 1.3 | 8.0 ± 1.8 | 2.5 ± 0.9 | 6.8 ± 2.4 | 17.3 ± 1.7 |
| 62.5 | 7.5 ± 0.8 | 10.2 ± 2.8 | 4.7 ± 1.5* | 8.2 ± 2.3* | 23.1 ± 4.1* |
| 125 | 6.4 ± 0.6* | 14.8 ± 4.3* | 5.4 ± 1.9* | 9.3 ± 2.4* | 29.5 ± 7.0* |
| 250 | 6.0 ± 1.0* | 15.1 ± 2.9* | 5.5 ± 1.9* | 16.7 ± 4.7* | 37.3 ± 8.6* |
| 500 | 5.7 ± 0.9* | 15.2 ± 3.9* | 5.1 ± 1.2* | 20.1 ± 7.6* | 40.4 ± 8.2* |
| 1000 | 4.8 ± 1.0* | 16.1 ± 3.1* | 7.8 ± 3.2* | 29.7 ± 11.1* | 53.6 ± 11.1* |
| (–)-усниновая кислота | |||||
| 31.2 | 8.8 ± 0.8 | 10.6 ± 2.0 | 2.5 ± 0.8 | 7.7 ± 1.5 | 20.8 ± 2.2 |
| 62.5 | 8.6 ± 1.2 | 13.8 ± 4.3* | 6.4 ± 1.9* | 7.9 ± 2.3* | 28.1 ± 4.9* |
| 125 | 5.8 ± 0.9* | 14.4 ± 3.7* | 7.6 ± 2.7* | 14.2 ± 3.3* | 36.2 ± 6.3* |
| 250 | 5.2 ± 1.6* | 16.1 ± 5.3* | 7.9 ± 3.6* | 15.2 ± 2.9* | 39.2 ± 4.8* |
| 500 | 4.1 ± 0.8* | 17.0 ± 6.3* | 8.3 ± 2.3* | 26.4 ± 7.7* | 51.7 ± 4.2* |
| 1000 | 3.5 ± 1.0* | 24.3 ± 9.9* | 8.6 ± 3.6* | 27.7 ± 10.3* | 60.6 ± 10.3* |
Изучено влияние энантиомеров УК на частоту образования хромосомных аберраций в делящихся клетках корешков проростков A. fistulosum. Показано, что в диапазоне концентраций (+) и (–)-УК 62.5–1000 мкМ наблюдалось повышение в 1.8–4.1 и 2.1–4.6 раз, соответственно, частоты образования патологических митозов по сравнению с контролем, что указывает на мутагенный эффект изученных соединений (табл. 2). Основными типами нарушений были отставания хромосом, одиночные (хроматидные дицентрики) и двойные мосты (хромосомные асимметричные обмены), одиночные фрагменты (хроматидные делеции). Это свидетельствует о дозозависимых нарушениях как в самих хромосомах, так и в ахроматиновом веретене деления.
Ранее при изучении клеток лимфоцитов периферической крови отмечалось отсутствие роста частоты хромосомных аберраций в клетках при действии на них (+)-УК в диапазоне концентраций 3–580 мкМ [22]. Кроме того, исследование влияния обоих энантиомеров УК на лимфоциты микроядерным тестом, также не выявило повышения частоты образования микроядер в клетках [23]. Можно предположить, что генетический аппарат растительных клеток является более чувствительным к действию УК по сравнению с животными клетками.
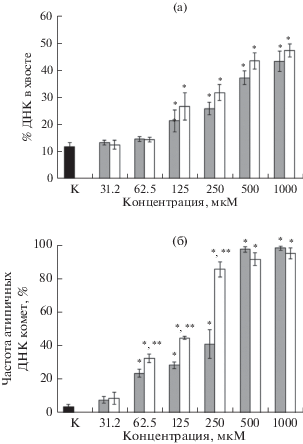
Изучение генотоксического действия УК в отношении растительных клеток ранее не проводилось. Генотоксичность (+) и (-)-УК оценивали с использованием щелочной версии метода ДНК-комет. Выявлено, что при концентрациях (+) и (–) энантиомеров УК 125–1000 мкМ степень повреждения ядерной ДНК (% ДНК в хвосте кометы) была в 1.8–3.6 и 2.2–3.9 раз, соответственно, выше по сравнению с контролем (рис. 2).
Рис. 2.
Генотоксическое действие различных концентрации энантитомеров усниновой кислоты в отношении проростков A. fistulosum: (а) – процент ДНК в хвосте кометы; (б) – частота атипичных ДНК комет. Серые столбцы – (+)-энантиомер, белые столбцы – (–)-энантиомер; *– статистически значимые отличия от контроля (К) при P ≤ 0.05 (ANOVA, t –тест Даннета), **– статистически значимые отличия между энантиомерами при P ≤ 0.05 (ANOVA, критерий Ньюмена-Кейлса).
Помимо сформированных ДНК комет нами были выявлены кометы с отсутствующей или практически отсутствующей головой и широким диффузным хвостом, называемые ghost cells, или hedgehogs. По имеющимся представлениям, появление таких атипичных ДНК-комет является следствием процесса клеточной гибели, связанного с высоким уровнем оксидативного стресса, либо формирования апоптотических клеток, находящихся на стадии фрагментации хроматина [14].
Показано, что доля клеток с атипичными ДНК кометами в проростках при действии (+) и (–)-УК в концентрациях 65.2-1000 мкМ была выше в 6–25 и 8–24 раз, соответственно, по сравнению с контролем. Выявлено, что действие (–)-УК в диапазоне концентраций 62.5–250 мкМ приводило к формированию большего числа атипичных ДНК комет (в 1.4–2.1 раз), чем (+) энантиомер, что может говорить о ее более сильной способности индуцировать клеточные процессы, ведущие к фрагментации ДНК.
В предыдущем нашем исследовании было показано, что оба энантиомера УК проявляют генотоксические свойства в отношении лимфоцитов человека, при этом (-)-УК индуцировала больше атипичных комет, чем ее (+) энантиомер [8], что подтверждается данными, полученными в настоящем исследовании, для растительных клеток.
Нами было проведено исследование действия энантиомеров УК на суммарное содержание хлорофиллов (a + b) в проростках A. fistulosum. Показано, что содержание хлорофиллов в тканях снижалось при действии (+) и (-)-УК в диапазоне концентраций 62.5–1000 мкМ в 1.4–10.0 и 1.7–7.5 раз, соответственно, относительно контроля, приводя при концентрациях 1000 мкМ практически к полному обесцвечиванию проростков (рис. 3).
Рис. 3.
Содержание хлорофилла в тканях проростков A. fistulosum при действии различных концентрации (+)- и (–)-энантиомеров усниновой кислоты. Серые столбцы – (+)-энантиомер, белые столбцы – (–)-энантиомер; *– статистически значимые отличия от контроля (К) при P ≤ 0.05 (ANOVA, t-тест Даннета).

Раннее при исследовании действия энантиомеров УК в отношении проростков Lactuca sativa и A. cepa было выявлено дозозависимое обесцвечивание семядольных тканей, связанное с уменьшением количества хлорофиллов и каротиноидов, у растений, обработанных только (–)-УК,в то время как (+)-энантиомер практически не оказывал никакого влияния на содержание пигментов [24], что не подтверждается полученными нами данными.
Одним из возможных механизмов депигментации растений при действии энантиомеров УК является необратимое ингибирование ферментов 4-гидроксифенилпируватдиоксигеназы и протопорфириногеноксидазы, участвующих в биосинтезе фотосинтетических пигментов [24].
Механизм биологической активности УК связывают с ее влиянием на функциональную активность хлоропластов и митохондрий. При изучении действия УК на хлоропласты отмечали подавление фотосинтеза в тилакоидах, инактивацию реакционных центров ФС II и дестабилизацию тилакоидных мембран [25]. В митохондриях наблюдалось разобщение окислительного фосфорилирования и подавление синтеза АТФ [26]. Считается, что вышеперечисленные процессы могут приводить к гиперпродукции АФК в клетках [27]. Хотя и известно, что УК обладает антиоксидантной активностью, но по имеющимся экспериментальным данным для нее характерны концентрационно-зависимые инверсии эффектов, связанные с переходом антиоксидантной активности в прооксидантную [1, 28]. Так, при воздействии УФ-облучения на клетки лимфоцитов человека УК в сравнительно низких концентрациях (0.01–1 мкМ) проявляла антиоксидантные свойства, тогда как в концентрации 100 мкМ – проокидантные, усиливая повреждающее действие УФ-облучения [28]. Похожие результаты были получены и при исследовании влияния УК на ДНК-повреждающие эффекты прооксиданта диоксидина [29]. В отношении лимфоцитов человека было показано, что оба энантиомера в концентациях до 10 мкМ снижали токсические эффекты, вызванные диоксидином, а при концентрации 100 мкМ, напротив, приводили к их усилению.
Гиперпродукция АФК может инициировать мобилизацию ответных реакций, способных существенно увеличить антиоксидантный потенциал растений [27]. Нами установлено, что в диапазоне концентраций обоих энантиомеров УК 62.5–1000 мкМ наблюдалось повышение активности ферментов антиоксидантной защиты (СОД, КАТ, ПОК) по сравнению с контролем (табл. 3). В то же время при концентрациях (+) и (–)-УК 125–1000 мкМ содержание флавоноидов (выполняющих, в том числе, функцию низкомолекулярных антиоксидантов) в клетках тканей проростков снижалось в 1.2–3.7 и 1.4–6.5 раз, соответственно. При концентрациях (+) и (-)-УК от 125 до 1000 мкМ отмечался рост накопления ТБК-реактивных продуктов в клетках проростков в 1.3–1.9 и 1.4–2.3 раз, соответственно, по сравнению с контролем. Ранее при действии (+)-УК в концентрации 30 мкМ на корни проростков томата также фиксировали повышение активности фермента каталазы и содержания малонового диальдегида (основной продукт ПОЛ), что в целом, согласуется с полученными нами данными [30].
Таблица 3.
Биохимические характеристики проростков Allium fistulosum при действии различных концентраций энантиомеров усниновой кислоты
| Концентрация УК, мкМ | Активность СОД, мМ/(г сырой массы мин) | Активность ПОК мМ/(г сырой массы мин) | Активность КАТ, мМ/(г сырой массы мин) | Содержание флавоноидов, мг/г сырой массы |
Содержание ТБК-реактивных продуктов, нМ/г сырой массы |
|---|---|---|---|---|---|
| Контроль | 2.2 ± 0.1 | 0.8 ± 0.2 | 0.1 ± 0.0 | 2.6 ± 0.1 | 17.2 ± 2.7 |
| (+)-усниновая кислота | |||||
| 31.2 | 2.0 ± 0.2 | 1.2 ± 0.1 | 0.1 ± 0.0 | 2.5 ± 0.1 | 17.4 ± 2.2 |
| 62.5 | 2.7 ± 0.2* | 1.5 ± 0.1* | 0.3 ± 0.1 | 2.5 ± 0.1 | 18.3 ± 2.2 |
| 125 | 3.7 ± 0.3* | 1.8 ± 0.2* | 0.4 ± 0.1* | 2.1 ± 0.2* | 21.5 ± 2.8* |
| 250 | 3.5 ± 0.4* | 1.8 ± 0.1* | 0.4 ± 0.1* | 2.0 ± 0.2* | 25.6 ± 2.3* |
| 500 | 5.1 ± 0.5* | 1.9 ± 0.5* | 0.8 ± 0.2* | 1.3 ± 0.1* | 30.2 ± 3.4* |
| 1000 | 8.5 ± 0.9* | 2.5 ± 0.2* | 0.6 ± 0.1* | 0.7 ± 0.2* | 32.5 ± 6.3* |
| (–)-усниновая кислота | |||||
| 31.2 | 2.1 ± 0.1 | 1.3 ± 0.2 | 0.3 ± 0.1 | 2.4 ± 0.1 | 17.2 ± 2.2 |
| 62.5 | 3.0 ± 0.2* | 1.7 ± 0.1* | 0.2 ± 0.1 | 2.0 ± 0.1 | 19.8 ± 2.2 |
| 125 | 5.2 ± 0.6* | 1.6 ± 0.2* | 0.4 ± 0.1* | 1.8 ± 0.2* | 23.4 ± 2.8* |
| 250 | 5.3 ± 0.5* | 1.9 ± 0.3* | 0.4 ± 0.1* | 1.6 ± 0.1* | 29.1 ± 3.3* |
| 500 | 7.4 ± 0.6* | 2.3 ± 0.5* | 0.8 ± 0.2* | 1.4 ± 0.2* | 35.0 ± 4.9* |
| 1000 | 9.1 ± 1.4* | 3.2 ± 0.6* | 0.7 ± 0.1* | 0.4 ± 0.1* | 39.6 ± 5.6* |
Можно предположить, что в диапазоне концентраций энантиомеров УК 31.2–62.5 мкМ гиперпродукция АФК компенсировалась за счет активации защитных антиоксидантных систем, обеспечивающих сбалансированное протекание окислительно-восстановительных реакций в тканях проростков A. fistulosum. В тоже время при действии более высоких концентрации УК наблюдалось смещение прооксидантно-антиоксидантного равновесия в сторону активации ПОЛ и развития окислительного стресса.
Таким образом, микромолярные концентрации (+) и (–)-УК вызывали фитотоксические эффекты, выраженные в снижении лабораторной всхожести, угнетении ростовых процессов, замедлении митотической активности корневых меристем и депигментации тканей проростков A. fistulosum. Показан дозозависимый рост частоты хромосомных аберраций и степени повреждения ядерной ДНК в клетках, что указывает на потенциально генотоксический и мутагенный эффект изученных энантиомеров УК. При этом (–)-УК индуцировала большее число атипичных ДНК комет, чем (+)-энантиомер, что может указывать на ее более сильное действие на фрагментацию ДНК в клетках. В диапазоне концентраций энантиомеров УК 62.5-1000 мкМ наблюдалось повышение активности ферментов антиоксидантной защиты и снижение содержания флавоноидов на фоне роста концентрации продуктов ПОЛ в клетках, что свидетельствует о развитии окислительного стресса. В то же время значимых различий между активностью (+) и (–)-УК на уровне физиолого-биохимических параметров проростков нами выявлено не было.
Работа выполнена в рамках госзаданий Института биологических проблем криолитозоны Сибирского отделения Российской академии наук на 2017-2020 № АААА-А17- 117020110055-3 “Разработка биопрепаратов из тканей растений и животных Якутии на основе изучения особенностей их биохимического состава и механизмов адаптации к условиям Севера” и АААА-А17- 117020110056-0 “Фундаментальные и прикладные аспекты изучения разнообразия растительного мира Северной и Центральной Якутии”
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Araujoa A.A.S., de Meloa M.G.D., Rabelob T.K., Nunesa P.S., Santosa S.L., Serafinic M.R., Santosa M.R.V., Quintans-Ju’niora L.J., Gelainc D.P. Review of the biological properties and toxicity of usnic acid // Nat. Prod. Res. 2015. V. 29. P. 1. https://doi.org/10.1080/14786419.2015.1007455
Galanty A., Pasko P., Podolak I. Enantioselective activity of usnic acid: a comprehensive review and future perspectives // Phytochem Rev. 2019. V. 18. P. 527. https://doi.org/10.1007/s11101-019-09605-3
Dalvi R.R., Singh B., Salunkhe D.K. Physiological and biochemical investigations on the phytotoxicity of usnic acid // Phyton. 1972. V. 29. P. 63.
Kytöviita M.M., Stark S. No allelopathic effect of the dominant forest-floor lichen Cladonia stellaris on pine seedlings // Funct. Ecol. 2009. V. 23. P. 435. https://doi.org/10.1111/j.1365-2435.2008.01508.x
Lechowski Z., Mej E., Bialczyk J. Accumulation of biomass and some macroelements in tomato plants grown in media with (+)-usnic acid // Environ. Exp. Bot. 2006. V. 56. P. 239. https://doi.org/10.1016/j.envexpbot.2005.03.001
Lasceve G., Gaugain F. Effects of usnic acid on sunflower andmaize plantlets // J. Plant Physiol. 1990. V. 136. P. 723. https://doi.org/10.1016/S0176-1617(11)81352-0
Fiskesjo G. The Allium test as a standard in environmental monitoring // Hereditas. 1985. V. 102. P. 99. https://doi.org/10.1111/j.1601-5223.1985.tb00471.x
Прокопьев И.А., Филиппов Э.В., Филиппова Г.В., Гладкина Н.П. Генотоксичность энантиомеров усниновой кислоты in vitro в лимфоцитах периферической крови человека // Цитология. 2017. Т. 59. С. 13. )https://doi.org/10.1134/S1990519X17020031
Huneck S., Yoshimura I. Identification of lichen substances. 1996. Berlin-Heidelberg: Springer-Verlag. 493 p.
Jin J., Rao Y., Bian X., Zeng A., Yang G. Solubility of (+)-usnic acid in water, ethanol, acetone, ethyl acetate and n-hexane // J Solution Chem. 2013. V. 42. P. 1018. https://doi.org/10.1007/s10953-013-0010-1
Huneck S., Schreiber K. Wachstumsregulatorische eigenschaften von flechten-und moos-inhaltsstoffen // Phytochemistry. 1972. V. 11. P. 2429.
Паушева З.П. Практикум по цитологии растений. М.: Колос, 1974. 288 с.
Gichner T., Patkova Z., Szakova J., Demnerova K. Cadmium induces DNA damage in tobacco roots, but no DNA damage, somatic mutations or homologous recombination in tobacco leaves // Mutat. Res. 2004. V. 559. P. 49. https://doi.org/10.1016/j.mrgentox.2003.12.008
Жанатаев А.К., Никитина В.А., Воронина Е.С., Дурнев А. Д. Методические аспекты оценки ДНК-повреждений методом ДНК-комет // Прикладная токсикология. 2011. Т. 2. № 4. С. 28.
Giannopolitis C.N., Ries S.K. Superoxide dismutases: I. Occurrence in higher plants // Plant Physiol. 1977. V. 59. P. 309. https://doi.org/10.1104/pp.59.2.309
Лебедева О.В., Угарова Н.Н., Березин И.В. Кинетическое изучение реакции окисления (о)-дианизидина перекисью водорода в присутствии пероксидазы из хрена // Биохимия. 1977. Т. 42. С. 1372.
Aebi H. Catalase in vitro // Meth. Enzymol. 1984. V. 105. P. 121. https://doi.org/10.1016/s0076-6879(84)05016-3
Рогожин В.В. Методы биохимических исследований. Якутск: ЯГУ, 1999. 93 с.
Lichtenthaler H.K. Chlorophylls and carotenoids pigments of photosynthetic biomembranes // Method. Enzymol. 1987. V. 148. P. 350. https://doi.org/10.1016/0076-6879(87)48036-1
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с.
Ozturk S., Guvenc S., Arikan N., Yilmaz Ö. Effect of usnic acid on mitotic index in root tips of Allium cepa L // Lagascalia. 1999. V. 21. P. 47.
Polat Z., Aydın E., Türkez H., Aslan A. In vitro risk assessment of usnic acid compound // Toxicol. Ind. Health. 2013. V. 32. P. 468. https://doi.org/10.1177/0748233713504811
Koparal A.T., Tüylü B.A., Türk H. In vitro cytotoxic activities of (+)-usnic acid and (-)-usnic acid on V79, A549, and human lymphocyte cells and their non-genotoxicity on human lymphocytes // Nat. Prod. Res. 2006. V. 20. P. 1300. https://doi.org/10.1080/14786410601101910
Romagni J.G., Meazza G., Nanayakkara N.P.D., Dayan F.E. The phytotoxic lichen metabolite, usnic acid, is a potent inhibitor of plant p-hydroxyphenylpyruvate dioxygenase // FEBS Letters. 2000. V. 480. P. 301. https://doi.org/10.1016/s0014-5793(00)01907-4
Endo T., Takahagi T., Kinoshita Y., Yamamoto Y., Sato F. Inhibition of photosystem II of spinach by lichenderived depsides // Biosci. Biotechnol. Biochem. 1998. V. 62. P. 2023. https://doi.org/10.1271/bbb.62.2023
Abo-Khatwa A.N., al-Robai A.A., al-Jawhari D.A. Lichen acids as uncouplers of oxidative phosphorylation of mouse-liver mitochondria // Nat. Toxins. 1996. V. 4. P. 96. https://doi.org/10.1002/19960402NT7
Креславский В. Д., Лось Д. А., Аллахвердиев С.И., Кузнецов В.В. Сигнальная роль активных форм кислорода при стрессе у растений // Физиология растений. 2012, Т. 59. С. 163.
Kohlhardt-Floehr C., Boehm F., Troppens S., Lademann J., Truscott T.G. Prooxidant and antioxidant behaviour of usnic acid from lichens under UVB-light irradiation - studies on human cells // J. Photochem. Photobiol. B. 2010. V. 101. P. 97. https://doi.org/10.1016/j.jphotobiol.2010.06.017
Прокопьев И.А., Филиппов Э.В., Филиппова Г.В., Жанатаев А.К. Про/антигенотоксическая активность энантиомеров усниновой кислоты in vitro // Бюллетень экспериментальной биологии и медицины. 2017. Т. 164. С. 289. )https://doi.org/10.1007/s10517-018-3979-z
Latkowska E., Bialczyk J., Lechowskit Z., Czaja-Prokop U. Responses in tomato roots to stressc ausedb y exposure to (+)-usnic acid // Allelopathy J. 2008. V. 2l. P. 239.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений