Физиология растений, 2020, T. 67, № 6, стр. 625-635
Мелатонин и селен регулируют рост и окислительный статус клеточных культур Saussurea orgaadayi in vitro, полученных от разных эксплантов
И. Ф. Головацкая a, *, Е. В. Бойко a, А. Е. Резниченко a, И. Н. Плюснин a
a Федеральное государственное автономное образовательное учреждение высшего образования
Национальный исследовательский Томский государственный университет
Томск, Россия
* E-mail: golovatskaya.irina@mail.ru
Поступила в редакцию 26.11.2019
После доработки 23.01.2020
Принята к публикации 03.02.2020
Аннотация
Проведено комплексное исследование влияния 0.1 пМ мелатонина, 1.0 нМ селенита натрия (${\text{SeO}}_{3}^{{2 - }}$) и их смеси на морфогенез и метаболизм у двух линий клеточной культуры Saussurea orgaadayi (Khanm.) Krasnob. Показаны фенотипические различия культур, полученных от разных эксплантов: гипокотилей и семядолей. Гипокотильная линия клеточной культуры (ГКК) характеризовалась большим числом и большими размерами крупных клеток по сравнению с семядольной линией (СКК). Установлено, что ростовые процессы у каллусных культур связаны с особенностями их метаболизма. Активно растущая ГКК отличалась большим содержанием пролина (2.5-кратно) и экдистерон-подобного соединения (2.3-кратно), повышенной интенсивностью перекисного окисления липидов (ПОЛ) (2-кратно) и меньшим содержанием флавоноидов (Фл). В то время как у СКК отмечали 3-кратно больший уровень Фл и меньший уровень других соединений. Экзогенный мелатонин увеличивал ростовой индекс по сырой массе (РИ) у обеих культур до 20 суток, тогда как ${\text{SeO}}_{3}^{{2 - }}$ повышал РИ у СКК на 20–25 сутки и не менял его у ГКК по сравнению с контролем. Совместное действие факторов повышало РИ, начиная с 15 суток больше у ГКК, чем у СКК. Мелатонин и ${\text{SeO}}_{3}^{{2 - }}$ регулировали функционирование антиоксидантной системы в клетке. Мелатонин понижал интенсивность ПОЛ и повышал содержание пролина у обеих линий. Влияние ${\text{SeO}}_{3}^{{2 - }}$ было менее эффективным, чем влияние мелатонина. Совместное действие факторов на интенсивность ПОЛ снижалось, а на содержание пролина повышалось относительно действия мелатонина у СКК, тогда как у ГКК эффективность действия комбинации факторов совпадало с эффективностью мелатонина. Высказано предположение о дифференцированном изменении дыхания клеточной культуры, как источника АФК, под действием мелатонина и ${\text{SeO}}_{3}^{{2 - }}$.
ВВЕДЕНИЕ
В настоящее время известно о широком распространении мелатонина (N-ацетил-5-метокситриптамина) в царствах животных, растений и грибов [1]. И если функции этого индоламина у животных и человека исследованы достаточно подробно, то его роль в растениях остается открытой. Несмотря на общего предшественника (L-триптофана) и сходство по строению с индолил-3-уксусной кислотой (основополагающим фитогормоном), мелатонин характеризуется особыми свойствами. Возможно, являясь амфипатической молекулой, он может воздействовать на свободные радикалы, как в гидрофильной, так и в липофильной среде [2]. Он может напрямую влиять на внутриклеточные процессы, при этом изменяя окислительный статус клетки. В тоже время он может связываться с рецепторными молекулами, запуская каскад вторичных мессенджеров [3]. Мелатонин выступает в качестве двойного антиоксиданта, поскольку может сам удалять разные виды активных форм кислорода (АФК), а также увеличивать активность антиоксидантной системы клетки, состоящей из неферментативных и ферментативных компонентов. Показано влияние мелатонина на разных этапах онтогенеза растений (прорастание семян, развитие корней, старение листьев, цветение, формирование семян и созревание плодов) [1]. Установлена способность мелатонина регулировать ИУК-зависимые ростовые реакции колеоптилей пшеницы и проростков Arabidopsis в темноте и на селективном свету [4]. Мелатонин является важным модулятором экспрессии генов, контролирующих разные аспекты клеточной активности: формирование гормонального статуса, клеточной стенки, фотосинтетического потенциала и т.д. [5]. Он также участвует в формировании защитных механизмов при действии абиотических стрессоров [6]. Эффективность действия мелатонина на фотосинтетические процессы зависит от его концентрации. С увеличением концентрации экзогенного мелатонина от 0.1 пМ до 1.0 мкМ, используемого для корневой обработки, уменьшалось время последействия для активации фотосинтеза, транспирации и устьичной проводимости листа огурца [7].
Сложность определения всех функций индоламина в растении заключается в том, что растения часто содержат его большие количества, чем животные. Можно было объяснить этот факт его синтезом в хлоропластах наравне с митохондриями, но видоспецифичность в содержании мелатонина усложняет однозначную интерпретацию [8, 9]. Кроме того, большинство моделей, с помощью которых изучаются функции мелатонина, представлены интактными проростками и растениями, получающими мелатонин через корень или лист и имеющими комплексное строение. Это усложняет установление действующих концентраций веществ, поскольку известно о буферной емкости корней и структур побега. В ходе транспорта веществ они подвергаются компартментализации или модификации, что имеет значение для обмена веществ и его регуляции.
Удобной моделью для выяснения механизмов регулирования роста клеток растения разнообразными экзогенными факторами являются культуры клеток in vitro. Перспективными для практики служат растения, содержащие биологически активные вещества, среди которых можно выделить виды рода Saussurea DC. Соссюрея оргаадай (горькуша оргаадай) – травянистое многолетнее растение из семейства Сложноцветные (Asteraceae), эндемик Юго-Восточного Алтая, Юго-Западной Тувы и Северо-Западной Монголии [10]. Она является редким видом, имеющим статус – уязвимый вид, и внесена в Красные книги Республики Тыва и Республики Алтай. Статус редкости связан с уменьшением численности особей популяций вследствие чрезмерного использования или изменений среды обитания. В настоящее время ограничены сведения о химическом составе видов рода Saussurea DC. Известно, что во всех описанных видах соссюрей содержатся фенольные соединения (флавоноиды, кумарин, фенолкарбоновые кислоты, дубильные вещества). В ряде видов обнаружен сесквитерпеновый лактон, относящийся к гваянолидам – цинаропикрин [11]. Ранее нами показано присутствие в культуре клеток S. orgaadayi терпеноидных сапонинов [12].
Ограничены сведения о влиянии мелатонина на рост отдельных клеток. Вызывает интерес совместное действие мелатонина с другим веществом с антиоксидантной активностью – селеном [13]. Согласно нашим данным, селен регулирует морфогенез и метаболизм однодольных и двудольных растений in vivo и каллусной клеточной культуры S. orgaadayi in vitro [14, 15, 12 ].
В связи с этим целью нашей работы явилось изучение роли мелатонина, селенита натрия и их смеси в регуляции роста и окислительного статуса гипокотильной и семядольной линий каллусной клеточной культуры Saussurea orgaadayi (Khanm.) Krasnob.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили две линии клеточной культуры Saussurea orgaadayi (Khanm.) Krasnob. Впервые клеточная культура S. orgaadayi получена на кафедре физиологии растений и биотехнологии Томского государственного университета под руководством проф. Р.А. Карначук на среде Мурасиге-Скуга, содержащей 0.8 мг/л 2,4-Д и 0.5 мг/л 6-БАП [16].
В качестве эксплантов для получения культур использовали семядоли и гипокотили проростков, соответственно этому линии названы семядольная и гипокотильная (рис. 1а, б). Для характеристики клеточных культур двух линий изучали особенности их роста и метаболизма (содержание суммы флавоноидов и экдистерона).
Рис. 1.
Морфология и цвет каллуса клеточной культуры S. orgaadayi семядольной (а) и гипокотильной (б) линий на стадии активного роста, семядольной линии (в, г, д) на питательной среде без (в) и с мелатонином в концентрации 0.001 пМ (г) и 0.1 пМ (д) на 25 сутки культивирования.

Каллусную культуру клеток S. orgaadayi выращивали на твердой питательной среде Мурасиге-Скуга (МС-среда), содержащей сахарозу и витамины (контроль), или МС-среда + 0.1 пМ мелатонин, или МС-среда + 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$ и МС-среда + 0.1 пМ мелатонин + 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$ (опыт). Выбор низких концентраций экзогенных веществ обусловлен самим объектом исследований – культурой растительных клеток. Она легко поглощает экзогенные вещества и не имеет хорошо развитых буферных систем тканевого (организованный апопласт) или органного (сосуды, запасающие ткани и др.) уровней нативного растения. Растительную культуру культивировали в темноте при влажности 60–70% и температуре воздуха 20–23°С.
В ходе исследований изучали влияние экзогенных мелатонина и селенита натрия по отдельности и в смеси на рост и морфологию (форму, линейные размеры и объем клеток, ростовой индекс по сырой массе) и биохимические параметры (интенсивность перекисного окисления липидов, содержание пролина) клеточной культуры S. orgaadayi двух линий. Данные, касающиеся кинетики роста, собирали через 5 суток в течение 25 суток. Интенсивность перекисного окисления липидов и содержание пролина измеряли на 25 сутки культивирования для двух линий S. orgaadayi, что позволило оценить окислительный статус изучаемых культур в фазу активного роста.
Метод определения размеров клеток. Для определения размеров клеток использовали световую микроскопию и видеокамеру с программой “Moticam 2300” (Испания). Перед цитологическим анализом проводили фиксацию клеточной культуры с помощью фиксатора Кларка в течение 2 суток, затем клеточный материал дважды промывали 70% раствором этилового спирта, и оставляли в новой порции этого раствора для долговременного хранения. Микропрепараты готовили из предварительно отмацерированных каллусных тканей. Мацерацию проводили в 3 N растворе соляной кислоты при встряхивании, время мацерации зависело от времени субкультивирования от 8 до 24 ч, так более молодые культуры требовали меньше времени мацерации. Измеряли длину (L) и ширину (D) клеток. Объем клеток (V) высчитывали по формулам, предложенным Ю. А. Цельникер (1978) [17].
При L/D ≤ 2.5 рассчитывали V по формуле эллипсоида вращения:
(1)
$V = {{{4 \mathord{\left/ {\vphantom {4 {3\pi {L \mathord{\left/ {\vphantom {L {2\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}} \right. \kern-0em} {2\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}}}} \right. \kern-0em} {3\pi {L \mathord{\left/ {\vphantom {L {2\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}} \right. \kern-0em} {2\left( {{D \mathord{\left/ {\vphantom {D 2}} \right. \kern-0em} 2}} \right)}}}}}^{2}}.$При отношении L/D > 5 рассчитывали V по формуле цилиндра:
(2)
$V = \pi \times {1 \mathord{\left/ {\vphantom {1 {4{{D}^{2}}L}}} \right. \kern-0em} {4{{D}^{2}}L}}.$При L/D > 2.5, но L/D < 5 рассчитывали V по формуле цилиндра с использованием коэффициентов k, зависящих от L/D (3), например, при L/D = = 2.6 k = 0.69; при L/D = 3.4 k = 0.78; при L/D = = 4.2 k = 0.89 и т.д.:
(3)
$V = \pi \times {1 \mathord{\left/ {\vphantom {1 {4{{D}^{2}}L}}} \right. \kern-0em} {4{{D}^{2}}L}}k.$Интенсивность перекисного окисления липидов (ПОЛ) установили спектрофотометрическим методом по накоплению малонового диальдегида (МДА). Метод основан на способности МДА реагировать с тиобарбитуровой кислотой при нагревании и образовывать окрашенный комплекс, количество которого оценивали по оптической плотности раствора при длине волны 532 нм, согласно ранее описанной методике [7].
Определение содержания пролина в клеточной культуре проводили в свежем растительном материале с помощью метода Bates с соавт. (1973), основанного на реакции с нингидрином в кислой среде, которая идет с образованием окрашенного продукта, имеющего максимум поглощения при длине волны 520 нм, согласно ранее описанной методике [7].
Количественное определение суммы флавоноидов в клеточной культуре в пересчете на рутин в исследуемом экстракте проводили согласно ранее описанной методике [15]. Метод основан на реакции комплексообразования с хлоридом алюминия в уксуснокислой среде с использованием спектрофотометрии (Genesys 10S UV–Vis, “ThermoScientific”, США) при длине волны 414 нм.
Количественное определение экдистерона в клеточной культуре. Навеску сухой массы клеточной культуры S. orgaadayi (10 г) экстрагировали в течение 12 ч при температуре 60°C 70% этиловым спиртом в соотношении 1 : 10 (m/V) с модификацией по Якубовой с соавт. [18]. Отфильтрованный экстракт упаривали до минимального объема. Разделение фракций осуществляли тонкослойной хроматографией на пластинках “Sorbfil UV-254”. После центрифугирования экстрактов сорбента измеряли оптическую плотность при длине волны 242 нм на фоне элюата холостого опыта (контроль). Расчет осуществляли по формуле:
(4)
$Х\% = {{({{С}_{{{\text{st}}}}}{{D}_{x}}{{V}_{1}}{{V}_{3}} \times 100 \times 100)} \mathord{\left/ {\vphantom {{({{С}_{{{\text{st}}}}}{{D}_{x}}{{V}_{1}}{{V}_{3}} \times 100 \times 100)} {{\kern 1pt} ({{D}_{{{\text{st}}}}}{{V}_{2}}a \times (100 - h) \times 1000)}}} \right. \kern-0em} {{\kern 1pt} ({{D}_{{{\text{st}}}}}{{V}_{2}}a \times (100 - h) \times 1000)}}{\kern 1pt} $где Dx − оптическая плотность исследуемого раствора; Dst − оптическая плотность раствора стандартного образца; Сst − концентрация раствора стандартного образца, мг/мл; V1 − объем элюата, мл; V2 − объем исследуемого раствора, нанесенного на хроматограмму, мл; V3 − объем экстрагента, мл; а − навеска, г; h – содержание влаги в растительном материале, %.
Для сравнения независимых выборок, подчиняющихся закону нормального распределения, использовали параметрический критерий Стьюдента. Значения t-критерия находили для 95% уровня значимости (Р ≤ 0.05). В статье использовано 3 биологических повторности (чашки Петри) по 9 каллусов, то есть по 27 каллусов на вариант. На рисунках представлены средние арифметические (М) биохимических параметров (n = 9) с двухсторонними доверительными интервалами (М ± 1.96 SEM).
РЕЗУЛЬТАТЫ
Характеристика клеточных культур, полученных на основе разных эксплантов
Клеточные культуры S. orgaadayi, полученные на основе разных эксплантов – семядолей и гипокотилей проростков, характеризовались разными темпами роста и имели разный уровень вторичных метаболитов. Ростовой индекс по сырой массе (РИ) семядольной линии клеточной культуры (СКК) колебался от 0.091 до 1.015 соответственно в течение периода от 5 до 25 суток субкультивирования. Максимальный прирост биомассы приходился на 10 сутки. РИ гипокотильной линии клеточной культуры (ГКК) изменялся от 0.271 до 2.420 в этот же период культивирования. Максимальный прирост биомассы приходился на 20–25 сутки.
Исследование уровня вторичных метаболитов показало трехкратное превышение суммы флавоноидов у СКК по сравнению с ГКК, что соответствовало 0.026 ± 0.006 и 0.008 ± 0.002% к сухой массе (табл. 1). Определение экдистерон-подобных соединений установило, что у СКК их содержание составило 0.012 ± 0.001% от сухой массы, тогда как в ГКК отмечено двукратное увеличение уровня соединения этого типа – 0.029 ± 0.005% от сухой массы.
Влияние мелатонина и селена на рост клеточной культуры
СКК характеризовалась менее интенсивным приростом сырой массы в первые 5 суток субкультивирования (рис. 2а, 1), чем ГКК (рис. 2б, 1). В связи с этим РИ ГКК трехкратно превышал таковой у СКК. Затем темпы прироста сырой массы культур сохранялись приблизительно на одном уровне, но начиная с 20 суток, РИ ГКК увеличивался в 2 раза.
Рис. 2.
Динамика ростового индекса по сырой массе каллусной культуры S. orgaadayi семядольной (а) и гипокотильной (б) линий в зависимости от мелатонина (Мел), селенита натрия (${\text{SeO}}_{3}^{{2 - }}$) и их смеси: 1 – контроль, 2 – 0.1 пМ Мел, 3 – 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$, 4 – 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$ + 0.1 пМ Мел.

Мелатонин оказывал 2.5-кратное увеличение РИ СКК на 10 сутки субкультивирования и поддерживал высокий уровень скорости роста на протяжении всего периода роста относительно контроля (рис. 2а, 2). При этом на 20 сутки, в период стационарной фазы роста контрольного варианта СКК (рис. 2а, 1), мелатонин 3-кратно увеличивал РИ. Стимулирующее действие мелатонина на РИ ГКК также проявлялось, начиная с 10 суток и поддерживалось на уровне 50, 30 и 50% соответственно на 10, 15 и 20 сутки относительно контроля. На 25 сутки мелатонин снижал интенсивность роста на 20% по сравнению с контролем (рис. 2б, 2).
Действие ${\text{SeO}}_{3}^{{2 - }}$ было эффективно в первые 5 суток и последние 20–25 сутки субкультивирования СКК и соответственно составило 70% и 40–70% по сравнению с контролем (рис. 2а, 3). В то время как у ГКК на начальном этапе субкультивирования (5 сутки) отмечено 2-кратное торможение роста, а в последующем одинаковая с контролем динамика РИ (рис. 2б, 3).
Совместное действие мелатонина и ${\text{SeO}}_{3}^{{2 - }}$ увеличивало прирост РИ СКК в среднем в 1.7–2.0 раз относительно контроля (рис. 2а, 4), что было меньше эффективности мелатонина на 50% (10 и 15 сутки) и 100% (20 сутки). В то же время эффективность двух факторов у ГКК составила от 1.24 до 2.36 раз по сравнению с контролем, что было выше результативности действия мелатонина на РИ на 10% (10 и 20 сутки), 45% (25 сутки) и 112% (15 сутки) (рис. 2б, 4).
Цитологический анализ показал, что прирост биомассы клеточной культуры в процессе субкультивирования был обусловлен размерами клеток и их долей к общему количеству измеренных клеток. В общей массе отмацерированных клеток выделяли мелкие, средние и крупные клетки. К разряду “мелких” клеток относили клетки с меньшим объемом в пределах от 1 до 10 тыс. мкм3, к “средним” – клетки с объемом от 11 до 90 тыс. мкм3, и “крупным” – остальные клетки от 91 тыс. мкм3 (например, до 600 тыс. мкм3 на 20 сутки у ГКК).
В контрольном варианте СКК на 5 сутки отмечено максимальное число средних клеток (рис. 3в, С) и много мелких. На 10 сутки увеличивалась доля средних паренхимных клеток и размеры крупных клеток, на 20–25 сутки происходило увеличение доли крупных клеток и их размеров и отсутствие мелких клеток, что свидетельствовало о преимущественном растяжении (рис. 3а, 3в). Мелатонин увеличивал клеточное деление на 5 и 20 сутки по сравнению с контролем, поскольку возрастала доля мелких клеток. На 10–15 сутки увеличивался объем крупных клеток. ${\text{SeO}}_{3}^{{2 - }}$ увеличивал долю средних и крупных клеток на 5 сутки по сравнению с контролем, с последующим снижением доли средних и увеличением доли крупных клеток до 15 суток, однако на 25 сутки доля мелких клеток вновь увеличивалась. Совместное действие мелатонина и ${\text{SeO}}_{3}^{{2 - }}$ уменьшило долю мелких клеток в начальной стадии субкультивирования, но увеличило с 15 по 25 сутки, что отражалось на биомассе в этот период.
Рис. 3.
Динамика размеров (а, б) и частоты встречаемости (в, г) клеток каллусной культуры Saussurea orgaadayi семядольной (а, в) и гипокотильной (б, г) линий в зависимости от мелатонина (Мел), селенита натрия (${\text{SeO}}_{3}^{{2 - }}$) и их смеси: К – крупные клетки, М – мелкие клетки, С – средние клетки.
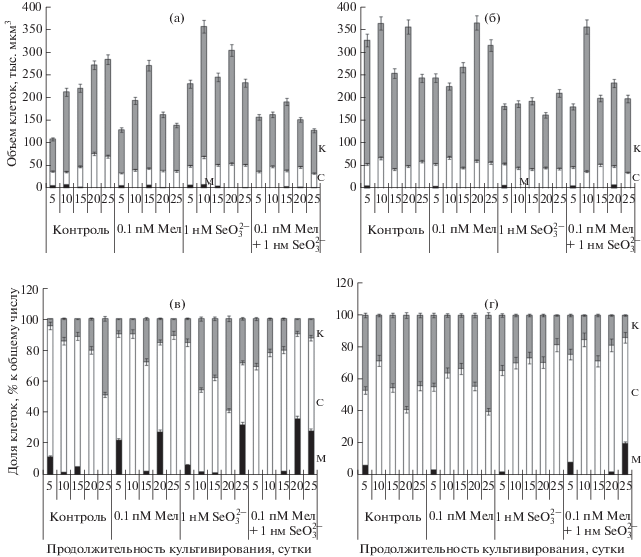
Прирост РИ ГКК, вероятно, был обусловлен увеличением размеров крупных клеток, начиная с 5 суток, при этом увеличивалась доля крупных клеток, по сравнению с СКК (рис. 3б, 3г). Существенный прирост РИ на 20 сутки был обусловлен увеличением размеров и доли крупных клеток. Мелатонин увеличивал долю средних клеток на 10–15 сутки, а в дальнейшем и крупных. ${\text{SeO}}_{3}^{{2 - }}$ увеличивал долю средних клеток и уменьшал объем клеток на 5 и 20 сутки, что обусловливало в эти сутки снижение прироста биомассы относительно контроля. Совместное действие экзогенных факторов увеличивало долю мелких клеток на 5 сутки и индуцировало их образование на 20–25 сутки. Связано ли это с делением клеток или торможением их роста еще предстоит установить.
Влияние мелатонина и селенита натрия на интенсивность перекисного окисления липидов
Оценка окислительного статуса двух линий каллусных культур контрольного варианта показала накопление МДА в количестве 0.010 ± 0.002 и 0.023 ± 0.003 мкмоль/г сырой массы соответственно у СКК и ГКК линий, что свидетельствовало о разной интенсивности ПОЛ (рис. 4а). Действие экзогенных факторов на культуру изменяло интенсивность ПОЛ. При обработке мелатонином данный показатель уменьшался на 64% у СКК и 30% у ГКК. В то же время ${\text{SeO}}_{3}^{{2 - }}$ был менее эффективным, чем мелатонин, удаление АФК составило 9% у первой культуры, и 17.4% – у второй (рис 4а). Совместное действие веществ обусловливало снижение интенсивности ПОЛ на 45% у СКК и 26% у ГКК.
Рис. 4.
Влияние мелатонина, селенита натрия и их смеси на содержание малонового диальдегида (а, МДА) и пролина (б) у каллусной клеточной культуры двух линий на 25 сутки субкультивирования: 1 – контроль, 2 – 0.1 пМ мелатонин, 3 – 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$, 4 – 1.0 нМ ${\text{SeO}}_{3}^{{2 - }}$ + 0.1 пМ мелатонин. Различия между средними значениями, отмеченные разными буквами, статистически значимы при P ≤ 0.05.

Влияние мелатонина и селенита натрия на аккумуляцию пролина в клеточной культуре
Отмечена специфичность линий по содержанию пролина у контрольных вариантов. Наибольшее содержание пролина (1.48 ± 0.06 мкмоль/г сырой массы) отмечено у ГКК по сравнению с СКК (0.59 ± ± 0.02 мкмоль/г сырой массы).
Действие экзогенных веществ повышало уровень пролина в клеточных культурах (рис. 4б). Мелатонин увеличивал пролин на 59% у СКК и 45% у ГКК. Эффективность ${\text{SeO}}_{3}^{{2 - }}$ была ниже и составила соответственно 49 и 39%. Совместное действие мелатонина и ${\text{SeO}}_{3}^{{2 - }}$ повышало уровень антиоксиданта. У СКК увеличение составило 93%, тогда как у ГКК – 52% относительно соответствующего контрольного варианта.
ОБСУЖДЕНИЕ
В результате наших исследований установлено, что клеточные культуры S. orgaadayi, полученные на основе разных эксплантов (гипокотили, семядоли), имели разные скорости роста и биохимические параметры. Так, ГКК отличалась большими размерами клеток и большей скоростью роста РИ, по сравнению с СКК. Активно растущая ГКК характеризовалась на 25 сутки субкультивирования большим содержанием пролина (2.5-кратно) и экдистерон-подобных соединений (2.3-кратно), большей интенсивностью ПОЛ (2-кратно) и меньшим содержанием суммы флавоноидов (Фл). В то же время СКК, имеющая 3-кратно большее содержание Фл, характеризовалась меньшей интенсивностью ПОЛ (табл. 1), что согласовалось с известной антиоксидантной функцией Фл [19].
Концентрации экзогенного мелатонина, применяемые в представленном эксперименте, были выбраны на основе обнаруженной нами ранее дозо-зависимой эффективности индоламина при растяжении клеток колеоптилей пшеницы в присутствии экзогенной ИУК [4]. Было изучено действие экзогенных гормонов в диапазоне от 0.0001 до 1000 нМ. При комплексном влиянии мелатонин (Мел) оказал большее рост-стимулирующее действие в концентрации 0.1 пМ, чем в концентрации 1.0 мкМ. Увеличение концентрации мелатонина в смеси с ИУК (ИУК + 1.0 мкМ Мел) снижало их совместный эффект на 40 и 20% по сравнению с ИУК + 0.1 пМ Мел соответственно при концентрациях 0.1 и 1.0 мкМ ИУК. Кроме того, при выборе концентрации экзогенного мелатонина для регуляции роста клеточной культуры исходили из положения, что для жизнедеятельности меристематических клеток, которыми являются большинство клеток каллуса в начале субкультивирования, требуются низкие концентрации веществ. В связи с этим было опробировано действие мелатонина в сверхнизких концентрациях 0.001 и 0.1 пМ. Клеточные культуры, выращиваемые на МС-среде с мелатонином, на протяжении всего времени субкультивирования оставались однородного светло-желтого цвета, что свидетельствовало об отсутствии некротических явлений (рис. 1г, д). Наиболее эффективной была среда с 0.1 пМ мелатонином (рис. 1д), что определило ее дальнейшее использование в ходе эксперимента.
Длительное сохранение жизнедеятельности клеток могло быть обусловлено антиоксидантными свойствами мелатонина, удаляющего свободные радикалы (гидроксильный радикал, оксид азота, пероксинитрит) [2], тем самым, поддерживая функционирование структурных компонентов клеток и задерживая старение [20]. В работе Zhao с соавт. [20] установлено, что предварительная обработка каллусов Rhodiola crenulata мелатонином перед криоконсервацией улучшает выживаемость каллусов и защищает их ткани от окислительного повреждения.
Анализ динамики ростового индекса двух культур горькуши контрольных вариантов показал, что ГКК отличалась от СКК более продолжительным и активным ростом, кривая РИ к 25 суткам не выходила на плато. Действие мелатонина повышало темпы роста клеточных культур. Особенно наглядно показана активация роста РИ у СКК на 20 сутки (рис. 2а, 2), что совпадало по времени с периодом стационарной фазы в кинетике РИ у контрольного варианта СКК (рис. 2а, 1).
Выход на плато кривой РИ СКК и замедление прироста биомассы под влиянием мелатонина с 20 по 25 сутки (рис. 2а, 2) зависели от изменения роста клеток, прежде всего преобладающего растяжения более мелких клеток (рис. 3в, М), при котором увеличивалась доля средних клеток за счет уменьшения доли мелких клеток (рис. 3в, С, М), таким образом, несмотря на растяжение клеток, они оказывали меньший вклад в общую биомассу культуры. У ГКК стабильный прирост РИ с 20 по 25 сутки (рис. 2б, 2) под влиянием мелатонина сопровождался увеличением доли крупных клеток (рис. 3г, К) за счет уменьшения доли клеток среднего класса (рис. 3г, С) и уменьшения среднего объема крупной клетки (рис. 3б, К).
Клеточные культуры отличались по чувствительности к ${\text{SeO}}_{3}^{{2 - }}$. Культура с большим ростовым потенциалом (ГКК), которая в норме (контроле) формировала более крупные клетки, уменьшала размеры крупных клеток под действием ${\text{SeO}}_{3}^{{2 - }}$. В то же время СКК с меньшим объемом крупных клеток в присутствии ${\text{SeO}}_{3}^{{2 - }}$ увеличивала размеры клеток этой группы.
Для растений пролин является метаболитом, обладающим осмопротекторными и антиоксидантными свойствами [21, 22]. Экзогенные мелатонин и селенит натрия увеличивали уровень пролина в клеточных культурах, который мог обусловливать снижение их окислительного статуса, поскольку наблюдали отрицательную связь между уровнем пролина (рис. 4б) и уровнем интенсивности ПОЛ (рис. 4а). Другими авторами показано, что увеличение внутриклеточной концентрации пролина изменяло редокс-баланс и активность супероксиддисмутазы (SOD) и аскорбатпероксидазы (APX) у клеток суспензионной культуры Thellungiella salsuginea [22]. В условиях окислительного стресса, вызванного действием Н2О2, в культуре клеток Th. salsuginea экзогенный пролин способствовал снижению уровня ПОЛ и повышению количества живых клеток. Экзогенный пролин в присутствии Н2О2 повышал активность APX и общую активность SOD в клеточной культуре. По аналогии с данными других авторов [22] повышение уровня пролина в клеточной культуре горькуши можно рассматривать как один из механизмов проявления антиоксидантных свойств экзогенных факторов. Но поскольку уровень пролина повышался приблизительно одинаково, то отличия по интенсивности ПОЛ могли быть обусловлены другими свойствами молекул мелатонина и ${\text{SeO}}_{3}^{{2 - }}$. Например, известно, что мелатонин сам обладает высокой антиоксидантной активностью, поскольку и он и его продукты окисления являются антиоксидантами [23]. Они действуют как естественные доноры электронов. Мелатонин, генерируя каскад радикалов – продуктов окисления, таких как β-гидроксимелатонин, циклический β-гидроксимелатонин или циклический мелатонин и N1-ацетил-N2-формил-5-метоксикинурамин, вносит свой вклад в дальнейшую ликвидацию АФК. В связи с этим, подобная способность делает мелатонин эффективным в защите клетки от окислительного стресса даже в малых дозах. Кроме того, мелатонин увеличивает активность SOD и гваякол-пероксидазы [7]. Селен в низких концентрациях увеличивает активность SOD, каталазы, APX и глутатион-редуктазы, содержание аскорбата [13, 14, 24]. Антиоксидантные свойства ${\text{SeO}}_{3}^{{2 - }}$ могут проявляться также через его способность регулировать вторичный метаболизм растений, увеличивая уровень антиоксидантов Фл [14].
Проявление осмопротекторной роли пролина наблюдалось у СКК и ГКК при увеличении РИ (рис. 2а, б) в процессе их культивирования. Большему уровню пролина в контрольном варианте ГКК соответствовал и больший прирост биомассы по сравнению с СКК. О важной роли пролина в увеличении биомассы каллуса и суспензионной культуры (свежей и сухой массы) отмечали и другие авторы [21].
Особенности роста клеток каллусных культур могли быть связаны с динамикой метаболизма пролина, поскольку известно, что он играет важную роль в регуляции общего синтеза белка и клеточного цикла растительной клетки [25]. У мутанта pro1 кукурузы с нарушенным ферментом Pro1 (P5CS2), катализирующим синтез пролина из глутамата в цитозоле, отмечают дефицит пролина, снижение экспрессии генов циклинов и других генов, связанных с клеточным циклом, остановку клеточного цикла при переходе от фазы G1 к S и подавление пролиферации клеток. Из этого следует, что наибольший прирост биомассы ГКК по сравнению с СКК в нашем эксперименте, вероятно, был обусловлен большим уровнем пролина, который мог выступать источником азота и энергии, поскольку в митохондриях происходит его разложение до глутамата с высвобождением энергии в форме FADH2 и NAD(P)H.
Эффективность действия мелатонина на уровень МДА (снижение интенсивности ПОЛ) у СКК составила 64%, что в 2 раза выше, чем у ГКК (рис. 4а, 2). Это могло быть связано с повышением других антиоксидантов, например, Фл, как это показано для культуры клеток Fagonia indica [26]. В тоже время ${\text{SeO}}_{3}^{{2 - }}$ оказывал существенно меньший эффект в регуляции интенсивности ПОЛ у СКК по сравнению с мелатонином. Торможение интенсивности ПОЛ у ГКК под действием ${\text{SeO}}_{3}^{{2 - }}$ составило 17.5%, что в 2 раза эффективнее, чем у СКК. Совместное действие экзогенных факторов уменьшало интенсивность ПОЛ, но с меньшей эффективностью, чем отдельно действующий мелатонин, у СКК и равной эффективностью мелатонину у ГКК. Следует ожидать, что подобные эффекты ${\text{SeO}}_{3}^{{2 - }}$ и смеси веществ связаны с активацией метаболических процессов, вызывающих увеличение продукции АФК.
В клеточной культуре S. orgaadayi, выросшей в темноте, исключено образование АФК хлоропластами. Наиболее вероятными производителями АФК являются митохондрии, в которых основными местами для генерации ${\text{O}}_{2}^{ - }$ служат комплекс I, убихинон и комплекс III электрон-транспортной цепи [27]. В связи с этим интенсивность ростовых процессов клеток зависит от согласованности их с функционированием органелл и антиоксидантных защитных систем, среди которых называют SOD, полифенолы, аскарбат, глутатион, фуростаноловые гликозиды, удаляющих супероксид анион [2, 28]. Мелатонин может изменять интенсивность метаболических процессов, прежде всего дыхания, поскольку Wan с соавт. [29] обнаружили, что этот индоламин вызывает изменения в профилях экспрессии генов, связанных с гликолизом, циклом трикарбоновых кислот, циклом глиоксиловой кислоты, метаболизмом первичного азота и катаболизмом нескольких ключевых аминокислот.
Различия в антиоксидантном действии мелатонина и ${\text{SeO}}_{3}^{{2 - }}$ могли быть связаны также с их влиянием на разные пути утилизации альдегидов. Волковой с соавт. [28] показана зависимость физиологического состояния клеток суспензионной культуры диоскореи дельтовидной от их антиоксидантного статуса. В процессе культивирования клеток альдегиддегидрогеназный путь с максимумом на 14 сутки преобладал над альдегидредуктазным.
Анализируя активность мелатонина и ${\text{SeO}}_{3}^{{2 - }}$, необходимо также помнить, что при культивировании каллусной культуры в питательную среду добавляли экзогенные фитогормоны ауксин (3.6 мкМ 2,4 Д) и цитокинин (2.2 мкМ 6-БАП). Действие дополнительных факторов накладывает отпечаток на их функционирование. Ранее нами показано взаимодействие мелатонина и ИУК в регулировании роста отмытых от фитогормонов этиолированных колеоптилей пшеницы [4]. Мелатонин усиливал эффективность действия экзогенной ИУК на растяжение клеток. Другими авторами также установлено, что комбинация мелатонина и ауксина (нафтилуксусной кислоты) увеличивала накопление биомассы в больших количествах, чем один мелатонин [30]. При этом совместное действие этих веществ повышало содержание общего белка и протеазную активность в культурах Prunella vulgaris L. (Selfheal). Взаимодействие мелатонина и ИУК в ходе регуляции ростовых процессов проявляется также через изменение экспрессии генов, контролирующих модификацию и рост клеточной стенки, транспорт и гомеостаз ИУК [5].
Наблюдения за ростом клеток разных линий клеточных культур S. orgaadayi показали, что мелатонин увеличивает объем клеток на начальных этапах субкультивирования (5, 15 сутки) у СКК и на последних этапах (20–25 сутки) – у ГКК. Действие мелатонина поддерживает на высоком уровне РИ, что свидетельствует об активности ростовых процессов клеточной культуры. Следовательно, если мелатонин может выполнять рост-регулирующие функции, то он может быть использован вместе с ИУК при культивировании клеток.
Таким образом, нами показано, что экзогенный мелатонин увеличивал РИ по сырой массе у обеих культур до 20 суток, тогда как ${\text{SeO}}_{3}^{{2 - }}$ повышал РИ у СКК на 20–25 сутки и не менял его у ГКК по сравнению с контролем. Совместное действие факторов повышало РИ, начиная с 15 суток больше у ГКК, чем у СКК. Мелатонин и селенит натрия регулировали функционирование антиоксидантной системы в клетке. Мелатонин понижал интенсивность ПОЛ и повышал содержание пролина у обеих линий. Действие ${\text{SeO}}_{3}^{{2 - }}$ было менее эффективным, чем мелатонина. Совместное действие факторов на интенсивность ПОЛ снижалось, а на содержание пролина повышалось относительно действия мелатонина у СКК, тогда как у ГКК эффективность действия комбинации факторов совпадало с эффективностью мелатонина. Высказано предположение о дифференцированном изменении дыхания клеточной культуры, как источника АФК, под действием мелатонина и ${\text{SeO}}_{3}^{{2 - }}$.
Статья написана в рамках научного проекта, выполненного при поддержке Программы повышения конкурентоспособности ТГУ.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Arnao M.B., Hernandez-Ruiz J. Melatonin and its relationship to plant hormones // Ann. Bot. 2018. V. 121. P. 195. https://doi.org/10.1093/aob/mcx114
Arnao M., Hernández-Ruiz J. Melatonin and reactive oxygen and nitrogen species: a model for the plant redox network // Melatonin Research. 2019. V. 2 (3). P. 152. https://doi.org/10.32794/11250036
Wei J., Li D.X., Zhang J.R., Shan C., Rengel Z., Song Z.B., Chen Q. Phytomelatonin receptor PMTR1-mediated signaling regulates stomatal closure in Arabidopsis thaliana // J. Pineal Res. 2018. V. 65. e12500. https://doi.org/10.1111/jpi.12500
Головацкая И.Ф., Бойко Е.В., Карначук Р.А. Роль мелатонина в регуляции ИУК-зависимых реакций растений в разных условиях освещения // Вестн. Томск. гос. унив. Биол. 2017. № 37. С. 144. https://doi.org/10.17223/19988591/37/8
eeda S., Zhang N., Zhao X., Ndip G., Guo Y., Buck G.A., Fu C., Ren S. Arabidopsis transcriptome analysis reveals key roles of melatonin in plant defense systems // PLoS ONE. 2014. V. 9. e93462. 10.1371/journal.pone.009346
Холодова В.П., Васильев С.В., Ефимова М.В., Воронин П.Ю., Рахманкулова З.Ф., Данилова Е.Ю., Кузнецов Вл.В. Экзогенный мелатонин защищает растения рапса от токсического действия избытка меди // Физиология растений. 2018. Т. 65. С. 463. https://doi.org/10.1134/S0015330318060088
Бойко Е.В., Головацкая И.Ф., Бендер О.Г., Плюснин И.Н. Влияние кратковременной корневой обработки мелатонином на фотосинтез листьев огурца // Физиология растений. 2020. Т. 67. С. 196. https://doi.org/10.1134/S0015330320020037
Zheng X., Tan D.X., Allan A.C., Zuo B., Zhao Y., Reiter R.J., Wang L., Wang Z., Guo Y., Zhou J., Shan D., Li Q., Han Z., Kong J. Chloroplastic biosynthesis of melatonin and its involvement in protection of plants from salt stress // Sci. Rep. 2017. V. 7. 41236. https://doi.org/10.1038/srep41236
Tan D.-X., Manchester L.C., Qin L., Reiter R.J. Melatonin: a mitochondrial targeting molecule involving mitochondrial protection and dynamics // Int. J. Mol. Sci. 2016. V. 17. P. 2124. https://doi.org/10.3390/ijms17122124
Красная книга Республики Алтай. Растения. / Под ред. А.Г. Манеев (гл. редактор), А.А. Ачимова, Н.В. Седельникова, И.А. Горбунова – г. Горно-Алтайск: ООО Горно-Алтайская типография, 2017. 272 с.
Погодин И.С., Лукша Е.А., Предейн Н.А. Химический состав рода Saussurea DC., произрастающих на территории Сибири // Химия растительного сырья. 2014. № 3. С. 43. https://doi.org/10.14258/jcprm.1403043
Головацкая И.Ф., Володина Н.А. Регуляция роста и вторичного метаболизма клеточной культуры Saussurea orgaadayi 28-гомобрассинолидом и селеном // Известия Самарского научного центра РАН. 2013. Т. 15. № 3 (5). С. 1591. http://www.ssc.smr.ru/media/journals/izvestia/2013/ 2013_3_1591_1595.pdf
Djanaguiraman M., Devi D.D., Shanker A.K., Sheeba J.A., Bangarusamy U. Selenium – an antioxidative protectant in soybean during senescence // J. Plant Soil. 2005. V. 272. P. 77. https://doi.org/10.1016/S2095-3119(15)61201-1
Головацкая И.Ф., Кулагина Ю.М., Павлова Д.Г., Карначук Р.А. Влияние селена на морфогенез и биохимические параметры растений Triticum aestivum L. в зависимости от селективного света // Агро-химия. 2013. № 5. С. 58.
Головацкая И.Ф., Бойко Е.В., Видершпан А.Н., Лаптев Н.И. Возрастные морфофизиологические и биохимические изменения у растений Lactuca sativa L. под влиянием селена и света разной интенсивности // Сельскохозяйственная биология. 2018. Т. 53. № 5. С. 1025. https://doi.org/10.15389/agrobiology.2018.5.1025rus
Карначук Р.А., Лихачева А.В. Питательная среда для культивирования клеточной культуры Saussurea orgaadayi V. Khan. Et Krasnov. / Пат. 2428472 РФ; ГОУ ВПО ТГУ – № 2010118803; заявл. 05.11.2010; опубл. 09.10. 2011, Бюл. 25 – 6 с.
Цельникер Ю.Л. Физиологические основы теневыносливости древесных растений. М.: Наука, 1978. 212 с.
Якубова М.Р., Генкина Г.Л., Шакиров Т.Т., Абубакиров Н.К. Хроматоспектрофотометрический метод определения экдистерона в растительном сырье // Химия природных соединений. 1978. № 6. С. 737.
Zhang N., Sun Q.Q., Li H.F., Li X.S., Cao Y.Y., Zhang H.J., Li S.T., Zhang L., Qi Y., Ren S.X., Zhao B., Guo Y.D. Melatonin improved anthocyanin accumulation by regulating gene expressions and resulted in high reactive oxygen species scavenging capacity in cabbage // Front. Plant Sci. 2016. V. 7. Art. 222. https://doi.org/10.3389/fpls.2016.00197
Zhao Y., Qi L.W., Wang W.M., Saxena P.K., Liu C.Z. Melatonin improves the survival of cryopreserved callus of Rhodiola crenulata // J. Pineal Res. 2011. V. 50 (1). P. 83. https://doi.org/10.1111/j.1600-079X.2010.00817.x
Gupta P., Sharma S., Saxena S. Biomass yield and steviol glycoside production in callus and suspension culture of Stevia rebaudiana treated with proline and polyethylene glycol // Appl. Biochem. Biotechnol. 2015. V. 176 (3). P. 863. https://doi.org/10.1007/s12010-015-1616-0
Сошинкова Т.Н., Радюкина Н.Л., Королькова Д.В., Носов А.В. Пролин и функционирование антиоксидантной системы растений и культивируемых клеток Thellungiella salsuginea при окислительном стрессе // Физиология растений. 2013. Т. 60. С. 47. https://doi.org/10.7868/S0015330313010090
Salehi B., Sharopov F., Fokou P.V.T., Kobylinska A., de Jonge L., Tadio K., Sharifi-Rad J., Posmyk M.M., Martorell M., Martins N., Iriti M. Melatonin in medicinal and food plants: occurrence, bioavailability, and health potential for humans // Cells. 2019. V. 8 (7). P. 681. https://doi.org/10.3390/cells8070681
Sharma S., Kaur N., Kaur S., Nayyar H. Ascorbic acid reduces the phytotoxic effects of selenium on rice (Oryza sativa L.) by up-regulation of antioxidative and metal-tolerance mechanisms // J. Plant Physiol. Pathol. 2014. V. 2. P. 3. https://doi.org/10.4172/2329-955X.1000128
Wang G., Zhang J., Wang G., Fan X., Sun X., Qin H., Xu N., Zhong M., Qiao Z., Tang Y., Song R. Proline responding1 plays a critical role in regulating general protein synthesis and the cell cycle in maize // The Plant Cell. 2014. V. 26 (6). P. 2582. https://doi.org/10.1105/tpc.114.125559
Khan T., Ullah M.A., Garros L., Hano C., Abbasi B.H. Synergistic effects of melatonin and distinct spectral lights for enhanced production of anti-cancerous compounds in callus cultures of Fagonia indica // J. Photochem. Photobiol. B: Biology. 2019. V. 190. P. 163. https://doi.org/10.1016/j.jphotobiol.2018.10.010
Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants // Plant Physiol. Biochem. 2010. V. 48 (12). P. 909. https://doi.org/10.1016/j.plaphy.2010.08.016
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Носов А.М. Чувствительность антиоксидантного статуса растительных клеток к действию фуростаноловых гликозидов // Физиология растений. 2016. Т. 63. С. 804. https://doi.org/10.7868/S0015330316060154
Wan J., Zhang P., Wang R., Sun L., Ju Q., Xu J. Comparative physiological responses and transcriptome analysis reveal the roles of melatonin and serotonin in regulating growth and metabolism in Arabidopsis // BMC Plant Biology. 2018. V. 18. P. 362. https://doi.org/10.1186/s12870-018-1548-2
Fazal H., Abbasi B.H., Ahmad N., Ali M. Exogenous melatonin trigger biomass accumulation and production of stress enzymes during callogenesis in medicinally important Prunella vulgaris L. (Selfheal) // Physiol. Mol. Biol. Plants. 2018. V. 24 (6). P. 1307. https://doi.org/10.1007/s12298-018-0567-7
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


