Физиология растений, 2020, T. 67, № 6, стр. 616-624
Взаиморегуляция сигнальных путей цитокинина и ауксина в контроле естественного старения листьев Arabidopsis thaliana
М. Н. Данилова a, *, А. С. Дорошенко a, Н. В. Кудрякова a, А. В. Клепикова b, c, В. Ю. Штратникова d, В. В. Кузнецов a
a Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Сколковский институт науки и технологии
Москва, Россия
c Институт проблем передачи информации Российской академии наук
Москва, Россия
d Научно-исследовательский институт им. А. Н. Белозерского, Московский государственный университет
им. М. В. Ломоносова
Москва, Россия
* E-mail: mariadanilova86@yandex.ru
Поступила в редакцию 10.04.2020
После доработки 10.04.2020
Принята к публикации 10.04.2020
Аннотация
Естественное старение листьев – закономерный физиологический процесс, который подчиняется определенной генетической программе и контролируется различными фитогормонами. Цитокинины (ЦК) играют важнейшую роль в контроле старения листьев, являясь негативными регуляторами данного процесса. Ранее мы сообщали о пролонгированном вегетативном росте и развитии двойного нокаут-мутанта Arabidopsis thaliana по генам рецепторов ЦК ahk2ahk3. Согласно данным проведенного нами транскриптомного анализа и ОТ ПЦР РВ избранных генов, задержка старения листьев у мутанта ahk2ahk3 сопровождалась повышением экспрессии группы генов семейства SAUR (small auxin-up RNA), кодирующих белки ответа на ауксины (от 4 до 281 раза), а также гена SSPP (senescence-suppressed protein phosphatase) с активацией экспрессии в 137 раз по сравнению с контрольным транскриптомом дикого типа. Таким образом, вполне возможно, что при значительном подавлении сигналинга ЦК регуляция старения листьев Arabidopsis осуществляется за счет компенсаторного механизма, связанного с изменением экспрессии генов семейства SAUR, а также определенного пула генов транспорта и сигналинга ауксинов.
ВВЕДЕНИЕ
Старение представляет собой разновидность возрастной программируемой клеточной смерти, которая происходит на клеточном, тканевом, органном и организменном уровнях и приводит к отмиранию растения [1]. Несмотря на деструктивную направленность, старение – динамичный и генетически строго регулируемый физиологический процесс [2]. Его особой формой является старение листьев, в ходе которого происходит мобилизация и рециркуляция питательных веществ в развивающиеся семена или в другие части растений [2]. Важная роль в контроле старения листьев отводится фитогормонам, которые могут ингибировать этот процесс (цитокинины и частично ауксины) или выступают его позитивными регуляторами (салициловая, абсцизовая, жасмоновая кислоты и этилен).
Существование механизмов взаимной регуляции цитокининов (ЦК) и ауксинов не вызывает сомнений. Множественные связи между системами синтеза, рецепции и транспорта этих двух растительных гормонов предоставляют широкий спектр возможностей для их взаимного усиления или сдерживания [3]. Известно, например, что синергизм ЦК и ауксина в контроле деления клеток может трансформироваться в антагонизм при регуляции дифференцировки клеток и тканей [4], однако взаимодействие двух гормонов в контроле старения изучено недостаточно.
Система восприятия сигнала ауксина включает семейство транскрипционных репрессоров Aux/ IAA, два транскрипционные фактора ARF и TIR1/ AFB1-AFB5 F-box компоненты комплекса SCF. В присутствие ауксина белки Aux/IAA формируют комплекс с TIR1/AFB1-AFB5, при этом IAA действует как молекулярный “клей”, удерживающий вместе компоненты этого ко-рецепторного комплекса. Формирование комплекса вызывает убиквитинирование белков репрессоров транскрипции Aux/IAA и их последующую деградацию 26S протеосомами с высвобождением ARF. Активированные ARF модулируют экспрессию многочисленных ауксин-зависимых генов. При этом большое число генов ко-рецепторов и транскрипционных факторов (IAA – 23, ARF – 23 и TIR – 5) обеспечивают широкое разнообразие возможных ответов на действие гормона [5].
Цитокинин реализует свое действие в растительной клетке и регулирует экспрессию ядерных генов по принципу транскрипционных каскадов при помощи двухкомпонентной сигнальной системы [6]. У растения Arabidopsis thaliana открыты три рецепторных сенсорных гистидинкиназы, кодируемые генами CRE1/WOL/AHK4, AHK3 и AHK2, функции которых значительно перекрываются [7, 8]. Вместе с тем в контроле некоторых цитокинин-зависимых ответов выявлены AHK-специфичные реакции, которые, вероятно, говорят о способности индивидуальных рецепторов определять экспрессию набора генов, вовлеченных в конкретные цитокинин-зависимые процессы. У A. thaliana доминирующим рецептором цитокининов в листьях является AHK3, тогда как рецепторный белок AHK2 выполняет вспомогательную функцию [9, 10]. Цитокинин-опосредованный контроль продолжительности жизни листьев осуществляется рецептором AHK3 через фосфорилирование транскрипционного фактора ARR2 [11].
Ранее мы сообщали о пролонгированном онтогенезе двойного мутанта A. thaliana ahk2ahk3, листья которого характеризовались замедленным распадом хлорофилла и поддержанием повышенного уровня фотосинтетической функции [12]. На первый взгляд эти данные противоречат традиционным представлениям об омолаживающем действии цитокининов, тем более что одинарные мутанты ahk3 с инактивированным геном AHK3 отличались ускоренным старением. Для объяснения этого кажущегося противоречия и выявления молекулярных механизмов задержки естественного старения цитокининами нами был проведен сравнительный анализ транскриптомов, выделенных из стареющих листьев растений с инактивированными генами рецепторов ЦК.
Цель работы – выяснение возможных генных мишеней, изменение экспрессии которых лежит в основе пролонгированного онтогенеза мутантного растения A. thaliana ahk2ahk3.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования были растения Arabidopsis thaliana Heynh. (L.), экотип Columbia-0, и полученные на его основе двойные нокаут-мутанты ahk2-2ahk3-3 (далее в тексте ahk2ahk3) и ahk2cre1-12 (далее ahk2ahk4), а также одинарный мутант ahk2-2 (далее ahk2), впервые описанные в работе Higuchi с соавт. [8]. Растения выращивали в почве при температуре 22°С, 16-часовом фотопериоде и освещенности 100 мкмоль/(м2 с). Для экспериментов использовали шестой лист 7-недельных растений. Экстракцию и определение суммарного хлорофилла проводили по методу Лихтенталлера [13].
Библиотеки мРНК для RNA-seq анализа получали на основе тотальной РНК, выделенной из листьев с помощью реагента Trizol (“Invitrogen”, США). Перед подготовкой библиотек качество РНК проверяли с помощью капиллярного электрофореза на приборе Bioanalyzer2100 (“Agilent”, США). Для подготовки библиотек использовали РНК с показателем целостности RIN не менее 7. Библиотеки готовили набором NEBNext Ultra II RNA Library Prep, с использованием NEBNext Poly(A) mRNA Magnetic Isolation Module (“New England Biolabs”, США) согласно инструкциям производителя. Количественные измерения РНК и ДНК проводили на флуориметре Qubit 1.0 (“Thermo Fisher Scientific”, США). Секвенирование проводили с использованием платформы Illumina HiSeq4000 (“Illumina Inc.”, США) с получением не менее 25 миллионов одноконцевых чтений длиной 50 нуклеотидов. Дальнейшая обработка чтений проводилась с помощью программы CLC Genomics Workbench 7.0.3 (“Qiagen”, Нидерланды). Полученные чтения были отфильтрованы по качеству с удержанием только тех позиций, которые имели качество больше 20, и чтений с длиной более 25 и картированы на референсный геном A. thaliana (TAIR10) cо следующими установками: доля выравненного участка – 100%, порог по уровню сходства – 94%, штраф за несовпадение – 2, штраф за индель – 3, допускаются только уникальные картирования. В результате было получено в среднем 22.5 миллионов высококачественных уникально картированных чтений для каждого образца. Для учета влияния размера библиотеки на уровень экспрессии гена суммарное число чтений, картированных на ген, было нормализовано с помощью метода медианы [https://genomebiology. biomedcentral.com/articles/10.1186/s13059-014-0550-8]. Анализ дифференциальной экспрессии проводился с помощью пакета “DESeq2” статистической среды R [https://genomebiology.biomedcentral.com/ articles/10.1186/s13059-014-0550-8]. В качестве порога статистической значимости использовалось p-значение с поправкой на множественное тестирование FDR меньше 0.05 и уровень изменения экспрессии (fold сhange) более 2.
Для последующего подтверждения данных RNA-seq анализа относительный уровень транскриптов оценивали методом полимеразной цепной реакции в режиме реального времени после обратной транскрипции (ОТ ПЦР РВ) на приборе LigthCyclerR96 (“Roche”, Швейцария) согласно протоколу, описанному ранее [12]. Специфичные пары праймеров к исследуемым генам подбирали с помощью программы Vector NTI11 (табл. 1). В качестве референсного гена использовали ген UBQ10.
Таблица 1.
Нуклеотидные последовательности праймеров, использованных в работе
| Название гена | Локус | Прямой, 5′ → 3′ | Обратный, 5′ → 3′ |
|---|---|---|---|
| SAG12 | At5g45890 | GCGGTTGCGGCTATTGAAG | CGCAGTATCCATTAAACCGC |
| CAB2 | AT1G29920 | TCAAGTTTGGAGAGGCAGTT | GTAACCTTCAACGGCTCCCAT |
| SSPP | At5g02760 | CTGTTGGAGAATAGGTGCCG | AAACTCTCCAAAGGTGTGAA |
| UBQ10 | AT4G05320 | GCGTCTTCGTGGTGGTTTCTAA | GAAAGAGATAACAGGAACGGAAAC |
Статистический анализ. Все эксперименты проводили в трех биологических повторностях. На рисунках приведены средние значения и стандартные ошибки средних. Достоверность различий между опытными и контрольными образцами оценивали с помощью критерия Стьюдента. Данные RNA-seq представлены в виде средних значений двух биологических повторностей.
РЕЗУЛЬТАТЫ
В качестве материла для исследования был выбран закончивший рост шестой лист 7-недельных растений, который у растений дикого типа характеризовался в этом возрасте развитием пожелтения края листовой пластинки. Этот симптом, являющийся выраженным проявлением старения листа, сопровождался существенным снижением содержания хлорофилла по сравнению с мутантными растениями. При этом повышенное содержание суммарного хлорофилла (a + b) в листьях мутантов ahk2 (на 31%), ahk2ahk3 (на 24%) и ahk2ahk4 (на 13%) (рис. 1) примерно соответствовало увеличенным значениям максимального квантового выхода ФСII Fv/Fm [12].
Рис. 1.
Содержание суммарного хлорофилла в шестом листе 7-недельных растений дикого типа и ahk мутантов A. thaliana. Содержание суммарного хлорофилла в листьях дикого типа были приняты за 100%. Данные представлены в виде средних значений трех биологических повторностей и ошибки среднего. Достоверность различий оценивалась по критерию Стьюдента. * P ≤ 0.05.

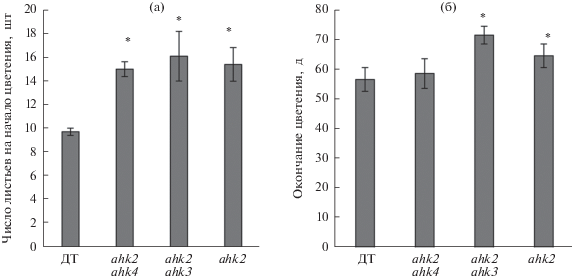
Известно, что естественное старение листьев Arabidopsis может зависеть от инициации развития репродуктивных тканей и органов. Согласно литературным данным [14] и результатам наших предшествующих исследований [12], время выброса цветоноса нокаут-линий по рецепторам цитокининов могло отличаться от времени появления цветоносов у растений Arabidopsis дикого типа. Действительно, в использованных нами экспериментальных условиях растения с инактивированным рецептором АНК2 обнаружили пролонгированный период вегетации по сравнению с растениями дикого типа, что сопровождалось появлением достоверно большего количества настоящих розеточных листьев к моменту начала цветения (рис. 2а) и удлинением периода цветения (рис. 2б).
Рис. 2.
Физиологические особенности растений дикого типа и ahk мутантов A. thaliana, связанные с цветением. Количество настоящих розеточных листьев на момент начала цветения (а) и дни окончания цветения (б) ahk мутантов Arabidopsis. Данные представлены в виде средних значений трех биологических повторностей и ошибки среднего. Достоверность различий оценивалась по критерию Стьюдента. * P ≤ 0.05.
Измененным физиологическим характеристикам соответствовало кратное снижение уровня транскриптов гена SAG12 (senescence-associated gene 12), молекулярного маркера старения, а также повышенное накопление матриц ядерных генов фотосинтетических белков CAB2 и LHCB2.4 (табл. 2).
Таблица 2.
Гены с наиболее значимым количественным изменением транскриптов в шестом листе 7-недельных растений Arabidopsis thaliana дикого типа и нокаут-мутантов ahk2ahk4, ahk2ahk3 и ahk2 согласно результатам RNA-seq. Жирным шрифтом выделены гены, экспрессия которых подтверждена методом ОТ ПЦР РВ
| Название гена | Локус | FC* | ||
|---|---|---|---|---|
| ahk2ahk4/ДТ | ahk2ahk3/ДТ | ahk2/ДТ | ||
| Активированы | ||||
| SSPP | AT5G02760 | x | 137.9 | 27 |
| SAUR3 | AT4G34790 | x | 281.1 | x |
| SAUR29 | AT3G03820 | x | 238.2 | 196.7 |
| SAUR57 | AT3G53250 | x | 203.4 | x |
| SAUR1 | AT4G34770 | x | 139.6 | x |
| SAUR26 | AT3G03850 | x | 138.5 | x |
| SAUR20 | AT5G18020 | x | 19.6 | x |
| SAUR50 | AT4G34760 | x | 17.4 | x |
| SAUR7 | AT2G21200 | x | 17.1 | x |
| SAUR68 | AT1G29510 | x | 16.7 | x |
| SAUR16 | AT4G38860 | x | 15.6 | x |
| SAUR51 | AT1G75580 | x | 9.3 | 6.6 |
| SAUR15 | AT4G38850 | x | 6.2 | x |
| SAUR6 | AT2G21210 | x | 4.1 | x |
| CAB2 | AT1G29920 | x | 7.7 | 5.4 |
| LHCB2.4 | AT3G27690 | x | 29.6 | 30.3 |
| Репрессированы | ||||
| SAUR36 (SAG201) | AT2G45210 | x | –5.53 | –5.05 |
| SAG12 | AT5G45890 | –4.2 | –137.5 | x |
В общей сложности сравнение транскриптома листьев двойного мутанта ahk2ahk3 и контрольного генотипа (дикий тип) выявило измененную экспрессию 1755 генов, причем 775 были подавлены, а 980 активированы. Оба списка генов ранжировали по количественному изменению транскрипции, при этом значимым результат считали при условии изменения экспрессии генов более чем в два раза.
Прежде всего, мы обратили особое внимание на гены сигналинга и метаболизма ЦК, экспрессия которых по литературным данным [15, 16] изменялась в ходе старения. Среди генов, ассоциированных с синтезом ЦК, более высокий уровень экспрессии у мутанта ahk2ahk3 был выявлен для гена IPT3 (At3g63110), тогда как два других гена этого семейства (At2g36800 и At1g22400) были ингибированы (табл. S1 ). При естественном старении все эти гены экспрессировались слабо [15]. У мутанта ahk2ahk3 были подавлены гены ЦК-оксидаз, связанные со специфичной деградацией ЦК и активируемые при естественном старении, а также гены пуринпермеаз (табл. S1 ), ответственные за транспорт ЦК [17]. Кроме того, был снижен уровень транскриптов генов гликозилтрансфераз At2g36800 и At1g22400 (табл. S1 ), обеспечивающих превращение цитокининов в неактивные гликозилированные формы [18]. Напротив, экспрессия генов регуляторов ответа на ЦК типа А ARR6, 7, 9, которая снижалась при естественном старении, была существенно повышена, как и экспрессия гена быстрого ответа на ЦК At2g18300, кодирующего транскрипционный фактор семейства bHLH (табл. S1 ) [6]. Подобная регуляция ЦК-зависимых генов, контролируемых программами старения, свидетельствует о замедлении возрастных изменений у ahk2ahk3 на молекулярном уровне и о непосредственном участии системы рецепции гормонального сигнала в этом процессе.
Пул ЦК-зависимых генов составлял лишь часть генов со специфичными изменениями экспрессии в транскрипционном профиле мутанта. В верхней части ранжированного списка транскриптов генов с активированной экспрессией у мутанта ahk2ahk3 наше внимание привлек ген SSPP (senescence-suppressed protein phosphatase), уровень экспрессии которого был повышен в 137 раз (табл. 2). Этот ген кодирует серин-треониновую протеинфосфатазу типа 2С, которая негативно регулирует естественное старение листьев у Arabidopsis [19]. RNA-seq анализ также показал, что аналогичный ген в транскриптоме листьев одинарного нокаут-мутанта ahk2 экспрессировался в 27 раз выше по сравнению с диким типом, тогда как у мутанта ahk2ahk4 отличий от дикого типа выявлено не было (табл. 2). Согласно данным сайта http://bar.utoronto.ca/interactions2/, SSPP взаимодействует с белками различной локализации. Интересно, что у мутанта ahk2/3 более чем вдвое была повышена экспрессия гена фосфоглюкомутазы ATPGMP, кодирующего пластидную изоформу фосфоглюкомутазы, которая связана с образованием амилопластов и оттоком углерода. Анализ транскриптома листьев мутанта ahk2ahk3 обнаружил среди генов с активированной экспрессией также 13 генов семейства SAUR (SMALL AUXIN UP RNAs). У Arabidopsis семейство генов SAUR насчитывает в общей сложности 81 представителя, которые кодируют близкородственные РНК и белки, вовлеченные в быстрый ответ на ауксины [20]. Регуляторная роль этих белков может различаться в зависимости от физиологического состояния, типа ткани, а также воздействия различных фитогормонов [21]. У мутанта ahk2ahk3 активация экспрессии 13 выделенных генов SAUR варьировала от 4 до 281 раза (табл. 2), при этом только один ген из семейства – SAUR36 – обнаружил снижение уровня транскриптов. Интересно, что у мутанта ahk2 был повышен уровень экспрессии только двух генов семейства, SAUR29 и SAUR51, а у двойного мутанта ahk2ahk4 какие-либо изменения в экспрессии генов SAUR отсутствовали (табл. 2). Таким образом, анализ транскриптома позволяет предположить, что пролонгированный онтогенез мутантов ahk2 и ahk2ahk3 может быть связан с повышенной экспрессией ряда ауксин-индуцируемых генов семейства SAUR, возможной мишенью которых является SSPP, а также ген с подавленной экспрессией SAUR36.
Чтобы понять молекулярные механизмы, лежащие в основе регуляции генов семейства SAUR, мы проанализировали также профили экспрессии ряда генов сигналинга и метаболизма ауксинов. Известно, что при естественном старении гены метаболизма ауксина преимущественно активируются, а гены транскрипционных репрессоров Aux/IAA и транспортеров подавляются [15]. У мутанта ahk2ahk3 картина была несколько иной. Гены метаболизма nitrilase 1 (At3g44310) и aldehyde oxidase 1 (At5g20960) оказались ингибированы (табл. S2 ). Помимо них уменьшалось накопление транскриптов трех генов семейства GH3 – At4g37390, At4g27260 и At2g23170, кодирующих фермент IAA-амидосинтазу, который регулируют активность ауксинов (табл. S2 ). Вместе с тем мы выявили повышенную экспрессию генов сигналинга и транспорта ауксина Aux/IAA29 (At4g32280), ARF8 (At5g37020) и PIN7 (At1g23080) (табл. S2 ). Значимые количественные изменения были отмечены также для транскриптов членов семейства B ABC-транспортеров ABCB1/Pgp1 (At3g28860), ABCB2/Pgp2 (At4g25960) и ABCB19/Pgp19 (At2g36910), обеспечивающих полярный транспорт ауксинов как непосредственно, так и при участии PIN белков [22]. Все это позволяет предположить их участие в передаче сигнала ИУК к генам семейства SAUR, которые могут быть непосредственными мишенями этого пути. Однако для выяснения деталей функционирования этого пути необходимы дополнительные исследования.
Для подтверждения полученных с помощью RNA-seq данных мы применили независимый ОТ ПЦР РВ анализ экспрессии ряда генов. Количественный ПЦР подтвердил результаты транскриптомного анализа и выявил значительную активацию генов SSPP и CAB2 в листьях мутантов ahk2 и ahk2ahk3 на фоне снижения экспрессии гена SAG12 (рис. 3). При этом у мутанта ahk2ahk4 на фоне повышенной экспрессии генов фотосинтетических белков активации гена SSPP обнаружено не было (рис. 3).
Рис. 3.
Уровень транскриптов генов SAG12 (а), CAB2 (б) и SSPP (в) в шестом листе 7-недельных растений дикого типа и ahk мутантов A. thaliana. Данные представлены в виде средних значений трех биологических повторностей и ошибки среднего. Достоверность различий оценивалась по критерию Стьюдента. * P ≤ 0.05.

ОБСУЖДЕНИЕ
В последние годы в изучении механизмов восприятия и передачи эндогенных сигналов и выявлении генных модулей, ответственных за инициацию естественного или индуцированного старения листьев, достигнут большой прогресс, который стал возможен благодаря интенсивному развитию методов геномики. Однако, несмотря на значительные успехи и понимание роли рецепторов цитокинина в контроле процесса естественного старения листьев A. thaliana, конкретные молекулярные мишени действия ЦК остаются неизвестными.
В данном исследовании, используя данные секвенирования транскриптомов и их последующую оценку методом ПЦР в режиме реального времени мы показали, что пролонгированный онтогенез у мутанта ahk2ahk3 сопровождался снижением экспрессии SAUR36, позитивного регулятора старения, и резким повышением экспрессии гена SSPP (AT5G02760), негативно регулирующего естественное старение листьев у Arabidopsis, а также 13 генов из семейства SAUR, кодирующих белки ответа на ауксины.
Из литературы известно, что уровень транскриптов гена SSPP значительно снижается как при естественном, так и при индуцированном внешними факторами старении [19]. Особенностью продукта гена SSPP является его способность непосредственно взаимодействовать с цитоплазматическим доменом серин-треониновой рецепторной киназы SARK (receptor-like kinase) и дефосфорилировать его, задерживая тем самым старение листьев [19]. Ранее было показано, что ген SARK (At4g30520), кодирующий рецепторную киназу с лейциновыми повторами (LRR), положительно регулирует старение листьев у Arabidopsis и относится к группе SAG генов [23]. Однако профилирование транскриптомов ahk мутантов не выявило изменений в экспрессии гена SARK.
Известно, что в задержку старения, индуцированного SSPP, вовлечен сигналинг цитокинина, в частности рецептор АНК3 [24]. Такой вывод был сделан на основании фенотипического анализа двойного мутанта ahk3-3/SSPPox, который утрачивал способность к задержке старения листьев при инактивации гена AHK3. Трансгенное растение Arabidopsis 35S:SSPP характеризовалось гиперчувствительностью к экзогенным цитокининам, которая исчезала при дополнении нокаутированным геном AHK3. Тем не менее, согласно результатам ДНК-микрочипирования, доступным на Arabidopsis e-FP Browser (http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi), экспрессия гена SSPP не регулируется цитокинином, но в значительной степени активируется индолилуксусной кислотой.
Механизм регуляции гена SSPP ауксинами подробно изучался в работе Wen с соавт. [25]. Как оказалось, белок SAUR49 способен непосредственно взаимодействовать с SSPP и подавлять его активность, тем самым ускоряя старение листьев Arabidopsis через SARK-зависимый сигнальный путь. При этом оверэкспрессия гена SAUR49 значительно ускоряла как естественное старение, так и старение листьев Arabidopsis, индуцированное темнотой. Согласно результатам двугибридного анализа, помимо SAUR49, с SSPP взаимодействовали еще 4 представителя семейства SAUR белков: SAUR30, 39, 41, 72. Вероятно, эти представители семейства SAUR являются интеграторами положительной регуляции старения листьев Arabidopsis [25]. К их числу относится также ауксин-активируемый SAUR36, экспрессия которого возрастала по мере развития симптомов старения [26].
Следует, однако, заметить, что среди 13 генов SAUR, активированных у мутанта ahk2ahk3, отсутствовали гены, продукты которых взаимодействовали бы с SSPP. Более того, избирательная активация генов SAUR сопровождалась усилением экспрессии гена SSPP (табл. 2) и пролонгированным онтогенезом мутантов ahk2 и ahk2/3. При этом почти все выделенные нами гены SAUR относились к числу активируемых ИУК, тогда как гены белков, взаимодействовавших с SSPP, могли не отвечать на ауксины (SAUR30, 39, 49) или даже ингибировались ими (SAUR72) [27]. Таким образом, различные представители семейства SAUR действовали как антагонисты, что характерно также и для членов семейств ARF и ARR [27]. Интересно, что помимо реакции на ауксины почти все гены SAUR, обнаружившие повышенную экспрессию у мутанта ahk2ahk3, активировались гиббереллинами и частично брассиностероидами, то есть гормонами, стимулирующими рост [27]. Это отличало их от генов SAUR – положительных регуляторов старения. Более того, представители последней группы активировались АБК в отличие от выделенных нами SAUR генов, замедлявших старение, которые ингибировались этим гормоном или не отвечали на его воздействие. Все это позволяет заключить, что система SAUR-зависимой регуляции старения является композитной, причем различные представители семейства способны обеспечить положительную или негативную регуляцию старения листьев в зависимости от генетической среды и внешних стимулов.
Как отмечалось выше, цитокинин-зависимый контроль продолжительности жизни листьев осуществляется рецептором AHK3 через фосфорилирование транскрипционного фактора ARR2. Инактивация гена AHK3 ускоряет старение листьев, тогда как gain-of-function мутации ore12-1 и rock3, обеспечивающие усиление функции этого гена, приводят к замедлению старения [11, 28]. Одновременная инактивация двух рецепторов ЦК у мутанта ahk2ahk3 оказывает плейотропный эффект на физиологическое состояние растения, включая появление полукарликового фенотипа, повышенное содержание эндогенных цитокининов зеатинового ряда, задержку цветения, и пролонгированный онтогенез [7, 12]. Мы предполагаем, что задержка старения листьев и пролонгированный онтогенез мутанта ahk2ahk3, а также одинарного мутанта ahk2 обусловлены измененной экспрессией набора ауксин-чувствительных генов, негативно регулирующих старение листьев. Помимо выявленных нами SAUR генов, в состав этого модуля, возможно, входят гены транспорта и сигналинга ауксина PIN7 (At1g23080), Aux/IAA29 (At4g32280) и ARF8 (At5g37020), однако для доказательства их прямого участия необходимы дополнительные тесты.
Полученные результаты наводят на мысль, что при частичном подавлении сигналинга ЦК основная роль в контроле естественного старения растения и его листьев переходит к ауксиновому сигналингу, одной из мишеней которого является ген SSPP. Таким образом, мы приходим к парадоксальным результатам, когда при подавлении сигналинга ЦК наблюдается замедление старения. Как известно, любая биологическая функция реализуется несколькими независимыми механизмами [29] и именно с таким параллелизмом, повышающим вероятность выполнения функции (и весьма эффективно), мы сталкиваемся при анализе особенностей старения мутанта ahk2ahk3. Появление подобных компенсаторных механизмов заставляет с известной сдержанностью относиться к результатам, полученным методами обратной генетики, так как в основе видимых эффектов может лежать не прямое нарушение функции исследуемого гена, а возникновение альтернативных путей ее реализации. О возможном включении компенсаторных механизмов при деэтиоляции тройного мутанта по регуляторам ответа на ЦК arr1arr10arr12 сообщали Cortleven с соавт. [30]. Увеличенный синтез хлорофилла у мутанта с инактивированным сигналингом ЦК авторы связывали с экспрессией транскрипционных факторов, принадлежащих к альтернативным системам регуляции формирования хлоропластов, напрямую не связанных с ЦК.
В пользу множественности путей реализации программ старения свидетельствует и транскриптомный профиль нокаут-мутанта ahk2ahk4 с пролонгированным периодом вегетации. Замедление скорости старения листьев этого мутанта не было связано с изменением экспрессии модуля SSPP-SAUR и, очевидно, определялось активацией АНК3-зависимых мишеней.
Таким образом, анализ транскриптома мутанта ahk2ahk3 позволяет заключить, что в основе задержки естественного старения листьев растений могут лежать антагонистические взаимоотношения цитокинина и ауксина. При этом инактивация индивидуальных рецепторов цитокинина (прежде всего, АНК2 и АНК3) способствует перепрограммированию экспрессии генома и включению компенсаторных механизмов, связанных с активацией ауксин-зависимых генов.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 18-74-00135. Секвенирование и биоинформатический анализ данных секвенирования проводились в ЦКП геномики Сколковского института науки и технологии.
Авторы выражают благодарность руководителю ЦКП геномики Сколковского института науки и технологии к.б.н. Логачевой М.Д. за оказанную помощь при проведении данного исследования.
Авторы заявляют, что у них нет конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Nooden L.D. Senescence and aging in plants. Academic Press, 1998. 564 p.
Buchanan-Wollaston V., Earl S., Harrison E., Mathas E., Navabpour S., Page T., Pink D. The molecular analysis of leaf senescence – a genomics approach // Plant Biotechnol. J. 2003. V. 1. P. 3.
El-Showk S., Ruonala R., Helariutta Y. Crossing paths: cytokinin signalling and crosstalk // Development. 2013. V. 140. P. 1373. https://doi.org/10.1242/dev.086371
Miller C.O., Skoog F., von Saltza N.M., Strong F.M. Kinetin, a cell division factor from deoxyribonucleic acid // J. Am. Chem. Soc. 1955. V. 77. P. 1329.
Schaller G.E., Bishopp A., Kieber J.J. The yin-yang of hormones: cytokinin and auxin interactions in plant development // Plant Cell. 2015. V. 27. P. 44. https://doi.org/10.1105/tpc.114.133595
Brenner W.G., Romanov G.A., Köllmer I., Bürkle L., Schmülling T. Immediate-early and delayed cytokinin response genes of Arabidopsis thaliana identified by genome-wide expression profiling reveal novel cytokinin-sensitive processes and suggest cytokinin action through transcriptional cascades // Plant J. 2005. V. 44. P. 314.
Riefler M., Novak O., Strnad M., Schmülling T. Arabidopsis cytokinin receptor mutants reveal functions in shoot growth, leaf senescence, seed size, germination, root development and cytokinin metabolism // Plant Cell. 2006. V. 18. P. 40.
Higuchi M., Pischke M.S., Mahonen A.P., Miyawaki K., Hashimoto Y., Seki M., Kobayashi M., Shinozaki K., Kato T., Tabata S., Helariutta Y., Sussman M.R., Kakimoto T. In planta functions of the Arabidopsis cytokinin receptor family // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 8821.
Романов Г.А. Как цитокинины действуют на клетку // Физиология растений. 2009. Т. 56. С. 295.
Kieber J.J., Schaller G.E. Cytokinin signaling in plant development // Development. 2018. V. 145: dev149344. https://doi.org/10.1242/dev.149344
Kim H.J., Ryu H., Hong S.H., Woo H.R., Lim P.O., Lee I.C., Sheen J., Nam H.G., Hwang I. Cytokinin-mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 814.
Danilova M.N., Kudryakova N.V., Doroshenko A.S., Zabrodin D.A., Rakhmankulova Z.F., Oelmüller R., Kusnetsov V.V. Opposite roles of the Arabidopsis cytokinin receptors AHK2 and AHK3 in the expression of plastid genes and genes for the plastid transcriptional machinery during senescence // Plant Mol. Biol. 2017. V. 93. P. 533. https://doi.org/10.1007/s11103-016-0580-6
Lichtenthaler H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes // Meth. Enzymol. 1987. V. 148. P. 350.
Igarashi D., Izumi Y., Dokiya Y., Totsuka K., Fukusaki E., Ohsumi C. Reproductive organs regulate leaf nitrogen metabolism mediated by cytokinin signal // Planta. 2009. V. 229. P. 633. https://doi.org/10.1007/s00425-008-0858-2
van der Graaff E., Schwacke R., Schneider A., Desimone M., Flügge U.I., Kunze R. Transcription analysis of Arabidopsis membrane transporters and hormone pathways during developmental and induced leaf senescence // Plant Physiol. 2006. V. 141. P. 776.
Buchanan-Wollaston V., Page T., Harrison E., Breeze E., Lim P.O., Nam H.G., Lin J.F., Wu S.H., Swidzinski J., Ishizaki K., Leaver C.J. Comparative transcriptome analysis reveals significant differences in gene expression and signalling pathways between developmental and dark/starvation-induced senescence in Arabidopsis // Plant J. 2005. V. 42. P. 567.
Bürkle L., Cedzich A., Döpke C., Stransky H., Okumoto S., Gillissen B., Kühn C., Frommer W.B. Transport of cytokinins mediated by purine transporters of the PUP family expressed in phloem, hydathodes, and pollen of Arabidopsis // Plant J. 2003. V. 34. P. 13.
Hou B., Lim E.K., Higgins G.S., Bowles D.J. N-glucosylation of cytokinins by glycosyltransferases of Arabidopsis thaliana // J Biol Chem. 2004 V. 46 P. 47822-32.
Xiao D., Cui Y., Xu F., Xu X., Gao G., Wang Y., Guo Z., Wang D., Wang N.N. SENESCENCE-SUPPRESSED PROTEIN PHOSPHATASE directly interacts with the cytoplasmic domain of SENESCENCE-ASSOCIATED RECEPTOR-LIKE KINASE and negatively regulates leaf senescence in Arabidopsis // Plant Physiol. 2015. V. 169. P. 1275. https://doi.org/10.1104/pp.15.01112
Hagen G., Guilfoyle T. Auxin-responsive gene expression: genes, promoters and regulatory factors // Plant Mol. Biol. 2002 V. 49. P. 373.
van Mourik H., van Dijk A.D.J., Stortenbeker N., Angenent G.C., Bemer M. Divergent regulation of Arabidopsis SAUR genes: a focus on the SAUR10-clade // BMC Plant Biol. 2017. V. 17. P. 245. https://doi.org/10.1186/s12870-017-1210-4
Hellsberg E., Montanari F., Ecker G.F. The ABC of phytohormone translocation // Planta Med. 2015.V. 6. P. 474. https://doi.org/10.1055/s-0035-1545880
Xu F., Meng T., Li P., Yu Y., Cui Y., Wang Y., Gong Q., Wang N.N. A soybean dual-specificity kinase, GmSARK, and its Arabidopsis homolog, AtSARK, regulate leaf senescence through synergistic actions of auxin and ethylene // Plant Physiol. 2011. V. 157. P. 2131.
Wang Y., Zhang X., Cui Y., Li L., Wang D., Mei Y., Wang N.N. AHK3-mediated cytokinin signaling is required for the delayed leaf senescence induced by SSPP // Int. J. Mol. Sci. 2019. V. 20: e2043. https://doi.org/10.3390/ijms20082043
Wen Z., Mei Y., Zhou J., Cui Y., Wang D., Wang N.N. SAUR49 can positively regulate leaf senescence by suppressing SSPP in Arabidopsis // Plant Cell Physiol. 2019. V. 61P. 644. https://doi.org/10.1093/pcp/pcz231
Hou K., Wu W., Gan S.S. SAUR36, a small auxin up RNA gene, is involved in the promotion of leaf senescence in Arabidopsis // Plant Physiol. 2013. V. 161. P. 1002. https://doi.org/10.1104/pp.112.212787
Ren H., Gray W.M. SAUR Proteins as effectors of hormonal and environmental signals in plant growth // Mol. Plant. 2015. V. 8. P. 1153. https://doi.org/10.1016/j.molp.2015.05.003
Bartrina I., Jensen H., Novák O., Strnad M., Werner T., Schmülling T. Gain-of-function mutants of the cytokinin receptors AHK2 and AHK3 regulate plant organ size, flowering time and plant longevity // Plant Physiol. 2017. V. 173. P. 1783. https://doi.org/10.1104/pp.16.01903
Скулачев В.П. Старение организма – особая биологическая функция, а не результат поломки сложной живой системы: биохимическое обоснование гипотезы Вейсмана // Биохимия. 1997. Т. 62. С. 1394.
Cortleven A., Marg I., Yamburenko M.V., Schlicke H., Hill K., Grimm B., Schaller G.E., Schmülling T. Cytokinin regulates the etioplast-chloroplast transition through the two-component signaling system and activation of chloroplast-related genes // Plant Physiol. 2016. V. 172. P. 464. https://doi.org/10.1104/pp.16.00640
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


