Физиология растений, 2021, T. 68, № 1, стр. 53-62
Различия в проявлении плюрипотентности клеток in vivo и in vitro у мутанта Arabidopsis thaliana с фенотипом нарушения клеточной памяти
Е. В. Куприянова a, *, Е. Р. Денисова a, М. А. Байер a, Т. А. Ежова a
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет им. М.В. Ломоносова”
Москва, Россия
* E-mail: ekupriyanova@gmail.com
Поступила в редакцию 30.04.20
После доработки 16.06.2020
Принята к публикации 17.06.2020
Аннотация
Культивируемые in vitro клетки растений – удобная модель для изучения генетических и физиологических механизмов, необходимых для приобретения клетками состояния плюрипотентности. Благодаря исследованиям на модельном растении Arabidopsis thaliana ранее была установлена ключевая роль генов, поддерживающих плюрипотентность клеток апикальной меристемы побега, в регенерации побегов de novo в культуре ткани. В соответствии с этим, клетки мутантных растений с более высоким уровнем экспрессии генов плюрипотентности характеризовались повышенным потенциалом регенерации побегов de novo. Мутант tae оказался исключением из этого правила. На поздних стадиях развития листа у мутанта возобновлялись экспрессия генов плюрипотентности и пролиферация клеток, что указывает на нарушение механизмов поддержания эпигенетической клеточной памяти. В то же время культивируемые клетки листа in vitro демонстрировали более низкую пролиферативную активность по сравнению с диким типом и не были способны к регенерации побегов de novo. Снижение регенерационного потенциала культивируемых клеток мутанта tae указывает на важную роль эпигенетической памяти в ответе клеток на экзогенные гормоны. Нарушение эпигенетической памяти клеток листа мутанта tae и различия в их пролиферативной и регенерационной способности в условиях in planta и in vitro делают этот мутант уникальной моделью для изучения роли эпигенетических модификаций в регуляции плюрипотентности клеток.
ВВЕДЕНИЕ
Растения характеризуются высокой пластичностью развития, способностью к перепрограммированию клеток и приобретению ими свойства плюрипотентности. Эти особенности позволяют растениям образовывать новые меристемы в ходе морфогенеза, а при повреждениях – формировать каллусы на месте поранения, обеспечивая непрерывность развития. В связи с этим изучение генетической и физиологической регуляции плюрипотентности растительных клеток – актуальное в последнее десятилетие направление биологии развития растений. Удобной моделью для изучения степени детерминированности соматических клеток и тканей из разных органов, выявления ключевых факторов, необходимых для каллусогенеза и регенерации побегов, являются культивируемые клетки растений. В условиях in vitro клетки эксплантов способны к дедифференцировке и приобретению плюрипотентного состояния, которое может приводить к образованию побеговых и корневых меристем и соматических эмбриоидов, что отражает основные стратегии регенерации растений in vivo [1].
Ключевые факторы каллусогенеза и регенерации – содержание фитогормонов (экзогенных в питательной среде и эндогенных в клетках экспланта), а также генетически обусловленный уровень чувствительности клеток к фитогормонам. Не менее важным фактором для инициации каллусогенеза in vitro и in vivo являются стрессовые воздействия – поранения, активные формы кислорода, биотические и абиотические стрессовые воздействия. Поранения приводят к нарушениям межклеточных взаимодействий, которые играют ключевую роль в определении клеточной идентичности у растений, и также вызывают изменения гормонального гомеостаза, влияя на синтез гормонов и гормональные сигнальные пути [2–4].
Установлена роль активных форм кислорода и генов, контролирующих их метаболизм, в регуляции процессов регенерации [5, 6]. Выявлены общие генетические компоненты и активное взаимодействие генных сетей, вовлеченные в ответ на поранения, окислительный стресс и воздействие экзогенных гормонов, что объясняет сходные конечные эффекты их воздействия [7, 8]. Главным итогом воздействия гормонов, поранений и окислительного стресса является дедифференцировка клеток, которая обусловлена активацией нескольких групп генов, поддерживающих недетерминированность клеток меристем [4, 5].
К основным генам, поддерживающим недетерминированное состояние клеток апикальной меристемы побега (генам плюрипотентности, или стволовости), относятся ген WUS и гены KNOX-семейства класса I – KN1/BP, KN2, KN6, STM [9, 10]. Установлено, что цитокинины активируют экспрессию гена WUS и KNOX-генов, продукты которых, в свою очередь, активируют экспрессию генов синтеза цитокинина [11–13]. Экспрессия гена WUS также приводит к подавлению транскрипции негативных регуляторов цитокининового сигнального пути [14] и снижению уровня ауксинового сигнала в центральной зоне апикальной меристемы побега, предохраняя клетки от дифференцировки [15]. На экспрессию гена WUS влияет содержание активных форм кислорода: перекись водорода снижает, а супероксид-анион повышает уровень экспрессии WUS [5], хотя механизмы этого влияния пока не исследованы.
Способность фитогормонов активировать экспрессию генов плюрипотентности и механизмы обратной регуляции генов синтеза гормонов и генов сигнальных гормональных путей являются неотъемлемой частью поддержания меристем при развитии растений. Активация генов плюрипотентности при стрессовых воздействиях (в первую очередь, при поранениях) – основа механизмов репарации повреждений у растений. Влияние фитогормонов и стрессовых воздействий на экспрессию генов плюрипотентности объясняет и способность экзогенных гормонов в культуре in vitro индуцировать перепрограммирование клеток эксплантов и вызывать органогенез de novo. При нарушении функции генов плюрипотентности (например, при мутациях stm, wus) способность к регенерации побегов in vitro снижается или полностью отсутствует [16, 17]. И наоборот, при оверэкспрессии генов плюрипотентности наблюдается усиление регенерационной способности in vitro [18].
Оверэкспрессия генов плюрипотентности (у трансгенных растений или у растений с мутациями в негативных регуляторах экспрессии генов плюрипотентности) вызывает также нарушения морфогенеза листа. Клетки листа таких растений сохраняют плюрипотентность, что приводит к развитию на листьях эктопических выростов и почек. Например, выросты образуются у одиночных мутантов as1 [19, 20], as2 [21, 22] и двойных мутантов bop1 bop2. Во всех случаях в листьях мутантов наблюдалась эктопическая экспрессия генов плюрипотентности [19–21]. У растений Arabidopsis thaliana дикого типа, также как и у других видов растений с простым листом, гены плюрипотентности прекращают экспрессию в клетках листа на ранних стадиях его формирования. Это замолкание поддерживается эпигенетическими механизмами на всех последующих стадиях развития листа, что необходимо для развития простого нерассеченного листа [23].
Ранее нами описан мутант, у которого наблюдали эктопические деления клеток листа [24], развитие вторичного края листа и формирование почек на верхней стороне листа [25]. Эти процессы наблюдались только на поздних стадиях развития листа, что указывает на репрограммирование генома и приобретение плюрипотентности клетками листа.
Цель работы – изучение экспрессии генов плюрипотентности и эпигенетических регуляторов в листьях мутанта и дикого типа Arabidopsis thaliana разного возраста и оценка способности к каллусогенезу и регенерации листовых эксплантов in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали линию мутанта Arabidopsis thaliana tae из коллекции кафедры генетики МГУ, прошедшую семь возвратных скрещиваний на родительскую расу Blanes-M (дикий тип, ДТ). Растения выращивали в условиях длинного дня в ростовой комнате при трех температурных режимах: 26–28°C, 22–24°C, 18–20°C. Для визуализации делений клеток листа использовали ранее полученную линию мутанта, содержащую трансген CycB1;1:GUS в гомозиготном состоянии. Об активации промотора гена циклина CycB1;1 в трансгенной конструкции CycB1;1:GUS судили по экспрессии репортерного гена uidA β-глюкуронидазы (GUS), как указано ранее [24]. Число выростов и почек учитывали на развитых листьях растений, перешедших к цветению.
Для каллусогенеза использовали среду, содержащую соли МС-среды, витамины Гамборга (В5), 2% сахарозы, 0.8% агара, а также гормоны – 0.2 мг/л БАП и 1 мг/л НУК. Для индукции регенерации побегов 4-недельные каллусы пересаживали на среду того же состава, но с иным содержанием гормонов – 1 мг/л БАП, 0.05 мг/л НУК. Каллусные культуры и исходные растения (источники эксплантов) выращивали либо при 22–24°C, либо при 18–20°C. Экспланты получали из листьев растений на начальных этапах роста цветоносов. Эксперименты проводили в двух повторностях. Высаживали по 44–50 эксплантов каждого генотипа. Эффективность каллусогенеза оценивали как отношение число каллусов/число эксплантов после 4 недель культивирования в %.
РНК выделяли из листьев растений разного возраста, выращенных при температуре 22–24°C. РНК из каллусов выделяли после трех недель культивирования при температуре 22–24°C на среде каллусогенеза и на среде регенерации. В последнем случае для выделения РНК выбирали каллусы без почек. РНК для анализа экспрессии выделяли с помощью RNeasy Plant Mini Kit (“Qiagen”, США) по методике производителя и обрабатывали ДНазой (“Qiagen”, США). Первую цепь кДНК синтезировали с помощью обратной транскриптазы MMLV (“Силекс”, Россия).
ПЦР в реальном времени (ПЦР-РВ) проводили на амплификаторе Agilent AriaMx (“Agilent Technologies”, США) с набором реагентов для проведения ПЦР-РВ в присутствии красителя SYBR Green (“Синтол”, Россия). Синтез праймеров осуществляли в ЗАО Евроген (Россия), список и последовательности праймеров представлены в приложении (Supplementary, Table 1). Для амплификации была использована следующая программа: 1 цикл 3 мин при 95°С; 40 циклов 15 с при 95°C, 1 мин при 62°C. Анализ относительного содержания транскриптов проводили по методу 2–ΔΔCt. В качестве референсных генов использовали гены At4g33380 и At4g34270.
Таблица 1.
Сравнение каллусогенеза и способности к регенерации побегов в культуре тканей из листьев мутанта tae и ДТ
| Условия | Генотип | Эффективность каллусогенеза, % | Масса каллуса, мг | Каллусов с почками, % | Число почек/каллус |
|---|---|---|---|---|---|
| 18–20°С | ДТ | 100 | 540 ± 45 | 6.8 ± 0.8 | 0.1 ± 0.1 |
| tae | 81.5 ± 7.0 | 225 ± 24 | 0 | 0 | |
| 22–24°С | ДТ | 100 | 600 ± 60 | 42.0 ±5.0 | 0.8 ± 0.1 |
| tae | 86.0 ± 8.1 | 450 ± 45 | 0 | 0 |
РЕЗУЛЬТАТЫ
Экспрессивность фенотипа мутанта tae и время возобновления клеточных делений в листе зависят от температуры
Фенотип растений мутантной линии характеризовался высокой вариабельностью, которая показала зависимость от температуры выращивания. При 26–28°С морфология листьев мутанта была мало отличима от дикого типа: не выявляли ни характерного сужения листовой пластинки, ни эктопических выростов (рис. 1а–в). При 22–24°С отмечены обе характерные особенности, хотя их проявление различалось по времени. Сужение листовой пластинки было заметно уже при развитии первой пары настоящих листьев (рис. 1г, д); изредка были сужены даже семядольные листья. В то же время формирование вторичного края, выростов разной морфологии и особенно почек наблюдали на зрелых листьях растений (рис. 1е), особенно – после выметывания цветоноса. Анатомия зрелых листьев, формирующих выросты [25], а также особенности пролиферативной активности клеток зрелых листьев [24] были детально исследованы ранее.
Рис. 1.
Зависимость фенотипа мутанта tae от температуры. Верхняя, средняя и две нижние линии – растения в условиях 26–28°С, 22–24°С и 18–20°С, соответственно. (а, б) – растения 3-недельного возраста ДТ и tae, соответственно; (в) – 4-недельные растения ДТ (слева) и tae (справа); (г, д) – растения 3-недельного возраста ДТ и tae, соответственно; (е) – 4-недельные растения ДТ (слева) и tae (справа); (ж,з) – растения в возрасте 1.5 месяца ДТ и tae, соответственно (верхние листья розетки tae прекратили рост; с – семядоли); (и) – деформированные листья 2-месячных растений мутанта с выростами и почками; (к–м) – сканирующая электронная микроскопия листьев растений tae, изображенных на рис (з); (к) – пучок недоразвитых листьев на верхушке побега; (л) – листья, остановившиеся в развитии на разных стадиях развития; (м) – основание одного из верхушечных листьев с многочисленными почками. Бары соответствуют 1 см (а–и), 300 мкм (к, л), 100 мкм (м) .

Выращивание растений при 18–20°С вызывало не только сужение, но нередко и деформацию листовой пластинки (рис. 1ж–и). У части растений (~ 15%) после формирования нескольких настоящих листьев образовывался пучок из многочисленных недоразвитых листьев (рис. 1з, к, л). Такие растения не формировали цветонос. На относительно нормально развитых листьях развивались выросты и почки (рис. 1и). Среднее число выростов и почек из расчета на лист (2.5 и 0.6, соответственно) было значительно выше, чем у растений при 22–24°С (1.0 и 0.14, соответственно). Многочисленные почки можно было обнаружить и в пазухах недоразвитых листьев (рис. 1м).
Для изучения особенностей пролиферативной активности клеток листьев использовали репортерный ген ß-глюкуронидазы (GUS) под контролем промотора гена циклина CycB1;1, позволяющего визуализировать клетки, находящиеся на стадиях G2/M. Активную экспрессию трансгена CycB1;1:GUS в листьях растений tae при 18–20°С (как у мутанта при 22–24°С и у растений A.thaliana дикого типа при всех температурных режимах) можно было обнаружить на самых ранних этапах развития листового примордия. По мере роста листа ДТ и мутанта деления прекращались сначала в дистальной, а затем и в проксимальной части (рис. 2а–в), что соответствует результатам ранее проведенных исследований пролиферации клеток при развитии простого листа A. thaliana [26].
Рис. 2.
Активность маркера клеточных делений CycB1;1:GUS в листьях ДТ и мутанта tae на разных стадиях онтогенеза. (а–в) 7-дневные проростки ДТ (а) и мутанта tae, выращенные при 22–24°С (а,б) и 18–20°С (в), экспрессируют трансген в апексе и основании первых настоящих листьев ((б) стрелка указывает на полностью окрашенные зачатки второй пары настоящих листьев). (г–е) – 14-дневные растения ДТ (г) и мутанта tae (д, е), выращенные при 22–24°С (г, д) и 18–20°С (е), экспрессируют трансген в апексе; листья ДТ (г) и мутанта (д) при 22–24°С, достигшие размера 1 мм, прекращают экспрессию трансгена; при 18–20°С (е) в листьях мутанта экспрессия трансгена выявляется в листьях размером 5–10 мм, в молодых верхних листьях (на вкладке – большее увеличение) экспрессия трансгена детектируется не только в основании, но и в центре листового зачатка; (ж–з) – зрелые листья цветущих растений мутанта, выращенных при 18–20°С (стрелки указывают на экспрессию, сосредоточенную вдоль жилок и участков, где начинают развиваться выросты,). Звездочкой обозначены семядоли. Бары соответствуют 0.1 мм (а–в), 1 мм (г–е), 1 см (ж, з).
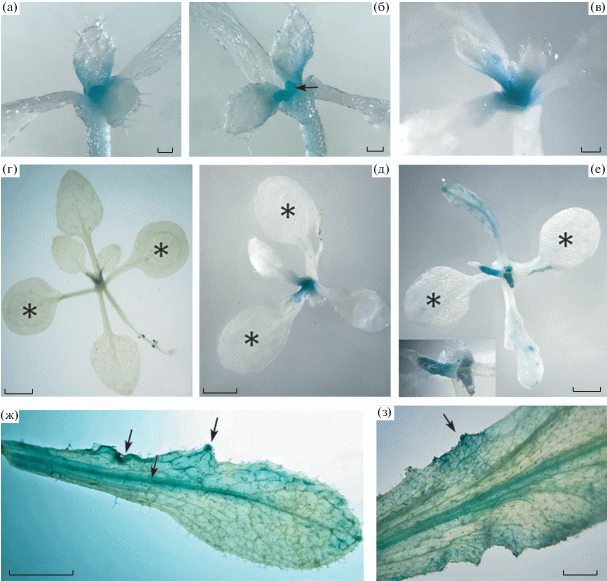
При 22–24°С в листьях длиннее 1 мм у ДТ и мутанта деления не выявлялись (рис. 2г, д) и возобновлялись у мутанта только в зрелых листьях [24]. При 18–20°C это возобновление можно было увидеть значительно раньше – в листьях длиной 5–10 мм ювенильных растений мутанта (рис. 2е). Более того, часть молодых листьев верхних ярусов значительно дольше сохраняли экспрессию CycB1;1:GUS в проксимальной и центральной частях (рис. 2е, вкладка). По-видимому, аномалии развития верхних листьев розетки при 18–20°C (рис. 1з, к–м) связаны именно с наличием эктопических клеточных делений в примордиях листа. Наиболее высокий уровень экспрессии CycB1;1:GUS в листьях мутанта наблюдали незадолго до зацветания и после него (рис. 2ж, з) – как и при 22–24°С [24]. Деления были сосредоточены в основном в области центральной и боковых жилок. На периферии листовых пластинок выявляли и локальные скопления делящихся клеток, которые приводили к формированию эктопических выростов (рис. 2ж, з).
Таким образом, при 18–20°С эктопические деления клеток в листьях мутанта начинались раньше, чем при более высокой температуре [24]. В результате общее число выростов и почек на листьях цветущих растений оказывалось выше, чем у растений, выращенных при 22–24°С. При развитии простого листа у A.thaliana гены плюрипотентности замолкают на ранних этапах развития примордия листа, и это замолкание поддерживается эпигенетическими механизмами на протяжении всего онтогенеза [23]. Возобновление клеточных делений в листе мутанта, тестируемое по экспрессии CycB1;1:GUS, а позже и по появлению выростов и почек на листе, указывает на нарушение стабильности эпигенетического замолкания генов плюрипотентности и их реактивацию в листе мутанта tae.
Гены, поддерживающие недетерминированность клеток, возобновляют экспрессию на поздних стадиях развития листа мутанта tae
Для проверки предположения о реактивации генов плюрипотентности и нарушении стабильности эпигенетических модификаций проведен анализ экспрессии основных генов, поддерживающих плюрипотентность клеток побеговой меристемы, а также генов, участвующих в поддержании стабильности эпигенетического молчания генов. Анализ экспрессии генов WUS, STM, KN1, KN2, KN6 проводили в листьях разного возраста у растений мутанта и ДТ, выращенных при температуре 22–24°С. Использовали листья без почек четырех возрастов: 1в – листья длиной 2–3 мм от 7-дневных проростков, 2в – листья 5–6 мм от 14‑дневных ювенильных растений, 3в – листья 17–22 мм от растений в возрасте 21 день, 4в – зрелые листья от растений с цветоносами.
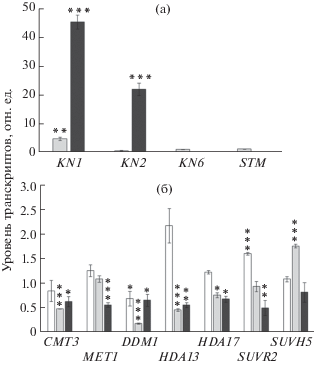
Выявить экспрессию исследуемых генов плюрипотентности в молодых листьях 1в и 2в нам не удалось ни у ДТ, ни у мутанта. По-видимому, у мутанта, как и у растений ДТ, экспрессия этих генов на ранних этапах развития листа подавляется. В листьях 3в у мутанта была повышена экспрессия гена KN1 (рис. 3а); уровень экспрессии остальных генов не отличался от контроля (листья ДТ того же возраста). В зрелых листьях 4в у мутанта наблюдалось повышение экспрессии всех генов, кроме гена WUS, в то время как у ДТ выявили лишь следовые количества экспрессии KN1 и KN2, а экспрессия генов KN6 и STM не выявлялась (рис. 3а, Supplementary Fig. 1 ). Время реактивации генов плюрипотентности совпадает со временем, когда в листьях возобновляются клеточные деления и экспрессия CycB1;1:GUS. Эти данные указывают на то, что активация делений является результатом возобновления экспрессии генов плюрипотентности в листьях мутанта.
Рис. 3.
Относительный уровень транскрипции генов в листьях мутанта tae разного возраста по сравнению с ДТ. Уровень экспрессии генов в листьях ДТ того же биологического возраста, что и у мутанта принят за единицу. (а) и (б) – экспрессия генов плюрипотентности и эпигенетических регуляторов соответственно. Для генов KN6 и STM, которые не экспрессировались в листьях ДТ 4в, в Supplementary (Fig. 1) представлен абсолютный уровень экспрессии. Значения представлены в виде среднего арифметического ± стандартная ошибка среднего трех биологических повторностей. Звездочкой выделены статистически достоверные отличия от уровня экспрессии ДТ (t-тест Стьюдента, уровень значимости: * 0.01 < P < 0.05; ** 0.001 < P < 0.01; *** P< 0.001). Белый, светло серый и темный цвет – листья 2, 3 и 4 возрастов соответственно.
В листе мутанта tae изменена работа генов, контролирующих метилирование ДНК и модификацию гистонов
Изучение экспрессии эпигенетических регуляторов проводили в листьях возрастов 2в, 3в, 4в (зрелый лист). Анализировали уровень экспрессии трех генов, контролирующих метилирование ДНК – MET1 (метилирование CG-сайтов), CMT3 (метилирование CXG-сайтов), DDM1 (хроматин-опосредованное метилирование ДНК и гистона Н3), двух генов гистоновых деацетилаз (HDA13, HDA17), гена SUVR2, участвующего в РНК-зависимом метилировании ДНК, а также гена SUVH5, кодирующего гистоновую метилтрансферазу, поддерживающую метку H3mK9 и участвующего в метилировании ДНК, зависимом от CMT3. Анализ экспрессии генов ДНК-метилаз MET1 и CMT3 не выявил различий в уровне их экспрессии в листьях 2в. В листьях 3в и 4в (зрелые листья) был снижен уровень экспрессии гена CMT3. Экспрессия MET1 снижалась только в зрелых листьях 4в. Уровень экспрессии гена DDM1 был снижен у мутанта по сравнению с ДТ в листьях всех возрастов (рис. 3б).
Уровни экспрессии генов гистоновых деацетилаз HDA13 и HDA17 были ниже у мутанта по сравнению с ДТ в листьях 3в и 4в, хотя в листьях 2в уровень HDA13 был выше, чем у ДТ. Похожая динамика снижения уровня экспрессии с возрастом обнаружена и для гена SUVR2. В листьях 3в у мутанта выявлено транзитное повышение экспрессии гена SUVH5, хотя в зрелых листьях (4в) уровень экспрессии SUVH5 был ниже, чем в листьях ДТ того же возраста (рис. 3б). Хотя анализ экспрессии отдельных представителей из разных групп эпигенетических регуляторов не дает полной картины происходящих в геноме процессов, выявленные в листьях мутанта изменения их экспрессии подтверждают предположение о процессах перепрограммирования генома, которые необходимы для реактивации генов плюрипотентности.
Клетки из листьев мутанта tae не проявляют плюрипотентности in vitro
Для изучения проявления плюрипотентности клеток in vitro использовали экспланты зрелых листьев. Каллусогенез из эксплантов мутанта tae оказался менее эффективным по сравнению с ДТ (табл. 1). Скорость роста каллусов мутанта также была значительно ниже, чем у каллусов ДТ. Средняя масса каллуса из листьев мутанта в конце месяца культивирования при температуре 18–20°С оказалась в 2 раза ниже, чем у каллусов ДТ (табл. 1). При 22–24°С каллусы росли лучше, однако различия между мутантом tae и ДТ сохранялись. Отставание в росте каллусов из мутанта сохранялось и на среде регенерации (рис. 4а, б).
Рис. 4.
Каллусы из листовых эксплантов. Общий вид 4-недельных каллусов ДТ (а) и мутанта tae (б) на среде регенерации. Экспрессия CycB1;1:GUS в каллусах ДТ (в, д) и мутанта tae (г, е) после 2 нед. (в, г) и 3 нед. (д, е) роста на среде каллусогенеза. Бары соответствуют 1 см (а, б), 2 мм (в–е).
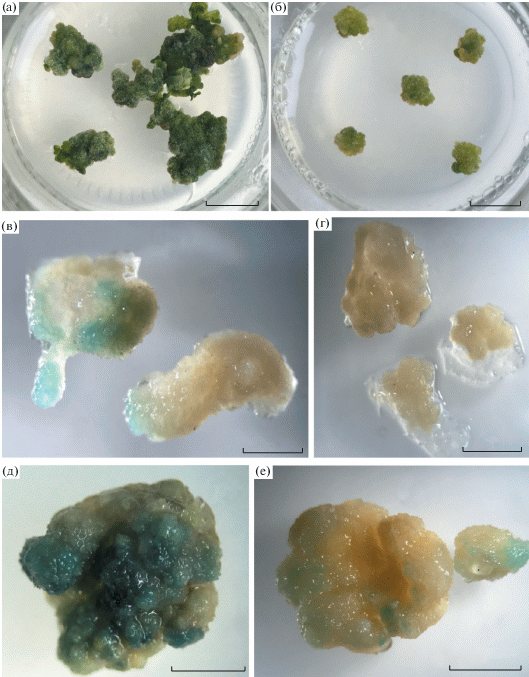
Экспрессия трансгена CycB1;1:GUS в каллусах мутанта также оказалась ниже, чем в каллусах ДТ (рис. 4в–е). Таким образом, эктопические деления, которые характерны для листьев, в каллусах из тех же листьев не выявлялись. В отличие от каллусов из листьев ДТ, каллусы из мутанта не были способны и к регенерации побегов. Эта способность не зависела от температуры (табл. 1). Доля каллусов с побегами из листьев ДТ при 18–20°С была существенно ниже, чем при 22–24°С (табл. 1). Таким образом, in vitro клетки мутанта демонстрировали пониженную скорость пролиферации, не проявляли способности к образованию почек даже в условиях температуры, усиливающей эктопическую пролиферацию клеток в листе in vivo.
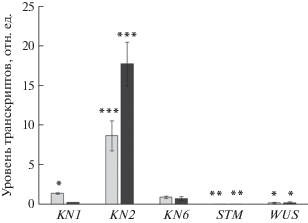
Анализ экспрессии генов плюрипотентности на среде каллусогенеза и на среде регенерации выявил повышение экспрессии у мутанта по сравнению с ДТ только одного гена – KN2 (рис. 5). Экспрессия генов WUS и STM была ниже, чем в каллусах ДТ, а уровень экспрессии гена KN1 либо не отличался от ДТ (на среде каллусогенеза), либо был ниже (на среде регенерации).
Рис. 5.
Относительный уровень транскрипции генов плюрипотентности в каллусах из листьев мутанта tae, культивируемых на среде каллусогенеза и на среде регенерации по сравнению с ДТ. Уровень экспрессии генов в каллусах ДТ принят за единицу. Значения представлены в виде среднего арифметического ± стандартная ошибка среднего трех биологических повторностей. Звездочкой выделены статистически достоверные отличия от уровня экспрессии ДТ (t-тест Стьюдента, уровень значимости: * 0.01 < P < 0.05; ** 0.001 < P < 0.01; *** P < 0.001). Светло-серый и темный цвет – данные для каллусов на среде каллусогенеза и регенерации, соответственно.
Таким образом, в культуре ткани клетки мутанта не проявляли эктопических делений и повышенной экспрессии большинства генов плюрипотентности, которая характерна для клеток зрелого листа. Эти особенности клеток мутанта не зависели от содержания экзогенных гормонов, что указывает на снижение чувствительности к экзогенным гормонам.
ОБСУЖДЕНИЕ
Пролиферация клеток листовых зачатков у проростков мутанта tae имела те же закономерности, что и у ДТ. Экспрессия маркера клеточных делений (трансгена CycB1;1:GUS) сначала наблюдалась во всем листовом зачатке, а затем прекращалась – сначала в дистальной части листовых зачатков, а затем и в проксимальной (рис. 2а–в). В листе размером более 1мм деления не выявлялись. Дальнейший рост листа обеспечивался за счет растяжения клеток, что характерно для простого листа A.thaliana. Утрата пролиферации клетками листа – результат транскрипционной репрессии генов плюрипотентности на ранних стадиях его развития. Молчание генов плюрипотентности поддерживается эпигенетическими механизмами на всех последующих этапах онтогенеза, обуславливая развитие простого не рассеченного листа [23]. Усложнение структуры листа у мутанта tae (появление эктопических лопастей и почек на его поверхности) указывает на утрату клеточной памяти, связанную, по-видимому, с нарушением функции каких-то генов, контролирующих стабильность эпигенетических модификаций.
Нестабильность эпигенетических изменений может приводить к репрограммированию генома и активации молчащих генов плюрипотентности. На наличие такого репрограммирования указывает выявленное изменение экспрессии ряда эпигенетических регуляторов в листьях мутанта разного возраста (рис. 3б), реактивация генов плюрипотентности (рис. 3а) и возобновление клеточных делений по мере роста листа (рис. 2). Генетически обусловленные изменения в эпигенетических регуляторах у мутанта tae, по-видимому, влияют и на процессы каллусогенеза и регенерации in vitro.
О роли эпигенетических процессов в регуляции процессов каллусогенеза и регенерации in vitro свидетельствуют ранее полученные результаты анализа транскриптомов и динамики изменения метилирования ДНК и модификации гистоновых белков [27]. О роли эпигенетических модификаций в регуляции процессов дедифференцировки клеток эксплантов, каллусогенеза и регенерация свидетельствуют также серьезные нарушения этих процессов при мутациях в генах, осуществляющих метилирование ДНК и модификацию гистонов [10, 28, 29].
Эпигенетические модификации могут оказывать влияние на процессы каллусогенеза и регенерации, изменяя экспрессию многих генов, контролирующих гормональный гомеостаз – метаболизм гормонов и гормональный ответ. Наиболее полно исследована эпигенетическая регуляции экспрессии генов синтеза, катаболизма и транспорта ауксина, генов ауксинового ответа [30]. Нельзя исключить, что выявленные ранее изменения ауксинового гомеостаза в линии tae также связаны с изменениями работы эпигенетических регуляторов. Эпигенетические изменения могут лежать и в основе нечувствительности культивируемых клеток мутанта к экзогенным гормонам, что отражается на эффективности каллусогенеза и регенерации листовых эксплантов in vitro.
Мутант tae обладает уникальными характеристиками анатомического строения и онтогенеза листа [24, 25], которые отличают его от ранее исследованных мутантов и трансгенных растений с эктопической экспрессией генов плюрипотентности в листе. Среди главных отличий – возобновление клеточных пролифераций и экспрессии генов плюрипотентности на поздних этапах онтогенеза листа, что указывает на нарушения у мутанта эпигенетической клеточной памяти. Эти особенности морфогенеза листа вместе с отсутствием регенерационных способностей у клеток листа мутанта tae in vitro делают его уникальной моделью для изучения роли эпигенетических модификаций в регуляции плюрипотентности клеток.
Электронномикроскопические исследования мутантов выполнены на оборудовании Центра коллективного пользования Московского государственного университета им. М.В. Ломоносова “Электронная микроскопия в науках о жизни”. Исследование поддержано Российским фондом фундаментальных исследований (грант № 19-04-00149).
Авторы заявляют об отсутствии конфликта интересов. Настоящая работа не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Shin J., Bae S., Seo P.J. De novo shoot organogenesis during plant regeneration // J. Exp. Bot. 2020. V. 71. P. 63. https://doi.org/10.1093/jxb/erz395
Chen L., Sun B., Xu L., Liu W. Wound signaling: the missing link in plant regeneration // Plant Signaling Behav. 2016. V. 11. (10): e1238548. https://doi.org/10.1080/15592324.2016.1238548
Lup S.D., Tian X., Xu J., Perez-Perez J.M. Wound signaling of regenerative cell reprogramming // Plant Sci. 2016. V. 250. P. 178. https://doi.org/10.1016/j.plantsci.2016.06.012
Ikeuchi M., Iwase A., Rymen B., Lambolez A., Kojima M., Takebayashi Y., Heyman J., Watanabe S., Seo M., Veylder L., Sakakibara H., Sugimoto K. Wounding triggers callus formation via dynamic hormonal and transcriptional changes // Plant Physiol. 2017. V. 175. P. 1158. https://doi.org/10.1104/pp.17.01035
Zeng J., Dong Z., Wu H., Tian Z., Zhao Z. Redox regulation of plant stem cell fate // The EMBO J. 2017. V. 36. P. 2844. https://doi.org/10.15252/embj.201695955
Zhang H., Zhang T.T., Liu H., Shi Y., Wang M., Bie X.M., Li X.G., Zhang X.S. Thioredoxin-mediated ROS homeostasis explains natural variation in plant regeneration // Plant Physiol. 2018. V. 176. P. 2231. https://doi.org/10.1104/pp.17.00633
Ikeuchi M., Shibata M., Rymen B., Iwase A., Bågman A.M., Watt L., Coleman D., Favero D.S., Takahashi T., Ahnert S.E., Brady S.M., Sugimoto K. A gene regulatory network for cellular reprogramming in plant regeneration // Plant Cell Physiol. 2018. P. 59. P. 765. https://doi.org/10.1093/pcp/pcy013
Huang H., Ullah F., Zhou D.X., Yi M., Zhao Y. Mechanisms of ROS regulation of plant development and stress responses // Front. Plant Sci. 2019. V. 10. P. 800. https://doi.org/10.3389/fpls.2019.00800
Gaillochet C., Lohmann J.U. The never-ending story: from pluripotency to plant developmental plasticity // Development. 2015. V. 42. P. 2237. https://doi.org/10.1242/dev.117614
Lee Z.H., Hirakawa T., Yamaguchi N., Ito T. The roles of plant hormones and their interactions with regulatory genes in determining meristem activity // Int. J. Mol. Sci. 2019. V. 20. P. 4065. https://doi.org/10.3390/ijms20164065
Rupp H.M., Frank M., Werner T., Strnad M., Schmulling T. Increased steady state mRNA levels of the STM and KNAT1 homeobox genes in cytokinin overproducing Arabidopsis thaliana indicate a role for cytokinins in the shoot apical meristem // Plant J. 1999. V. 18. P. 557.
Jasinski S., Piazza P., Craft J., Hay A., Woolley L., Rieu I., Phillips A., Hedden P., Tsiantis M. KNOX action in Arabidopsis is mediated by coordinate regulation of cytokinin and gibberellin activities // Curr. Biol. 2005. V.15. P. 1560. https://doi.org/10.1016/j.cub.2005.07.023
Yanai O., Shani E., Dolezal K., Tarkowski P., Sablowski R., Sandberg G., Samach A., Ori N.Arabidopsis KNOXI proteins activate cytokinin biosynthesis // Curr. Biol. 2005. V. 15. P. 1566. https://doi.org/10.1016/j.cub.2005.07.060
Leibfried A., To J.P., Busch W., Stehling S., Kehle A., Demar M., Kieber J.J., Lohmann J.U. WUSCHEL controls meristem function by direct regulation of cytokinin-inducible response regulators // Nature. 2005. V. 438. P. 1172. https://doi.org/10.1038/nature04270
Ma Y., Miotk A., Šutiković Z., Ermakova O., Wenzl C., Medzihradszky A., Gaillochet C., Forner J., Utan G., Brackmann K., Galván-Ampudia C.S., Vernoux T., Greb T., Lohmann J.U. WUSCHEL acts as an auxin response rheostat to maintain apical stem cells in Arabidopsis // Nat. Commun. 2019. V.10. P.5093. https://doi.org/10.1038/s41467-019-13074-9
Barton M.K., Poethig R.S. Formation of the shoot apical meristem in Arabidopsis thaliana: an analysis of development in the wild type and in the shoot meristemless mutant // Development. 1993. V. 119. P. 823.
Gordon S.P., Heisler M.G., Reddy G.V., Ohno C., Das P., Meyerowitz E.M. Pattern formation during de novo assembly of the Arabidopsis shoot meristem // Development. 2007. V. 134. P. 3539. https://doi.org/10.1242/dev.010298
Zhang T.Q., Lian H., Zhou C.M., Xu L., Jiao Y., Wang J.W. A two-step model for de novo activation of WUSCHEL during plant shoot regeneration // Plant Cell. 2017. V. 29. P. 1073. https://doi.org/10.1105/tpc.16.00863
Byrne M.E., Barley R., Curtis M.,Arroyo J.M., Dunham M., Hudson A., Martienssen R.A. Asymmetric leaves 1 mediates leaf patterning and stem cell function in Arabidopsis // Nature. 2000. V. 408. P. 967. https://doi.org/10.1038/35050091
Ori N., Eshed Y., Chuck G., Bowman J.L., Hake S. Mechanisms that control KNOX gene expression in the Arabidopsis shoot // Development. 2000. V. 127. P. 5523.
Semiarti E., Ueno Y., Tsukaya H., Iwakawa H., Machida C., Machida Y. The ASYMMETRIC LEAVES2 gene of Arabidopsis thaliana regulates formation of asymmetric lamina, establishment of venation and repression of meristem-related homeobox genes in leaves // Development. 2001. V. 128. P. 1771.
Ha C.M., Jun J.H., Nam H.G., Fletcher J.C. BLADE-ON-PETIOLE 1 and 2 control Arabidopsis lateral organ fate through regulation of LOB domain and adaxial-abaxial polarity genes // The Plant cell. 2007. V. 19. P. 1809. https://doi.org/10.1105/tpc.107.051938
Hay A., Tsiantis M. KNOX genes: versatile regulators of plant development and diversity // Development. 2010. V. 137. P. 3153. https://doi.org/10.1242/dev.030049
Ежова Т.А., Куприянова Е.В. Изучение роли ауксина в регуляции развития эктопических выростов на листьях мутанта taeniata Arabidopsis thaliana // Онтогенез. 2019. Т. 50. С. 312. https://doi.org/10.1134/S0475145019050057
Fedotov A.P., Ezhova T.A., Timonin A.C. Bizarre lamina margins in tae mutant of Arabidopsis thaliana (L.) Heynh. (Brassicaceae) // Wulfenia. 2017. V. 24. P. 163.
Donnelly P.M., Bonetta D., Tsukaya H., Dengler R.E., Dengler N.G. Cell cycling and cell enlargement in developing leaves of Arabidopsis // Dev. Biol. 1999. V. 215. P. 407. https://doi.org/10.1006/dbio.1999.9443
Lee K., Seo P.J. Dynamic epigenetic changes during plant regeneration // Trends Plant Sci. 2018. V. 23. P. 235. https://doi.org/10.1016/j.tplants.2017.11.009
Li W., Liu H., Cheng Z.J., Su Y.H., Han H.N., Zhang Y., Zhang X.S. DNA methylation and histone modifications regulate de novo shoot regeneration in Arabidopsis by modulating WUSCHEL expression and auxin signaling // PLoS Genet. 2011. V. 7:e1002243. https://doi.org/10.1371/journal.pgen.1002243
He C., Chen X., Huang H., Xu L. Reprogramming of H3K27me3 is critical for acquisition of pluripotency from cultured Arabidopsis tissues // PLoS Genet. 2012. V. 8. e1002911. https://doi.org/10.1371/journal.pgen.1002911
Mateo-Bonmatí E., Casanova-Sáez R., Ljung K. Epigenetic regulation of auxin homeostasis // Biomolecules. 2019. V. 9. P. 623. https://doi.org/10.3390/biom9100623
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


