Физиология растений, 2021, T. 68, № 1, стр. 63-74
Сравнение редокс-состояния аскорбиновой кислоты и аскорбатоксидазной активности у вакуолей и лейкопластов клеток корнеплодов столовой свеклы в период физиологического покоя
Е. В. Прадедова a, *, О. Д. Нимаева a, Н. В. Семенова a, Р. К. Саляев a
a Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: praded@sifibr.irk.ru
Поступила в редакцию 07.02.2020
После доработки 16.05.2020
Принята к публикации 16.05.2020
Аннотация
Проведено сравнительное исследование содержания аскорбиновой кислоты и аскорбатоксидазной активности (АО-активности) у вакуолей и лейкопластов клеток корнеплодов столовой свеклы (Beta vulgaris L.). Установлено, что вакуоли аккумулировали больше аскорбиновой кислоты (АКсум) по сравнению с пластидами. Содержание окисленной формы аскорбиновой кислоты, а именно дегидроаскорбиновой кислоты (ДАК), в вакуолях также было выше. Однако, величины соотношений восстановленной формы аскорбиновой кислоты (АК) к окисленной форме (АК/ДАК) у вакуолей и лейкопластов оказались близкими. Для исследуемых органелл была характерна относительно высокая АО-активность. Реакции оксидазного окисления АК в вакуолях катализировала аскорбатоксидаза , а в лейкопластах – аскорбатоксидаза и полифенолоксидаза. Окисляющие АК оксидазы, вероятно, регулируют редокс-состояние аскорбиновой кислоты в этих органеллах.
ВВЕДЕНИЕ
Физиологическое действие аскорбиновой кислоты обусловлено обратимостью процессов ее окисления и восстановления. В ходе реакций окисления от восстановленной аскорбиновой кислоты (АК) к акцепторам переходят один электрон (e–) или два e– (и два H+). В первом случае образуется нестабильное, но реакционноспособное соединение – монодегидроаскорбат-радикал (МДА). Во втором случае образуется дегидроаскорбат (ДАК) – более стабильная реакционноспособная окисленная форма аскорбиновой кислоты [1]. Эти окисленные формы, в свою очередь, принимают восстановительные эквиваленты и переходят в енольную форму АК. Благодаря обратимому окислению-восстановлению аскорбиновая кислота выполняет функцию эффективного переносчика водорода (H+ + e–) в ферментативных реакциях и вносит весомый вклад в окислительно-восстановительные процессы клетки.
В клетках растений АК, МДА и ДАК находятся, главным образом, в свободном состоянии. Как правило, преобладает АК, хотя в отдельных случаях накапливается ДАК [2]. Соотношение двух форм аскорбиновой кислоты АК/ДАК может служить показателем физиологического состояния растения в онтогенезе: преимущественное накопление АК – признак высокой интенсивности процессов жизнедеятельности; повышение содержания ДАК – низкая интенсивность жизнедеятельности [2]. Кроме того, соотношение АК/ДАК, характеризующее редокс-состояние аскорбиновой кислоты, может быть маркером физиологического состояния органов, тканей и клеток в стрессирующих условиях. Воздействие стрессирующего фактора приводит к повышению интенсивности окислительных процессов (вследствие активации защитных механизмов), которое, как правило, сопровождается уменьшением величин соотношений АК/ДАК или АК/АКсум [3, 4]. С помощью этих соотношений можно оценивать редокс-состояния не только органов, тканей и клеток, но и отдельных клеточных компартментов. Аскорбиновая кислота сосредоточена практически во всех органеллах клетки, цитозоле и апопластном пространстве, в которых выполняет определенные функции [3, 5]. Ее редокс-состояние изменяют низкомолекулярные прооксиданты (активные формы кислорода, окисленные фенолы и токоферол, и др.) и ферменты, для которых она выступает в роли кофактора (монооксигеназы, диоксигеназы, пролингидроксилазы и др.), неспецифичного субстрата (фенолазы, фенольная пероксидаза и др.) и специфичного субстрата (аскорбатпероксидаза, аскорбатоксидаза и др.) [1–5].
Аскорбиновая кислота (АК, МДА, ДАК) и специфично взаимодействующие с ней ферменты (аскорбатпероксидаза, аскорбатоксидаза, монодегидроаскорбатредуктаза, дегидроаскорбатредуктаза и др.) объединены в систему аскорбиновой кислоты [1, 2]. Эта система частично охарактеризована у митохондрий, хлоропластов, пероксисом, цитозоля, а также у апопласта [1, 6]. В то же время ее наличие в центральной вакуоли ранее не рассматривалось, несмотря на некоторые факты, указывающие на вакуолярную локализацию аскорбиновой кислоты и аскорбат-зависимых ферментов. Например, показано накопление аскорбиновой кислоты в вакуолях Armoracia rusticana и Vicia faba [7, 8],а в изолированных вакуолях Arabidopsis thaliana с помощью протеомного анализа выявлены апоферменты аскорбатпероксидазы (КФ 1.11.1.11) и дегидроаскорбатредуктазы (КФ 1.8.5.11) [9]. В вакуолях Cucurbita maxima с помощью иммуноферментного анализа с применением электронной микроскопии обнаружена аскорбатоксидаза (АО, КФ 1.10.3.3) [10]. На основании этих данных можно предположить функционирование системы аскорбиновой кислоты в вакуолях клеток растений.
Цель настоящей работы заключалась в изучении этой системы у вакуолей клеток корнеплодов столовой свеклы (Beta vulgaris L.). В рамках проводимого исследования решались следующие задачи. Прежде всего, следовало определить содержание аскорбиновой кислоты и ее редокс-состояние. Затем следовало выявить ферменты, для которых аскорбиновая кислота служила субстратом, и которые изменяли ее редокс-состояние. Основное внимание на этом этапе исследования было уделено аскорбатоксидазной активности (АО-активности) вакуолей.
Оценить содержание и редокс-состояние аскорбиновой кислоты, а также активность аскорбатокисляющих ферментов в вакуолях позволяет сравнение с другими структурами клетки. Наиболее подходящими объектами для сравнения могли быть пластиды, в которых система аскорбиновой кислоты ранее исследовалась в рамках аскорбат-глутатионового цикла. В связи с этим, главными объектами настоящего исследования были вакуоли и лейкопласты, которые изолировали из корнеплодов столовой свеклы в период их физиологического покоя.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Растения столовой свеклы (Beta vulgaris L.) сорта Бордо выращивали на опытном участке Сибирского института физиологии и биохимии растений СО РАН. Корнеплоды свеклы хранили при 4°С.
Выделение органелл. Макрообъемный метод выделения вакуолей из ткани корнеплодов применяли в некоторой модификации [11]. Фракция вакуолей подвергалась дополнительной очистке в ступенчатом градиенте плотности (1.050–1.080–1.145–1.180 г/см3), составленном из растворов 1 М КCl и 1.8 М сахарозы, которые готовили на основе буфера 20 мМ Трис-HCl, рН 7.4. Градиент центрифугировали в течение 20 мин при 125 g. Чистоту фракций контролировали с помощью маркерных ферментов вакуолей и других клеточных структур [12], а также с помощью световой микроскопии.
Пластиды изолировали из корнеплодов, используя общепринятый подход с некоторой модификацией, которая заключалась в изменении ступенчатого градиента плотности для очистки органелл. Он состоял из растворов, содержащих среду выделения (1 мМ ЭДТА, 10 мМ NaCl, 1 мМ MgCl2, 0.5 мМ KH2PO4, 50 мМ HEPES-KOH, pH 7.6) и разные концентрации Percoll (10–22–35–60%). Градиент центрифугировали в течение 5 мин при 9200 g [13]. Поскольку в клетках корнеплода сосредоточены главным образом лейкопласты, то наиболее чистую фракцию пластид собирали на границе слоев с 22–35% Percoll.
Получение водных экстрактов из ткани корнеплода и выделенных органелл. Ткань корнеплода растирали в среде для экстракции, содержащей 2 мM фенилметилсульфонил фторида, 0.1% нерастворимого поливинилпирралидона, 50 мМ Na2НРО4/KН2РО4 (pH 7.8). Изолированные вакуоли помещали в указанную среду для экстракции, в которой они легко разрушались. Изолированные пластиды разрушали в этой же среде при помощи многократного замораживания-оттаивания, используя для этих целей жидкий азот. Полученные экстракты центрифугировали в течение 10 мин при 13 500 g.
Определение аскорбиновой кислотыДля определения АК использовали метод ВЭЖХ. К образцам добавляли 0.1% раствор метафосфорной кислоты (в конечной концентрации), затем центрифугировали в течение 15 мин при 13500 g. Супернатант очищали с помощью картриджа Sep-Pak С18 [14]. Фильтрат делили на две равные части, получая в дальнейшем два образца. Одну часть оставляли без изменения, в ней определяли АК. Другую часть инкубировали 10 мин с 5 мM ДТТ, в результате ДАК восстанавливалась до АК. В этой части определяли содержание “суммарной аскорбиновой кислоты” (АКсум = АК + ДАК). Количественное определение проводили на жидкостном микроколоночном хроматографе Милихром А-02 (ООО ИХ “ЭкоНова”, Россия): колонка 2 × 75 мм; сорбент ProntoSil-120-5-С18 AQ#0838 (обращеннофазный). Изократическое элюирование осуществляли раствором, содержащим метанол и воду (15 : 85), pH 2.5, скорость потока 0.2 мл/мин. Детекция проходила при длине волны 248 нм. С помощью спектрофотометрического метода определяли АК и АКсум, используя реагент 2,6-дихлорфенолиндофенол (DCPIP). Измерения проводили на планшетном фотометре ImmunoChem-2100 (“High Technology” США) согласно ранее описанному методу [15].
Определение ферментативной активности. С помощью спектрофотометрического метода в исследуемых образцах определяли АО-активность. Оптическую плотность регистрировали при 265 нм [16]. Реакционная среда содержала 0.8 мМ АК и 50 мМ Na2НРО4/NaН2РО4/Na3PO4 (pH 4.0–5.0–6.0–7.0–8.0–9.0). Для подавления ферментативной активности использовали ингибиторы: 10 мМ трополон (2-гидрокси-2.4.6-циклогептатриен); 30 мМ DTNB (5,5'-дитиобис-(2-нитробензойная кислота); 50 мМ NaN3; 1 мМ ЭДТА. АО-активность выражали в нмоль АК на мг белка, концентрацию последнего определяли с помощью метода Бредфорд.
Активность определяли также в ПААГ после электрофореза белков при неденатурирующих условиях (CN-PAGE). Для разделения анионных белков использовали Трис/глициновцую систему и 7% ПААГ. Для разделения катионных белков использовали систему ß-аланин/уксусная кислота и 6% ПААГ [12]. В пластинах геля визуализировали активность аскорбатоксидазы, фенольной пероксидазы и полифенолоксидазы.
АО-активность выявляли с помощью ранее описанного метода [17]. Пластины ПААГ помещали в реакционные среды, содержащие 4 мМ АК и буфер с разными значениями pH: 1) 100 мМ Na2НРО4/NaН2РО4, pH 6.0 или pH 8.0; 2) 100 мМ Трис/HCl, pH 6.0 или pH 8.0. После 10-мин инкубации гели споласкивали дистиллированной водой и обрабатывали красителем DCPIP (0.025%).
Активность фенольной пероксидазы (ПО) визуализировали в пластинах геля, которые помещали в реакционную среду, содержащую: 100 мМ Na2НРО4/NaН2РО4 (pH 6.0), 0.01% H2O2, 0.07 мМ 3,3'-диаминобензидина-4HCl (DAB) [17].
Активность полифенолоксидазы (ПФО) проявлялась в пластинах геля, когда их инкубировали в реакционной среде, содержащей 50 мМ Na2НРО4/ NaН2РО4 (pH 6.0 или pH 8.0), 50 мМ пирокатехина (1.2-дигидроксибензола) и 0.93 мМ п-фенилендиамина (PPD) [17].
Эксперимент с пероксидазой хрена. Фенольные пероксидазы растений катализируют реакции пероксидазного и оксидазного окисления субстратов. Подтвердить причастность вакуолярных ПО к пероксидазному и оксидазному окислению испытуемых субстратов позволяет эксперимент с пероксидазой из корней хрена, которая также имеет вакуолярную локализацию. Активность очищенной пероксидазы хрена (“Sigma”, США) определяли двумя указанными методами в тех же условиях.
Статистическая обработка данных. Эксперименты повторяли не менее пяти раз, используя три аналитические пробы. В ходе статистического анализа применяли такие показатели, как среднее арифметическое значение и стандартное отклонение. Они представлены в таблицах и графиках. Однофакторный дисперсионный анализ (ANOVA) и апостериорный тест Тьюки использовали для оценки статистически значимых различий между величинами концентраций аскорбиновой кислоты, которые приведены в таблице.
РЕЗУЛЬТАТЫ
Содержание аскорбиновой кислоты
Самое высокое содержание аскорбиновой кислоты (АКсум) установлено в экстрактах ткани, в которых концентрация ДАК превышала концентрацию АК. В результате соотношение АК/ДАК оказалось низким и соответствовало 0.72 или 0.8 (в зависимости от метода определения) (табл. 1). В то же время, в вакуолях и пластидах содержание АК превосходило содержание ДАК, поэтому соотношение АК/ДАК было выше: у вакуолей – 1.01 или 1.77; у пластид – 1.17 или 1.93. При этом вакуоли аккумулировали намного больше аскорбиновой кислоты по сравнению с лейкопластами.
Таблица 1.
Содержание аскорбиновой кислоты в изолированных органелла и экстрактах ткани
| Образец | Концентрация аскорбиновой кислоты, мкМ /мг белка | |||||
|---|---|---|---|---|---|---|
| метод | AК | ДАК | AКcум | AК/ДАК | AК/AКсум | |
| Вакуоли | Спектрофотометрия | 2.21 ± 0.23* | 2.18 ± 0.25 | 4.39 ± 0.48 | 1.01 | 0.50 |
| ВЭЖХ | 3.16 ± 0.19* | 1.79 ± 0.39 | 4.95 ± 0.58 | 1.77 | 0.64 | |
| Пластиды | Спектрофотометрия | 0.41 ± 0.11* | 0.35 ± 0.09* | 0.76 ± 0.2* | 1.17 | 0.54 |
| ВЭЖХ | 0.27 ± 0.09* | 0.14 ± 0.03* | 0.41 ± 0.11* | 1.93 | 0.66 | |
| Экстракт ткани | Спектрофотометрия | 4.15 ± 1.02* | 5.73 ± 1.19 | 9.88 ± 2.21 | 0.72 | 0.42 |
| ВЭЖХ | 5.38 ± 0.32* | 6.70 ± 1.56 | 12.08 ± 1.88 | 0.81 | 0.45 | |
Результаты, полученные с помощью разных методов, несколько различались. Если аскорбиновую кислоту определяли с помощью ВЭЖХ, то во всех исследуемых образцах концентрации АК были выше, а концентрации ДАК были ниже таковых, установленных с помощью спектрофотометрического анализа. В результате величины редокс-соотношений АК/ДАК и АК/АКсум также были выше (табл. 1). Наблюдаемый эффект, вероятно, обусловлен ошибкой спектрофотометрического метода, в котором следует учитывать влияние пигментов и неспецифичную реакцию красителя. Для этого необходимо вводить дополнительные контрольные варианты и производить соответствующие вычисления. В то же время, такие контрольные варианты не требуются для ВЭЖХ.
Несмотря на некоторые различия в концентрациях аскорбиновой кислоты при определении разными методами, сравнение между собой вакуолей, пластид и экстрактов ткани позволяло выявить одну и ту же картину. Во-первых, независимо от способа измерения, концентрация АКсум в вакуолях была на порядок выше, чем в пластидах. Во-вторых, в вакуолях и пластидах содержание АК превосходило содержание ДАК, тогда как в тканевом экстракте, наоборот, ДАК было больше, чем АК. В-третьих, величины соотношений АК/ДАК и АК/АКсум, полученные для вакуолей, были близки соответствующим величинам, полученным для пластид (табл. 1).
Аскорбатоксидазная активность
В клетках растений разные ферменты окисляют АК, изменяя ее редокс-состояние. В настоящей работе внимание уделено АО, так как некоторые факты из более ранних работ указывали на возможное присутствие фермента в вакуолях растительных клеток [10].
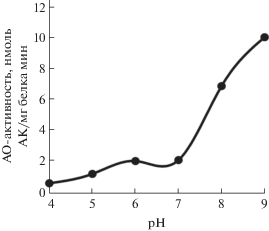
В вакуолях корнеплодов столовой свеклы мы выявили АО-активность (рис. 1). Она оказалась относительно высокой и превышала таковую пластид. Однако самая высокая активность была в экстрактах ткани. Ее максимальные значения приходились на pH 6.0,хотя активность оставалась относительно высокой в довольно широком диапазоне pH (pH 6.0–9.0) как у экстрактов ткани, так и других исследуемых объектов (рис. 1). На графике у кривых, отображающих изменение АО-активности вакуолей и тканевого экстракта, видны два пика. Они соответствовали pH 6.0 и 9.0. В то же время у лейкопластов единственный пик приходился на pH 6.0. Он был нечетко выражен, так как активность незначительно снижалась при pH 7.0, 8.0 и 9.0.
Рис. 1.
Изменение АО-активности в зависимости от pH среды. 1 – изолированные вакуоли; 2 – экстракт ткани; 3 – изолированные пластиды.
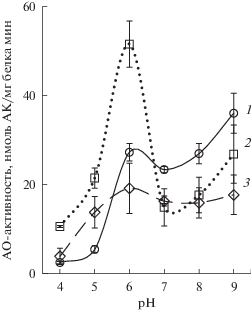
Возможно, два пика у кривых формировались вследствие окисления АК сразу несколькими ферментами, оптимальные pH для которых сильно различались. В своих более ранних исследованиях мы показали наличие фенольной пероксидазы (ПО) в вакуолях клеток корнеплодов столовой свеклы [18]. Известно, что АК служит субстратом для ПО. Например, пероксидаза из корней хрена катализировала реакции пероксидазного окисления АК в слабокислых и нейтральных условиях [19]. Однако нас интересовала способность ПО катализировать реакции оксидазного окисления АК. Чтобы оценить вклад этого фермента в АО-активность, мы провели эксперимент с пероксидазой хрена. Как оказалось, ее активность с АК в отсутствие H2O2 (в оксидазных реакциях) была довольно низкой (рис. 2). Повышение активности происходило только в средах с pH 8.0 и, особенно, pH 9.0. Таким образом, в условиях нашего эксперимента можно было ожидать небольшой вклад ПО вакуолей и тканевого экстракта в АО-активность при pH 9.0, на который приходился второй пик ферментативной активности на графиках (рис. 1). Первый пик, соответствующий pH 6.0, по всей видимости, отражал уровень активности АО.
Ингибиторный анализ
В растительном организме оксидазные реакции, в которых АК выступает в качестве доноров восстановительных эквивалентов для O2, катализируют не только АО, но и другие оксидазы, например, фенолазы (ПФО и лакказы) [2]. В пероксидазных реакциях АК окисляют аскорбатпероксидазы и ПО [2, 19]. В связи с этим, у исследуемых образцов следовало оценить вклад в АО-активность других оксидоредуктаз, окисляющих АК. Для этого использовали ингибиторы: 1) трополон, подавляющий ПФО; 2) DTNB, инактивирующую лакказы; 3) ЭДТА, которая подавляла активность ПФО и ПО и, согласно данным из литературы, практически не влияла на активность АО; 4) NaN3, подавляющий все рассматриваемые оксидоредуктазы [18, 20, 21]. В некоторых работах для подавления АО применяли диэтилдитиокарбамат или салицилальдоксим [2, 20]. В нашем случае исследование с применением этих хелатных реагентов было бы неинформативным, так как они ингибировали многие металлсодержащие ферменты, в том числе ПФО и лакказы [21].
Используемые ингибиторы вносили в реакционные среды с разными pH (pH 6.0, 80, 9.0). Как оказалось, их эффект зависел от pH реакционной среды. Исключение составлял азид натрия, при котором снижение АО-активности на 80–90% было отмечено в средах с pH 6.0, 8.0 и 9.0 у всех исследуемых объектов (рис. 3а–в).
Рис. 3.
Влияние ингибиторов на АО-активность. 1 – условия с pH 6.0; 2 – условия с pH 8.0; 3 – условия с pH 9.0. (а) – вакуоли; (б) – пластиды; (в) – экстракт ткани.
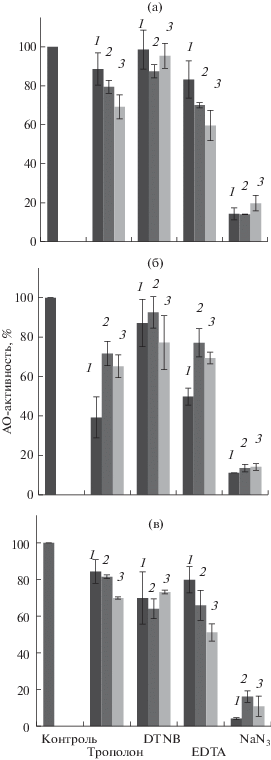
В то же время, с трополоном заметное снижение АО-активности у вакуолей и тканевого экстракта происходило в реакционных средах с рН 9.0 (рис. 3а, в). Ранее мы показали снижение активности вакуолярной ПО в пероксидазных и оксидазных реакциях в среднем на 30%, если реакционные среды содержали трополон [18]. В связи с этим, наблюдаемый эффект в условиях с рН 9.0 можно объяснить некоторым снижением активности ПО. Трополон оказался более эффективным в случае пластид, у которых АО-активность снижалась в среднем на 60% в слабокислых условиях (pH 6.0) (рис. 3б). По всей видимости, это снижение было вызвано подавлением ПФО, так как трополон является сильнодействующим ингибитором для этого фермента. В средах с pH 8.0 и 9.0, содержащих трополон, ферментативная активность снижалась лишь на 20–30%. Вероятно, в этих условиях вклад ПФО в АО-активность был незначительным, а вклад АО, наоборот, был существенным.
DTNB (признанный ингибитор лакказ) оказалась малоэффективной в случае вакуолей и пластид (рис. 3,б). Однако в экстрактах ткани АО-активность снижалась в среднем на 30%. Возможно, экстракты ткани содержали окисляющие АК оксидоредуктазы, которые подавляла DTNB.
Эффект ЭДТА также зависел от pH-условий. АО-активность снижалась у пластид в среднем на 50% при pH 6.0, а у вакуолей и тканевого экстракта – на 20–40% при pH 8.0 и 9.0. Очевидно, что АО-активность пластид понижалась вследствие подавления ПФО. В то же время, незначительное снижение АО-активности у вакуолей и тканевого экстракта в среде с pH 6.0, возможно, происходило из-за слабого инактивирования АО, которая менее подвержена ингибирующему действию ЭДТА.
В целом, результаты ингибиторного анализа показали, что АК в исследуемых образцах окисляли оксидоредуктазы, подавляемые азидом натрия. Разные эффекты трополона и ЭДТА были обусловлены величинами pH реакционной среды, что косвенно указывало на функционирование разных pH-зависимых ферментов. Подавление АО-активности трополоном и ЭДТА при pH 6.0 (в среднем на 50%) у лейкопластов свидетельствовало о значительном вкладе в эту активность ПФО. У вакуолей в этих условиях, по всей видимости, преобладала активность аскорбатоксидазы.
Определение активности АО в ПААГ
Метод, с помощью которого выявляли активности АО в ПААГ, предусматривал применение DCPIP [17]. Это синий хиноидный краситель, который восстанавливается АК до бесцветного соединения (лейко-формы DCPIP) [15]. Мы модифицировали метод, изменив способ нанесения раствора DCPIP на пластину геля. На основе этого раствора готовили 1% агарозный гель, который формировали на поверхности исследуемого ПААГ. Поскольку ПААГ (согласно протоколу, см. раздел Материалы и методы) предварительно инкубировали в реакционных средах, содержащих АК, то расположенный на его поверхности изначально окрашенный агарозный гель довольно быстро обесцвечивался. Синее окрашивание в агарозном геле сохранялось только в зонах локализации фермента.
Следует отметить, что в этом методе предусмотрено применение сразу двух субстратов АО, а именно АК и DCPIP. В более ранних работах была продемонстрирована способность АО окислять DCPIP (лейко-формы) [22]. Оптимальный pH для такой реакции был pH 7.5, тогда как оптимальный pH для реакции окисления АК был pH 6.0 [20, 22, 23]. Поскольку, согласно протоколу, реакционная среда должна содержать Трис-буфер с pH 8.0, то можно предположить, что в этих условиях при участии фермента будет окисляться преимущественно восстановленный DCPIP. Чтобы подтвердить это предположение, мы применили две реакционные среды с Трис-буфером, которые различались значениями pH (pH 6.0 и 8.0). Наряду с указанными средами, использовали среды с фосфатным буфером с pH 6.0 и pH 8.0 для выявления активности ПО и ПФО.
Как отмечалось выше, ферментативную активность визуализировали в ПААГ после электрофоретического разделения отрицательно и положительно заряженных белков при неденатурирующих условиях (CN-PAGE). К сожалению, из-за низкой стабильности АО корнеплодов столовой свеклы мы не могли использовать изоэлектрическое фокусирование белков (ИЭФ) – более приемлемый подход для такого исследования.
Вакуоли. Если пластины геля с отрицательно заряженными белками инкубировали в реакционной среде с фосфатным буфером, содержащим субстраты, то проявлялась активность анионных изоформ ПО, которые катализировали: пероксидазное окисление DAB (pH 6.0); оксидазное окисление пирокатехина (pH 8.0); окисление АК или DCPIP (pH 6.0) (рис. 4б–г). Следует отметить, что зоны, окрашенные DCPIP, довольно быстро исчезали (в течение 30 мин). Возможно, в условиях эксперимента, когда DCPIP восстанавливался АК, ПО окисляла главным образом восстановленный краситель, а не АК. Предположительная последовательность окислительно-восстановительных реакций:
Рис. 4.
Ферментативная активность в ПААГ после электрофоретического разделения отрицательно заряженных белков: (а) – маркерные белки; (б) – активность пероксидазы с DAB в реакционной среде, содержащей фосфатный буфер с pH 6.0; (в) – полифенолоксидазная активность с пирокатехином и PPD в среде с фосфатным буфером с pH 8.0 (для образцов вакуолей, экстрактов ткани и пероксидазы хрена) и среде с фосфатным буфером с pH 6.0 (для образцов пластид); (г) – АО-активность в реакционной системе, содержащей субстраты АК и DCPIP, а также фосфатный буфер с pH 6.0; (д) – АО-активность в среде с фосфатным буфером с pH 8.0; (е) – АО-активность в среде с Трис-буфером с pH 6.0; (ж) – АО-активность в среде с Трис-буфером с pH 8.0. 1, 3, 4, 5 – изоформы пероксидазы (в образцах вакуолей, экстрактов ткани) или изоформы полифенолоксидазы (в образцах пластид); 2 – изоформа аскорбатоксидазы.

Очевидно, что требуется отдельное исследование этих реакций.
В реакционной среде с фосфатным буфером с pH 8.0 активность ПО заметно снижалась, а в области белков с низкой электрофоретической подвижностью появлялась дополнительная зона с АО-активностью (рис. 4д). Когда в эти же среды добавляли трополон, активность ПО становилась слабо различимой (рис. 6б). Хорошо просматривалась активность в дополнительной зоне. При наличии ЭДТА в реакционной среде активность ПО исчезала. АО-активность сохранялась только в дополнительной зоне (рис. 6в). DTNB не оказывала видимого эффекта (данные не приводятся).
Рис. 5.
Ферментативная активность в ПААГ после электрофоретического разделения положительно заряженных белков: (а) – маркер трипсиноген (pI 9.3); (б) – активность пероксидазы (ПО) с DAB (в вакуолях и экстрактах ткани) и полифенолоксидазы (ПФО) c пирокатехином и PPD (в пластидах) при инкубации в реакционных средах, содержащих фосфатный буфер с pH 6.0; (в) –АО-активность с АК и DCPIP в среде с фосфатным буфером, pH 6.0; (г) – АО-активность в среде с Трис-буфером, pH 8.0. 1, 2 – изоформы ПО (у вакуолей и экстрактов ткани) и изоформы ПФО (у пластид).

Рис. 6.
Эффект ингибиторов на ферментативную активность в ПААГ после электрофоретического разделения отрицательно заряженных белков. Пластины геля инкубировали в реакционной среде с фосфатным буфером, pH 8.0: (а) – контрольный вариант; (б) – с трополоном; (в) – с ЭДТА. 1, 3–5 – изоформы пероксидазы (в образцах вакуолей и экстрактов ткани) или изоформы полифенолоксидазы (в образцах пластид). 2 – изоформа аскорбатоксидазы.

Таким образом, в реакционных средах с фосфатным буфером в ПААГ проявлялась в основном активность ПО, которая была неспецифичной ферментативной активностью в настоящем эксперименте. Картина заметно менялась, когда использовали Трис-буфер. Известно, что буферные системы способны инактивировать некоторые ферменты [20]. В то же время, установлено, что активность АО в Трис-буфере была выше, чем в других буферных системах [20]. В средах с Трис-буфером с pH 6.0 и 8.0 активность изоформ ПО в области белков с высокой электрофоретической подвижностью не проявлялась. Однако АО-активность становилась более выраженной (особенно в средах с pH 8.0) в двух зонах в области белков с медленной электрофоретической подвижностью (рис. 4е, ж). Из двух зон одна не соответствовала зоне локализации изоформы ПО и не исчезала при наличии ЭДТА в реакционной среде (рис. 4ж, 6в). В этой зоне располагалась АО.
Поскольку активность АО в ПААГ оказалась высокой в реакционной среде с Трис-буфером с pH 8.0, то можно предположить следующую последовательность реакций:
Мы допускаем, что при таком способе визуализации ферментативной активности в ПААГ субстратом для АО служил восстановленный DCPIP, а не АК.
Что касается катионных белков, то в пластинах геля с положительнозаряженными белками зоны с активностью АО не обнаружены (рис. 5). Так называемая АО-активность была сосредоточена только в зонах с катионными изоформами ПО (рис. 5б, г). Эти зоны появлялись, когда ПААГ инкубировали в реакционных средах с фосфатным буфером (pH 6.0), но отсутствовали, когда гели инкубировали в средах с Трис-буфером (pH 8.0) (рис. 5в).
Экстракт ткани. Расположение зон с ферментативной активностью в ПААГ у образцов вакуолей и тканевого экстракта полностью совпадало (рис. 4, 5). Эффекты трополона и ЭДТА на пероксидазную активность вакуолей и тканевого экстракта были идентичными (рис. 6б, в). Следует отметить более высокую активность ПО тканевого экстракта, которая сохранялась при инкубации ПААГ в реакционной среде с Трис-буфером с pH 6.0 (рис. 4ж). Однако она практически исчезала в Трис-буфере с pH 8.0. Вместе с тем, в этих условиях так же, как и в вакуолярных образцах, были хорошо видны две зоны в области белков с низкой электрофоретической подвижностью, в одной из которых располагалась АО (рис. 4ж,6в).
Пластиды. В отличие от вакуолей и экстрактов ткани, у пластид активность с DAB не проявлялась, если пластины геля инкубировали в среде с фосфатным буфером с pH 6.0 (рис. 4б). Однако в этих условиях была видна активность анионных и катионных изоформ ПФО с субстратом пирокатехином (рис. 4в, 5б). В зонах с изоформами ПФО проявлялась активность с DCPIP и АК (рис. 4г, 5г), которую подавляли трополон и ЭДТА (рис. 6б, в). Предположительная последовательность реакций:
В случае с ПФО мы также допускаем окисление DCPIP (лейко-формы), а не АК.
В реакционных средах с pH 8.0 (с фосфатным буфером или Трис-буфером) в ПААГ появлялась дополнительная зона в области белков с медленной электрофоретической подвижностью (рис. 4д, ж). На ферментативную активность в этой зоне не влияли трополон и ЭДТА (рис. 6б, в), что указывало на локализацию в ней аскорбатоксидазы.
В ПААГ с положительно заряженными белками (катионными белками) дополнительные зоны с активностью АО не выявлены. Наблюдаемая активность была сосредоточена только в зонах локализации изоформ ПФО (Рис. 5б–г).
Пероксидаза хрена. Одновременно с анализируемыми образцами исследовали пероксидазу из корней хрена (рис. 4). Этот фермент катализировал реакции пероксидазного (с DAB) и оксидазного (с пирокатехином) окисления субстратов в реакционных средах с фосфатным буфером (с pH 6.0 и pH 8.0) (рис. 4а, б). Если инкубацию проводили в этих же реакционных средах, но при наличии АК и DCPIP, то в пластинах ПААГ также была видна активность изоформ ПО хрена (рис. 4г, д). Эта активность снижалась в реакционной среде с Трис-буфером с pH 6.0 и практически исчезала в реакционной среде с тем же буфером с pH 8.0 (рис. 4ж). Таким образом, эти результаты совпадали с результатами, полученными для ПО вакуолей и экстрактов ткани корнеплодов столовой свеклы.
ОБСУЖДЕНИЕ
На протяжении многих лет сохранятся высокий интерес к компартментализации аскорбиновой кислоты в растительной клетке. Она выявлена практически во всех клеточных структурах (ядре, хлоропластах, митохондриях, пероксисомах, вакуолях, цитозоле), однако ее основная функция в них во многом неясна [3, 10]. Вакуоли и лейкопласты покоящихся корнеплодов столовой свеклы тоже содержали аскорбиновую кислоту. Величины концентраций АКсум свидетельствовали о преимущественном накоплении аскорбиновой кислоты в вакуолях по сравнению с пластидами. Вместе с тем самая высокая концентрация AКсум была обнаружена в водном экстракте ткани. Очевидно, в клетках корнеплодов столовой свеклы основной пул аскорбиновой кислоты сосредоточен в цитозоле. Согласно современным представлениям, местом локализации аскорбиновой кислоты в растительной клетке служит, главным образом, цитозоль [1, 3–5].
Сравнивая собственные результаты с данными из литературы, мы пришли к заключению, что на сегодняшний день нет единого мнения относительно содержания аскорбиновой кислоты в вакуолях клеток растений. Согласно данным, полученным для корней A. rusticana, в вакуолях может быть самое высокое содержание аскорбиновой кислоты (до 70–90% всей АКсум клетки) [7]. В то же время, в протопластах H. vulgare, а также в клетках листьев A. thaliana и Nicotina tabacum самое высокое содержание установлено для цитозоля, а самое низкое – у вакуолей [3, 25]. Однако у вакуолей оно в несколько раз повышалось в стрессирующих условиях. В вакуолях корней C. maxima аскорбиновая кислота не обнаружена [10]. В вакуолях листьев V. faba ее концентрация достигала 6 мкМ/мг белка [8]. В вакуолях корнеплодов столовой свеклы в нашем исследовании концентрация аскорбиновой кислоты соответствовала 5 мкМ/мг белка.
В листьях Hordeum vulgare содержание восстановленной формы АК в вакуолях могло достигать 15–26% от общего содержания в клетке. В этом же исследовании доля восстановленной формы АК в хлоропластах соответствовала 8–16% [25]. В другой работе концентрация АК в хлоропластах листьев Spinacia oleracea составляла 50% от общего содержания [26]. Лейкопласты корнеплодов столовой свеклы, согласно результатам настоящего исследования, напротив, содержали мало АК (0.3-0.4 мкМ/мг белка).
В нормальных условиях концентрация АК в компартментах клетки намного превосходит концентрацию ДAК. Количество ДАК, как правило, составляет 10% от AКсум. Однако концентрация ДАК может существенно увеличиваться вследствие усиления окислительных процессов или замедления метаболических процессов [1, 4, 27]. Результаты нашего исследования показали, что вакуоли и лейкопласты покоящихся корнеплодов столовой свеклы содержали довольно много ДАК. Величины соотношений AК/ДАК у лейкопластов (1.2 и 1.9) корнеплодов столовой свеклы были заметно ниже величин этого соотношения у хлоропластов P. sativum (3.9–4.2) [6]. Вероятно, у разных растительных объектов большое значение имели фазы развития и функции пластид. В отличие от растений P. sativum, корнеплоды свеклы находились в фазе физиологического покоя, для которой характерна относительно низкая интенсивность жизнедеятельности, а их пластиды были представлены лейкопластами, функция которых существенно отличалась от функции хлоропластов.
Таким образом, накопление ДАК в клетках корнеплодов можно объяснить физиологическим покоем. Возможно, в фазу покоя снижалась активность дегидроаскорбатредуктаз цитозоля и замедлялось восстановление ДАК [4, 27]. Согласно современным представлениям, ДАК транспортируется из апопласта и центральной вакуоли в цитозоль, в котором происходит ее восстановление [1, 4, 25]. Целесообразность накопления ДАК в клетках корнеплода объясняли некоторые факты из литературы, которые указывали на специфическую роль аскорбиновой кислоты в росте и развитии растения. Например, АК необходима для деления клеток [27]. Если содержание АК низкое, то пролиферация клеток снижается [10]. А для быстро делящихся клеток характерно низкое внутриклеточное содержание ДАК и высокое редокс-соотношение АК/АКсум [27]. В связи с этим можно предположить, что низкое редокс-соотношение АК/АКсум у клеток корнеплодов столовой свеклы в период физиологического покоя – один из механизмов ингибирования ростовых процессов.
Направленность окислительно-восстановительных процессов в системе АК ↔ ДАК во многом зависит от активности ферментов, окисляющих AК (АО, аскорбатпероксидазы), а также ферментов, восстанавливающих МДА и ДАК (монодегидроаскорбатредуктазы и дегидроаскорбатредуктазы) [2]. Как уже отмечалось выше, все формы аскорбиновой кислоты (АК, ДАК, МДА), а также указанные аскорбат-зависимые ферменты объединены в систему аскорбиновой кислоты [1]. Некоторые элементы этой системы были выявлены в вакуолях [1, 10]. Сопоставление известных фактов и собственных результатов позволило предположить, что аккумулируемая вакуолями АК могла служить субстратом для вакуолярной АО.
Следует отметить, что сведений об АО, специфичной только для растений и грибов, не так много, как можно было бы ожидать. Этот фермент из семейства мультимедных оксидаз (из группы “голубых оксидаз”) катализирует четырехэлектронное восстановление О2 [4, 28]. Примечательно, что АК – не единственный субстрат для АО, донорами восстановительных эквивалентов могли быть полифенолы и ароматические полиамины [4].
Основная биологическая функция АО, несмотря на многолетние исследования, до сих пор не установлена. Согласно одним данным, активность AO была связана с ростом растяжением [27]. Механизм, посредством которого фермент влиял на растяжение клетки, мог быть опосредован АК, поскольку AO приписывали роль регулятора содержания AК [27]. Согласно другим данным, основная функция АО заключалась в управлении концентрациями кислорода [4, 5, 10, 27]. Некоторые факты указывали на то, что основная функция АО связана с катализом внутриклеточного синтеза воды при гиперосмотическом стрессе [4, 29]. Эта функция предполагает локализацию АО в клеточных структурах, которым необходима защита от гиперосмотического повреждения. Однако фермент выявлен, главным образом, в цитозоле и апопластном пространстве [4, 10]. Только единичные факты указывали на локализацию в хлоропластах [29], пероксисомах, Аппарате Гольджи и вакуолях [10]. Если на сегодняшний день AO из клеточных стенок и цитозоля относительно хорошо охарактеризованы [27], то АО других клеточных структур практически не изучены. Очевидно, что сравнение биохимических и физиологических характеристик ферментов разной локализации могло быть полезным для определения главной роли АО в растительном организме.
Рассматривая основные биохимические характеристики АО растений, следует отметить важное свойство АО, которое заключается в сохранении каталитической активности в довольно широком диапазоне pH 4.0–9.0 [16, 20]. Оптимумы pH для АО были обусловлены природой окисляемого субстрата, поэтому варьировали в широких пределах (от pH 4.0 до pH 8.0) [20, 23]. Для реакций окисления АК оптимальными, как правило, были слабокислые условия. Например, с АК в качестве субстрата, активность АО из плодов C. melo была высокой при pH 4.5–6.3, а из плодов C. maxima – при pH 5.5–7.0 [30]. В то же время для изоформы АО из хлоропластов Chaetomorpha linum были показаны оптимумы pH, которые изменялись в пределах pH 5.8–7.8 [29]. В нашем исследовании АО-активность, которую определяли с помощью спектрофотометрического метода, используя АК в качестве субстрата, была также относительно высокой в довольно широком диапазоне pH 6.0–9.0. Результаты ингибиторного анализа позволили предположить некоторый вклад в АО-активность фенольной пероксидазы в условиях с pH 9.0. В то же время у лейкопластов весомый вклад в АО-активность, особенно при pH 6.0, по всей видимости, вносила ПФО. Ранее мы установили, что для ПФО лейкопластов корнеплодов столовой свеклы оптимальными были слабокислые условия [18]. Если для АО вакуолей и тканевого экстракта pH 6.0 можно было рассматривать как оптимальный pH, то для АО пластид определить оптимальный pH не представлялось возможным из-за высокой активности ПФО в слабокислых условиях. В случае с пластидами нам удалось установить pH, при котором активность АО оставалась относительно высокой, по сравнению с активностью ПФО – это pH 8.0 и 9.0. В целом, относительно высокая активность АО клеток корнеплодов столовой свеклы в широком диапазоне pH говорила о возможном эффективном функционировании фермента как в кислых условиях вакуолярного содержимого (pH 5.5–6.9), так и в нейтральных условиях стромы пластид (pH 7.3).
Аскорбатоксидаза имеет довольно сложную структуру. Активный фермент представлен димерным или тетрамерным белком, гликопротеином с молекулярной массой мономера: 64 кДа (C. maxima); 68 кДа (Cucumis melo, Cucumis sativus); 72 кДа (Cucurbita pepa) [28]. Аминокислотная последовательность субъединиц АО из разных растений высоко консервативна (до 80% идентичности). Кроме того, они обладали сигнальной последовательностью, типичной для секретируемых белков [28]. В связи с этим, фермент мог транспортироваться во внеклеточное пространство и центральную вакуоль. Так, в работе Liso с соавт. [10], иммунные метки, ассоциированные с АО, были видны как в апопластном пространстве листьев C. maxima, так и в вакуолях, а также в Аппарате Гольджи.
Обычно АО была представлена несколькими изоформами, количество которых варьировало в зависимости от вида растения. У C. melo были выявлены шесть изоформ АО, [16, 28], у C. sativus – три, у N. tabacum – одна изоформа [27]. Однако изоформ могло быть намного больше. Например, у C. maxima АО была представлена четырнадцатью изоформами. Изоформы АО, чаще всего, были анионными белками с pI 5.1–6.6. У некоторых объектов обнаруживали катионную изоформу с pI 8.0–8.3 [24]. В нашем исследовании активность АО выявлена в ПААГ с анионными белками (у всех анализируемых образцов). Зона со специфичной для АО активностью располагалась близко к зонам маркерных белков с молекулярной массой 116 и 205 кДа (рис. 4а). Следует отметить, что метод CN-PAGE с последующей визуализацией активности в геле позволял определить, главным образом, активность фермента, но довольно приблизительно позволял оценить количество его изоформ и их молекулярную массу.
В некоторых более ранних работах методы CN-PAGE или ИЭФ с последующей визуализацией активности в пластинах геля применялись как основные подходы для определения изоферментного состава АО [16, 28]. Количество изоформ при таком способе определения могло быть довольно большим. Наш опыт показал, что изоформы ПФО и ПО, сохраняющие активность при определенных условиях, способны демонстрировать так называемую АО-активность. В связи с этим их можно принять за изоформы АО. Очевидно, что для более точного определения количества изоформ АО необходимо использовать разные подходы, а также тщательно подбирать буферные системы и оптимальные pH.
В заключение следует отметить, что полученные результаты продемонстрировали наличие аскорбиновой кислоты и аскорбатоксидазы в вакуолях клеток корнеплодов столовой свеклы в период физиологического покоя. Вакуоли характеризовались более высоким содержанием АК и ДАК, а также относительно высокой активностью АО по сравнению с лейкопластами. Наличие АК, ДАК и АО свидетельствовало о функционировании системы аскорбиновой кислоты в вакуолярном компартменте растительной клетки.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Davey M.W., Van Montagu M., Inze D., Sanmartin M., Kanellis A., Smirnoff N., Benzie I.J.J., Strain J.J., Favell D., Fletcher J. Plant l-ascorbic acid: chemistry, function, metabolism, bioavailability and effects of processing // J. Sci. Food Agric. 2000. V. 80. P. 825. https://doi.org/10.1002/(SICI)1097-0010(20000515)80:7<825::AID-JSFA598>3.0.CO;2-6
Чупахина Г.Н. Система аскорбиновой кислоты растений.Калининград: Калинингр. ун-т, 1997. 120 с.
Zechmann B. Subcellular distribution of ascorbate in plants // Plant Signal. Behav. 2011. V. 6. P. 360. https://doi.org/10.4161/psb.6.3.14342
Akram N.A., Shafiq F., Ashraf M. Ascorbic acid – a potential oxidant scavenger and its role in plant development and abiotic stress tolerance // Front. Plant Sci. 2017. V. 8. P. 613. https://doi.org/10.3389/fpls.2017.00613
Arrigoni O., De Tullio M.C. The role of ascorbic acid in cell metabolism: between gene-directed functions and unpredictable chemical reactions // J. Plant Physiol. 2000. V.157. P. 481. https://doi.org/10.1016/S0176-1617(00)80102-9
Palma J.M., Jiménez A., Sandalio L.M., Corpas F.J., Lundqvist M., Gómez M., Sevilla F., del Río L.A. Antioxidative enzymes from chloroplasts, mitochondria, and peroxisomes during leaf senescence of nodulated pea plants // J Exp Botany. 2006. V. 57. P. 1747. https://doi.org/10.1093/jxb/erj191
Grob K.J., Matile P. Capillary GC of glucosinolate-derived horseradish constituents // Phytochemistry. 1980. V. 19. P. 1789. https://doi.org/10.1016/S0031-9422(00)83814-5
Takahama U. Hydrogen peroxide scavenging systems in vacuoles of mesophyll cells of Vicia faba // Phytochemistry. 1992. V. 31. P. 1127. https://doi.org/10.1016/0031-9422(92)80246-B
Jaquinod M., Villiers F., Kieffer-Jaquinod S., Hugouvieux V., Bruley C., Garin J., Bourguignon J. A proteomics dissection of Arabidopsis thaliana vacuoles isolated from cell culture // Mol. Cell Proteomics. 2007. V. 6. P. 394. https://doi.org/10.1074/mcp.M600250-MCP200
Liso R., De Tullio M.C., Ciraci S., Balestrini R., La Rocca N., Bruno L., Chiappetta A., Bitonti M.B., Bonfante P., Arrigoni O. Localization of ascorbic acid, ascorbic acid oxidase, and glutathione in roots of Cucurbita maxima L. // J. Exp. Bot. 2004. V. 55. P. 2589. https://doi.org/10.1093/jxb/erh262
Кузеванов В.Я., Катков Б.Б., Саляев Р.К. Общие принципы выделения вакуолей и вакуолярных мембран // Структура и функции биологических мембран растений / Под ред. Саляева Р.К., Войникова В.К. Новосибирск: Наука, 1985. С. 93. http://bogard.isu.ru/articles/1985/vacuoles_general_principles_1985.pdf
Gaal O., Medgyesi G.A., Vereczke L. Electrophoresis in the separation of biological macromolecules. New York: Wiley. 1980. 422 p. https://doi.org/10.3109/08923978009026414
Boyle S.A., Hemmingsen S.M., Dennis D.T. Uptake and processing of the precursor to the small subunit of ribulose 1.5-bisphosphate carboxylase by leucoplasts from the endosperm of developing castor oil seeds // Plant Physiol. 1986. V. 81. P. 817. https://doi.org/10.1104/pp.81.3.817
Alos E., Rodrigo M.J., Zacarias L. Transcriptomic analysis of genes involved in the biosynthesis, recycling and degradation of L-ascorbic acid in pepper fruits (Capsicum annuum L.) // Plant Science. 2013. V. 207. P. 2. https://doi.org/10.1016/j.plantsci.2013.02.007
Caregnato F.F., Bortolin R.C., Divan J.A.M., Moreira C.F. Exposure to elevated ozone levels differentially affects the antioxidant capacity and the redox homeostasis of two subtropical Phaseolus vulgaris L. varieties // Chemosphere. 2013. V. 93. P. 320. https://doi.org/10.1016/j.chemosphere.2013.04.084
Moser O., Kanellis A.K. Ascorbate oxidase of Cucumis melo L. var. reticulatus: purification, characterization and antibody production // J. Exp. Botany. 1994. V. 45. P. 717. https://doi.org/10.1093/jxb/45.6.717
Manchenko G.P. Handbook of detection of enzymes on electrophoretic gels.Second Edition. Boca Raton (Florida): CRC Press. 2002. 568 p.
Прадедова Е.В., Нимаева О.Д., Трухан И.С., Саляев Р.К. Тирозиназная и супероксиддисмутазная активность пероксидазы вакуолей клеток корнеплодов столовой свеклы // Физиология растений. 2014. Т. 61. С. 77. https://doi.org/10.7868/s0015330313060109
Suzuki T., Honda Y., Mukasa Y., Kim S.J. Characterization of peroxidase in buckwheat seed // Phytochemistry. 2006. V. 67. P. 219. https://doi.org/10.1016/j.phytochem.2005.11.014
Gerwin B., Burstein S.R., Westley J. Ascorbate Oxidase. Inhibition, activation, and pH effects // J. Biol. Chem. 1974. V. 249. P. 2005.
Kim Y.J., Uyama H. Tyrosinase inhibitors from natural and synthetic sources: structure, inhibition mechanism and perspective for the future // Cell. Mol. Life Sci. 2005. V. 62. P. 1707. https://doi.org/10.1007/s00018-005-5054-y
Murata K., Sugihara M., Nakamura N., Ohno H. Ascorbate oxidase-catalyzed electrochemical reduction of dioxygen using 2,6-dichloroindophenol as an electron-transfer mediator // Chem. Lett. 2006. V. 35. P. 1232. https://doi.org/10.1246/cl.2006.1232
Sugino M., Kajita S., Banno K., Shirai T., Yamane T., Kato M., Kobayashi T., Tsukagoshi N. Upward shift of the pH optimum of Acremonium ascorbate oxidase // Biochim. Biophys. Acta. 2002. V. 1596. P. 36. https://doi.org/10.1016/S0167-4838(01)00310-7
Sekiya J., Hamade R., Kimura O., Mizuno K., Shimose N. Purification and properties of ascorbate oxidase from cucumber fruit // Soil Sci. Plant Nutr. 1990. V. 36. P. 1. https://doi.org/10.1080/00380768.1990.10415704
Rautenkranz A.A.F., Li L., Machler F., Martinoia E., Oertli J.J. Transport of ascorbic and dehydroascorbic acid across protoplasts and vacuole membranes isolated from barley (Hordeum vulgare L. cv. Gerbel) leaves // Plant Physiol. 1994. V. 106. P. 187. https://doi.org/10.1104/pp.106.1.187
Luwe M.W.F., Takahama U., Heber U. Role of ascorbate in detoxifying ozone in the apoplast of spinach (Spinacia oleracea L) leaves // Plant Physiol. 1993. V. 101. P. 969. https://doi.org/10.1104/pp.101.3.969
Pignocchi C., Fletcher J.M., Wilkinson J. E., Barnes J. D., Foyer C.H. The function of ascorbate oxidase in tobacco // Plant Physiol. 2003. V. 132. P.1631. https://doi.org/10.1104/pp.103.022798
Al-Madhoun A.S., Sanmartin M., Kanellis A.K. Expression of ascorbate oxidase isoenzymes in cucurbits and during development and ripening of melon fruit // Postharvest Biol. Tec. 2003. V. 27. P. 137. https://doi.org/10.1016/S0925-5214(02)00090-X
Caputo E., Ceglie V., Lippolis M., La Rocca N., De Tullio M.C. Identification of a NaCl-induced ascorbate oxidase activity in Chaetomorpha linum suggests a novel mechanism of adaptation to increased salinity // Environ. Exp. Bot. 2010. V. 69. P. 63. https://doi.org/10.1016/j.envexpbot.2010.02.008
Carvalho J. L.B., Lima C.J., Medeiros P.H. Ascorbateoxidase from Cucurbita maxima // Phytochemistry. 1981. V. 20. P. 2423. https://doi.org/10.1016/S0031-9422(00)82680-1
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений