Физиология растений, 2021, T. 68, № 4, стр. 421-429
Влияние мелатонина и салициловой кислоты на генерацию АФК митохондриями семядолей люпина
П. А. Буцанец a, Н. А. Шугаева a, А. Г. Шугаев a, *
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: ag-shugaev@ifr.moscow
Поступила в редакцию 10.08.2020
После доработки 15.10.2020
Принята к публикации 23.10.2020
Аннотация
Исследовали влияние мелатонина и салициловой кислоты (СК) на дыхание и генерацию АФК (перекиси водорода) при окислении сукцината митохондриями, изолированными из семядолей 5-дневных этиолированных проростков люпина (Lupinus angustifolius L.). Показано, что в широком диапазоне концентраций (10–7–10–4 М) мелатонин не оказывал заметного влияния на скорость окисления сукцината в различных метаболических состояниях и величину дыхательного контроля, но в зависимости от концентрации, существенно (до 60% от контроля) ингибировал образование АФК митохондриями, основной вклад в которое вносил комплекс II (сукцинатдегидрогеназа). Присутствие в среде инкубации 0.05–0.5 мМ СК активировало (в 1.5–2.5 раза) образование перекиси водорода при окислении сукцината. При этом СК в низких концентрациях оказывала преимущественно разобщающее (активирующее) действие на окисление сукцината в состоянии 4 (в отсутствие АДФ), а при увеличении ее концентрации наблюдалось ингибирование дыхания в состоянии 3 (в присутствии АДФ). В целом, полученные результаты демонстрируют способность мелатонина и СК оказывать прямое регуляторное действие на генерацию АФК митохондриями, обеспечивая защиту органелл от окислительного стресса, а также способствуя их участию в формировании ответной реакции растений на неблагоприятные условия окружающей среды.
ВВЕДЕНИЕ
Высокая пластичность митохондрий растений, т.е. способность к кардинальным изменениям многих параметров своей структурной организации и функциональной активности в зависимости от изменения внутренних и внешних условий жизнедеятельности растительного организма, хорошо известна [1–3]. В последнее время накапливается все больше доказательств того, что подобная изменчивость митохондрий играет важную роль в адаптации растений к неблагоприятным факторам (НФ) окружающей среды [4, 5]. При этом актуальной задачей становится исследование механизмов регуляции дыхания и редокс-состояния митохондрий в условиях стресса, а также возможного участия в этом процессе фитогормонов и сигнальных молекул.
Известно, что митохондрии являются одним из центров образования АФК в клетках растений и одновременно одной из наиболее уязвимых мишеней окислительного стресса. В низких концентрациях АФК, прежде всего перекись водорода, выходя из митохондрий, играют важную физиологическую роль в клеточном сигналинге. Однако, при действии НФ (засухи, засоления, экстремальных температур и т.д.) уровень АФК в клетках растений значительно повышается, что может привести к развитию окислительного стресса, следствием чего является повреждение мембран и нарушение нормального функционирования митохондрий [3–5]. Показано, что действие различных НФ вызывает, как правило, неспецифичную защитную реакцию митохондрий, направленную на преодоление избыточной генерации АФК: индукцию процессов свободного окисления (альтернативной оксидазы) и разобщения в ЭТЦ (разобщающих белков), активацию АФК-гасящих ферментов, а также повышение уровня молекулярных антиоксидантов [1, 4, 6, 7].
Среди последних особое внимание в настоящее время уделяется мелатонину, нейрогормону животных, который выполняет важную регуляторную роль практически во всех живых организмах, включая растения [8, 9]. Постулируется, что мелатонин может синтезироваться в митохондриях животных и растений, а также транспортироваться в эти органеллы извне и накапливаться в них в достаточно высоких концентрациях [10, 11]. На клетках животных и на изолированных митохондриях показано, что мелатонин, выполняя антиоксидантную функцию, способен нейтрализовать практически все АФК, включая перекись водорода, и, таким образом, защищать клетки и митохондрии от окислительного стресса при патологических состояниях и старении организма [11, 12]. В многочисленных исследованиях было показано, что обработка мелатонином способствовала повышению стресс-устойчивости растений благодаря, в частности, его антиоксидантным свойствам [13]. Вместе с тем влияние мелатонина на метаболическую активность митохондрий растений, включая генерацию АФК, остается практически неизученным.
Среди стрессовых фитогормонов важное регуляторное влияние на метаболическую активность митохондрий растений при действии НФ, включая генерацию АФК, по-видимому, оказывает салициловая кислота (СК) [14]. Известно, что СК, являясь сигнальной молекулой, играет ключевую роль в формировании защитных реакций растений на действие различных биотических и абиотических стресс-факторов [15]. При этом в литературе накапливаются данные, свидетельствующие о том, что митохондрии, а именно образующиеся в них АФК, могут быть вовлечены в передачу сигнала СК при формировании ответной адаптивной реакции растений [16, 17]. В этом процессе могут быть задействованы переносчики электронов дыхательной цепи (комплексы II и III), на АФК-генерирующую активность которых СК оказывает прямое действие [14, 16, 17]. Однако, количество работ, посвященных этому вопросу, остается ограниченным, а представленные в них результаты, в частности по влиянию СК на дыхание и образование АФК митохондриями растений, достаточно противоречивы.
Целью данной работы было изучение влияния мелатонина и СК на дыхательную активность и генерацию АФК (перекиси водорода) митохондриями семядолей люпина.
МАТЕРИАЛЫ И МЕТОДЫ
Объект исследования. Объектом исследований служили митохондрии, выделенные из семядолей проростков люпина узколистного (Lupinus angustifolius L., сорт “Дикаф”). Проростки люпина выращивали в течение 5 дней на воде в термостате при 24°С в темноте.
Выделение митохондрий осуществляли согласно методике дифференциального центрифугирования, описанной ранее [18], с модификациями. Семядоли люпина промывали дистиллированной водой, высушивали, охлаждали и измельчали в ступке со средой гомогенизации (в соотношении 1 : 4), содержащей 0.5 М сахарозу, 50 мМ MOPS-буфер (рН 8.0), 10 мМ ЭДТА, 5 мМ дитиотрейтол и 0.1% БСА, свободный от ЖК. Гомогенат отфильтровывали через 4 слоя мираклоса и центрифугировали при 4000 g в течение 5 мин. Полученный супернатант центрифугировали при 15 000 g в течение 5 мин, осадок митохондрий ресуспендировали в среде отмывания, содержащей 0.4 М сахарозу, 50 мМ МОРS-буфер (рН 7.2), 5 мМ ЭДТА, 0.1% БСА свободный от ЖК и центрифугировали при 4000 g в течение 5 мин. Для осаждения митохондрий супернатант центрифугировали при 13 000 g в течение 10 мин. Выделенные митохондрии ресуспендировали в малом объеме среды, содержащей 0.3 М сахарозу, 20 мМ Hepes-Трис-буфер (рН 7.2) и 0.1% БСА, свободный от ЖК. Суспензию митохондрий хранили на льду. Все операции проводили в холодной комнате при 2–4°С.
Поглощение кислорода митохондриями измеряли на полярографическом приборе Oxytherm Electrode Control Unit (“Hansatech Instruments”, Англия). Инкубационная среда (1 мл) при 25°С содержала 0.3 М сахарозу, 20 мМ Hepes-Трис-буфер (рН 7.2), 5 мМ калий-фосфатный буфер (рН 7.2), 0.1% БСА, 5 мМ MgCl2, 5 мМ сукцинат, 5 мМ глутамат (необходимый для удаления оксалоацетата) и 0.5 – 0.6 мг белка митохондрий. Остальные добавки и условия экспериментов приведены в подписях к таблицам и рисункам. Скорость поглощения кислорода митохондриями в состоянии 3 и 4, величину коэффициента дыхательного контроля (ДК) рассчитывали по методу [19]. Количество митохондриального белка определяли по методу Lowry с соавт. [20], используя БСА в качестве стандарта.
Образование перекиси водорода в митохондриях тестировали с использованием 2,7-дихлородигидрофлуоресцеин диацетата (DCFDA) по методу Degli-Esposti [21] в модификации Belt et al. [17]. Митохондрии (0.5 мг/мл) инкубировали в среде (1 мл), содержащей 0.3 М сахарозу, 20 мМ Hepes-Трис-буфер (рН 7.2), 1 мМ МgСl2, 0.1% БСА, 5 мМ сукцинат, 5 мМ глутамат, 1 мкМ DCFDA, 1 Е/мл НР. Флуоресценцию дихлорофлуоресцеина (DCF) регистрировали на спектрофлуориметре Hitachi-850 (“Hitachi”, Япония), длина волны возбуждения – 480 нм, регистрации – 520 нм и рассчитывали скорость образования перекиси в относительных единицах. Для выявления неспецифического действия СК на флуоресценцию DCF в контрольных опытах измерения проводили в отсутствие субстрата дыхания. При этом скорость образования перекиси водорода митохондриями определяли разностью опытных и контрольных значений флуоресценции индикатора [17].
В работе использованы соли (MgCl2, КН2РО4 и другие) отечественного производства (о. с. ч. или х. ч.), а также дыхательные субстраты, нуклеотиды, ингибиторы, БСА, MOPS, DCFDA, СК, мелатонин и другие реактивы производства фирмы “Sigma” (США).
Все опыты и серии опытов были выполнены минимум в трех биологических и трех аналитических повторностях. На рисунках представлены данные характерных опытов, в таблицах и графиках представлены средние значения и их стандартные отклонения. В некоторых случаях средние значения сравнивали по t-критерию Стьюдента (P < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние мелатонина на дыхание и генерацию перекиси водорода митохондриями при окислении сукцината
Митохондрии, изолированные из семядолей 5-дневных этиолированных проростков люпина узколистного, при инкубации в стандартной сахарозной реакционной среде характеризовались высокой скоростью окисления дыхательных субстратов, в частности сукцината, которая существенно стимулировалась добавкой АДФ (состояние 3) и тормозилась после его исчерпания в процессе синтеза АТФ (состояние 4) (табл. 1). При этом величина ДК по Чансу (состояние 3/состояние 4) составляла около 3, что свидетельствовало о прочном сопряжении процессов окисления и фосфорилирования и высокой интактности внутренней мембраны органелл. В предварительных опытах нами было показано, что присутствие в среде инкубации 100 мкМ мелатонина не оказывало существенного влияния на скорость окисления сукцината митохондриями растений в разных метаболических состояниях, а также на величину ДК [22]. В данной работе мы изучили действие мелатонина на дыхание митохондрий семядолей люпина в широком диапазоне концентраций (10–500 мкМ). Было подтверждено, что в используемых нами условиях мелатонин даже в очень высоких и, очевидно, нефизиологических концентрациях (100–500 мкМ) не вызывал статистически достоверных изменений в скорости окисления сукцината, а также в величине коэффициента ДК (табл. 1). Аналогичные результаты были получены нами при изучении действия мелатонина на окисление митохондриями люпина других дыхательных субстратов ЦТК, в частности малата (данные не приведены). Интересно, что указанные высокие концентрации мелатонина существенно ингибировали окисление малата в состоянии 3 в митохондриях печени мыши, но увеличивали активность отдельных комплексов ЭТЦ (особенно комплексов I и IV) в опытах, проведенных на субмитохондриальных частицах, полученных из этих органелл [23]. Возможно, что подобные различия в действии гормона обусловлены различными условиями проведения экспериментов и/или более низкой проницаемостью внутренней мембраны митохондрий растений для экзогенного мелатонина.
Таблица 1.
Влияние мелатонина на скорость окисления сукцината в разных метаболических состояниях и величину дыхательного контроля (ДК) в митохондриях семядолей люпина
| Вариант | Состояние 3 (V3) | Состояние 4 (V4) | ДК (V3/V4) |
|---|---|---|---|
| Контроль | 226 ± 17 | 69 ± 5 | 3.3 ± 0.05 |
| 10 мкМ мелатонин | 231 ± 15 | 68 ± 4 | 3.4 ± 0.1 |
| 100 мкМ мелатонин | 211 ± 13 | 67 ± 6 | 3.2 ± 0.06 |
| 500 мкМ мелатонин | 234 ± 16 | 71 ± 8 | 3.3 ± 0.09 |
Примечание: состав среды инкубации приведен в разделе Материалы и методы. Дополнительные добавки: 10, 100 или 500 мкМ мелатонина, 100 мкМ АДФ, суспензия митохондрий (0.6–0.7 мг белка/мл). V3 – скорость окисления субстрата в присутствии АДФ (cостояние 3), V4 – скорость окисления субстрата после исчерпания АДФ (cостояние 4). Скорости окисления сукцината выражены в нг-атом О2/(мин мг белка).
Поскольку митохондрии являются одним из центров образования АФК в клетках растений и одновременно одной из наиболее уязвимых мишеней окислительного стресса, представляет интерес изучение механизмов, регулирующих образование и поддержание баланса АФК в этих органеллах, а также возможное участие в этом процессе фитогормонов.
На рис. 1 показано влияние мелатонина на образование перекиси водорода интактными митохондриями семядолей люпина при окислении сукцината, которое тестировали, используя индикатор DCFDA. Известно, что DCFDA способен проникать в митохондрии (где происходит его деацетилирование) и реагировать, помимо перекиси, с другими формами АФК и некоторыми активными формами азота [21, 24]. Однако, в работах, выполненных с использованием этого индикатора, в том числе на митохондриях растений, часто указывают на определение именно уровня перекиси водорода, поскольку другие виды АФК, в частности супероксидный радикал, являются нестабильными [17, 21]. Следует также отметить, что, хотя этот индикатор удобен в работе и вплоть до настоящего времени широко применяется при определении уровня АФК в митохондриях и тканях растений и животных, его использование имеет ряд ограничений, требует наличия дополнительных контролей, а также осторожности в трактовке полученных результатов [17, 24].
Рис. 1.
Влияние мелатонина на продукцию перекиси водорода при окислении сукцината митохондриями (МтХ) семядолей люпина. Cостав среды инкубации приведен в разделе Материалы и методы; дополнительно вносили 1–500 мкМ мелатонина. а – динамика образования Н2О2 митохондриями при окислении сукцината (кривая 1, контроль) и влияние на нее: 5 мМ аскорбиновой кислоты (кривая 2), 100 мкМ мелатонина (кривая 3) и отсутствия в среде инкубации дыхательного субстрата (кривая 4). Поглощение кислорода митохондриями семядолей люпина при окислении сукцината (кривая 5). б – дозозависимое ингибирование мелатонином образования Н2О2 митохондриями люпина при окислении сукцината. * – достоверные различия по сравнению с контролем (уровень значимости P < 0.05).
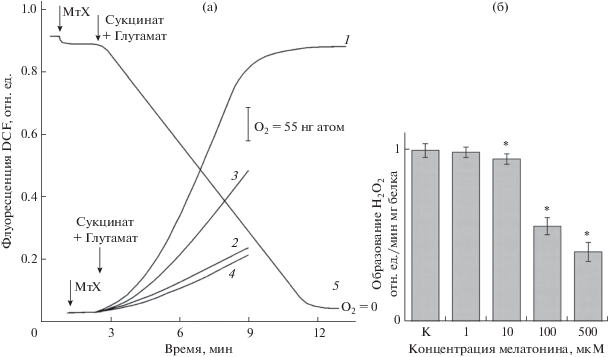
Как показано на рис. 1а, кривая 1, интенсивность образования АФК (перекиси водорода) при окислении сукцината в митохондриях семядолей люпина, измеренная с помощью DCFDA, носит нелинейный характер. Вначале наблюдалось постепенное увеличение сигнала, что связано, по-видимому, с проникновением индикатора в митохондрии, его деацетилированием и окислением до DCF. Затем в течение нескольких минут генерация АФК митохондриями происходила с примерно одинаковой скоростью, а затем следовало ее резкое ингибирование. Начало торможения образования перекиси водорода митохондриями по времени коррелировало с существенным (до 30–35% от исходного) падением уровня кислорода в кювете, в процессе окисления сукцината, что проверялось нами в параллельных опытах в аналогичных условиях с помощью кислородного электрода (рис. 1а, кривая 5). Учитывая это, в дальнейшем мы оценивали влияние мелатонина именно на линейную скорость образования перекиси водорода митохондриями при окислении сукцината, когда уровень кислорода в кювете был не ниже 50% от исходного. Как показано на рис. 1а, кривая 3, добавка в среду инкубации 100 мкМ мелатонина заметно ингибировала продукцию Н2О2 митохондриями семядолей проростков люпина. Антиоксидантное действие мелатонина подтверждалось аналогичным влиянием на генерацию Н2О2 аскорбиновой кислоты (рис. 1а, кривая 2). Наличие слабого неспецифического сигнала DCF при отсутствии дыхательного субстрата в среде свидетельствовало о зависимости генерации АФК митохондриями от работы ЭТЦ (рис. 1а, кривая 4). Таким образом, достоверность результатов, полученных нами с использованием DCFDA, подтверждается проведением контрольных экспериментов, показавших строгую зависимость скорости генерации АФК (перекиси водорода) митохондриями от активности дыхательной цепи, уровня кислорода в среде инкубации и присутствия в ней известных антиоксидантов.
Результаты аналогичных опытов по влиянию различных концентраций мелатонина на образование Н2О2 митохондриями семядолей люпина при окислении сукцината приведены на рис. 1б. Видно, что присутствие мелатонина в среде инкубации заметно снижало скорость образования перекиси водорода митохондриями (до 45–50% ингибирования в присутствии 100 мкМ мелатонина) и зависело от концентрации гормона, начиная с 10 мкМ. Это подтверждают данные, полученные нами ранее с использованием другого флуоресцентного индикатора (Amplex Red) [22], а также согласуется с результатами аналогичных исследований, проведенных на митохондриях животных [11, 12].
Известно, что окисление субстратов ЦТК в митохондриях животных и растений сопровождается образованием АФК в трех комплексах ЭТЦ (I, II и III) [1, 17]. C использованием известных ингибиторов дыхания, оптимальные концентрации которых были подобраны нами в предварительных опытах, мы попытались определить основной сайт дыхательной цепи, который ответственен за генерацию АФК при окислении сукцината с участием СДГ (сукцинатдегидрогеназа) комплекса II в митохондриях семядолей люпина. Это представляло дополнительный интерес, учитывая имеющиеся литературные данные о том, что мелатонин в микромолярных концентрациях, по-видимому, способен проявлять также прооксидантные свойства, стимулируя образование АФК в комплексе III (убихинон-цитохром с редуктаза) митохондрий животных (клетки почек), которое было чувствительно к антимицину А [25]. В наших опытах было показано, что, во-первых, образование АФК в митохондриях семядолей люпина при окислении сукцината не тормозилось ротеноном, классическим ингибитором комплекса I (NADH-убихинон оксидоредуктазы), что свидетельствовало об отсутствии его вовлеченности в генерацию АФК посредством обратного транспорта электронов (ОТЭ). Во-вторых, добавка в среду инкубации митохондрий антимицина А, ингибирующего перенос электронов в комплексе III, связываясь с убихиноном в точке Qi (ближе к внутренней стороне мембраны) заметно увеличивала скорость образования АФК, что прямо указывало на участие этого комплекса в генерации АФК, по крайней мере, в присутствии ингибитора (рис. 2, кривая 1) [26]. Наконец, добавка в среду инкубации митохондрий стигмателлина, ингибитора комплекса III в точке Qo (ближе к внешней стороне мембраны), не тормозила образование АФК при окислении сукцината и, кроме того, предотвращала ее активацию антимицином А (рис. 2, кривая 2). На основании полученных результатов, а также высокой чувствительности продукции АФК при окислении сукцината к ингибитору СДГ малонату (85–95% подавления), можно заключить, что в митохондриях семядолей люпина основной вклад в этот процесс вносит комплекс II (сукцинат-убихинон редуктаза). Далее, учитывая результаты предыдущих опытов, мы попытались выяснить, насколько сильное влияние на антиоксидантные свойства мелатонина оказывала возможная активация этим гормоном продукции АФК в комплексе III при окислении сукцината? Судя по данным, представленным на рис. 2б, это влияние было незначительным, поскольку уровень ингибирования мелатонином (100 мкМ) образования АФК при окислении сукцината в митохондриях семядолей люпина практически не зависел от присутствия в среде инкубации стигмателлина, блокирующего перенос электронов в этом комплексе.
Рис. 2.
Действие ингибиторов дыхания на образование Н2О2 при окислении сукцината митохондриями люпина и на уровень ее торможения мелатонином. Cостав среды инкубации приведен в разделе Материалы и методы. а – изменение флуоресценции DCF при окислении сукцината в присутствии ингибиторов ЭТЦ, где указано дополнительно вносили: 20 мкМ ротенон (R), 5 мкМ антимицин А (АА) (кривая 1), а также 7 мкМ стигмателлин (S), 5 мкМ АА (кривая 2). б – влияние стигмателлина (7 мкМ) на уровень ингибирования мелатонином (100 мкМ) образования Н2О2 при окислении сукцината. Варианты опытов: 1 – митохондрии в присутствии сукцината (контроль), 2 – митохондрии в присутствии сукцината и мелатонина, 3 – митохондрии в присутствии сукцината, мелатонина и стигмателлина * – достоверные различия по сравнению с контролем (уровень значимости P < 0.05).
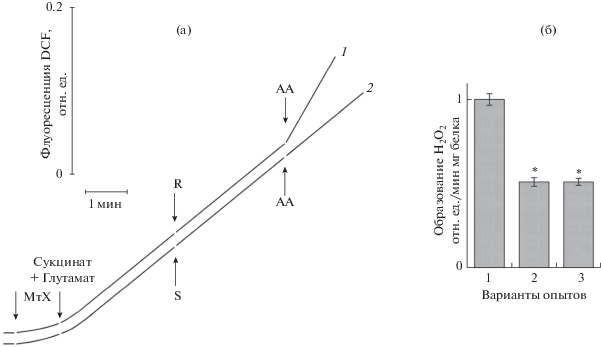
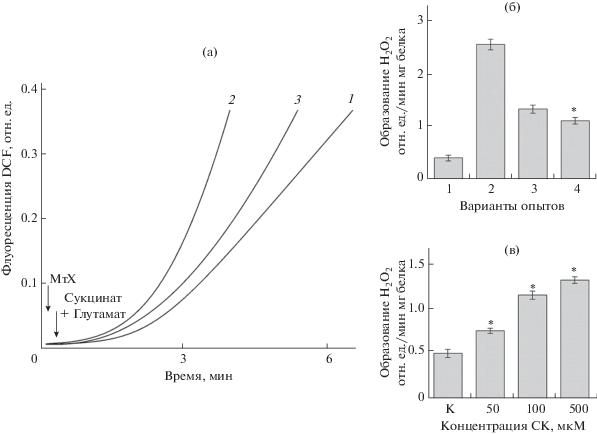
Рис. 3.
Влияние СК на генерацию Н2О2 митохондриями семядолей люпина при окислении сукцината. Состав среды инкубации как для рисунка 1, дополнительно вносили 50–500 мкМ СК. а – изменение флуоресценции DCF в присутствии: сукцината (кривая 1, контроль), сукцината и 100 мМ СК (кривая 2), 100 мкМ СК, но в отсутствие субстрата (кривая 3); б – определение влияния СК на образование перекиси водорода с учетом неспецифического действия гормона. Варианты опытов: 1 – митохондрии в присутствии сукцината (контроль), 2 – митохондрии в присутствии сукцината и СК, 3 – митохондрии в отсутствие субстрата, но в присутствии СК, 4 – выявление реальной стимуляции СК образования АФК митохондриями люпина, как разницы между флуореcценцией DCF в вариантах 2 и 3; в – влияние различных концентраций СК на образование Н2О2 в митохондриях семядолей при окислении сукцината. * – достоверные различия по сравнению с контролем (уровень значимости P < 0.05).
Влияние СК на дыхание и генерацию АФК митохондриями семядолей люпина
Ранее показано, в том числе и в наших исследованиях, что СК способна оказывать прямое действие на процесс окислительного фосфорилирования, разобщая и ингибируя дыхание митохондрий в зависимости от ее концентрации, продолжительности воздействия, а также чувствительности к фитогормону органелл, выделенных из различных растительных объектов [14, 18, 27, 28]. Результаты опытов по изучению влияния различных концентраций СК на окисление сукцината в присутствии глутамата в митохондриях семядолей L. angustifolius приведены в табл. 2. Видно, что в более низкой концентрации СК незначительно разобщала дыхание митохондрий, что проявлялось, в первую очередь, в увеличении скорости окисления субстрата в состоянии 4, в отсутствие АДФ. Однако, это разобщение было неполным, поскольку скорость разобщенного дыхания была существенно ниже скорости поглощения кислорода митохондриями в состоянии 3. Разобщающее действие СК сопровождалось также снижением величины ДК, т.е. частичным ослаблением прочности сопряжения процессов окисления и фосфорилирования и снижением эффективности работы дыхательной цепи (табл. 2). Следует также отметить, что при увеличении концентрации СК (500 мкМ) наблюдалось уже заметное ингибирование окисления сукцината в состоянии 3 и резкое снижение ДК (табл. 2).
Таблица 2.
Влияние салициловой кислоты на скорость окисления сукцината в разных метаболических состояниях и величину ДК в митохондриях семядолей люпина
| Вариант | Состояние 3 (V3) | Состояние 4 (V4) | ДК (V3/V4) |
|---|---|---|---|
| Контроль | 220 ± 14 | 68 ± 13 | 3.2 ± 0.06 |
| 100 мкМ СК | 216 ± 23 | 85 ± 18* | 2.5 ± 0.03* |
| 500 мкМ СК | 179 ± 22 | 94 ± 16* | 1.9 ± 0.05* |
Примечание: состав среды инкубации, как для таблицы 1. Дополнительно вносили 100 или 500 мкМ СК. Скорости окисления субстрата выражены в нг-атом О2/(мин мг белка). * – достоверные различия по сравнению с контролем (уровень значимости P < 0.05).
С использованием трансгенных растений арабидопсиса было обнаружено, что митохондрии, будучи одной из мишеней регуляторного действия СК, играют важную роль в процессе формирования стресс-устойчивости растений [14, 16, 17]. При этом были получены доказательства участия СК в митохондриальном сигналинге, основанном на существенной активации под влиянием гормона образования перекиси водорода органеллами при окислении сукцината, катализируемого комплексом II ЭТЦ (СДГ) [17]. С использованием аналогичного методического подхода мы исследовали влияние СК на образование перекиси водорода при окислении сукцината митохондриями семядолей люпина. Было показано, что присутствие в среде инкубации митохондрий 100 мкМ СК, действительно, вызывало очень значительное увеличение сигнала DCF (рис. 3а, кривая 2) по сравнению с контролем (рис. 3а, кривая 1), что свидетельствовало о гормональной стимуляции скорости образования перекиси водорода митохондриями L. angustifolius при окислении сукцината. Аналогичные результаты были получены китайскими учеными на митохондриях листьев A. thaliana [16]. Однако оказалось, что добавка СК в среду инкубации митохондрий в отсутствие сукцината также заметно увеличивала флуоресценцию индикатора (рис. 3а, кривая 3). Этот негативный контроль показывает существенное увеличение базового сигнала DCF в присутствии СК, очевидно, не связанного с генерацией АФК в дыхательной цепи митохондрий. Полученные нами результаты согласуются с данными австралийских исследователей, которые на митохондриях A. thaliana показали, что только разница между интенсивностью сигнала DCF в отсутствие и в присутствии дыхательного субстрата выявляет реальную активацию скорости образования Н2О2 дыхательной цепью под влиянием СК [17]. Но даже с учетом этого, СК существенно, примерно в 2.0–2.5 раза, усиливала образование Н2О2 митохондриями семядолей люпина при окислении сукцината (рис. 3б). При этом увеличение концентрации СК (500 мкМ) в инкубационной среде выявило дополнительную (на 15–20%) активацию образования АФК митохондриями семядолей (рис. 3в).
Таким образом, нами впервые было проведено сравнительное исследование влияния СК и мелатонина на дыхание и генерацию АФК митохондриями растений. Полученные результаты показали, что фитогормоны способны оказывать противоположно-направленное и дозо-зависимое действие на интенсивность процесса образования АФК митохондриями семядолей люпина в широком диапазоне, от его кратной активации до значительного ингибирования. При этом, регуляторное действие двух гормонов на генерацию АФК митохондриями может осуществляться различными путями. Так, мелатонин, не оказывая в используемых нами условиях существенного влияния на скорость окисления сукцината в различных метаболических состояниях (табл. 1), проявляет антиоксидантную функцию, по всей вероятности, путем гашения (инактивации) различных АФК, генерируемых дыхательной цепью. В этой связи следует отметить, что, судя по литературным данным, протекторное действие мелатонина и его производных на митохондрии оказалось сопоставимо или даже превосходило защитную АФК-гасящую активность других природных и синтетических антиоксидантов [11–13]. Кроме того, имеются сведения о влиянии мелатонина на активность ряда ключевых антиоксидантных ферментов митохондрий животных, включая CОД и глутатионпероксидазу [11]. Показано также, что мелатонин может увеличивать активность и экспрессию генов некоторых разобщающих белков митохондрий, которые являются важным механизмом, снижающим уровень АФК в этих органеллах [12].
Механизмы регуляторного влияния СК на скорость образования АФК митохондриями растений, по-видимому, не менее разнообразны. В этом процессе могут быть задействованы: АФК-генерирующие переносчики дыхательной цепи (комплексы II и III) [16, 17], гексокиназа, локализованная на внешней мембране органелл [27], и, по-видимому, некоторые антиоксидантные ферменты митохондрий [14], на активность которых СК оказывает прямое действие. Например, было показано, что СК в низких физиологических концентрациях (10–50 мкМ) активировала перенос электронов в комплексе II, на уровне сукцинат-убихинон редуктазы. При этом существенно возрастала скорость образования супероксида при окислении сукцината, который в дальнейшем трансформировался в Н2О2 с участием СОД в матриксе митохондрий [17]. Кроме того, регуляция активности альтернативной оксидазы митохондрий растений, препятствующей избыточному образованию АФК в дыхательной цепи, особенно в неблагоприятных условиях внешней среды, также осуществляется с участием СК посредством ее влияния на экспрессию генов, кодирующих этот фермент [1, 4–6]. Очевидно, что наличие такого уникального для растений механизма гормональной регуляции уровня АФК и редокс-гомеостаза митохондрий должно иметь важное значение для функционирования как самих органелл, так и клетки в целом. Конечно, это не отрицает важности других известных путей регуляторного воздействия СК и мелатонина на активность немитохондриальных АФК-генерирующих систем и антиоксидантных ферментов в ходе ответной реакции растений на неблагоприятные условия среды [10, 14].
Следует также отметить, что полученные в данной работе результаты подтверждают высказанное нами ранее предположение о том, что причиной (или одной из причин) повышения протонной проницаемости внутренней мембраны митохондрий семядолей люпина и диссипации мембранного потенциала под влиянием экзогенной СК является окислительный стресс, индуцирующий открытие АФК-зависимой поры (РТР) [29]. Способность СК индуцировать пермеабилизацию внутренней мембраны вследствие открытия РТР в условиях окислительного стресса была показана на митохондриях печени крысы [30]. Кроме того, на митохондриях животных была неоднократно продемонстрирована протекторная роль антиоксидантов, в том числе мелатонина, препятствующая индукции РТР [11, 12]. Проведение аналогичных опытов на митохондриях растений представляет интерес, и полученные при продолжении этих исследований результаты, несомненно, помогут выявить множественность механизмов регуляторного воздействия стрессовых фитогормонов на метаболическую активность митохондрий, что будет способствовать лучшему пониманию роли этих органелл в процессах формирования устойчивости растений к неблагоприятным факторам внешней среды.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Грабельных О.И., Боровик О.А., Таусон Е.Л., Побежимова Т.П., Катышев А.И., Павловская Н.С., Королева Н.А., Любушкина И.В., Башмаков В.Ю., Попов В.Н., Боровский Г.Б., Войников В.К. Митохондриальные энергорассеивающие системы (альтернативная оксидаза, разобщающие белки и “внешняя” NADH-дегидрогенеза) вовлечены в развитие морозоустойчивости проростков озимой пшеницы // Биохимия. 2014. Т. 79. С. 645.
Logan D.C. The mitochondrial compartment // J. Exp. Bot. 2006. V. 57. P. 1225. https://doi.org/10/1093/jxb/eri151
Jacoby R.P., Li L., Huang S.B., Lee C., Millar A.H., Taylor N.L. Mitochondrial composition, function and stress response in plants // J. Integr. Plant Biol. 2012. V. 54. P. 887. https://doi.org/10.1111/j.1744-7909.2012.01177.x
Atkin O.K., Macherel D. The crucial role of plant mitochondria in orchestrating drought tolerance // Ann. Bot. 2009. V. 103. P. 581. https://doi.org/10.1093/aob/mcn094
Liberatore K.L., Dukowic-Schulze S., Miller M.E., Chen C., Kianian S.F. The role of mitochondria in plant development and stress tolerance // Free Radical Biology and Medicine. 2016. V. 100. P. 238. https://doi.org/10.1016/j.freeradbiomed.2016.03.033
van Aken O., Giraud E., Clifton R., Whelan J. Alternative oxidase: a target and regulator of stress responses // Physiol. Plant. 2009. V. 137. P. 354. https://doi.org/10.1111/j.1399-3054.2009.01240.x
Apel K., Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction // Annu. Rev. Plant Biol. 2004. V. 55. P. 373. https://doi.org/10.1146/annurev.arplant.55.031903.141701
Hardeland R. Melatonin in plants – diversity of levels and multiplicity of functions // Front. Plant Sci. 2016. V. 7. Article 198. https://doi.org/10.3389/fpls.2016.00198
Debnath B., Islam W., Li M., Sun Y., Lu X., Mitra S., Hussain M., Liu S., Qiu D. Melatonin mediates enhancement of stress tolerance in plants // Int. J. Plant Sci. 2019. V. 20 P. 1040. https://doi.org/10.3390/ijms20051040
Wang L., Feng C., Zheng X., Guo T., Zhou F., Shan D., Liu X., Kong J. Plant mitochondria synthesize melatonin and enhance the tolerance of plants to drought stress // J. Pineal. Res. 2017. V. 63. e12429. https://doi.org/10.1111/jpi.12429
Reiter R.J., Tan D.X., Rosales-Corral S., Galano A., Zhou X.J., Xu B. Mitochondria: central organelles for melatonin’s antioxidant and anti-aging actions // Molecules. 2018. V. 23. E509. https://doi.org/10.3390/molecules23020509
Tan D.-X., Reiter R.J. Mitochondria: The birth place, battle ground and the site of melatonin metabolism in cells // Melatonin Res. 2019. V. 2. P. 44. https://doi.org/10/32794/mr11250011
Fan J., Xie Y., Zhang Z., Chen L. Melatonin: A multifunctional factor in plants. // Int. J. Mol. Sci. 2018. V. 19. P. 1528. https://doi.org/10.3390/ijms1905128
Poore P. Effect of salicylic acid on the metabolism of mitochondrial reactive oxygen species in plants // Biomolecules. 2020. V. 10. P. 341. https://doi.org/10.3390/biom10020341
Vlot A.C., Dempsey D.A., Klessig D.F. // Salicylic acid, a multifaceted hormone to combat disease // Annu. Rev. Phytopatol. 2009. V. 47. P. 177. https://doi.org/10.1146/annurev.phyto.050908.135202
Nie S., Yue H., Zhou J., Xing D. Mitochondria-derived reactive oxygen species play a vital role in the salicylic acid signaling pathway in Arabidopsis thaliana // PLoS One. 2015. 10: e0119853. https://doi.org/10.1371/journal.pone.0119853
Belt K., Huang S., Thatcher L.F., Casarotto H., Singh K.B., Van Aken O., Millar A.H. Salicylic acid-dependent plant stress signaling via mitochondrial succinate dehydrogenase. // Plant Physiol. 2017. V. 173. P. 2029. https://doi.org/10.1104/pp.1600060
Шугаев А.Г., Буцанец П.А., Андреев И.М., Шугаева Н.А. Влияние салициловой кислоты на метаболическую активность митохондрий растений // Физиология растений. 2014. Т. 61. С. 555. https://doi.org/10.7868/S0015330314040186
Chance B., Williams G.R. The respiratory chain and oxidative phosphorylation // Adv. Enzymol. 1956. V. 17. P. 65.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Degli-Esposti M. Measuring mitochondrial reactive oxygen species. // Methods. 2002. V. 26. P. 335.
Буцанец П.А., Баик А.С., Шугаев А.Г., Кузнецов Вл.В. Мелатонин ингибирует продукцию перекиси водорода митохондриями растений // Доклады Академии наук. 2019. Т. 489. С. 205. https://doi.org/10.31857/S0869-56524892205-208
Lopez A., Garcia J.A., Escames G., Venegas C., Ortiz F., Lopez L.C., Acuna-Castroviejo D. Melatonin protects the mitochondria from oxidative damage reducing oxygen consumption, membrane potential, and superoxide anion production // J. Pineal. Res. 2009. V. 46. P. 188. https://doi.org/j.1600-079X.2008.000647.x
Kalyanaraman B., Darley-Usmar V., Davies K.J.A., Dennery P.A., Forman H.J., Grisham M., Mann G.E., Moore K., Roberts L.J., Ischiropoulos H. Measurements reactive oxygen and nitrogen species with fluorescent probes: challenges and limitations // Free Rad. Biol. Med. 2012. V. 52. P. 1. https://doi.org/10.1016/j.freeradbiomed.2011.09.030
Zhang H.-M., Zhang Y., Zang B.-X. The role of mitochondrial complex III in melatonin-induced ROS production in cultured mesangial cell // J. Pineal Res. 2011. V. 50. P. 78. https://doi.org/10.1111/j.1600-079X.2010.00815.x
Drose S., Bleier L., Brandt U. A common mechanism links differently acting complex II inhibitors to cardioprotection. Modulation of mitochondrial reactive oxygen species production // Mol. Pharmacol. 2011. V. 79. P. 814.
Poore P., Patyi G., Szekeres A., Bodi N., Bagyanszki M. Tari I. Salicylic acid-induced ROS production by mitochondrial electron transport chain depends on the activity of mitochondrial hexokinases in tomato (Solanum lycopersicum L.) // J. Plant Res. 2019. V. 132. P. 273. https://doi.org/10.1007/S10265-019-01085-y
Norman C., Howell K.A., Millar A.H., Whelan J.M., Day D.A. Salicylic acid is an uncoupler and inhibitor of mitochondrial electron transport // Plant Physiol. 2004. V. 134. P. 492. https://doi.org/10.1104/pp.103.031039
Шугаев А.Г., Буцанец П.А., Шугаева Н.А. Салициловая кислота индуцирует протонную проницаемость внутренней мембраны митохондрий семядолей люпина // Физиология растений. 2016. Т. 63. С. 765. https://doi.org/10.7868/S0015330316060099
Battaglia V., Salvi M., Toninello A. Oxidative stress is responsible for mitochondrial permeability induction by salicylate in liver mitochondria // J. Biol. Chem. 2005. V. 280. P. 33864. https://doi.org/10.1074/jbcM502391200
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


