Физиология растений, 2021, T. 68, № 4, стр. 430-438
Уровень перекисного окисления липидов, содержание пероксида водорода и активность супероксиддисмутазы в листьях факультативного CAM-растения Hylotelephium triphyllum (Haw.) Holub и C3-растения Plantago media L. в природных условиях
Е. В. Силина a, *, Г. Н. Табаленкова a, Т. К. Головко a
a Институт биологии Коми научного центра Уральского отделения
Российской академии наук
Сыктывкар, Россия
* E-mail: silina@ib.komisc.ru
Поступила в редакцию 18.09.2020
После доработки 02.11.2020
Принята к публикации 03.11.2020
Аннотация
Исследовали ключевые показатели про-/антиоксидантного состояния листьев подорожника среднего Plantago media L. (C3-вид) и очитника трехлистного Hylotelephium triphyllum (Haw.) Holub (факультативный CAM-вид), произрастающих в несомкнутом ценозе пойменного луга в подзоне средней тайги Республики Коми (европейский Северо-Восток России). В период генеративного развития содержание продуктов перекисного окисления липидов в листьях H. triphyllum составляло в среднем 400 нМ/г сухой массы, что в 1.2 раза больше, чем в листьях P. media. Содержание пероксида водорода (Н2О2) в листьях H. triphyllum достигало 90 мкМ/г сухой массы, тогда как у P. media не превышало 25 мкМ/г сухой массы. Уровень активности супероксиддисмутазы (SOD) в листьях H. triphyllum варьировал в пределах 50–80 ед/мг белка и был в 2–3 раза выше, чем в листьях P. media. Обработка листьев H. triphyllum индуктором окислительного стресса – метилвиологеном (10 мкМ) – повышала уровень активности SOD в 1.6 раз, но не повлияла существенно на содержание Н2О2 и накопление продуктов липопероксидации. Таким образом, листья H. triphyllum характеризовались более высоким про-/антиоксидантным статусом, чем листья обитающего в тех же условиях C3-растения P. media, что связано с функционированием CAM-фотосинтеза. О переходе H. triphyllum на САМ в период генеративного развития указывают выявленные нами ранее закономерные суточные изменения кислотности клеточного сока, содержания малата и активности ФЕП-карбоксилазы. Полученные данные согласуются с представлениями о том, что повышенный про-/антиоксидантный статус является общей характеристикой метаболизма CAM-растений, а стабильно высокое содержание Н2О2 может свидетельствовать об участии в регуляции CAM.
ВВЕДЕНИЕ
Активные формы кислорода (АФК) образуются в процессе метаболизма растений и выполняют важные функции, участвуют в сигналинге, модулируют процессы жизнедеятельности, являются компонентами адаптивных реакций [1, 2]. Неблагоприятное воздействие факторов окружающей среды является основной причиной избыточного образования АФК, что может привести к окислительному повреждению важнейших биомолекул – белков, ДНК, липидов, торможению ростовых процессов и снижению продуктивности растений [2]. Поэтому поддержание окислительно-восстановительного баланса является важным условием сохранения структурно-функциональной целостности растительных клеток и тканей. Устойчивость растительных организмов к окислительному стрессу во многом зависит от состояния системы детоксикации АФК, включающей антиоксидантные ферменты и низкомолекулярные антиоксиданты. Однако функция антиоксидантной системы растений состоит не в полном устранении АФК, а в достижении надлежащего баланса между их производством и удалением, совместимого с процессами фотосинтеза и в то же время позволяющего эффективно передавать окислительно-восстановительные сигналы в ядро [3].
Эффективность и направленность работы антиоксидантной системы растений зависит от таксономического положения и фазы развития, а также типа, силы и продолжительности воздействия стресс-фактора [4–6]. Несмотря на множество исследований, функционирование про-/антиоксидантного метаболизма растений в природных условиях изучено слабо, а количество модельных видов весьма ограничено. Большой интерес в этом отношении представляют растения, отличающиеся по типу фотосинтетического метаболизма углерода и особенно растения, способные индуцировать переход с C3 на CAM при стрессовых воздействиях [7]. Следует отметить, что CAM (Сrassulaceae Acid Metabolism) осуществляют преимущественно виды растений, обитающие в условиях, где экологические факторы (дефицит влаги, засоление, избыточная инсоляция, высокие температуры и др.) способствуют повышению генерации АФК.
Изучение видов с разным типом фотосинтетического метаболизма углерода показало, что листья CAM-растений накапливали в 2 раза больше Н2О2, чем листья C3- и C4-растений, которые не отличались существенно по этому показателю [4]. Некоторые авторы считают пероксид водорода ключевым метаболитом, участвующим в регуляции перехода с C3 на CAM тип фотосинтеза [8, 9].
Очитник трехлистный (Hylotelephium triphyllum (Haw.) Holub) является одним из немногочисленных видов природной флоры таежной зоны, способных к индукции CAM-фотосинтеза. О переходе с C3 на CAM свидетельствуют закономерные изменения кислотности клеточного сока, содержания малата и активности ФЕП-карбоксилазы. Нами установлено, что с началом генеративного развития в листьях H. triphyllum существенно повышалась кислотность клеточного сока, увеличивалось содержание малата, возрастал уровень активности ФЕП-карбоксилазы [10]. Наиболее выраженные суточные флуктуации этих показателей отмечали в фазу цветения, которая приходится на наиболее теплый период вегетации (июль). В этот период титруемая кислотность клеточного сока листьев очитника в утренние часы достигала 100 нмоль[H+]/г сырой массы и снижалась к полудню в 4–5 раз, тогда как в фазу вегетативного роста (май) величина данного показателя варьировала в течение суток в пределах 10–12 нмоль[H+]/г сырой массы. Суточные изменения кислотности коррелировали с содержанием малата. Уровень активности ФЕП-карбоксилазы повышался в 1.5 раза на фоне снижения пула органических кислот. Переход H. triphyllum на CAM в период генеративного развития способствует сохранению фотосинтетического аппарата и реализации репродуктивного потенциала растений, обитающих на легко теряющих влагу песчано-супесчаных почвах в условиях гумидного климата таежной зоны европейского Северо-Востока.
Цель работы – провести сравнительное изучение ключевых показателей про-/антиоксидантного статуса листьев Hylotelephium triphyllum и Plantago media и выявить особенности окислительного метаболизма C3- и CAM-растений, обитающих в сходных природных условиях подзоны средней тайги европейского Северо-Востока России.
МАТЕРИАЛЫ И МЕТОДЫ
Очитник трехлистный (Hylotelephium triphyllum (Haw.) Holub) – многолетнее травянистое растение сем. Crassulaceae. Побеги монокарпические, плотно облиственные, неразветвленные; листья уплощенные, продолговато-яйцевидной формы с толстой кутикулой. Размножается семенами, частями стеблей и корневища. Вид обычен в лесной зоне. На территории Республики Коми встречается в пойме, на склонах, вырубках, бечевниках. Произрастает на глинистой, песчаной и супесчаной почве, известняках, сланцевых обнажениях и скалах. Суккулентные черты и способность осуществлять C3-CAM переход отражают адаптацию этих растений к недостатку влаги [11].
Подорожник средний (Plantago media L.) – многолетнее травянистое растение сем. Plantaginaceae. Стебель прямостоячий, чаще восходящий. Листья широколанцетные или эллиптические, плоские, с 7 – 9 жилками, острые, опушенные. Размножается семенами и вегетативным путем. Бореальный евроазиатский вид. На территории Республики Коми встречается на пойменных лугах, по обочинам дорог, в разреженных лесах, бывает пионером на отмелях и обнажениях известняка. Типичный C3-вид. Как и все виды рода, P. media проявляет высокую морфофизиологическую пластичность, способность формировать фенотипы, адаптированные к обитанию в разных экотопах [12].
Полевые исследования проведены в июне–августе 2017 и 2018 гг. в подзоне средней тайги Республики Коми (европейский Северо-Восток России). В работе использовали растения, произрастающие на слабо покрытом растительностью участке с дерново-слоистой песчано-супесчаной, хорошо дренируемой почвой в прирусловой части поймы левого берега р. Вымь (62°16′19.4′′ N 50°39′29.1′′ E). Участок расположен вблизи Лесоэкологического стационара Института биологии Коми НЦ УрО РАН.
Климат района умеренно континентальный. Средняя температура самого теплого месяца июля около +16°C, самого холодного месяца января −16°C. Средняя суточная температура воздуха выше 10°C наблюдается 90 дней в году. Среднегодовое количество осадков составляет 700 мм, половина приходится на вегетационный период (май–август) [13]. В целом, погодные условия в годы проведения исследований соответствовали среднемноголетним значениям регионального климата, но в отдельные периоды вегетации наблюдались отклонения в ту или иную сторону (табл. 1).
Таблица 1.
Погодные условия в районе проведения исследований
| Показатель | 2017 | 2018 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| июнь | июль | август | июнь | июль | август | |||||||||||
| Средняя за декаду температура воздуха, °С | I | II | III | I | II | III | I | II | I | II | III | I | II | III | I | II |
| 10.1 | 13.8 | 12.1 | 16.1 | 20.4 | 18.1 | 14.6 | 16.6 | 6.6 | 12.9 | 20.2 | 17.9 | 20 | 19.2 | 15.2 | 14.5 | |
| Отклонение от нормы, °С | –2 | 0 | –3 | 0 | 4 | 2 | 0 | 3 | –5 | –1 | 5 | 2 | 4 | 3 | 0 | 2 |
| Максимальная температура за декаду, °С | 20 | 27 | 21 | 25 | 30 | 27 | 24 | 24 | 14 | 26 | 32 | 27 | 27 | 30 | 27 | 25 |
| Сумма осадков за декаду, мм | 25 | 43 | 41 | 2 | 25 | 10 | 49 | 31 | 30 | 19 | 16 | 50 | 35 | 13 | 21 | 8 |
| В процентах к норме, % | 115 | 195 | 177 | 10 | 107 | 40 | 211 | 130 | 10 | 86 | 70 | 217 | 150 | 54 | 91 | 37 |
Примечание: в таблице представлены данные с сайта www.rp5.ru. I, II, III – декады, синоптический индекс метеостанции 237707.
Микроклиматические условия (освещенность, температура и влажность воздуха) в местах обитания растений регистрировали во время отбора образцов с помощью портативной метеостанции LI-1400 (“LI-COR”, США) с набором датчиков. Определения показали, что в ясный солнечный день освещенность на уровне растений достигала 1400−1600 мкмоль квантов/м2 с, а интенсивность УФ (А + Б)-радиации – 15 Вт/м2. Относительная влажность воздуха варьировала в пределах от 30 до 80%. Температура поверхности листьев в полуденные часы превышала температуру воздуха в среднем на 2−3°С.
Для характеристики ключевых показателей состояния про-/антиоксидантной системы исследуемых растений использовали функционально зрелые листья. Образцы (по одному листу с 25−30 растений) отбирали в период генеративного развития растений (июнь−август) ранним утром (6 ч), днем (11−16 ч) и поздним вечером (21−22 ч). Высечки (1−1.5 см) средней части листовой пластинки массой около 500 мг помещали в сосуд с жидким азотом, транспортировали в лабораторию и хранили до проведения анализов при температуре −70°С. Содержание сухого вещества определяли в образцах, высушенных до постоянной массы при 105°C.
Активность перекисного окисления липидов оценивали по содержанию в листьях продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) [14]. Растительный материал гомогенизировали в 0.1 М Трис-HCl буфере, pH 7.6, содержащем 0.35 М NaCl. В гомогенат добавляли 0.5% ТБК в 20% трихлоруксусной кислоте. Пробы помещали в нагретую до 95–100°С водяную баню на 30 мин. Затем охлаждали и центрифугировали 10 мин при 10 000g. Оптическую плотность супернатанта измеряли при длине волны 532 и 600 нм. Здесь и далее использовали двухлучевой спектрофотометр Shimadzu UV-1700 (“Shimadzu”, Япония). Количество ТБК-РП рассчитывали с учетом коэффициента экстинкции (ε = 155 мМ–1 см–1) после вычитания неспецифического поглощения при 600 нм.
Содержание пероксида водорода (Н2О2) определяли с использованием ксиленолового оранжевого [15]. Образец растирали в жидком азоте, добавляя 4 мл дистиллированной воды. Гомогенат центрифугировали 15 мин при 12 000 g. Супернатант и реагент смешивали в соотношении 1 : 1. Состав реагента: 0.5 мМ Fe(NH4)(SO4)2·6H2O (соль Мора), 0.5% (v/v) H2SO4, 200 мкМ ксиленолового оранжевого (“Sigma”) и 200 мМ сорбитола. Смесь инкубировали 40 мин при комнатной температуре. Затем центрифугировали в течение 5 мин при 10 000 g. Оптическую плотность раствора измеряли при 560 нм. Содержание Н2О2 определяли по калибровочным зависимостям. Проверку на специфичность проводили по ингибированию образования Н2О2 при добавлении каталазы (активность 500 ед/мг белка, производитель “Sigma”).
Активность супероксиддисмутазы (SOD) определяли по ее способности подавлять фотохимическое восстановление нитросинего тетразолия (НСТ) [16]. Реакционную смесь готовили на 0.1 М Na-фосфатном буфере, рН 7.8. В состав реакционной среды входили: L-метионин 39 мкМ, НСТ 0.245 мкМ, Тритон Х-100 1% раствор и Na-ЭДТА 0.3 мкМ (все реактивы производства “Sigma”). К пробе добавляли 0.1 мл супернатанта, к контролю вместо супернатанта добавляли 0.1 мл Na-фосфатного буфера. Для запуска ферментативной реакции вносили водный раствор рибофлавина (117 мкМ). После смешивания содержимое проб освещали в течение 10 мин при 40 клк. Пробирка с белком, находившаяся в темноте, служила контрольной пробой. Оптическую плотность измеряли при 560 нм. Активность SOD выражали в ед/мг белка.
Содержание растворимого белка анализировали по методу Brаdford [17], используя в качестве стандарта бычий сывороточный альбумин.
Для индукции окислительного стресса в листьях H. triphyllum использовали метилвиологен (паракват). Отделенные листья экспонировали в растворе метилвиологена (10 мкМ) в течение 12 ч в темноте, затем выставляли на 2 ч на умеренный свет (интенсивность ФАР 600 мкмоль квантов/м2 с). Контрольные листья помещали в воду, остальные манипуляции проводили, как и с опытными листьями. После завершения эксперимента образцы листьев фиксировали в жидком азоте.
Все анализы проводили в 3–5-кратной биологической и 2–3-кратной аналитической повторности. Для сравнения средних величин применяли дисперсионный анализ ANOVA (критерий Дункана). Расчеты осуществляли при заданном уровне значимости P ≤ 0.05. На рисунках и в таблицах представлены средние арифметические значения и их стандартные ошибки.
РЕЗУЛЬТАТЫ
Интенсивность перекисного окисления липидов принято рассматривать как один из показателей уровня окислительного стресса. Мы оценивали активность липопероксидации по накоплению в листьях продуктов, реагирующих с тиобарбитуровой кислотой.
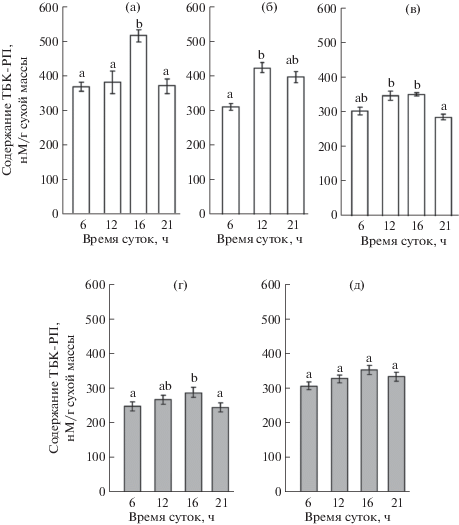
В период генеративного развития содержание ТБК-РП в листьях H. triphyllum варьировало в зависимости от времени суток и сроков определения от 300 до 500 нМ/г сухой массы (рис. 1). В полуденное и послеполуденное время количество ТБК-РП в листьях было в среднем на 15–25% больше, чем рано утром или поздно вечером. Суточная динамика изменения содержания ТБК-РП в листьях P. media не отличалась существенно от таковой в листьях H. triphyllum. Однако уровень накопления продуктов липопероксидации был заметно ниже. Максимальные значения содержания ТБК-РП немногим превышали 350 нМ/г сухой массы, а основная часть данных варьировала в пределах 230–280 нМ/г сухой массы.
Рис. 1.
Содержание продуктов липопероксидации (ТБК-РП) в листьях Hylotelephium triphyllum (а–в) и Plantago media (г, д) в период генеративного развития растений: а – начало бутонизации (20–21 июня 2017 г.), б – массовое цветение (19–20 июля 2017 г.), в – массовое цветение/начало плодоношения (30 июля–1 августа 2018 г.), г – бутонизация/начало цветения (2–3 июля 2018 г.), д – массовое цветение/начало плодоношения (1–2 августа 2018 г.). Разные латинские буквы над столбцами обозначают статистически значимые суточные изменения величины исследуемого показателя при P ≤ 0.05.
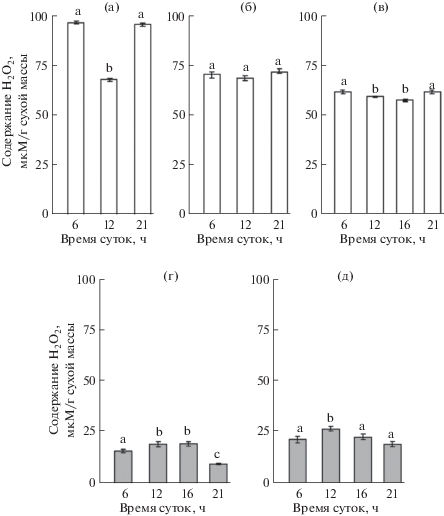
Листья H. triphyllum характеризовались сравнительно высоким накоплением пероксида водорода. Содержание Н2О2 в них варьировало в зависимости от времени суток и сроков определения в пределах 70–90 мкМ/г сухой массы (рис. 2). В суточной динамике проявлялась тенденция снижения концентрации Н2О2 в дневные часы. Содержание Н2О2 в листьях P. media не превышало 25 мкМ/г сухой массы, что в 3–4 раза меньше, чем в листьях H. triphyllum. В отличие от H. triphyllum, концентрация Н2О2 в листьях P. media повышалась в дневные часы, достигая максимальных значений к полудню, затем снижалась.
Рис. 2.
Содержание пероксида водорода в листьях Hylotelephium triphyllum (а–в) и Plantago media (г, д) в период генеративного развития растений: а – массовое цветение (19–20 июля 2017 г.), б – начало бутонизации (2–3 июля 2018 г.), в – массовое цветение/начало плодоношения (30 июля–1 августа 2018 г.), г – бутонизация/начало цветения (2–3 июля 2018 г.), д – массовое цветение/начало плодоношения (1–2 августа 2018 г.). Разные латинские буквы над столбцами обозначают статистически значимые суточные изменения величины исследуемого показателя при P ≤ 0.05.
Уровень активности супероксиддисмутазы в листьях P. media варьировал в зависимости от времени суток и сроков определения в пределах от 18 до 28 ед/мг белка (рис. 3). Активность SOD повышалась днем в среднем на 25% и достигала максимальных значений в полуденные и послеполуденные часы. Следует отметить, что активность SOD в листьях P. media в конце июля – начале августа была несколько выше, чем в начале июля.
Рис. 3.
Активность супероксиддисмутазы в листьях Hylotelephium triphyllum (а–г) и Plantago media (д, е) в период генеративного развития растений: а – начало бутонизации (20–21 июня 2017 г.), б – массовое цветение (19–20 июля 2017 г.), в – начало бутонизации (2–3 июля 2018 г.), г – массовое цветение/начало плодоношения (30 июля–1 августа 2018 г.), д – бутонизация/начало цветения (2–3 июля 2018 г.), е – массовое цветение/начало плодоношения (1–2 августа 2018 г.). Разные латинские буквы над столбцами обозначают статистически значимые суточные изменения величины исследуемого показателя при P ≤ 0.05.
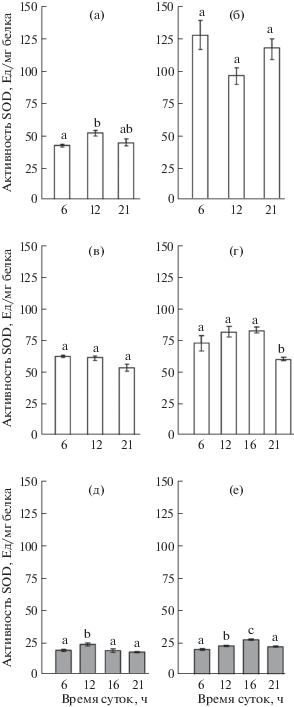
По сравнению с P. media уровень активности SOD в листьях H. triphyllum был существенно выше, от 40 до 90 ед/мг белка (рис. 3). В начале июля (фаза бутонизации – начало цветения) активность SOD составляла в среднем 50 ед/мг белка, к концу июля – началу августа (фаза массового цветения – начала плодоношения) повышалась в 1.4 – 2.2 раза. Уровень активности SOD в течение суток либо достоверно не изменялся, либо снижался к ночи.
Для тестирования реакции про-/антиоксидантного метаболизма H. triphyllum на усиление окислительного стресса свежесобранные листья обрабатывали метилвиологеном. Воздействие метилвиологеном (10мкМ) в течение 12 ч в темноте с последующей 3 ч экспозицией на свету не оказало влияния на содержание Н2О2 в листьях (табл. 2). Обработанные листья накапливали меньше (в 1.2 раза) продуктов липопероксидации, чем контрольные. При этом уровень активности SOD в них был в 1.6 раза больше.
Таблица 2.
Влияние метилвиологена (10 мкМ) на содержание пероксида водорода (Н2О2), продуктов липопероксидации (ТБК-РП) и активность супероксиддисмутазы (SOD) в листьях Hylotelephium triphyllum
| Показатель | Вариант | |
|---|---|---|
| Контроль | Опыт | |
| Н2О2, мкМ/ сухой массы | 134.0 ± 0.2a | 130.1 ± 0.1 a |
| ТБК-РП, нМ/г сухой массы | 336.0 ± 7.9 a | 277.2 ± 13.9b |
| SOD, Ед/мг белка | 61.8 ± 12.9 a | 102.2 ± 8.4 b |
Таким образом, нами установлено, что в период генеративного развития растений листья факультативного CAM-вида H. triphyllum характеризовались более высоким про-/антиоксидантным статусом, чем листья обитающего в тех же условиях C3-вида P. media.
ОБСУЖДЕНИЕ
Листья относятся к органам, характеризующимся наиболее высокой активностью энерго-пластического обмена. В клетках мезофилла функционируют основные источники генерации АФК – хлоропластные и митохондриальные ЭТЦ [1, 2]. Усиление образования АФК в условиях, когда не вся поглощенная энергия может быть использована при фотосинтезе, ведет к нарушению про-/антиоксидантного баланса и интенсификации окислительных процессов в тканях [3]. Хорошими индикаторами про-/антиоксидантного статуса растений, на наш взгляд, могут служить ключевые показатели про-/антиоксидантного метаболизма: накопление продуктов перекисного окисления липидов, содержание Н2О2 (наиболее стабильная форма АФК) и уровень активности основного фермента актиоксидантной защиты – супероксиддисмутазы. Уникальность SOD состоит в том, что этот фермент контролирует концентрацию ${\text{O}}_{2}^{{\centerdot - }}$ и Н2О2.
Нами установлено, что в период генеративного развития листья факультативного CAM- растения H. triphyllum характеризовались более высоким про-/антиоксидантным статусом, чем листья обитающего в тех же условиях C3-вида P. media. В фазу массового цветения, когда признаки CAM у H. triphyllum были хорошо выражены [10], его листья накапливали около 400 нМ/г сухой массы продуктов перекисного окисления липидов, что в 1.2 раза больше, чем в листьях P. media. Содержание Н2О2 в листьях H. triphyllum достигало 90 мкМ/г сухой массы, тогда как у P. media не превышало 25 мкМ/ г сухой массы. Уровень активности SOD в листьях H. triphyllum в 3 раза выше, чем в листьях P. media. Сравнительные данные свидетельствуют об интенсивном про-/антиоксидантном метаболизме листьев факультативного CAM-растения H. triphyllum, что согласуется с имеющимися в литературе сведениями о содержании АФК в растениях с разным типом фотосинтетического метаболизма углерода [4].
Известно, что в индукции C3-CAM перехода важную роль играют факторы внешней среды и, в первую очередь, водный дефицит. Считается, что воздействие стресс-факторов приводит к усилению генерации АФК и, как следствие, активации механизмов антиоксидантной защиты в клетках. Однако, вопрос о том, является ли CAM причиной или следствием окислительного стресса окончательно не решен [18]. Так, например, авторы исследования модельного растения Mesembryanthemum crystallinum пришли к выводу, что переход на CAM может снижать уровень образования АФК, поскольку способствует поддержанию фотосинтеза при закрытых устьицах [19]. Согласно нашим данным CAM не вносил существенного вклада в рост и накопление биомассы растений H. triphyllum [10].
До сих пор дискуссионным остается вопрос, как происходит детекция сигнала и что представляет собой каскад событий, ведущих к индукции CAM. В литературе обсуждается значение Н2О2 как одного из индукторов C3-CAM перехода [8, 9]. Н2О2 является одной из самых распространенных и стабильных форм АФК, способных диффундировать через цитоплазматические и внутриклеточные мембраны по водным каналам – аквапоринам [20]. Н2О2 может влиять на проницаемость плазмодесм, регулируя тем самым транспорт веществ и воды. Показано также, что H2O2 участвует в индуцируемом АБК закрывании устьиц [21]. Увеличение содержания Н2О2 предшествовало переключению на CAM-тип метаболизма растений M. crystalinum при добавлении NaCl в корневую среду [22]. Добавление в корневую среду экзогенной Н2О2 (50, 100 и 200 мМ) приводило к увеличению амплитуды суточных изменений содержания малата [23]. По мнению авторов данной работы, повышение концентрации этого метаболита в ночное время до 400 мМ свидетельствовало об индукции перехода с С3 на САМ-тип фотосинтетического метаболизма углерода. Интересно отметить, что C3-CAM переход сопровождался снижением каталазной активности. Как известно, каталаза играет важную роль в регуляции содержания Н2О2 в клетках растений. Фермент осуществляет разложение двух молекул Н2О2 с выделением молекулярного кислорода и воды. Каталаза имеет высокую скорость оборота, но низкое сродство к H2O2, она начинает работать при концентрации Н2О2 выше 10–6 М [24]. Нам не удалось получить достоверные данные о каталазе в листьях H. triphyllum, возможно из-за низкого уровня ее активности.
Супероксиддисмутаза является одним из основных ферментов антиоксидантной системы, нейтрализующих супероксид-радикал в реакции дисмутации до молекулярного кислорода и Н2О2 [25]. Другими словами, образование Н2О2 зависит от активности SOD. Как уже отмечалось, уровень активности SOD в листьях H. triphyllum был в 3 раза выше, чем у обитающего в тех же условиях типичного C3-растения P. media. По-видимому, высокое содержание Н2О2 в листьях H. triphyllum, по крайней мере частично, обусловлено повышенной активностью SOD. Это согласуется с имеющимися в литературе данными. Так, например, активность SOD в листьях Guzmania monostachia (бромелиевые) увеличивалась при индукции CAM под действием высокой освещенности и водного дефицита [26]. Причем изменения активности SOD в апикальной части листа были выражены в большей степени, чем в базальной. Повышение активности SOD при водном дефиците было обнаружено у различных видов сем. Crassulaceae [27, 28]. Интересно отметить, что у типичного CAM-вида Sedum album изменения активности ферментов, контролирующих содержание пероксида водорода – супероксиддисмутазы и каталазы, были выражены сильнее по сравнению с CAM-cycling видом S. stoloniferum [28].
Известно, что существует три различных формы SOD, причем Cu/Zn-SOD, в отличие от Fe-SOD и Mn-SOD (соответственно хлоропластная и митохондриальная формы), присутствует в цитозоли, хлоропластах, пероксисомах, межмембранном пространстве митохондрий и апопласте [25]. Так как в данной работе мы не определяли изоформы фермента, то не имеем возможности оценить их вклад в общую активность. Однако тот факт, что уровень активности SOD в листьях H. triphyllum был не только существенно выше, но и более стабильным в течение суток позволяет предположить доминирование Cu/Zn-SOD, присутствующей практически во всех клеточных компартментах.
Поскольку содержание растворимого белка в листьях P. media варьировало в пределах 10–15 мг/г сухой массы, а у H. triphyllum его концентрация была вдвое меньше, мы пересчитали активность SOD на единицу содержания хлорофилла (данные не приводятся). Выявленные различия в уровне активности SOD в листьях двух исследованных видов сохранялись и не зависели от способа расчета.
Тот факт, что SOD вносит весомый вклад в защиту H. triphyllum от окислительного стресса и контролирует накопление пероксида водорода в период функционирования CAM, подтверждается результатами опыта с метилвиологеном. Обработка листьев индуктором окислительного стресса активировала данный фермент. В результате содержание Н2О2 в листьях оставалось стабильным. Видимо, сохранение стабильно высокого уровня Н2О2 играет важную роль в регуляции CAM.
Несмотря на многократную разницу в содержании Н2О2 и активности SOD, исследованные виды сопоставимы по накоплению продуктов перекисного окисления липидов в листьях (разница не превышала 20%). В связи с этим следует отметить, что произрастание P. media на открытых участках приводит к формированию светового фенотипа, характеризующегося меньшим габитусом растений и более высоким уровнем перекисного окисления липидов по сравнению с растениями, обитающими в затененных условиях [29, 30].
Таким образом, нами установлено, что в период генеративного развития листья факультативного САМ растения H. triphyllum накапливали в 4–5 раз больше пероксида водорода и отличались высокой активностью SOD по сравнению с листьями обитающего в тех же условиях типичного С3 растения P. media. Обработка листьев H. triphyllum индуктором окислительного стресса – метилвиологеном (10 мкМ) – повышала уровень активности SOD, но не повлияла существенно на содержание Н2О2 и накопление продуктов перекисного окисления липидов. Наши результаты и имеющиеся в литературе сведения указывают на то, что высокий уровень про-/антиоксидантного метаболизма является общей характеристикой CAM-видов и обусловлен ограничением дневной ассимиляции углерода при адаптации к неблагоприятным условиям среды. Учитывая функции пероксида водорода и его стабильно высокое содержание в листьях H. triphyllum, логично предположить, что Н2О2 может участвовать в регуляции CAM. Изучение ключевых показателей, характеризующих про-/антиоксидантный статус растений в природных условиях, позволяет углубить понимание биохимических механизмов и путей их адаптации к условиям среды.
Работа выполнена в рамках темы госбюджетных научно-исследовательских и опытно-конструкторских работ “Физиология и стресс-устойчивость фотосинтеза растений и пойкилогидрических фотоавтотрофов в условиях Севера” (№ АААА-А17-117033010038-7).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов.
Список литературы
Apel K., Hirt H. Reactive Oxygen Species: Metabolism, Oxidative Stress, and Signal Transduction // Annu. rev. Plant Biol. 2004. V. 55. P. 373. https://doi.org/10.1146/annurev.arplant.55.031903.141701
Sharma P., Jha A. B., Dubey R. S., Pessarakli M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions // J. Bot. 2012. V. 2012. P. 1. https://doi.org/10.1155/2012/217037
Foyer C.H. Reactive oxygen species, oxidative signaling and the regulation of photosynthesis // Environ. Exp. Bot. 2018. V. 154. P. 134. https://doi.org/10.1016/j.envexpbot.2018.05.003
Li J., Zhao X., Matsui S. Hydrogen peroxide contents and activities of antioxidative enzymes among C3, C4 and CAM plants // J. Jpn. Soc. Hortic. Sci. 2001. V. 70. P. 747.
Lukatkin A.S. Contribution of oxidative stress to the development of cold-induced damage to leaves of chilling-sensitive plants: 2. The activity of antioxidant enzymes during plant chilling // Russ. J. Plant Physiol. 2002. V. 49. P. 782.
Anjum N.A., Umar S., Ahmad A., Iqbal M., Khan N.A. Ontogenic variation in response of Brassica campestris L. to cadmium toxicity // J. Plant Interact. 2008. V. 3 (3). P. 189.
Winter K., Holtum J.A.M. Facultative crassulacean acid metabolism (CAM) plants: powerful tools for unravelling the functional elements of CAM photosynthesis // J. Exp. Bot. 2014. V. 65 (13). P. 3425. https://doi.org/10.1093/jxb/eru063
Slesak I., Karpinska B., Surówka E., Miszalski Z., Karpinski S. Redox changes in the chloroplast and hydrogen peroxide are essential for regulation of C3-CAM transition and photooxidative stress responses in the facultative CAM plant Mesembryanthemum crystallinum L. // Plant Cell Physiol. 2003. V. 44 (6). P. 573. https://doi.org/10.1093/pcp/pcg073
Slesak I., Libik M., Karpinska B., Karpinski S., Miszalski Z. The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses // Acta Biochim. Pol. 2007. V. 54 (1). P. 39. https://doi.org/10.18388abp.2007_3267
Golovko T.K., Zakhozhiy I.G., Tabalenkova G.N. Induction of CAM Photosynthesis in Hylotelephum triphyllum (Haw.) Holub (Crassulaceae) under Climatic Condition of the European North-East of Russia // Russ. J. Plant Physiol. 2021. V. 68. P. 179. https://doi.org/10.1134/S1021443720060047
Головко Т.К., Дальке И.Г., Бачаров Д.С., Бабак Т.В., Захожий И.Г. Толстянковые в холодном климате (биология, экология, физиология). СПб.: Наука, 2007. 205 с.
Zakhozhiy I.G., Shadrin D.M., Pylina Y.I., Chadin I.F., Golovko T.K. Genetic differentiation of two phenotypes of Plantago media L. in South Timan // Ecological Genetics. 2020. V. 18 (2). P. 9. https://doi.org/10.17816/ecogen15605
Атлас по климату и гидрологии Республики Коми. Москва: Дрофа; ДиК, 1997. 116 с.
Heath R.L., Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation // Arch. Biochem. Biophys. 1968. V. 125 (1). P. 189.
Bellincampi D., Dipierro N., Salvi G., Cervone F., Lorenzo G. Extracellular H2O2 induced by oligogalacturonides is not involved in the inhibition of the auxin-regulated rolB gene expression in tobacco leaf explants. Plant Physiology // Plant Physiol. 2000. V. 122. P. 1379. https://doi.org/10.1104/pp.122.4.1379
Beauchamp C., Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels // Anal. Biochem. 1971. V. 44 (1). P. 276.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Niewiadomska E., Borland A. M. Crassulacean Acid Metabolism: a Cause or Consequence of Oxidative Stress in Planta? // Progress in Botany 69 / Eds. Lüttge U., Beyschlag W., Murata J., Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg, 2008. P. 247.
Sunagawa H., Cushman J., Agarie S. Crassulacean acid metabolism may alleviate production of reactive oxygen species in a facultative CAM plant, the common ice plant Mesembryanthemum crystallinum L. // Plant Prod. Sci. 2010. V. 13 (3). P. 256. https://doi.org/10.1626/pps.13.256
Borisova (Mubarakshina) M.M., Kozuleva M.A., Rudenko N.N., Naydov I.A., Klenina I.B., Ivanov B.N. Photosynthetic electron flow to oxygen and diffusion of hydrogen peroxide through the chloroplast envelope via aquaporins // Biochim. Biophys. Acta Bioenerg. 2012. V. 1817. P. 1314. https://doi.org/10.1016/j.bbabio.2012.02.036
Pei Z.-M., Murata Y., Benning G., Thomine S., Klüsener B., Allen G.J., Grill E., Schroeder J.I. Calcium channels activated by hydrogen peroxide mediate abscisic acidsignalling in guard cells // Nature. 2000. V. 406 (6797). P. 731.
Slesak I., Libik M., Miszalski Z. The foliar concentration of hydrogen peroxide during salt-induced C3-CAM transition in Mesembryanthemum crystallinum L. // Plant Science. 2008. V. 174 (2). P. 221. https://doi.org/10.1016/j.plantsci.2007.11.007
Surówka E., Dziurka M., Kocurek M., Goraj S., Rapacz M., Miszalski Z. Effects of exogenously applied hydrogen peroxide on antioxidant and osmoprotectant profiles and the C3-CAM shift in the halophyte Mesembryanthemum crystallinum L. // J. Plant Physiol. 2016. V. 200. P. 102. https://doi.org/10.1016/j.jplph.2016.05.021
Mhamdi A., Noctor G., Baker A. Plant catalases: peroxisomal redox guardians // Arch. Biochem. Biophys. 2012. V. 525. P. 181. https://doi.org/10.1016/j.abb.2012.04.015
Gill S.S., Anjum N.A., Gill R., Yadav S., Hasanuzzaman M., Fujita M., Mishra P., Sabat S.C., Tuteja N. Superoxide dismutase – mentor of abiotic stress tolerance in crop plants // Environ. Sci. Pollut. Res. 2015. V. 22 (14). P. 10375.
Abreu M.E., Carvalho V., Mercier H. Antioxidant capacity along the leaf blade of the C3-CAM facultative bromeliad Guzmania monostachia under water deficit conditions // Funct. Plant Biol. 2018. V. 45 (6). P. 620. https://doi.org/10.1071/fp17162
Habibi G., Hajiboland R. Comparison of water stress and UV radiation effects on induction of CAM and antioxidative defense in the succulent Rosularia elymaitica (Crassulaceae) // Acta Biol. Cracov., Ser. Bot. 2011. V. 53 (2). P. 15. https://doi.org/10.2478/v10182-011-0020-5
Habibi G., Hajiboland R. Comparison of photosynthesis and antioxidative protection in Sedum album and Sedum stoloniferum (Crassulaceae) under water stress // Photosynthetica. 2012. V. 50 (4). P. 508.
Golovko T.K., Dalke I.V., Zakhozhiy I.G., Dymova O.V., Tabalenkova G.N. Functional plasticity of photosynthetic apparatus and its resistance to photoinhibition in Plantago media // Russ. J. Plant Physiol. 2011. V. 58. P. 549.
Rozentsvet O.A., Golovko T.K., Bogdanova E.S., Tabalenkova G.N., Nesterov V.N., Dymova O.V. Polar lipid pool modification in leaves of hoary plantain (Plantago media L.) plants during their light adaptation under natural conditions // Biol. Bull. 2013. V. 40. P. 138. https://doi.org/10.1134/S1062359013020118
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


