Физиология растений, 2021, T. 68, № 4, стр. 412-420
Вовлечение нитратредуктазы и оксида азота (NO) в реализацию стресс-протекторного действия донора монооксида углерода (CO) на проростки пшеницы при гипертермии
М. А. Шкляревский a, Ю. Е. Колупаев a, *, Ю. В. Карпец a, А. А. Луговая a, В. П. Бессонова b
a Харьковский национальный аграрный университет им. В.В. Докучаева
Харьков, Украина
b Днепровский государственный аграрно-экономический университет
Днепр, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 05.11.2020
После доработки 16.11.2020
Принята к публикации 17.11.2020
Аннотация
Исследовали участие оксида азота (NO) и его связь с другими сигнальными посредниками при индуцировании теплоустойчивости проростков пшеницы (Triticum aestivum L.) донором монооксида углерода (CО) гемином. Показано, что обработка гемином (5 мкМ), повышающая теплоустойчивость, приводит к транзиторному, почти двукратному, увеличению содержания NO и активности нитратредуктазы (НР) в корнях. Максимальное повышение этих показателей отмечалось через 1 ч после начала инкубации проростков на среде, содержащей гемин. Подъем содержания оксида азота в корнях устранялся под влиянием ингибитора нитратредуктазы вольфрамата натрия, но не ингибитора NO-синтазы и диаминоксидазы аминогуанидина. Также активации НР и повышению содержания NO в корнях препятствовала обработка корней хелатором внеклеточного кальция ЭГТА и ингибитором поступления кальция в цитозоль из внутриклеточных компартментов неомицином. В то же время при обработке проростков антиоксидантом диметилтиомочевиной (ДМТМ) вызываемые донором CO эффекты повышения активности НР и содержания NO полностью сохранялись. Внесение в среду инкубации проростков скавенджера NO PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) и ингибитора НР вольфрамата натрия нивелировало повышение активности внеклеточной пероксидазы и содержания пероксида водорода в корнях, происходящее при обработке гемином. После повреждающего прогрева при 45°С под влиянием донора CO снижалось проявление окислительного стресса, определяемое по содержанию продукта ПОЛ малонового диальдегида, и повышалось выживание проростков. Эти эффекты гемина устранялись при обработке проростков скавенджерами NO (PTIO) и пероксида водорода (ДМТМ), ингибитором НР вольфраматом натрия и антагонистами кальция ЭГТА и неомицином. Сделано заключение, что в передаче сигнала экзогенного CO принимает участие NO, образующийся с участием НР. Повышение содержания NO активирует образование АФК, также задействованных в реализации стресс-протекторных эффектов монооксида углерода. При этом вызываемое CO усиление генерации NO клетками корней и развитие теплоустойчивости проростков зависят от кальциевого гомеостаза.
ВВЕДЕНИЕ
В последние годы интенсивно накапливаются сведения о роли газотрансмиттеров – эндогенных газообразных сигнальных молекул – в физиологических процессах у растений [1]. К основным газотрансмиттерам относят монооксид углерода (CO), оксид азота (NO) и сероводород (H2S) [2]. Для газотрансмиттеров растительных клеток характерно отсутствие конкретных рецепторов, наличие общих мишеней и многоуровневое функциональное взаимодействие друг с другом и фитогормонами [2–4].
Роль монооксида углерода в жизни растений до сих пор остается малоизученной. Одной из важных его функций является участие в формировании адаптивных реакций на действие стрессоров различной природы. Увеличение эндогенного содержания CO в клетках растений зарегистрировано в ответ на обезвоживание [5], действие натрий-хлоридного засоления [6], низких [7] и высоких [8] температур. Получены данные о повышении устойчивости к стрессорам растений разных таксономических групп под влиянием газообразного CO или его доноров – гемина и гематина [5, 9]. Эти соединения являются искусственными субстратами гемоксигеназы, образующей CO в результате окислительной деградации гема [10].
Несмотря на накопленный довольно широкий спектр феноменологических данных о влиянии CO на устойчивость растений, механизмы таких эффектов остаются малоизученными. В частности, открытым остается вопрос о роли других компонентов сигнальной сети в реализации стресс-протекторного действия монооксида углерода [10]. Одним из них является другой газотрансмиттер – оксид азота. Показано, что обработка проростков пшеницы гематином вызывала повышение содержания NO [5]. При этом скавенджер NO PTIO (2-phenyl-4,4,5,5-tetramethylimidazoline-1-oxyl-3-oxide) устранял повышение устойчивости проростков к осмотическому стрессу (действию ПЭГ 6000), вызываемое донором CO [5]. Эффекты увеличения эндогенного содержания NO зарегистрированы и при обработке проростков пшеницы раствором газообразного CO, которая вызывала повышение солеустойчивости [11]. Также показано, что индуцируемый гематином эффект закрывания устьиц у бобов сопровождался повышением содержания NO в замыкающих клетках и устранялся его скавенджером PTIO и ингибитором NO-синтазы L-NAME (NG-nitro-L-arginine methyl ester) [12]. Однако сведения о роли NO в реализации стресс-протекторного действия монооксида углерода на растения пока получены лишь в единичных исследованиях. При этом остается открытым вопрос о вкладе различных путей синтеза NO в увеличение его содержания под действием экзогенного CO на растительные объекты.
Известно, что NO как сигнальная молекула находится в тесном функциональном взаимодействии с активными формами кислорода (АФК) и ионами кальция [13]. Имеются немногочисленные данные, указывающие на роль АФК и Ca2+ в реализации устьичных и ростовых эффектов монооксида углерода [14, 15]. Недавно мы показали участие пероксида водорода, генерируемого внеклеточной пероксидазой (ПО), а также цитозольного кальция, в индуцировании донором CO гемином антиоксидантной системы проростков пшеницы и их теплоустойчивости [16, 17]. При этом роль NO и возможных функциональных связей между оксидом азота, АФК и ионами кальция в процессе индуцирования теплоустойчивости клеток растений экзогенным CO оставалась неизученной.
Цель настоящей работы состояла в исследовании возможного участия оксида азота и генерирующих его ферментативных систем в регуляции образования АФК и индуцировании теплоустойчивости проростков пшеницы действием донора CO гемина. Также в работе была изучена зависимость влияния донора монооксида углерода на генерацию NO клетками корней от их кальциевого статуса.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали 4-суточные (на момент начала эксперимента) этиолированные проростки пшеницы (Triticum aestivum L.) сорта Досконала. Зерновки обеззараживали 6% пероксидом водорода в течение 30 мин и проращивали 4 сут при температуре 18–20°С на водопроводной воде, очищенной с использованием системы водоподготовки, включающей в себя фильтр механической очистки, угольный фильтр и полупроницаемую обратноосмотическую мембрану с размером ячеек 1 нм. В среду инкубации корней добавляли гемин производства Sigma-Aldrich (в конечной концентрация 5 мкМ) и выдерживали проростки в течение 24 ч. Условия обработки и оптимальная концентрация гемина, при которой отмечалось максимальное повышение теплоустойчивости проростков, были выбраны ранее [16]. Также в предыдущей работе была подтверждена связь изучаемых на примере интактных корней проростков пшеницы эффектов гемина с образованием CO [16].
При изучении влияния скавенджера NO PTIO (0.1 мМ), ингибитора нитратредуктазы вольфрамата натрия (2 мМ) [13], ингибитора NO-синтазы и диаминоксидазы аминогуанидина (1 мМ) [18], скавенджера пероксида водорода диметилтиомочевины (ДМТМ, 0.150 мМ) [19], а также хелатора внеклеточного кальция ЭГТА (0.5 мМ) и ингибитора образования инозитол-1,4,5-фосфата неомицина (0.2 мМ) [17] инкубация корней в растворах составляла 26 ч. При оценке комбинированного действия гемина и антагонистов сигнальных посредников последние добавляли в среду инкубации корней за 2 ч до введения в нее гемина. Концентрации указанных соединений выбирали в предварительных опытах.
Биохимические показатели определяли в корнях проростков, поскольку они более чувствительны к воздействиям экзогенных соединений и теплового стресса [19]. Во время инкубации проростков на растворах исследуемых соединений определяли содержание в корнях оксида азота и пероксида водорода, активность нитратредуктазы (НР) и внеклеточной ПО, после стрессового воздействия также оценивали содержание продукта перекисного окисления липидов (ПОЛ) малонового диальдегида (МДА).
По окончании инкубации на растворах гемина и исследуемых ингибиторов проростки подвергали повреждающему прогреву в водяном ультратермостате при температуре 45°С в течение 10 мин [16]. В дальнейшем их переносили на очищенную водопроводную воду и выращивали в течение трех суток при температуре около 20°С и освещении 6000 лк для оценки выживания. После этого оценивали относительное количество выживших проростков. К таковым относили проростки, которые не имели выраженных признаков некроза на листьях и сохраняли способность к росту.
Содержание NO в корнях определяли по методу, описанному Zhou с соавт. [20], с некоторыми модификациями. В основе метода – превращение содержащегося в растениях NO в нитрит и определение концентрации последнего по реакции Грисса. Навеску свежесрезанного растительного материала гомогенизировали на льду в 50 мМ ацетатном буфере (рН 3.6) с добавлением 2%-го ацетата цинка. Гомогенат центрифугировали на центрифуге MPW 350R (“MPW MedInstruments”, Польша) при температуре 2–4°С при 8000 g в течение 15 мин, затем к 10 мл супернатанта добавляли 250 мг древесного угля. Смесь фильтровали через бумажный фильтр, после чего смешивали 2 мл фильтрата с 1 мл 1%-го реактива Грисса в 12%-й уксусной кислоте. Через 30 мин определяли светопоглощение раствора на спектрофотометре СФ 46 (“ЛОМО”, Россия) при длине волны 530 нм. В качестве стандарта использовали растворы нитрита натрия. Содержание NO выражали в нмоль/г сырой массы.
Активность НР (КФ 1.7.1.1) определяли in vitro по количеству накопленного продукта реакции нитрита [21]. Корни гомогенизировали на льду в 0.05 М K, Na-фосфатном буфере с pH 7.8, гомогенат центрифугировали в течение 15 мин при 4000 g при температуре 2–4°C. К супернатанту добавляли 0.1 М KNO3 и 5 мМ НАД·Н. В холостую пробу вместо НАД·Н добавляли дистиллированную воду. Реакцию проводили при 25°C в течение 30 мин, после чего останавливали добавлением ледяной уксусной кислоты. Для осаждения белков пробы центрифугировали 10 мин при 8000 g. К супернатанту добавляли 1%-й реактив Грисса в 12%-й уксусной кислоте. Через 30 мин измеряли оптическую плотность раствора при 527 нм на спектрофотометре СФ 46 (“ЛОМО”, Россия). Активность фермента выражали в нмоль нитрита/(г сырой массы мин).
Для определения содержания H2O2 корни гомогенизировали на льду в 5%-ной ТХУ. Пробы центрифугировали при 8000 g в течение 10 мин при температуре 2–4°С и в супернатанте определяли концентрацию пероксида водорода с использованием ферротиоцианатного метода [22]. Содержание H2O2 выражали в нмоль/г сырой массы.
Активность внеклеточной ПО (КФ 1.11.1.7) определяли в корнях проростков, как описано в работе [23] с модификациями. Корни исследуемых интактных проростков помещали в стаканчики с дистиллированной водой, pH которой доводили до 6.2 с помощью NaOH. Через 20 мин проростки извлекали, корни отсекали, обсушивали фильтровальной бумагой и взвешивали, а в инкубационной среде определяли активность фермента по реакции окисления гваякола пероксидом водорода [17]. Активность фермента выражали в мкмоль гваякола/(г сырой массы мин).
Для определения продуктов ПОЛ, реагирующих с 2-тиобарбитуровой кислотой (преимущественно МДА), корни гомогенизировали в реакционной среде, содержащей 0.25%-ю 2-тиобарбитуровую кислоту в 10%-й ТХУ, гомогенат помещали в кипящую баню на 30 мин. Затем пробы резко охлаждали и центрифугировали 15 мин при 10 000 g. Оптическую плотность надосадочной жидкости определяли при 532 нм (максимум светопоглощения МДА) и 600 нм (для поправки на неспецифическое светопоглощение) [24].
Эксперименты проводили в 4-кратной биологической повторности и каждый независимо воспроизводили не менее 3 раз. На рисунках приведены средние величины и их стандартные ошибки. Достоверность различий при P ≤ 0.05 определяли с использованием дисперсионного анализа.
РЕЗУЛЬТАТЫ
Содержание NO и активность НР в корнях проростков при действии гемина. Содержание оксида азота в корнях контрольного варианта в течение 24 ч наблюдений существенно не изменялось (рис. 1а). Внесение в среду инкубации проростков пшеницы гемина уже через 0.5 ч вызывало значительное повышение в них содержания оксида азота. Через 1 ч после начала обработки донором CO наблюдалось максимальное увеличение количества NO в корнях проростков опытного варианта. Повышенный уровень оксида азота в корнях сохранялся и через 2 ч после начала воздействия гемина, однако уже через 4 ч его содержание в варианте с донором NO не отличалось от контроля, не было существенных различий между вариантами и через 24 ч после начала воздействия гемина (рис. 1а).
Рис. 1.
Динамика содержания оксида азота (а) и активности нитратредуктазы (б) в корнях проростков пшеницы при действии гемина. 1 – контроль; 2 – гемин (5 мкМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05.
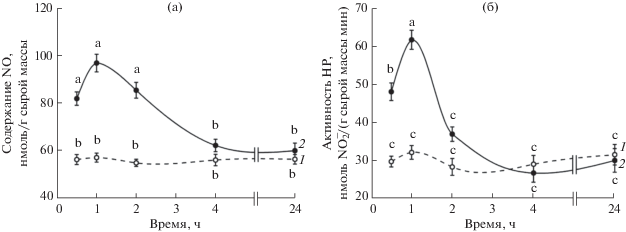
Активность НР в корнях в контроле за 24 ч наблюдений существенно не изменялась (рис. 1б). При обработке гемином ее динамика во многом была похожей на динамику содержания NO: увеличение начиналось через 0.5 ч от начала экспозиции, максимум наблюдался через 1 ч действия донора CO, после чего активность НР в корнях проростков опытного варианта не отличалась от контроля (рис. 1б).
Влияние модуляторов на индуцированное гемином увеличение содержания NO и активности НР в корнях проростков. В последующих экспериментах выясняли, какие ферментативные системы причастны к вызываемому экзогенным CO увеличению содержания NO в корнях. Сами по себе вольфрамат натрия и аминогуанидин достоверно не влияли на его количество в корнях, хотя и вызывали тенденцию к уменьшению его содержания (рис. 2а). При действии гемина в комбинации с ингибитором НР вольфраматом натрия влияние донора CO на содержание NO не проявлялось. Ингибитор НР вольфрамат натрия вызывал снижение активности фермента в корнях и устранял вызываемый донором CO эффект увеличения активности НР (рис. 2б). В то же время обработка проростков ингибитором NO-синтазы и диаминоксидазы аминогуанидином практически не препятствовала увеличению содержания NO, происходящему под влиянием гемина (рис. 2а). Таким образом, данные ингибиторного анализа и прямого определения активности НР указывают на значительный вклад именно этого фермента в эффект усиления генерации оксида азота клетками корней при действии донора CO.
Рис. 2.
Содержание NO (а) и активность НР (б) в корнях проростов пшеницы при обработке гемином и антагонистами оксида азота, АФК и кальция. (а): 1 – контроль; 2 – гемин (5 мкМ); 3 – вольфрамат натрия (2 мМ); 4 – гемин (5 мкМ) + + вольфрамат натрия (2 мМ); 5 – аминогуанидин (1 мМ); 6 – гемин (5 мкМ) + аминогуанидин (1 мМ); 7 – ДМТМ (0.15 мМ); 8 – гемин (5 мкМ) + ДМТМ (0.15 мМ); 9 – ЭГТА (0.5 мМ); 10 – гемин (5 мкМ) + ЭГТА (0.5 мМ); 11 – неомицин (0.2 мМ); 12 – гемин (5 мкМ) + неомицин (0.2 мМ). (б): 1 – контроль; 2 – гемин (5 мкМ); 3 – вольфрамат натрия (2 мМ); 4 – гемин (5 мкМ) + вольфрамат натрия (2 мМ); 5 – ДМТМ (0.15 мМ); 6 – гемин (5 мкМ) + ДМТМ (0.15 мМ); 7 – ЭГТА (0.5 мМ); 8 – гемин (5 мкМ) + ЭГТА (0.5 мМ); 9 – неомицин (0.2 мМ); 10 – гемин (5 мкМ) + неомицин (0.2 мМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05. Примечание. Содержание NO и активность НР в корнях определяли через 1 ч после начала обработки гемином и/или через 3 ч от начала обработки другими соединениями.
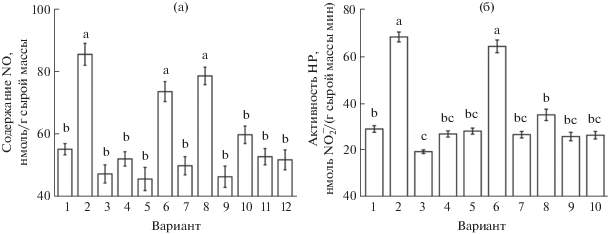
Обработка проростков антиоксидантом ДМТМ не влияла на содержание в них NO и не снимала эффект увеличения содержания оксида азота при инкубации в среде с гемином (рис. 2а). Не оказывал скавенджер пероксида водорода ДМТМ влияния и на активность НР в корнях проростков как в отсутствие, так и в присутствии донора монооксида углерода (рис. 2б).
Антагонисты кальция ЭГТА и неомицин достоверно не влияли на содержание NO и активность НР в корнях. При этом они полностью устраняли эффекты повышения количества NO и активности НР в ответ на внесение в среду инкубации проростков донора CO гемина (рис. 2).
Содержание пероксида водорода и активность внеклеточной ПО в корнях при действии гемина и антагонистов оксида азота. Ранее в идентичных экспериментальных условиях было установлено, что добавление 5 мкМ гемина в среду инкубации корней проростков вызывало в них увеличение содержания пероксида водорода и активности внеклеточной ПО с максимумами через 2 и 1.5 ч соответственно [16]. В связи с этим, именно в таких временных точках оценивали влияние скавенджера NO PTIO и ингибиторов ферментов синтеза оксида азота на количество H2O2 и активность внеклеточной ПО в корнях. Установлено, что обработка PTIO сама по себе почти не влияла на содержание пероксида водорода и активность фермента (рис. 3). При этом под влиянием скавенджера оксида азота полностью устранялось вызываемое обработкой гемином повышение активности внеклеточной ПО и значительно нивелировалось увеличение содержания пероксида водорода в корнях.
Рис. 3.
Содержание пероксида водорода (а) и активность внеклеточной ПО (б) в корнях проростов пшеницы при обработке гемином и антагонистами оксида азота. 1 – контроль; 2 – гемин (5 мкМ); 3 – PTIO (0.1 мМ); 4 – гемин (5 мкМ) + + PTIO (0.1 мМ); 5 – вольфрамат натрия (2 мМ); 6 – гемин (5 мкМ) + вольфрамат натрия (2 мМ); 7 – аминогуанидин (1 мМ); 8 – гемин (5 мкМ) + аминогуанидин (1 мМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05. Примечание. Содержание пероксида водорода в корнях определяли через 2 ч после начала обработки гемином и/или через 4 ч от начала обработки другими соединениями, активность внеклеточной ПО анализировали через 1.5 ч после начала действия гемина и/или через 3.5 ч после начала обработки другими соединениями.
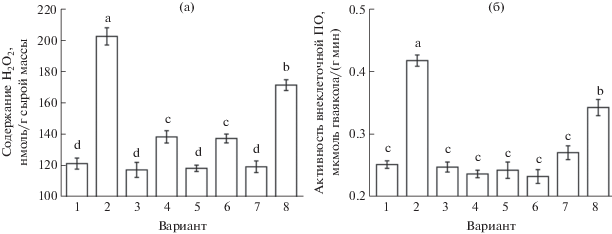
При обработке ингибитором НР вольфраматом натрия содержание пероксида водорода и активность внеклеточной ПО в корнях не изменялись (рис. 3). В то же время этот ингибитор полностью устранял эффекты повышения содержания H2O2 и активности внеклеточной ПО, вызываемые действием донора CO.
Обработка корней проростков аминогуанидином, ингибирующим NO-синтазу и диаминоксидазу, существенно не влияла на содержание в них пероксида водорода и активность внеклеточной ПО. При этом аминогуанидин лишь немного уменьшал проявление эффектов повышения содержания H2O2 и активности внеклеточной ПО в корнях, которые происходили при обработке гемином (рис. 3).
Влияние модуляторов NO-, АФК и кальциевого гомеостаза на проявление стресс-протекторного действия на проростки донора CO при гипертермии. Через сутки после повреждающего прогрева содержание продукта ПОЛ МДА в корнях проростков в контрольном варианте увеличивалось более чем на 40% (рис. 4а). Обработка проростков гемином значительно уменьшала окислительные повреждения, о чем свидетельствует лишь небольшое повышение содержания МДА в корнях проростков соответствующего варианта.
Рис. 4.
Содержание МДА в корнях (а) и выживание проростков пшеницы (б) после повреждающего прогрева. 1 – контроль; 2 – гемин (5 мкМ); 3 – PTIO (0.1 мМ); 4 – гемин (5 мкМ) + PTIO (0.1 мМ); 5 – вольфрамат натрия (2 мМ); 6 – гемин (5 мкМ) + вольфрамат натрия (2 мМ); 7 – аминогуанидин (1 мМ); 8 – гемин (5 мкМ) + аминогуанидин (1 мМ); 9 – ДМТМ (0.15 мМ); 10 – гемин (5 мкМ) + ДМТМ (0.15 мМ); 11 – ЭГТА (0.5 мМ); 12 – гемин (5 мкМ) + + ЭГТА (0.5 мМ); 13 – неомицин (0.2 мМ); 14 – гемин (5 мкМ) + неомицин (0.2 мМ). Одинаковыми латинскими буквами обозначены величины, различия между которыми не достоверны при P ≤ 0.05. Примечание. Содержание МДА определяли через 24 ч, выживание проростков – через 3 сут после повреждающего прогрева.
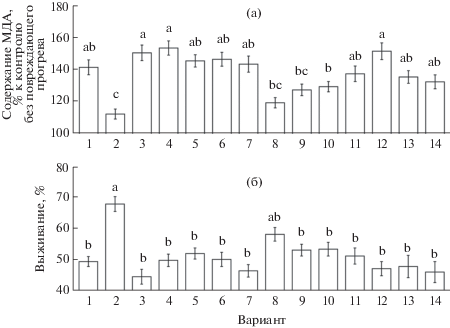
При обработке проростков скавенджером NO PTIO интенсивность процессов ПОЛ, индуцируемых тепловым стрессом, изменялась незначительно. При этом PTIO полностью устранял проявление антиоксидантного действия гемина (рис. 4а). Ингибитор НР вольфрамат натрия сам по себе не оказывал влияния на вызываемое тепловым стрессом накопление продуктов ПОЛ в корнях проростков, однако, как и PTIO, снимал эффект смягчения окислительного стресса, вызываемый обработкой проростков донором CO.
При обработке проростков аминогуанидином, который ингибирует NO-синтазу и диаминоксидазу, содержание МДА в корнях проростков, подвергнутых действию гипертермии, не отличалось от контроля. При этом данный ингибитор лишь немного ослаблял проявление антиоксидантного действия обработки проростков гемином (рис. 4а).
Обработка проростков скавенджером пероксида водорода ДМТМ несколько уменьшала проявление влияния гипертермии на содержание МДА, но при этом она частично нивелировала антиоксидантное действие донора CO (рис. 4а).
Антагонисты кальция ЭГТА и неомицин сами по себе слабо влияли на содержание МДА в корнях проростков пшеницы после действия гипертермии. В то же время ЭГТА устранял, а неомицин заметно уменьшал проявление эффекта смягчения процессов ПОЛ, вызываемого действием гемина (рис. 4а).
Обработка проростков донором CO значительно повышала их выживание после повреждающего прогрева (рис. 4б). Различные антагонисты NO (PTIO, вольфрамат натрия, аминогуанидин) не оказывали достоверного влияния на теплоустойчивость проростков. Однако скавенджер NO и ингибитор НР полностью устраняли защитное действие донора CO на проростки при гипертермии. В то же время аминогуанидин лишь частично уменьшал положительное влияние обработки гемином на выживание проростков после повреждающего прогрева.
Антиоксидант ДМТМ существенно не влиял на выживание проростков после теплового стресса, но устранял положительное влияние донора CO на их теплоустойчивость. Антагонисты кальция ЭГТА и неомицин сами по себе также не влияли на относительную величину выживания проростков после теплового стресса, но при этом полностью нивелировали повышение теплоустойчивости проростков, вызываемое обработкой гемином (рис. 4б).
ОБСУЖДЕНИЕ
Полученные результаты свидетельствуют о роли оксида азота в реализации стресс-протекторного действия экзогенного CO на проростки пшеницы при гипертермии. На это, в частности, указывает транзиторное повышение содержания NO в корнях проростков пшеницы в течение первых двух часов их инкубации на среде с донором CO гемином (рис. 1а). Такие результаты согласуются с данными Liu и соавт. [5], показавших увеличение содержания NO в семенах пшеницы, прорастание которых в условиях осмотического стресса стимулировалось действием гематина. Также зарегистрировано повышение содержания NO в корнях проростков пшеницы при действии водного раствора газообразного CO, которое индуцировало развитие их устойчивости к солевому стрессу [11]. Следует однако отметить, что в указанных работах повышение содержания NO в клетках зарегистрировано при продолжительном воздействии экзогенного CO (12–24 ч). На нашей модели показано достаточно быстрое и транзиторное повышение содержания NO, что характерно для его сигнальных эффектов [1].
В задачи нашей работы также входило выяснение возможных ферментативных путей синтеза NO в клетках корней под влиянием донора монооксида углерода. Как известно, NO у растений может образовываться по восстановительным или по окислительным путям [2, 25]. Восстановительный путь предполагает использование в качестве субстратов нитрата или нитрита в реакциях, катализируемых нитратредуктазой, связанной с плазматической мембраной нитрит-NO-редуктазой и локализованной в пероксисомах ксантиноксидоредуктазой [2]. Механизм образования оксида азота окислительным путем из L-аргинина у растений до сих пор остается предметом дискуссии, поскольку гомологи NO-синтазы животных обнаружены только у зеленых водорослей. В настоящее время считается, что наземные растения не имеют типичной NO-синтазы животных. Предполагают, что во время эволюции произошла потеря этого гена [26]. Однако не исключено, что у высших растений в пероксисомах имеются белки, отличные от NO-синтазы, но способные генерировать NO, используя L-аргинин в качестве субстрата. Эта реакция, как и катализируемая NO-синтазой животных, может происходить при наличии НАДФ∙H, ФМН, ФАД, кальмодулина и ионов кальция [25]. В качестве основных субстратов для образования NO в окислительном пути в последнее время рассматривают не только L-аргинин, но и полиамины, превращения которых катализируются ди- и полиаминоксидазами [2, 25].
В наших экспериментах показано отсутствие заметного влияния аминогуанидина, ингибирующего как NO-синтазу, так и диаминоксидазу, на вызываемое донором CO увеличение содержания оксида азота в корнях проростков пшеницы (рис. 2а). Это указывает на то, что окислительный путь практически не вовлекается в стимулируемый экзогенным CO синтез оксида азота в корнях проростков. В то же время при обработке проростков гемином отмечалось транзиторное повышение активности НР, которое по времени совпадало с эффектом увеличения содержания NO (рис. 2). Следует заметить, что активность НР в корнях в условиях наших экспериментов была довольно низкой, что связано с инкубированием проростков в отсутствие экзогенных нитратов. Однако эти результаты согласуются с полученными ранее данными о наличии активности НР в органах проростков пшеницы при их выращивании в течение нескольких дней на безнитратной среде [21]. Наши эксперименты показали, что ингибирование активности НР вольфраматом натрия устраняло эффект повышения содержания оксида азота в корнях, вызываемый донором CO (рис. 2). Таким образом, по-видимому, НР является основным ферментом, обеспечивающим генерацию оксида азота в клетках корней при действии донора CO. Похожие результаты получены Bai с соавт. при стимулировании растворами CO или гемина прорастания семян Baccaurea ramiflora при низких температурах. Под влиянием экзогенного CO повышалось содержание NO в зародышах. Такой эффект устранялся ингибитором НР вольфраматом натрия, но не ингибитором NO-синтазы L-NAME [7]. С другой стороны, в работе Xie с соавт. [11] показано устранение ингибитором NO-синтазы L‑NAME вызываемого экзогенным CO повышения содержания NO в корнях проростков пшеницы, подвергнутых солевому стрессу. Не исключено, что в зависимости от природы стрессоров и других экспериментальных условий в ответ на действие CO могут активироваться различные пути синтеза NO.
Наблюдаемые в наших экспериментах эффекты увеличения активности НР и содержания NO в корнях проростков, обработанных донором CO, оказались зависимыми от кальциевого гомеостаза. Они подавлялись как хелатором внеклеточного кальция ЭГТА, так и неомицином – ингибитором образования инозитол-1,4,5-фосфата, способного открывать внутриклеточные кальциевые каналы (рис. 2). Эффект активации растительной НР ионами кальция и ингибирования в присутствии хелатора кальция в условиях in vitro показан достаточно давно [27]. Также обнаружено повышение активности НР в интактных растениях под влиянием экзогенного кальция [28]. Вероятно, регуляция активности НР монооксидом углерода опосредована кальцием. В целом, участие кальция в реализации физиологических эффектов CO изучено очень слабо, хотя сообщается о его роли в проявлении ростовых эффектов монооксида углерода [14]. В наших экспериментах вызываемое обработкой гемином повышение активности антиоксидантных ферментов (супероксиддисмутазы, каталазы, гваяколпероксидазы) в корнях проростков пшеницы не проявлялось в присутствии ЭГТА и неомицина [17].
Еще одним посредником в сигнальных цепях, индуцируемых монооксидом углерода, является пероксид водорода [16]. Возможная связь между NO и АФК как участниками сигнальных процессов, инициируемых CO, на растительных объектах до сих пор почти не исследована. Из результатов наших экспериментов следует, что в сигнальной цепи, стимулируемой монооксидом углерода, NO находится выше пероксида водорода. На это указывают более быстрое образование NO в корнях пшеницы при обработке гемином (максимальный эффект через 1 ч) (рис. 1а) по сравнению с динамикой изменения содержания H2O2 (максимум через 2 ч) [16], а также результаты ингибиторного анализа. Так, предобработка проростков пшеницы скавенджером NO PTIO и ингибитором НР вольфраматом натрия устраняла вызываемые гемином эффекты увеличения в корнях проростков активности внеклеточной ПО и содержания пероксида водорода (рис. 3). С другой стороны, антиоксидант ДМТМ не влиял на вызываемое донором CO увеличение активности НР и содержания оксида азота в корнях (рис. 2). Можно полагать, что стимулируемое донором CO повышение содержания NO вызывает последующую активацию внеклеточной ПО, которая может катализировать образование АФК [29], в том числе в корнях [23]. В литературе имеются данные о повышении активности различных пероксидаз под влиянием доноров NO [30]. Не исключено, что такие эффекты могут быть обусловлены взаимодействием NO с гемом, входящим в состав активных центров этих ферментов. Естественно, что для определенных выводов о механизмах вызываемой донором CO и опосредованной NO активации внеклеточной ПО необходимы специальные исследования.
Оценка влияния модуляторов сигнальных процессов на интегральные физиологические показатели, характеризующие устойчивость – интенсивность ПОЛ и выживание проростков после повреждающего прогрева – также свидетельствует о вовлечении NO, АФК и ионов кальция в реализацию стресс-протекторных эффектов донора CO. Так, обработка PTIO устраняла как вызываемое донором CO смягчение эффекта окислительного стресса, так и происходящее под его влиянием повышение выживания проростков (рис. 4). Таким же образом снимала стресс-протекторные эффекты экзогенного CO и обработка проростков ингибитором НР вольфраматом натрия. В то же время аминогуанидин, ингибирующий ферменты окислительного пути образования NO, не оказывал влияния на его содержание при действии на проростки гемина и лишь незначительно уменьшал эффекты смягчения донором CO окислительного стресса (рис. 4а) и повышения выживания проростков после повреждающего прогрева (рис. 4б).
ДМТМ, обладающая антиоксидантными свойствами, сама по себе немного снижала вызываемое прогревом накопление МДА в корнях проростков, однако этот модулятор частично уменьшал вызываемый донором CO эффект смягчения окислительного стресса и полностью устранял его положительное влияние на теплоустойчивость (рис. 4). Эти данные подтверждают сделанное ранее заключение о роли пероксида водорода в реализации стресс-протекторного действия экзогенного монооксида углерода на проростки при гипертермии [16].
Антагонисты кальция (хелатор внеклеточного Ca2+ ЭГТА и ингибитор поступления кальция в цитозоль из внутриклеточных компартментов неомицин), как и скавенджер пероксида водорода ДМТМ и антагонисты NO (PTIO и вольфрамат натрия), устраняли эффект предотвращения развития окислительного стресса донором CO и полностью снимали его положительное влияние на выживание проростков после прогрева (рис. 4).
В целом устранение антагонистами NO повышения содержания в корнях H2O2, вызываемого экзогенным CO, а также более динамичное изменение содержания оксида азота по сравнению с пероксидом водорода, указывает на то, что NO в сигнальном пути расположен выше, чем H2O2. В свою очередь ингибирование вызываемого донором CO накопления NO в клетках корней кальциевыми антагонистами ЭГТА и неомицином позволяет предполагать, что запуск сигнального пути, связанного с активацией НР, увеличением содержания NO и последующим накоплением пероксида водорода, включает в себя изменение кальциевого гомеостаза. При этом, вероятно, поступление кальция в цитозоль из внеклеточного пространства и внутренних компартментов стимулирует образование NO и АФК. Безусловно, это предположение требует изучения вызываемых CO изменений кальциевого гомеостаза прямыми методами с определением его концентрации в цитозоле в реальном времени. Тем не менее, полученные в настоящей роботе данные позволяют сделать достаточно однозначное заключение о вовлечении NO, образуемого под действием НР, в формирование АФК-сигнала и реализацию стресс-протекторного действия донора CO гемина на проростки пшеницы при гипертермии.
Авторы благодарны за поддержку проекту Czech Republic Development Cooperation “Платформа AgriSciences для развития науки в высших учебных заведениях Украины”, который позволил начать это исследование.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Yao Y., Yang Y., Li C., Huang D., Zhang J., Wang C., Li W., Wang N., Deng Y., Liao W. Research progress on the functions of gasotransmitters in plant responses to abiotic stresses // Plants (Basel). 2019. V. 8 (12): 605. https://doi.org/10.3390/plants8120605
Kolupaev Yu.E., Karpets Yu.V., Beschasniy S.P., Dmitriev A.P. Gasotransmitters and their role in adaptive reactions of plant cells // Cytol. Genet. 2019. V. 53. P. 392.
Maslennikova D.R., Allagulova Ch.R., Fedorova K.A., Plotnikov A.A., Avalbaev A.M., Shakirova F.M. Cytokinins contribute to realization of nitric oxide growth-stimulating and protective effects on wheat plants // Russ. J. Plant Physiol. 2017. V. 64. P. 665.
Hancock J.T. Hydrogen sulfide and environmental stresses // Environ. Exp. Bot. 2019. V. 161. P. 50.
Liu Y., Xu S., Ling T., Xu L., Shen W. Heme oxygenase/carbon monoxide system participates in regulating wheat seed germination under osmotic stress involving the nitric oxide pathway // J. Plant Physiol. 2010. V. 167. P. 1371.
Verma K., Dixit S., Shekhawat G.S., Alam A. Antioxidant activity of heme oxygenase 1 in Brassica juncea (L.) Czern. (Indian mustard) under salt stress // Turk. J. Bio-l. 2015. V. 39. P. 540.
Bai X., Chen J., Kong X., Todd C.D., Yang Y., Hu X., Li D.Z. Carbon monoxide enhances the chilling tolerance of recalcitrant Baccaurea ramiflora seeds via nitric oxide-mediated glutathione homeostasis // Free Radical Biol. Med. 2012. V. 53. P. 710.
Cheng T., Hu L., Wang P., Yang X., Peng Y., Lu Y., Chen J., Shi J. Carbon monoxide potentiates high temperature-induced nicotine biosynthesis in Tobacco // Int. J. Mol. Sci. 2018. V. 19: 188.
Li Z.-G.,Gu S.-P. Hydrogen sulfide as a signal molecule in hematin-induced heat tolerance of tobacco cell suspension // Biol. Plant. 2016. V. 60. P. 595.
Mukherjee S., Corpas F.J. Crosstalk among hydrogen sulfide (H2S), nitric oxide (NO) and carbon monoxide (CO) in root-system development and its rhizosphere interactions: A gaseous interactome // Plant Physiol. Biochem. 2020. V. 155. P. 800.
Xie Y., Ling T., Han Y., Liu K., Zheng Q., Huang L., Yuan X., He Z., Hu B., Fang L., Shen Z., Yang Q., Shen W. Carbon monoxide enhances salt tolerance by nitric oxide-mediated maintenance of ion homeostasis and up-regulation of antioxidant defence in wheat seedling roots // Plant Cell Environ. 2008. V. 31. P. 1864.
Song X.G., She X.P., Zhang B. Carbon monoxide-induced stomatal closure in Vicia faba is dependent on nitric oxide synthesis // Physiol. Plant. 2008. V. 132. P. 514.
Karpets Yu.V., Kolupaev Yu.E., Yastreb T.O., Oboznyi A.I. Induction of heat resistance in wheat seedlings by exogenous calcium, hydrogen peroxide, and nitric oxide donor: functional interaction of signal mediators // Russ. J. Plant Physiol. 2016. V. 63. P. 490.
Sa Z.S., Huang L.Q., Wu G.L., Ding J.P., Chen X.Y., Yu T., Ci S., Shen W.B. Carbon monoxide: a novel antioxidant against oxidative stress in wheat seedling leaves // J. Integr. Plant Biol. 2007. V. 49. P. 638.
She X.-P., Song X.-G. Carbon monoxide-induced stomatal closure involves generation of hydrogen peroxide in Vicia faba guard cells // J. Integr. Plant Biol. 2008. V. 50. P. 1539.
Kolupaev Yu.E., Shkliarevskyi M.A., Karpets Yu.V., Shvidenko N.V., Lugovaya A.A. ROS-Dependent Induction of Antioxidant System and Heat Resistance of Wheat Seedlings by Hemin // Russ. J. Plant Physiol. 2021. V. 68. P. 322.
Shkliarevskyi M.A., Karpets Yu.V., Kolupaev Yu.E., Lugovaya A.A., Dmitriev A.P. Calcium-dependent changes in cellular redox homeostasis and heat resistance of wheat plantlets under the influence of hemin (carbon monoxide donor) // Cytol. Genet. 2020. V. 54. P. 522.
Glyan’ko A.K., Mitanova N.B., Stepanov A.V. Influence of environmental factors on the generation of nitric oxide in the roots of etiolated pea seedlings // Appl. Biochem. Microbiol. 2012. V. 48. P. 95.
Karpets Yu.V., Kolupaev Yu.E., Vayner A.A. Functional interaction between nitric oxide and hydrogen peroxide during formation of wheat seedling induced heat resistance // Russ. J. Plant Physiol. 2015. V. 62. P. 65.
Zhou B., Guo Z., Xing J., Huang B. Nitric oxide is involved in abscisic acid-induced antioxidant activities in Stylosanthes guianensis // J. Exp. Bot. 2005. V. 56. P. 3223.
Galeeva E.I., Trifonova T.V., Ponomareva A.A., Viktorova L.V., Minibayeva F.V. Nitrate reductase from Triticum aestivum leaves: Regulation of activity and possible role in production of nitric oxide // Biochemistry (Moscow) 2012. V. 77. P. 404.
Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica // Plant Physiol. 1976. V. 57. P. 308.
Minibayeva E.V., Gordon L.K., Kolesnikov O.P., Chasov A.V. Role of extracellular peroxidase in the superoxide production by wheat root cells // Protoplasma. 2001. V. 217. P. 125.
Fazlieva E.R., Kiseleva I.S., Zhuikova T.V. Antioxidant activity in the leaves of Melilotus albus and Trifolium medium from man-made disturbed habitats in the Middle Urals under the influence of copper // Russ. J. Plant Physiol. 2012. V. 59. P. 333.
Gupta K.J., Hancock J.T., Petrivalsky M., Kolbert Z., Lindermayr C., Durner J., Barroso J.B., Palma J.M., Brouquisse R., Wendehenne D., Corpas F.J., Loake G.J. Recommendations on terminology and experimental best practice associated with plant nitric oxide research // New Phytol. 2020. V. 225. P. 1828.
Jeandroz S., Wipf D., Stuehr D.J., Lamattina L., Melkonian M., Tian Z., Zhu Y., Carpenter E.J., Wong G.K., Wendehenne D. Occurrence, structure, and evolution of nitric oxide synthase-like proteins in the plant kingdom // Sci. Signal. 2016. V. 9: re2. https://doi.org/10.1126/scisignal.aad 4403
Sane P.V., Kumar N., Baijal M., Singh K.K., Kochhar V.K. Activation of nitrate reductase by calcium and calmodulin // Phytochem. 1987. V. 26. P. 1289.
Gao H., Jia Y., Guo S., Lv G., Wang T., Juan L. Exogenous calcium affects nitrogen metabolism in root-zone hypoxia-stressed muskmelon roots and enhances short-term hypoxia tolerance // J. Plant Physiol. 2011. V. 168. P. 1217.
Kreslavski V.D., Los D.A., Allakhverdiev S.I., Kuznetsov Vl.V. Signaling role of reactive oxygen species in plants under stress // Russ. J. Plant Physiol. 2012. V. 59. P. 141.
Mamaeva A.S., Fomenkov A.A., Nosov A.V., Moshkov I.E., Mur L.A.J., Hall M.A, Novikova G.V. Regulatory role of nitric oxide in plants // Russ. J. Plant Physiol. 2015. V. 62. P. 427.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


