Физиология растений, 2021, T. 68, № 4, стр. 380-391
Состояние антиоксидантной системы и долговременное хранение волосовидных корней табака с конститутивной экспрессией гена глутатион-S-трансферазы ATGSTF11
Х. Г. Мусин a, В. В. Федяев b, Б. Р. Кулуев a, b, *
a Институт биохимии и генетики – обособленное структурное подразделение Федерального государственного бюджетного научного учреждения Уфимского федерального исследовательского центра
Российской академии наук
Уфа, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
“Башкирский государственный университет”
Уфа, Россия
* E-mail: kuluev@bk.ru
Поступила в редакцию 17.09.2020
После доработки 17.12.2020
Принята к публикации 20.12.2020
Аннотация
Одной из актуальных задач современной биотехнологии растений является получение стрессоустойчивых растительных культур волосовидных (бородатых) корней и разработка технологий их долговременного хранения без частых пересадок и использования дорогостоящих и трудоемких методов криоконсервации. В противодействии стрессовым факторам у растений важнейшую роль выполняет антиоксидантная система, одним из компонентов которой являются глутатион-S-трансферазы. В настоящей работе нами были созданы и исследованы волосовидные корни табака с конститутивной экспрессией гена глутатион-S-трансферазы AtGSTF11 Arabidopsis thaliana. Волосовидные корни табака, содержащие данный трансген, характеризовались большим накоплением массы, а также более высокой устойчивостью при действии засоления, тяжелых металлов и теплового стресса. Также трансгенные волосовидные корни обладали более длительной выживаемостью при долговременном хранении без пересадок на свежую питательную среду. Конститутивная экспрессия гена AtGSTF11 в культурах волосовидных корней в стрессовых условиях сопровождалась снижением содержания перекиси водорода, пролина и малонового диальдегида, а также повышением скорости продукции супероксид-аниона и общей антиоксидантной способности.
ВВЕДЕНИЕ
Растения постоянно подвергаются воздействию стрессовых факторов биотической и абиотической природы. Универсальным процессом, который запускается на фоне развития любого стресса, является накопление активных форм кислорода (АФК) Избыток АФК приводит к деградации липидных мембран, ДНК, белков и блокирует работу многих ферментов. Защита от вредного воздействия и контроль уровня АФК обеспечивается многокомпонентной антиоксидантной системой. Одним из составляющих этой системы является суперсемейство ферментов глутатион-S-трансфераз (GST), которые, используя трипептид глутатион (GSH) в качестве косубстрата, осуществляют восстанавливающие реакции [1]. Глутатион-S-трансферазы обычно подразделяют на 14 классов, а ферменты, относящиеся к этим классам, различаются как по строению, так и по выполняемым функциям [2]. Большой интерес представляют GST класса phi (GSTF), выполняющие множество функций: конъюгация глутатиона с ксенобиотиками [3], связывание тяжелых металлов [4], регуляция свет-опосредованного синтеза глутатиона [5], нейтрализация продуктов перекисного окисления липидов [6]. В последние годы накапливаются данные, свидетельствующие о позитивном влиянии конститутивной экспрессии глутатион-S-трансфераз не только на стрессоустойчивость, но и на продуктивность трансгенных растений [1, 5]. Исходя из этого, мы предположили, что волосовидные (бородатые) корни, сверхэкспрессирующие гены GST, тоже могут обладать повышенной продуктивностью и стрессоустойчивостью.
Волосовидные корни (hairy roots; HRs) являются одними из перспективных биотехнологических систем для продуцирования ценных вторичных метаболитов. Кроме того, при помощи HRs можно тестировать эффективность целевых генно-инженерных конструкций и изучать некоторые функции встроенных трансгенов без этапа получения полноценных трансгенных растений, что особенно актуально в случае труднорегенерируемых видов растений. При этом не требуется проведение трудоемких и многолетних работ по получению гомозиготных по трансгену поколений растений. Поэтому HRs могут быть использованы как модельный объект при предварительном тестировании генно-инженерных конструкций, однако о полноценной замене трансгенных растений речь здесь не идет. При этом волосовидные корни, по крайней мере, имеют преимущество перед другими растительными культурами in vitro, которое заключается в том, что HRs сохраняют многие морфофизиологические параметры, характерные для нативных корней [7]. Культуры HRs в крупном биотехнологическом производстве могут подвергаться отрицательному влиянию изменений состава среды, температуры, и т.д., поэтому создание не только высокопродуктивных, но и стрессоустойчивых волосовидных корней весьма актуально, что может быть достигнуто также путем переноса генов GST.
Ранее нами был клонирован ген AtGSTF11 Arabidopsis thaliana (неопубл.). Этот ген и его ортологи в других растениях пока остаются неизученными, но являются потенциальной мишенью в генной инженерии растений для целенаправленного изменения продуктивности и стрессоустойчивости как целых растений, так и культур волосовидных корней. На сегодняшний день эффекты конститутивной экспрессии генов семейства GST на рост и стрессоустойчивость волосовидных корней не изучались. Однако работы по повышению стрессоустойчивости HRs посредством генетической модификации имеются. К примеру, трансгенные по двум генам пероксидаз (tpx1 и tpx2) HRs Nicotiana tabacum показали повышенную устойчивость к фенолу [8], а внедрение гена протеинкиназы GmBIN2 в HRs сои повышало их устойчивость к соли и дефициту влаги [9].
Другой актуальной проблемой в биотехнологии HRs является долговременное сохранение полученных культур волосовидных корней без частых пересадок на свежую питательную среду. Из-за того, что HRs являются гетеротрофной системой, их необходимо постоянно восполнять органическими и минеральными веществами, а быстрый рост вызывает необходимость частых пересадок, что весьма трудоемко и затратно. Традиционно культуры волосовидных корней сохраняют в жидком азоте, что требует специального оборудования и соответствующих высококачественных реактивов, к тому же выживаемость после таких процедур сильно зависит от вида и очень часто снижается до 10% [10]. Однако долговременное хранение волосовидных корней возможно также без использования жидкого азота, к примеру, сообщается о сохранении способности к росту у HRs табака в течение 600 дней хранения при низком содержании сахарозы в питательной среде [11]. При низких положительных температурах (+4°С) удалось сохранить живыми HRs женьшеня обыкновенного Panax ginseng C.A. Mey в течение четырех месяцев без пересадок [12]. Мы предположили, что сверхэкспрессия гена AtGSTF11 может увеличить процент выживаемости HRs при их долговременном культивировании в стрессовых условиях. Целью наших исследований стало получение волосовидных корней табака сверхэкспрессирующих ген AtGSTF11, их морфометрический анализ, биохимический анализ антиоксидантной системы и оценка возможности их долговременного хранения в стрессовых условиях без использования методов криоконсервации.
МАТЕРИАЛЫ И МЕТОДЫ
Создание культур волосовидных корней с конститутивной экспрессией гена AtGSTF11
Ген AtGSTF11 (at3g03190; NM_111189.3) был амплифицирован и клонирован из кДНК A. thaliana, используя праймеры: 5'-AGAAAATGGTGGTCAA-AGTATATGG-3', 5'-CGGAGGACTACAAGAACTACTAGACA-3'. Трансгенные растения табака Nicotiana tabacum L. сорта Petit Havana линии SR1 с конститутивной экспрессией гена AtGSTF11 были получены методом агробактериальной трансформации листовых дисков. Семена трансгенных растений табака 35S::AtGSTF11 поколения T2 с единичной копией трансгена стерилизовали в 75% этиловом спирте (~30 с) и в 2.5% гипохлорите натрия (~5 мин), после чего промывали стерильной дистиллированной водой 5 раз и высаживали в чашки Петри с селективной (200 мг/л антибиотика гигромицина), твердой (7 г/л агара) питательной средой МС (0.5 соли МС, 14 г/л сахарозы, 60 мг/л инозитола, 2 мг/глицина, 1 мг/л тиамина и 1 мг/л никотиновой кислоты). Спустя 20 дней проростки одинаковых размеров, не имеющих морфологических аномалий, высаживали в смесь почвы и вермикулита (3 : 1 соответственно). Растения выращивали в вегетационных сосудах объемом 500 мл при температуре воздуха 24 ± 1°С, освещенности 120 мкмоль × м–2 с–1 и фотопериоде 16 часов.
Культуры HRs были созданы из листовых эксплантов двухмесячных растений при помощи Agrobacterium rhizogenes штамма А4. Агробактерии предварительно выращивали на жидкой селективной среде LB (100 мг/л рифампицина). Экспланты листьев табака стерилизовали с использованием 75% раствора этилового спирта (~1 мин) и 2% раствора гипохлорита натрия (~8 мин). Совместное культивирование листовых эксплантов и агробактерий проводили на твердой (7 г/л агара) среде МС (1 соли МС, 28 г/л сахароза, 120 мг/л инозитола, 2 мг/л глицина, 1 мг/л тиамина и 1 мг/л никотиновой кислоты) в течение трех суток при температуре +26°С, после чего листовые экспланты были перенесены на твердую среду МС, содержащую антибиотик цефотаксим (100 мг/л). Все образованные на эксплантах волосовидные корни фрагментами длиной по 1.5–2 см помещались в отдельные чашки Петри со средой МС и содержались при температуре воздуха +24 ± 1°С, в темноте. Был проведен предварительный селективный отбор наиболее активно и стабильно растущих корней. После двух месяцев культивации на селективной среде МС фрагменты HRs вместе с апикальной меристемой (~1.2 см длиной) были пересажены на свежую среду МС.
В качестве контроля, относительно которого делали выводы об эффектах трансгена, выступала линия HRs, созданная из нетрансгенных растений N. tabacum сорта Petit Havana линии SR1.
ПЦР и ОТ-ПЦР анализ волосовидных корней
ДНК из волосовидных корней выделяли стандартным CTAB-методом. Для подтверждения трансгенности созданных HRs использовали классический метод ПЦР с праймерами, представленными в Дополнительных материалах 1, в табл. 1.
Тотальную РНК из волосовидных корней выделяли при помощи тризола, первую цепь кДНК синтезировали с использованием олиго(dT) праймера и M-MuLV обратной транскриптазы (NEB, USA). В качестве референсного гена был использован ген фактора элонгации EF-1α (AF120093.1). Полуколичественную ОТ-ПЦР проводили при следующих условиях: 94°C – 1 мин, затем 30 циклов: 94°C 30 с, 53°C 30 с, 72°C 1 мин, финальная элонгация 72°С – 5 мин. Для каждого эксперимента использовали по три контрольных и опытных растения (n = 3).
Морфометрический анализ волосовидных корней при действии стрессовых факторов
Общая схема испытаний на устойчивость культур HRs к стрессовым факторам представлена в таблице 1 и включала 7 различных вариантов обработки. Контрольным вариантом выступали линии волосовидных корней, выращенные в стандартных условиях (табл. 1, схема 7 ). Все опыты проводились в чашках Петри с агаризованной средой МС. Интенсивность стрессовых факторов была подобрана в ходе предварительных исследований по отношению к волосовидным корням табака без трансгена AtGSTF11, таким образом, чтобы она значительно (до 20 раз) замедляла рост, но вызывала гибель не более 10% образцов корней. Морфометрический анализ заключался в измерении среднего прироста длины волосовидных корней на 30 день культивации. Средний прирост рассчитывался как отношение суммы удлинения всех корней к числу корней. Для оценки продуктивности также анализировали прирост сырой и сухой массы корней. Поскольку начальная масса фрагментов корней очень мала (не более 1 мг) им было решено пренебречь. Корни высушивали в сухожаровом шкафу при 105°С в течение 16 ч. Все испытания велись в 64 биологических повторностях (n = 64). Достоверность различий проверяли относительно контрольного варианта волосовидных корней без трансгена AtGSTF11 по методу Duncan.
Таблица 1.
Схемы стресс-обработки волосовидных корней
| Схема № | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Стрессовый фактор | Засоление | Засоление | Гипертермия | Гипертермия | Действие тяжелых металлов | Действие тяжелых металлов | Нормальные условия |
| Состав среды | МС, 150 мМ NaCl | МС, 200 мM NaCl | МС | МС | МС, 100 мM CuSO4 | МС, 100 мМ Cd(CH3COO)2 | МС |
| Температура | +24°С | +24°С | +32°С | +35°С | +24°С | +24°С | +24°С |
Анализ антиоксидантной системы культур HRs
Для проведения биохимического анализа опосредованных стрессом изменений антиоксидантной системы культуры волосовидных корней выращивали в течение 30 ± 1 дней в условиях действия стресс-факторов. Активность всех ферментативных систем приводили в общепринятых единицах на мг общего растворимого белка. Остальные показатели пересчитывали на г сырой массы HRs. Все биохимические исследования по определению активности антиоксидантной системы проводили в 15 биологических повторностях (n = 15). Достоверность различий рассчитывали относительно HRs без трансгена AtGSTF11 (контрольный вариант) по методу Duncan.
Для определения активности СОД применяли метод, основанный на способности СОД конкурировать с нитросиним тетразолием за супероксид-анионы [13]. Пероксидазную активность определяли по способности полимеризации гваякола до тетрагваякола [13]. Каталазную активность проверяли по скорости деградации молекул перекиси водорода [13]. Количество МДА в навеске определяли с помощью тиобарбитуровой кислоты [13]. Метод определения пролина был основан на работе Khedr с соавт. [14]. Скорость образования супероксид-аниона (СА) определяли акцепторным методом, основанным на определении окрашенного продукта окисления адреналина – аденохрома [15]. Экстракцию перекиси водорода проводили по Chaouch et al. [16], измерение его содержания по Bindschedler с соавт. [17]. Общая антиоксидантная способность (ОAC) оценивалась на метанольных (80%) экстрактах по восстановлению Mo(VI) до Mo(V) при кислом pH [18]. Содержание общего растворимого белка определяли по методу Бредфорда [13].
Долговременное хранение волосовидных корней
Для проведения испытаний по долговременному хранению культур HRs табака использовали кончики корней, отсеченные от молодой культуры HRs (не более 14 дней роста на свежей среде). Отрезанные кончики корней подвергали воздействию в условиях, описанных в табл. 2. Все опыты проводили в чашках Петри с агаризованной средой МС. Выбор таких параметров долговременного хранения HRs объясняется тем, что при действии данных стрессоров рост корней заметно замедлялся (до 90%), но количество погибших корней на 30 день испытаний не превышало 10%. Выживаемость HRs проверяли пересадкой фрагментов корней вместе с апикальной меристемой на свежую стандартную среду МС (табл. 1, схема 7 ). Перенесшими неблагоприятные условия считали те корни, которые сохраняли способность к росту как минимум в течение первых 15 дней роста на стандартной среде. После 60, 90, 120, 150, 180, 210 и 240 дней культивирования в указанных в табл. 2 условиях корни пересаживали на стандартную среду. Через 15 дней после переноса измеряли удельный прирост и рассчитывали выживаемость культур HRs. В качестве контроля выступали HRs, которые не участвовали в испытаниях, росли в стандартной среде с ежемесячной пересадкой. Достоверность различий определяли относительно HRs без трансгена AtGSTF11. Все испытания по долговременному хранению велись в 40 биологических повторностях (n = 40).
РЕЗУЛЬТАТЫ
Получение трансгенных растений и волосовидных корней табака, несущих ген AtGSTF11
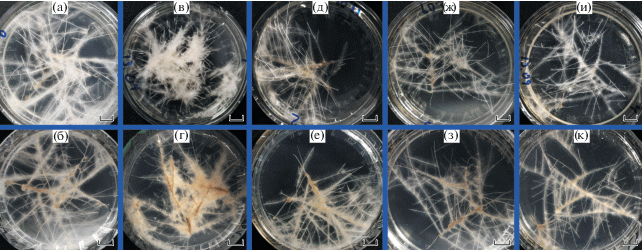
Было получено 14 линий трансгенных растений табака 35S::AtGSTF11. Наиболее высокий уровень транскрипционной активности целевого гена был обнаружен в линиях 1, 4, 5, 6 и 8: 169, 97, 124, 143, 108% относительно уровня экспрессии референсного гена EF-1α, соответственно. Для генетической трансформации при помощи A. rhizogenes была отобрана линия 1, характеризующаяся самой высокой транскрипционной активностью гена AtGSTF11. После агробактериальной трансформации листовых дисков трансгенных растений табака было получено 76 линий корней 35S::AtGSTF11. Полученные корни прошли селективный отбор на среде с гигромицином в течение 60 дней. Нами были отобраны культуры, которые не имели обнаруживаемых визуально морфологических патологий (рис. 1). По результатам ПЦР-анализа все отобранные культуры корней имели генетическую конструкцию, содержащую 35S::AtGSTF11, а также включали гены rolA и rolB. По результатам полуколичественной ОТ-ПЦР было отобрано 4 линии HRs (получившие нумерацию L1, L2, L3, L4) с наиболее высоким уровнем транскрипционной активности гена AtGSTF11: 108, 116, 127 и 119%, соответственно, относительно уровня экспрессии референсного гена EF-1α.
Конститутивная экспрессия гена AtGSTF11 повышает продуктивность и стрессоустойчивость HRs
Морфометрический анализ является наиболее простым и доступным методом оценки продуктивности и стрессоустойчивости культур HRs. Трансгенные HRs табака 35S::AtGSTF11 при стандартных условиях (табл. 1, схема 7 ) достоверно росли лучше контроля в 2.1 раза (рис. 2а). При действии теплового стресса (32°С) трансгенные линии корней росли достоверно хуже в среднем в 2.5 раза, чем при стандартных условиях, но превышали по этому параметру контрольные варианты (в 2 раза). На среде с 150 мМ NaCl (табл. 1, схема 1 ) скорость роста трансгенных HRs также была больше, чем в контроле. При действии 100 мкМ CuSO4 все четыре линии трансгенных HRs табака росли лучше в среднем в 2.3 раза, чем контрольные варианты. После анализа полученных результатов трансгенные линии HRs подвергли воздействию стресса большей интенсивности (табл. 1, схемы 2, 4, 6 ). Достоверное уменьшение скорости роста в длину всех исследованных HRs происходило при действии +35°С (рис. 2б). Однако трансгенные линии HRs при таком температурном стрессе росли в длину лучше, чем контроль в среднем в 18 раз. На среде с 200 мМ NaCl мы наблюдали резкое снижение роста как контрольных, так и трансгенных корней (рис. 2б). Тем не менее скорость роста трансгенных линий L3 и L4 достоверно была выше контроля в среднем в 2.8 раза. При действии 100 мкМ Cd (CH3COO)2 (CdAc) выявлено значительное угнетение роста в длину HRs всех линий. При этом трансгенные линии HRs росли лучше, чем контроль в среднем в 30 раз (рис. 2б). В стандартных условиях (табл. 1, схема 7 ) сырая масса трансгенных HRs линий L1, L2, L3 была в среднем на 28% больше контроля (рис. 2в). При действии 150 мМ NaCl сырая масса корней линий L2, L3, L4 была значительно больше контроля, однако при действии более высокой концентрации соли 200 мМ NaCl эта разница нивелировалась (рис. 2в). При помещении HRs в условия высокотемпературного стресса сырая масса корней контрольного варианта снизилась в 5, а трансгенных от 2.1 до 3.2 раза относительно стандартного. Сырая масса трансгенных линий при этом была больше контроля в среднем в 2.8 раза. В более жестких условиях гипертермии (35°С) сырая масса корней контроля достоверно уменьшилась в 45.5 раза, а трансгенных в 5.8–12.5 раза. Сырая масса трансгенных линий превышала контроль в среднем в 5.5 раза. На среде со 100 мкМ CuSO4 сырая масса HRs так же достоверно уменьшалась, но у трансгенных линий все же была больше в среднем в 1.6 раза, чем у контроля. На среде со 100 мкМ CdAc также наблюдали значительное сокращение сырой массы контроля. При этом трансгенные линии по сырой массе превышали контроль в среднем в 3.7 раза.
Рис. 2.
Удельный прирост (а, б), а также сырая (в) и сухая (г) масса волосовидных корней табака в условиях теплового стресса (+32°С; +35°С), засоления (150 мМ NaCl; 200 мМ NaCl) и действия 100 мкM CuSO4 и 100 мкМ Cd(CH3COO)2. 1 – дикий тип, 2 – линия L1, 3 – линия L2, 4 – линия L3, 5 – линия L4. Звездочками (*) обозначены достоверные различия от контроля согласно тесту Duncan (P < 0.05).
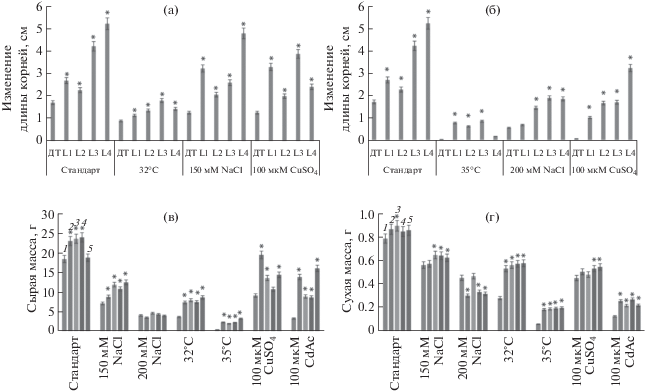
Измерение сухой массы корней в стандартных условиях выявило менее значительные различия между трансгенными и контрольными HRs (рис. 2г). После культивирования в 150 мM NaCl сухая масса была достоверно больше у линий L2–L4. При действии 200 мM NaCl сухая масса некоторых трансгенных линий корней была даже меньше контроля. При гипертермии в 32°С сухая масса трансгенных линий была больше контроля в среднем в 2 раза, при 35°С – в 3.2 раза. Сухая масса корней в 100 мкМ CuSO4 достоверно различалась от контроля в сторону повышения только в линиях L3 и L4. На среде со 100 мкМ CdAc сухая масса трансгенных корней была больше контроля в среднем в 2 раза (рис. 2г). Достоверность различий от контроля во всех случаях была доказана методом Duncan, все соответствующие числовые данные приведены в Дополнительных материалах (табл. 2–4 ).
Конститутивная экспрессия гена AtGSTF11 позитивно влияет на состояние антиоксидантной системы при действии стрессовых факторов
Так как трансгенные HRs обладали повышенной устойчивостью к действию стрессовых факторов, что может быть связано с обезвреживанием АФК и продуктов окисления, было решено измерить ряд параметров антиоксидантной системы.
При стандартных условиях активность СОД была достоверно выше у трансгенных линий. При засолении активность СОД в контроле возросла в 2.3 раза, тогда как у трансгенных линий осталась на том же уровне (рис. 3а). Активность пероксидаз в HRs (рис. 3б) резко возросла в условиях повышения температуры, причем в трансгенных корнях она была почти в 2 раза больше, чем в контроле. При действии остальных стрессовых факторов трансгенные и контрольные HRs существенно не отличались по активности пероксидаз. В стандартных условиях у трансгенных и контрольных HRs активность каталаз была на одном уровне (рис. 3в). При действии всех стрессовых факторов каталазная активность повышалась. К примеру, при засолении этот показатель во всех линиях достоверно повысился примерно в 2.8 раз, при гипертермии – в 1.7 раз и при действии кадмия – более чем в 3 раза. Достоверные отличия трансгенных линий в сторону уменьшения каталазной активности относительно контроля обнаруживались при засолении (рис. 3в). Интенсивность перекисного окисления липидов (рис. 3г) в культурах также увеличивалась при действии стрессоров. Причем в стандартных условиях содержание МДА у трансгенных линий было выше в среднем на 30%, чем в контроле. При засолении и тепловом стрессе HRs с трансгеном AtGSTF11 отличались от контроля меньшим содержанием МДА. Содержание МДА в волосовидных корнях контрольных вариантов было максимально при гипертермии, превышая значения трансгенных культур примерно в 3 раза (рис. 3г). Скорость образования супероксид-аниона (рис. 3д) в HRs с трансгеном AtGSTF11 по сравнению с контролем была выше почти в 4 раза при гипертермии и в 5 раз при действии CdAc. Содержание перекиси водорода (рис. 3е) было повышено во всех линиях волосовидных корней, которые подверглись действию стрессовых факторов. Стоит отметить, что в условиях гипертермии и повышенного содержания тяжелых металлов содержание перекиси в трансгенных корнях было достоверно меньше контроля. В стандартных условиях подобная закономерность не наблюдалась. В условиях гипертермии в контрольных вариантах содержание перекиси водорода увеличилось на 117% относительно стандарта, тогда как в линиях трансгенных корней только на 64% (рис. 3е). При действии стрессовых факторов накопление белка (рис. 3ж) уменьшалось во всех исследованных линиях HRs. Наименьшее количество растворимого белка было зафиксировано в культурах HRs, которые росли на среде с высоким содержанием ионов кадмия. Более высокое содержание белка у трансгенных линий HRs по сравнению с контролем было выявлено при засолении (рис. 3ж). ОAС всех линий HRs возрастала на питательных средах с повышенным содержанием NaCl и на среде с ацетатом кадмия (рис. 3з). В условиях высоких температур мы наблюдали за снижением ОАС. Как при стандартных, так и при стрессовых условиях ОАС была достоверно выше в трансгенных HRs, по сравнению с контролем. Наибольшая разница между трансгенными и контрольными HRs по данному параметру была обнаружена при гипертермии (рис. 3з). Содержание пролина (рис. 3и) при стандартных условиях существенно не различалось между контролем и трансгенными линиями. Однако при действии стрессоров накопление пролина в контрольных HRs было выше. Так, при засолении в трансгенных HRs содержание пролина было ниже на 32–67%, чем в контроле (рис. 3и). Достоверность различий от контроля во всех случаях была доказана методом Duncan, все соответствующие числовые данные приведены в Дополнительных материалах (табл. 5–12).
Рис. 3.
Анализ антиоксидантной системы культур HRs: (а) – СОД; (б) – пероксидазная активность; (в) – каталазная активность; (г) – МДА; (д) – скорость продукции супероксид-аниона; (е) – содержание H2O2; (ж) – содержание о-бщего белка; (з) – общая антиоксидантная способность; (и) – содержание пролина. 1 – дикий тип, 2 – линия L1, 3 – линия L3. Звездочками (*) обозначены достоверные различия от контроля согласно тесту Duncan (P < 0.05).
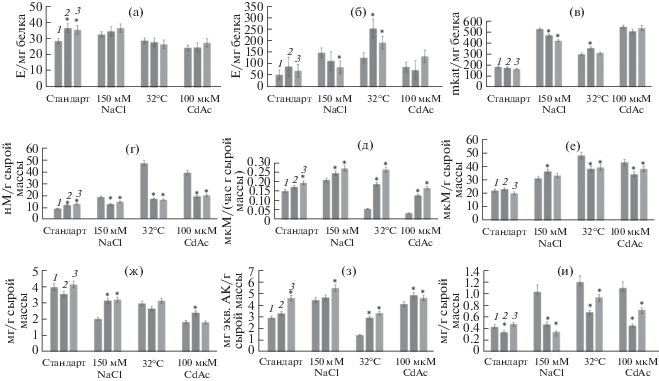
Рис. 4.
Возобновление роста HRs на стандартной среде МС через 14 дней после долговременного хранения в течение 240 дней при температуре +3°С. (а) – дикий тип, (б) – линия L1, (в) – линия L2, (г) – линия L3. Масштаб 10 мм.
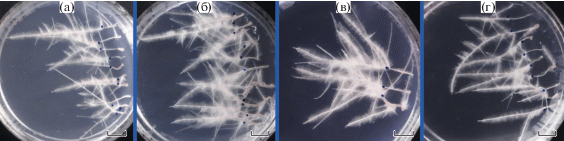
Рис. 5.
Изменения в длине корней и процент выживаемости HRs через 15 дней выращивания на среде
МС после долговременного хранения при температуре +3°C (а, б), дефиците сахарозы (в,
г), 50 мМ маннитоле (д, е), 250 мМ NaCl (ж, з).  – дикий тип,
– дикий тип,  – линия L1,
– линия L1,  – линия L2,
– линия L2,  – линия L3,
– линия L3, 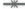 – линия L4. 1 – 60 дней, 2 – 90 дней, 3 – 120 дней, 4 – 150 дней, 5 – 180 дней, 6
– 210 дней, 7 – 240 дней. Звездочками (*) обозначены достоверные различия от контроля
согласно тесту Duncan (P < 0.05).
– линия L4. 1 – 60 дней, 2 – 90 дней, 3 – 120 дней, 4 – 150 дней, 5 – 180 дней, 6
– 210 дней, 7 – 240 дней. Звездочками (*) обозначены достоверные различия от контроля
согласно тесту Duncan (P < 0.05).
Конститутивная экспрессия гена AtGSTF11 повышает выживаемость культур HRs при их долговременном хранении
Для опытов по долговременному хранению HRs использовали четыре схемы эксперимента, представленные в таблице 2. После долговременного хранения при низких положительных температурах все испытанные культуры HRs возобновляли рост даже после 240 дней хранения (рис. 4). При этом не наблюдалось заметных изменений в удельном приросте (рис. 5а) и выживаемость корней (рис. 5б) сохранялась на относительно высоком уровне (≥ 80%). Различие между трансгенными и контрольной линиями наблюдалось только при измерении удельного прироста, однако подобное же различие наблюдалось при стандартных условиях роста (рис. 1). Пережившие долговременное хранение HRs внешне ничем не отличались от обычных волосовидных корней. В условиях дефицита сахарозы нам удалось сохранить высокий уровень выживаемости контрольных HRs до 150 дней, после чего выживаемость резко падала. При этом некоторые линии трансгенных корней выживали даже после 210 дней хранения (рис. 5г), но пережившие более длительное хранение корни росли намного хуже, чем обычные HRs (рис. 5д). Большинство испытанных трансгенных линий дольше сохраняли способность к росту в сравнении с контролем. Удельный прирост корней при хранении их в 50 мМ маннитоле снижался (рис. 5е) уже на 60 день испытаний. Наиболее сильное снижение прироста наблюдалось в трансгенных линиях. Так в контроле прирост корней на 60 день сократился на 15%, тогда как в линиях L1 и L3 на 23 и 31% соответственно. Однако контрольные HRs удалось сохранить живыми только в течение 120 дней, тогда как отдельные линии трансгенных HRs выживали после 180 дней хранения на среде с маннитолом (рис. 5ж). Также были проведены эксперименты по хранению HRs при высоких концентрациях NaCl. После первых измерений (60–90 дней) мы зафиксировали небольшое увеличение удельного прироста корней (рис. 5з). При этом выживаемость корней (рис. 5и) постепенно падала, и в L2 уже на 90 день упала на 58%. Контрольные HRs прекратили рост после 150 дней хранения. В то же время трансгенные корни L3 выживали даже после 240 дней, при этом удельный прирост практически не отличался от изначального. Достоверность различий от контроля во всех случаях была доказана методом Duncan, все соответствующие числовые данные приведены в Дополнительных материалах (табл. 13–21).
ОБСУЖДЕНИЕ
HRs являются одной из перспективных систем в биотехнологии растений для наработки различных метаболитов и рекомбинантных белков, поэтому задача повышения их продуктивности весьма актуальна. Более того, при выращивании в промышленных масштабах HRs могут испытывать негативное воздействие из-за изменений условий, прежде всего состава среды и температуры культивирования. Поэтому создание стрессоустойчивых трансгенных HRs также является весьма актуальным. Мы выявили более высокие темпы роста трансгенных HRs 35S::AtGSTF11 по сравнению с контролем при нормальных условиях, действии NaCl, тяжелых металлов и теплового стресса (рис. 2). Вероятнее всего, такой позитивный эффект трансгена AtGSTF11 на рост HRs достигался за счет снижения негативного влияния оксидативного стресса.
В нормальных условиях трансгенные корни отличались от контроля повышением активности СОД и пероксидаз (рис. 3а, б), более высоким содержанием МДА (рис. 3г), высокой скоростью образования СА (рис. 3д) и более высокой общей антиоксидантной способностью (рис. 3з). Вероятно, трансгенные корни характеризовались более высокими темпами всех жизненных процессов, что сопровождалось более высоким уровнем окислительного стресса. Однако это не несло с собой существенных отрицательных эффектов, поскольку по показателям роста в длину и массе трансгенные линии превосходили контроль. Мы полагаем, что это обуславливалось как раз более высокими антиокислительными свойствами трансгенных волосовидных корней, что, в свою очередь, обеспечивалось как прямым действием экспрессии трансгена AtGSTF11, так, возможно, и опосредованным повышением активности пероксидаз за счет защитного действия глутатион-S-трансферазы. В целом, при действии стрессовых факторов в трансгенных HRs было зафиксировано более низкое содержание перекиси водорода и МДА, чем в контрольных HRs, что свидетельствует о более высоком антиоксидантном статусе трансгенных по гену AtGSTF11 волосовидных корней, что приводило к уменьшению уровня перекисного окисления липидов.
При засолении было зафиксировано увеличение активности всех трех изученных нами ферментов антиоксидантной системы. Причем в трансгенных HRs определяющим оказалась каталаза, поскольку именно ее активность увеличилась в линиях L1 и L3 в 2.9 и 2.8 раза, соответственно. В контрольных HRs, в отличие от трансгенных форм, мы наблюдали повышение содержания пролина в ответ на действующие стрессоры. Повышенное содержание пролина при высоких концентрациях NaCl способствует стабилизации пероксидаз и каталаз [14], благодаря чему стрессоустойчивость тканей повышается. Также известно, что экзогенное внесение пролина способно усиливать активность пероксидаз и каталаз табака при засолении [19]. В трансгенных корнях при засолении мы наблюдали более низкие концентрации пролина, чем у контроля (рис. 4е). Вероятно, это связано с конститутивной экспрессией трансгена AtGSTF11, что говорит о возможном замещении одних компонентов антиоксидантной системы другими. То есть трансгенные волосовидные корни, вероятно, могут поддерживать высокий уровень стрессоустойчивости и без существенного повышения содержания пролина в условиях конститутивной экспрессии гена AtGSTF11. На это же указывает более высокий уровень ОАС у трансгенных HRs (рис. 4ж).
Выраженный эффект трансгена AtGSTF11 был обнаружен в условиях гипертермии, где удельный прирост корней был достоверно выше контроля в среднем в 18 раз. Вероятно, такой эффект наблюдался из-за более быстрой активации ферментов антиоксидантной системы в ответ на повышение количества перекиси водорода (рис. 3е). Подобные же результаты были продемонстрированы на растениях табака в работе [20]. Положительный эффект AtGSTF11 можно объяснить более быстрым восстановлением (а также устранением) окисленных фенольных соединений, на что указывает характер изменения ОАС (рис. 3з). Действительно, основной вклад в формирование общей антиоксидантной способности вносят витамины E и С, каротиноиды, флавоноиды и производные коричной кислоты [21], а ОAC трансгенных HRs культур (рис. 3з) всегда была выше, чем в контроле. Стоит заметить, что при действии стрессоров активность каталаз так же возрастала (рис. 3в), но в условиях гипертермии она была значительно меньше. Вероятно, это связано с тем, что при высоких температурах окружающей среды перекись водорода, в основном, нейтрализуется с помощью пероксидаз [20]. В условиях гипертермии интенсивность перекисного окисления липидов в трансгенных культурах HRs возросла, однако не превосходила значения культур контрольных вариантов. Как уже было сказано, AtGST класса phi способны нейтрализовать продукты перекисного окисления липидов [22]. Характер образования СА, как и содержание перекиси водорода в тканях, указывает на то, что перекисное окисление липидов происходит благодаря перекиси водорода (рис. 3е) и других АФК, но только не СА [23], поскольку продукция СА в HRs, где зарегистрировано повышенное содержание МДА, была значительно ниже стандартного и ниже, чем у трансгенных HRs, культивируемых в тех же условиях. С одной стороны, скорость образования СА в клетках часто коррелирует с интенсивностью внутренних биохимических процессов [24] и можно говорить о том, что в более продуктивных тканях СА образуется с большей интенсивностью [15]. С другой стороны, скорость образования СА может указывать на степень повреждения энергетических систем и степень ингибирования электрон-транспортной цепи продуктами кислородного окисления [15, 24]. Несмотря на то, что супероксид-анион может напрямую ингибировать или модифицировать некоторые белки, его токсичность связана, главным образом, с образованием высокореактивного гидроксильного радикала [15]. А поскольку активность СОД (рис. 4а) не сильно менялась в присутствии CdAc, то можно предположить, что СА своевременно дисмутировал в перекись водорода [24, 25].
При действии ацетата кадмия активность СОД понижалась (рис. 3а), а показатели активности каталаз повышались (рис. 3в), тогда как активность пероксидаз (рис. 3б) практически не изменилась. Ранее другими авторами были получены как схожие с нашими данные [25], так и немного отличающиеся [26]. Вероятнее всего, это связано с использованной в работах концентрацией ионов тяжелого металла. При низких концентрациях активность ферментов повышается, компенсируя токсическое действие ацетата кадмия, при более высоких – ферменты повреждаются и их активность падает. Накопление МДА в трансгенных HRs при действии CdAc увеличилось в 2.1 раза (рис. 3г), содержание перекиси водорода в среднем возросло в 1.4 раза (рис. 3е) относительно значений стандарта. В то же время в контрольных HRs содержание МДА выросло в 4.6 раза, а перекиси водорода – в 2 раза. Несмотря на более высокое, чем в стандартных условиях, содержание перекиси водорода и МДА в культурах контрольных HRs, скорость выработки СА была ниже относительно стандартного на 78%. Эти данные согласуются с тем, что кадмий оказывает общее токсическое действие, нарушает процессы экспрессии генов, снижает скорость транспорта веществ через мембрану [27]. При действии кадмия скорость образования СА в трансгенных корнях падала на 14–28%. Возможно, в трансгенных растениях продукт гена AtGSTF11 ускорял процесс связывания кадмия с глутатионом [28], вследствие чего степень негативного действия кадмия уменьшалась.
Таким образом, конститутивная экспрессия гена AtGSTF11 уменьшала содержание H2O2, повышала активность ферментов антиоксидантной системы и, как итог, существенно уменьшала интенсивность перекисного окисления липидов при действии стрессоров.
Нам удалось сохранить живыми культуры HRs табака в течение 240 дней (8 месяцев) при низких положительных температурах (рис. 5а, б). Ранее сообщалось об успешном сохранении культуры HRs P. ginseng в течение четырех месяцев при 4°С [12]. При этом выживаемость составляла 100%, в то время как при криогенном хранении выживаемость составляла менее 14% [29]. Уменьшение количества сахарозы в среде показывала хорошие результаты в работах Nagatome с соавт. [11]. Им удалось сохранить культуры корней N. tabacum в течение 600 дней при концентрации сахарозы в 2 г/л. Однако нам не удалось повторить эти результаты, испытанные HRs погибали после 200 дней хранения. А вот возможность долговременного хранения культур HRs на среде с маннитолом и при высокой концентрации NaCl, по-видимому, не изучалась ранее. Под действием этих стрессоров исследованные нами HRs табака оставались живыми, однако их не следует хранить в таких условиях дольше 90 дней (рис. 5).
Внедрение гена AtGSTF11 в культуру HRs действительно помогло повысить выживаемость культур после долговременного хранения без криогенной заморозки. К примеру, при дефиците сахарозы в питательной среде трансгенные линии HRs сохраняли способность к росту на 90 дней дольше, в маннитоле на 60 дней дольше, чем контрольные волосовидные корни без трансгена AtGSTF11. При условиях засоления одна линия трансгенных HRs выживала даже после 240 дней долговременного хранения, что говорит о существенном положительном эффекте трансгена.
Итак, ген AtGSTF11 и его ортологи являются потенциальной мишенью в генной инженерии и геномном редактировании растений для целенаправленного изменения продуктивности и стрессоустойчивости не только трансгенных растений, но и культур волосовидных корней. В нашей работе трансген AtGSTF11 повышал устойчивость HRs в условиях засоления, гипертермии и загрязнения тяжелыми металлами. Эти положительные эффекты объясняются комплексным действием продукта гена AtGSTF11 на антиоксидантную систему, в результате которой повышалась скорость восстановления клеточных антиоксидантов, снижалась интенсивность перекисного окисления мембранных липидов. Повышенная экспрессия гена AtGSTF11 также может быть полезна при долговременном хранении HRs, сохраняя их жизнеспособность на более длительный срок.
Работа выполнена в рамках госзадания AAAA-A19-119021190011-0 при поддержке гранта Президента Российской Федерации МД-2304.2020.4.
Настоящая статья не содержит каких-либо исследований с участием животных и людей в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dixon D.P., Lapthorn A., Edwards R. Plant glutathione transferases // Genome Biology. 2002. V. 3. P. 3004.1. https://doi.org/10.1186/gb-2002-3-3-reviews3004
Islam S., Rahman I.A., Islam T., Ghosh A. Genome-wide identification and expression analysis of glutathione S-transferase gene family in tomato: Gaining an insight to their physiological and stress-specific roles // PLoS One. 2017. V. 2: e0187504. https://doi.org/10.1371/journal.pone.0187504
Tossounian M.A., Wahni K., Van Molle I. Redox-regulated methionine oxidation of Arabidopsis thaliana glutathione transferase Phi9 induces H-site flexibility // Protein Science: a Publication of the Protein Society. 2019. V. 28. P. 56. https://doi.org/10.1002/pro.3440
Freeman J.L., Michael W., Persans K., Albrecht C., Peer W., Pickering I.J., Salt D.E. Increased glutathione biosynthesis plays a role in nickel tolerance in Thlaspi nickel hyperaccumulators // Plant Cell. 2004. V. 16. P. 2176.
Gallé A., Czékus Z., Bela K., Horváth E., Ördög A., Csiszár J., Poór P. Plant glutathione transferases and light // Front. Plant Sci. 2019. V. 9. P. 1944. https://doi.org/10.3389/fpls.2018.01944
Nianiou-Obeidat I., Madesis P., Kissoudis C. Plant glutathione transferase-mediated stress tolerance: functions and biotechnological applications // Plant Cell Rep. 2017. V. 36. P. 791. https://doi.org/10.1007/s00299-017-2139-7
Doran P.M. Application of plant tissue cultures in phytoremediation research: incentives and limitations // Biotechnol. Bioeng. 2009. № 103. P. 60. https://doi.org/10.1002/bit.22280
Sosa A.L.G., Agostini E., Medina M.I. Antioxidant response of tobacco (Nicotiana tabacum) hairy roots after phenol treatment // Plant Physiol. Biochem. 2011. V. 49. P. 1020. https://doi.org/10.1016/j.plaphy.2011.07.009
Wang L., Chen Q., Xin D., Qi Z., Zhang C., Li S., Jin Y., Li M., Mei H., Su A., Wu X. Overexpression of GmBIN2, a soybean glycogen synthase kinase 3 gene, enhances tolerance to salt and drought in transgenic Arabidopsis and soybean hairy roots // J. Integr. Agric. 2018. V. 17. P. 1959.
Benson E.E., Hamill J.D. Cryopreservation and post freeze molecular and biosynthetic stability in transformed roots of Beta vulgaris and Nicotiana rustica // Plant Cell, Tissue Organ Cult. 1991. V. 24. P. 163. https://doi.org/10.1007/BF0003347
Nagatome H., Yamamoto T., Taya M., Tanaka N. Viability of plant hairy roots is sustained without propagation in low sugar medium kept at ambient temperature // Biochem. Eng. J. 2000. V. 6. P. 75. https://doi.org/10.1016/S1369-703X(00)00077-2
Yoshimatsu K., Yamaguchi H., Shimomura K. Traits of Panax ginseng hairy roots after cold storage and cryopreservation // Plant Cell Rep. 1996. V. 15. P. 555. https://doi.org/10.1007/BF00232452
Сибгатуллина Г.В., Хаертдинова Л.Р., Гумерова Е.А., Акулов А.Н., Костюкова Ю.А., Никонорова Н.А., Румянцева Н.И. Методы определения редокс-статуса культивируемых клеток растений: учебно-методическое пособие / Под ред. Г.В. Сибгатуллиной, Л.Р. Хаертдиновой, Е.А. Гумеровой, А.Н. Акулова, Ю.А. Костюковой, Н.А. Никоноровой, Н.И. Румянцевой. Казань: Казанский (Приволжский) Федеральный университет. 2011. 61 с.
Khedr A.H.A., Abbas M.A., Abdel W.A.A., Quick W.P., Abogadallah G.M. Proline induces the expression of salt-stress-responsive proteins and may improve the adaptation of Pancratium maritimum L. to salt-stress // J. Exp. Bot. 2003. V. 54. P. 2553. https://doi.org/10.1093/jxb/erg277
Minibayeva F.V., Kolesnikov O.P., Gordon L.K. Contribution of a plasma membrane redox system to the superoxide production by wheat root cells // Protoplasma. 1998. V. 205. P. 101. https://doi.org/10.1007/BF01279299
Chaouch S., Queval G., Vanderauwera S., Mhamdi A., Vandorpe M., Langlois-Meurinne M., Breusegem F., Saindrenan P., Noctor G. Peroxisomal hydrogen peroxide is coupled to biotic defense responses by ISOCHORISMATE SYNTHASE1 in a daylength-related manner // Plant Physiol. 2010. V. 153 P. 1692. https://doi.org/10.1104/pp.110.153957
Bindschedler L.V., Minibayeva F., Gardner S.L., Gerrish C., Davies D.R., Bolwell G.P. Early signalling events in the apoplastic oxidative burst in suspension cultured French bean cells involve cAMP and Ca2+ // New Phytol. 2001. V. 151. P. 185. https://doi.org/10.1046/j.1469-8137.2001.00170.x
Boestfleisch C., Wagenseil N.B., Buhmann A.K., Seal C.E., Wade E.M., Muscolo A., Papenbrock J. Manipulating the antioxidant capacity of halophytes to increase their cultural and economic value through saline cultivation // AoB Plants. 2014. V. 13. P. 6. https://doi.org/10.1093/aobpla/plu046
Hoque M.A., Okuma E., Banu M.N. Exogenous proline mitigates the detrimental effects of salt stress more than exogenous betaine by increasing antioxidant enzyme activities // J. Plant Physiol. 2007. V. 164. P. 553. https://doi.org/10.1016/j.jplph.2006.03.010
Van Rensburg L., Krüger G. H. J. Evaluation of components of oxidative stress metabolism for use in selection of drought tolerant cultivars of Nicotiana tabacum L // J. Plant Physiol. 1994. V. 143. P. 730.
Prieto P., Pineda M., Aguilar M. Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomolybdenum complex: specific application to the determination of vitamin E // Anal Biochem. 1999. V. 269. P. 337.
Nianiou-Obeidat I., Madesis P., Kissoudis C. Plant glutathione transferase-mediated stress tolerance: functions and biotechnological applications // Plant Cell Reports. 2017. V. 36. P. 791. https://doi.org/10.1007/s00299-017-2139-7
Hammond-Kosack K.E., Jones J.D. Resistance gene-dependent plant defense responses // Plant Cell. 1996. V. 8. P. 1773. https://doi.org/10.1105/tpc.8.10.1773
Brand M.D. The sites and topology of mitochondrial superoxide production // Exp Gerontol. 2010. V. 45. P. 466. https://doi.org/10.1016/j.exger.2010.01.003
Hui F., Liu J., Gao Q., Lou B. Piriformospora indica confers cadmium tolerance in Nicotiana tabacum // J. Environ. Sci.-China. 2015. V. 37. P. 184. https://doi.org/10.1016/j.jes.2015.06.005
Boominathan R., Doran P.M. Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulator, Thlaspi caerulescens // Biotechnol. Bioeng. 2003. V. 2. P. 158. https://doi.org/10.1002/bit.10656
Bovet L., Rossi L., Lugon-Moulin N. Cadmium partitioning and gene expression studies in Nicotiana tabacum and Nicotiana rustica // Physiol. Plant. 2009. V. 128. P. 466. https://doi.org/10.1111/j.1399-3054.2006.00756.x
Csiszár J., Horváth E., Bela K., Gallé Á. Glutathione-related enzyme system: glutathione reductase (GR), glutathione transferases (GSTs) and glutathione peroxidases (GPXs) // Redox State as a Central Regulator of Plant-Cell Stress Responses. Springer, Cham, 2016. P. 137. https://doi.org/10.1007/978-3-319-44081-1_7
Oh S.Y., Wu C.H., Popova E. Cryopreservation of Panax ginseng adventitious roots // J. Plant Biol. 2009. V. 52. P. 348. https://doi.org/10.1007/s12374-009-9045-7
Дополнительные материалы
- скачать ESM.docx
- ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Инструменты
Физиология растений